电化学发光检测法在梅毒抗体确证中的应用
2023-05-09陈邦锐许婷婷张红乐淼
陈邦锐,许婷婷,张红,乐淼
(武汉血液中心,湖北 武汉 430030)
梅毒是一种可以通过输血传播的疾病,在采供血机构中,属于国家规定的血液检测的项目,近几年来,无偿献血的报废统计中,因梅毒阳性而报废的比例逐渐增大[1-2],超过HCV、HIV,严重威胁到血液安全。在我国采供机构的血液筛查实验室,按照国家规定,梅毒检测必须采用两个不同厂家的酶联免疫试剂同时检测,任一试剂阳性则血液报废,因为不同厂家抗原包被工艺不一样,在检测灵敏度特异性方面有所差异,所以存在一定比例的假阳性,这不仅浪费宝贵的血液资源,也给献血者咨询反馈带来麻烦,给其带来心理困扰,甚至家庭矛盾,严重影响了社会公众对采供血机构的信任度。为此,笔者认为有必要对梅毒ELISA 初筛阳性的血液,做进一步的抗体确证,通常行业内一般采用TPPA 检测作为梅毒抗体的确证实验,但是该方法为手工操作,且人工肉眼判读,更为经典的确证方法是免疫印迹,但是印迹法价格太贵,常规难以大量使用。因此,笔者通过不同方法学比对,意图建立起适合本实验室的确证策略,既操作规范,又可以批量检测,为此引入电化学发光检测,把TPPA、电化学发光、免疫印迹的检测做一个比较,实验过程如下。
1 材料与方法
1.1 标本 我中心ELISA 法检出的331 份梅毒阳性标本包括初次双试剂阳性标本、初次单试剂阳性重复检测仍为阳性标本 (包括灰区值,S/CO>0.7)。
1.2 试剂 梅毒螺旋体双抗原夹心法试剂盒(厦门新创),批号2018097525、批号2019027504;梅毒螺旋体双抗原夹心法试剂盒 (广州丽珠),批号2018030308、批号2019010108;TPPA 试剂:日本富士瑞必欧株式会社试剂盒,试剂批号VN81025;罗氏电化学发光梅毒抗体试剂,试剂批号44379703;德国欧蒙免疫印迹梅毒抗体检测试剂,其中IgG 抗体检测试剂批号D190417AL、IgM 抗体检测试剂批号D190417AM;所有试剂均为批批检合格并在有效期内使用。
1.3 仪器设备 FAME 全自动酶免分析仪 (瑞士HAMILTON24/20);STAR 加样仪 (瑞士HAMILTON);罗氏电化学发光检测仪e602 ;广州丽珠梅毒免疫印迹检测仪;洗板机 (TECAN);酶标仪(SUNRISE);离心机(SORVAL);混旋仪。
1.4 方法 收集双试剂梅毒阳性标本、单试剂梅毒阳性重复检测仍为阳性标本,同时进行TPPA 确证试验、电化学发光检测,不一致样本再做梅毒免疫印迹检测(IgG/IgM)。(1)TPPA 检测时严格按照试剂盒说明书进行操作。TPPA 步骤如下:室温条件下在U 型板上用稀释液依次倍比稀释样本,然后分别加入未致敏和致敏明胶颗粒,振荡混合30 s,加盖后于室温(15~30℃)下水平静置。2 h 后,在观察镜上记录并观察其反应图像,进行测定结果的判定。(2)梅毒电化学发光:在罗氏电化学发光检测仪实现自动化加样、检测,原理如下:第1 次孵育,10 μL 样本、生物素化的TP 特异性重组抗原和钌复合物标记的TP 特异性重组抗原反应形成一种夹心复合物。第2 次孵育,加入包被链霉亲合素的磁珠微粒后,该复合物通过生物素与链霉亲合素的相互作用与固相结合。将反应混合液吸入测量池中,通过电磁作用将微粒吸附在电极表面。给电极加以一定的电压,使复合物化学发光,并通过光电倍增器测量发光强度。仪器通过Elecsys 软件自动计算检测结果。(3)免疫印迹均按照仪器说明书操作,当印迹膜上出现2 条及以上特异抗原条带显色时,判为阳性,当无特异性抗原条带显色时结果为阴性。
1.5 统计学分析 采用SPSS 20.0 进行数据处理,卡方检验,计数资料以率(%)表示,P<0.05 为差异有统计学意义。
2 结果
梅毒ELISA 检测阳性样本的TPPA 确证结果和ECLIA 结果比较,二者检测有显著差异,见表1。不同区间ECLIA 检测值与TPPA 结果对应关系见表2,可以看出当反应值大于5 时,ECLIA 与TPPA符合性很高,当S/CO 值小于5 时,二者才有差异;15 例TPPA 和ECLIA 不一致样本进一步做免疫印迹最终确证(WB),可以看出ECLIA 仅存在假阳性,而TPPA 既有假阳性又有假阴性,见表3。
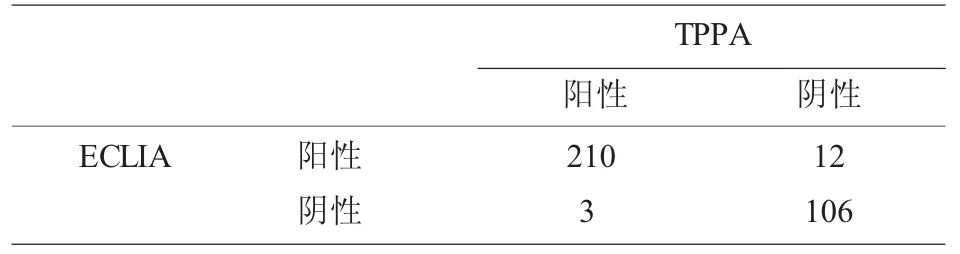
表1 TPPA 确证结果和ECLIA 结果比较
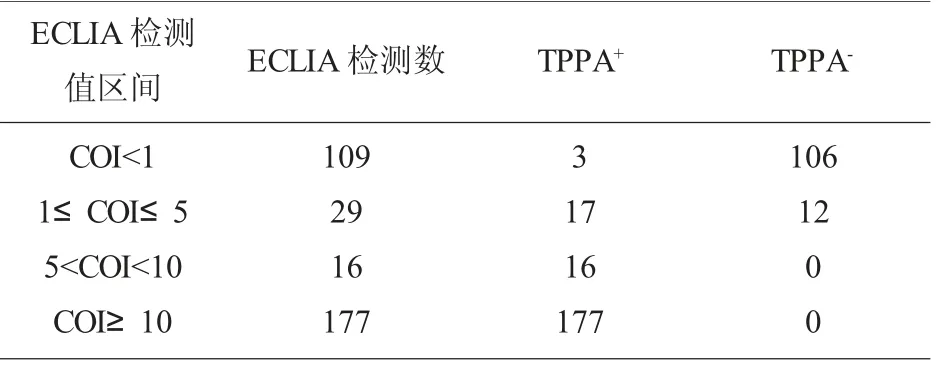
表2 ECLIA 检测值区间与TPPA 结果比较
3 讨论
梅毒是一种常见的传染性疾病,可以通过输血传播,因此国家卫生部门将其作为常规必检项目。近年来,在采供血机构的相关文献中,均有报道,梅毒阳性在无偿献血中的血液报废中占有比例在升高,其中一个原因是乙肝疫苗的全面接种导致人群乙肝感染率下降,另外梅毒通过亲密接触、性途径传播速度在增加[3],导致梅毒阳性占总阳性的比例在增加。因此,采供血机构采用国家规定且符合要求的ELISA 试剂,两个不同厂家的梅毒试剂同时检测,任一厂家试剂阳性,则该样本均判为阳性,ELISA 试剂检测具有操作简便,易于自动化,大批量检测,大通量,高效率,高灵敏度的优点,广泛在血站实验室使用。但是,由于不同厂家在制备工艺、抗原包被方面,存在差异,导致有假阳性的产生,这个给献血者咨询和回复带来困扰,假阳性的结果给献血者带来巨大心理压力,甚至家庭矛盾,献血者在临床医院检测后显示梅毒抗体为阴性,又直接影响到社会大众对采供血行业的信任度,给无偿献血宣传带来不利影响。为此,为了珍惜宝贵的血液资源,针对献血者献血后的关爱服务工作也相继开展,特别是献血者归队确认,要求血站实验室对献血者归队样本进行确认检测,以保证血液安全可靠,恢复献血者献血资格。笔者在本文主要探讨梅毒ELISA 初次阳性献血者的抗体确证工作,一般血站均采用TPPA 进行梅毒抗体阳性的确认检测,TPPA 是一种常有的梅毒抗体确证方法,将梅毒螺旋体Nichols 株的精制菌株包被于明胶颗粒上的一种检测方法,但是其操作主要是手工完成,且结果判读以人工肉眼判断,存在主观因素,同时由于明胶颗粒上包被的抗原差异,该方法有漏检现象,这在汪峰、莫艳萍等人[4-6]的文献中有提及,在梅毒血清盘用TPPA 检测时,有假阴性结果,即漏检发生,同时由于是肉眼判读凝集程度,很容易受人为因素干扰。在表1 中331 份ELISA 阳性样本同时用TPPA 和ECLIA 检测,二者检测差异有显著性,具体集中在低值区间,这一点在表2 中可以看出,ECLIA 的检测值COI 在小于5 时,与TPPA 存在不符结果;而ECLIA 的COI 高于5 时,与TPPA 结果具有一致性,与周贵芬、黎翠翠等人的相关文献报道一致[7-11]。针对ECLIA 与TPPA 不一致的15 例样本,我们进一步做免疫印迹(WB)最终确证,免疫印迹试验结合了分子生物学和免疫学的特点,敏感度和特异性高,是国际上公认的确证试验中的“金标准”,优点是在分子水平上检测标本中针对不同分子量多肽抗原成分的抗体,以保证检测结果的高特异性;试验过程简单,有配套仪器使用,结果容易区分反应带,缺点是每人份试剂的成本非常高,批量使用难以实现。具体结果见表3,TPPA 的结果中有5 例假阴性,3 例假阳性;ELCIA 的结果中仅有7 例假阳性;这也印证了部分学者关于TPPA 有漏检的观点,显然单一的TPPA 实验不宜用于献血者归队实验,但是如果不用TPPA 而全部用免疫印迹,这个成本太高,不可取,笔者通过增加电化学发光检测,该方法通过重组TP 多种抗原技术来测定血清梅毒特异性抗体,不仅具有较高的灵敏度和特异度,同时还具有检测范围广、速度快、重复性强、稳定性高的优势,可以实现全自动、高通量的检测,我们只需要针对低值的化学发光结果,补充TPPA实验,二者结果不一致的再做免疫印迹,从而获得最终梅毒抗体确证结果,这个策略,将有效降低确证实验成本,且可以单个检测也可以批量检测,非常灵活。
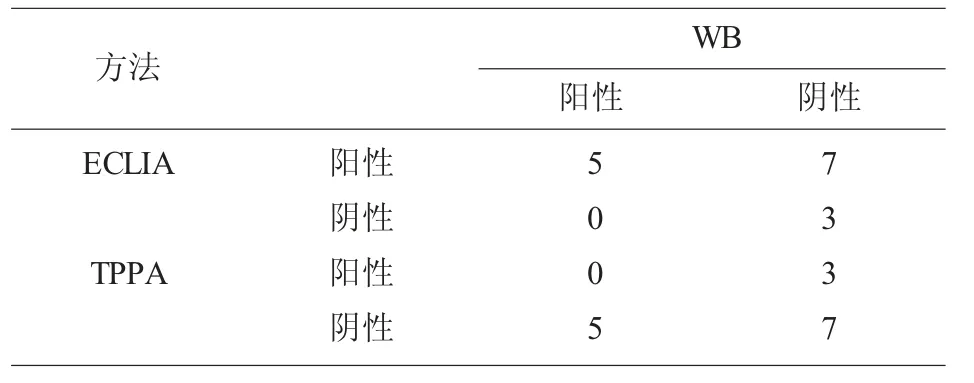
表3 15 例TPPA 与ECLIA 检测不符样本的免疫印迹结果
综上所述,ECLIA 用于梅毒抗体的检测,操作方便、自动化程度高、检测结果数据可与实验室信息化系统实现传输,可作为采供血机构建立梅毒ELISA 双试剂检测后的反应性样本补充试验的优选策略,结合TPPA 进一步确证献血者血液样本的一个重要手段,作为现阶段献血者血液初筛出现反应性时,献血者屏蔽和归队的检测方法之一。
具体到实际应用中,可先用ELISA 梅毒试剂初筛,反应性样本再使用ECLIA 法检测,最后我们只需对ECLIA 低值结果的标本做后续确证,主要是COI 值小于5 时,先用TPPA 实验检测,二者不一致的再用免疫印迹法进行复检,如果免疫印迹阴性则梅毒最终确证结果为阴性,如果免疫印迹阳性则最终梅毒抗体确证结果为阳性,如果免疫印迹不确定,则建议献血者间隔8 周后再次采集血样复查;这样的检测模式可以避免假阳性而导致的误诊[12],避免给献血者带来困扰和心理负担,增加社会大众对无偿献血的信任度;而且这样的梅毒抗体确证流程,不仅操作简单且成本可控,而且结果易于判断,具有可行性,具体操作流程,见图1。
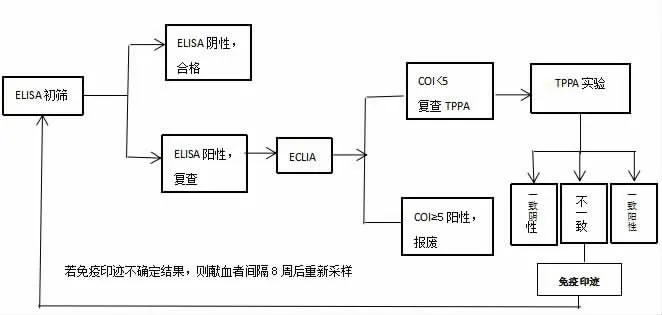
图1 ELISA 法检测
