两种新冠核酸检测试剂盒诊断性能评估
2023-05-09杨晓玉陈恩李通程丰龚国富雷文波
杨晓玉,陈恩,李通,程丰,龚国富,雷文波
(1.鄂州市中心医院检验科,湖北 鄂州 436000;2.南华大学衡阳医学院组织学与胚胎学教研室,湖南 衡阳 421001;3.南华大学附属第一医院检验医学中心,湖南 衡阳 421001)
2019 年底爆发的新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)是由新型冠状病毒(SARS-CoV-2)感染引起的一种严重急性呼吸道传染病。2020 年新冠肺炎在全球程爆发性扩散,目前已有5 900 余万人确诊,死亡人数达140 多万,且还呈增长之势,全世界均面临着严峻的疫情挑战。
SARS-CoV-2 是β 属的冠状病毒,有包膜,直径为60~140 nm[1],主要传染源是新冠肺炎患者及无症状感染者,其传播途径主要是通过呼吸道飞沫和密切接触传播,长时间暴露于高浓度气溶胶也有感染的可能[2]。有研究发现,粪便和尿液中也可以分离到新冠病毒[3]。根据流行病学统计,目前新冠肺炎的易感人群较广,部分研究显示男性的病例数比女性多[4],且年龄较大的患者,特别是自身具有基础性疾病的患者预后更差,比如高血压、糖尿病等[5-6]。新冠肺炎患者早期的临床症状以发热、干咳、乏力为主,少数患者伴有鼻塞、咽痛、流涕、腹泻、肌痛等症状[7]。重症患者可出现呼吸困难或者低氧血症,进而发展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和凝血功能障碍及多器官衰竭等[8]。
新冠病毒检测方法多种多样,有高通量测序检测、病原核酸检测、血清抗体检测等方法。病原核酸检测方法具有成本相对较低、特异性和敏感性相对较高[9],且其检测条件与检测人员技术水平等要求相对容易满足等特点,符合目前大样本量的筛查及诊断的客观需要。根据《新型冠状病毒肺炎诊疗方案(试行第七版)》,实时荧光RT-PCR 已成为检测新型冠状病毒的常规检测方法[10],主要针对新型冠状病毒两段主要的保守基因序列:开放读码框1ab (Open Reading Frame1ab,ORF1ab)和核壳蛋白(Nucleocapsid Protein,N)[11-12,1]。随着国内外疫情的发展,为满足国内外疫情防控的需要,各大体外诊断生物试剂公司推出了各种核酸检测试剂盒。但因各试剂厂家研发团队水平不一,技术参差不齐,检测试剂盒性能也各有优劣,其灵敏性、特异性等方面可能会有所差异。本研究就国内常用的两种核酸检测试剂盒进行比较与评估,旨在为临床实验室遴选核酸检测试剂选择提供参考。
1 材料与方法
1.1 材料
1.1.1 样本来源 湖北省鄂州市中心医院2020 年2 月17 日至24 日确诊的COVID -19(经核酸检测检测阳性及胸片CT 影像学检查有新冠肺炎典型性改变及临床症状者)咽拭子样本55 例,同时期经新冠核酸检测与影像学检查排除的非新冠肺炎患者咽拭子样本28 例。
1.1.2 检测试剂盒 某核酸扩增试剂盒A (双重荧光PCR 法,批号20200108);某核酸扩增试剂盒B(双重荧光PCR 法,批号:20200106);天隆EXRNA/DNA 核酸提取试剂盒 (磁珠法,批号:E0120010221)。
1.1.3 仪器 核酸全自动提取仪 (Natch CS S12C)(圣湘生物),核酸提取仪 (天隆科技),Applied Biosystems QuantStudio 3&5 实时荧光定量PCR 仪(Thermo)。
1.2 实验方法 以下实验的核酸提取均采用各试剂厂家推荐方法进行,并严格按照各试剂说明书操作。B 采用配套的一步法提取;A 采用其推荐之一的核酸提取试剂盒及相对应的提取仪提取。
1.2.1 一致性检测 选择COVID-19 临床确诊病例55 例、非COVID-19 患者28 例,用A、B 两种试剂进行检测,分析两种试剂的诊断效能。
1.2.2 分析灵敏度检测 从55 例COVID-19 患者中选择ORF1ab 基因和N 基因均强阳的样本1例,经过10×、100×、1 000×、10 000×、100 000×稀释,每个浓度设3 个平行孔,用两种试剂分别进行检测;在最低检测浓度基础上再进行倍比稀释,再用两种试剂分别进行检测。
1.2.3 精密度检测 将1.2.2 步骤中两种试剂均能100%检测到的高中低浓度,每个浓度分装成5 个样本,分别用两种试剂盒检测,重复3 次,分析试剂的精密度。
1.3 统计学分析 采用SPSS 18.0 进行统计分析,采用一致性Kappa 检验,分析试剂的诊断效能。精密度的分析采用方差分析levene 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一致性实验及准确性实验结果 用两种试剂盒检测COVID-19 样本55 例、非COVID-19 样本28 例,试剂A 与B 均检测ORF1a/b 和N 基因。试剂A 的检出率、特异度、符合度、Kappa 值、双靶标阳性率、单靶标阳性率、复检率分别是100%、96.4%、98.8%、0.973、90.7%、9.3%、9.3%。试剂B 的检出率、特异度、符合度、Kappa 值、双靶标阳性率、单靶标阳性率、复检率分别是98.2%、100%、98.8%、0.964、79.6%、20.4%、20.4%。经分析,试剂A 与B的一致性及准确性相当。见表1-2。

表1 两种核酸检测试剂盒检测结果分析
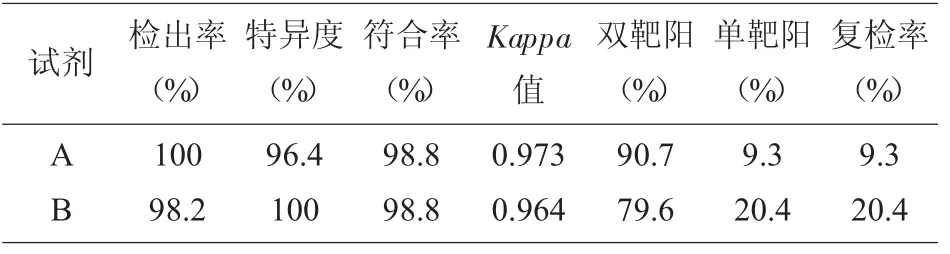
表2 两种核酸检测试剂盒的诊断效能评估
2.2 两种试剂盒诊断灵敏度比较 从55 例COVID-19 样本中取双靶标阳样本1 例进行10×梯度稀释,每个浓度设3 个平行孔,用两种试剂盒检测。各扩增曲线均呈典型的“S”型,根据稀释倍数做线性回归方程,发现试剂A 的线性范围最宽且线性关系良好见图1。试剂B 可稳定检测到100×稀释的样本,而试剂A 可以检测的最低浓度是1 000×稀释的样本。为进一步确认以上实验结果,再将样本稀释200×、400×、800×、1 000×、2 000×,每个浓度设8 个孔,用两种试剂检测。结果显示样本经200×、400×、800×、1 000×稀释后,试剂A 的检出率均是100%;试剂B 的检出率分别是100%、100%、62.5%、25%,见表3。
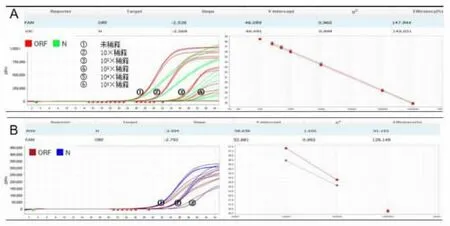
图1 10 倍梯度稀释样本后试剂A和B 的ORF1ab/N 基因扩增曲线图
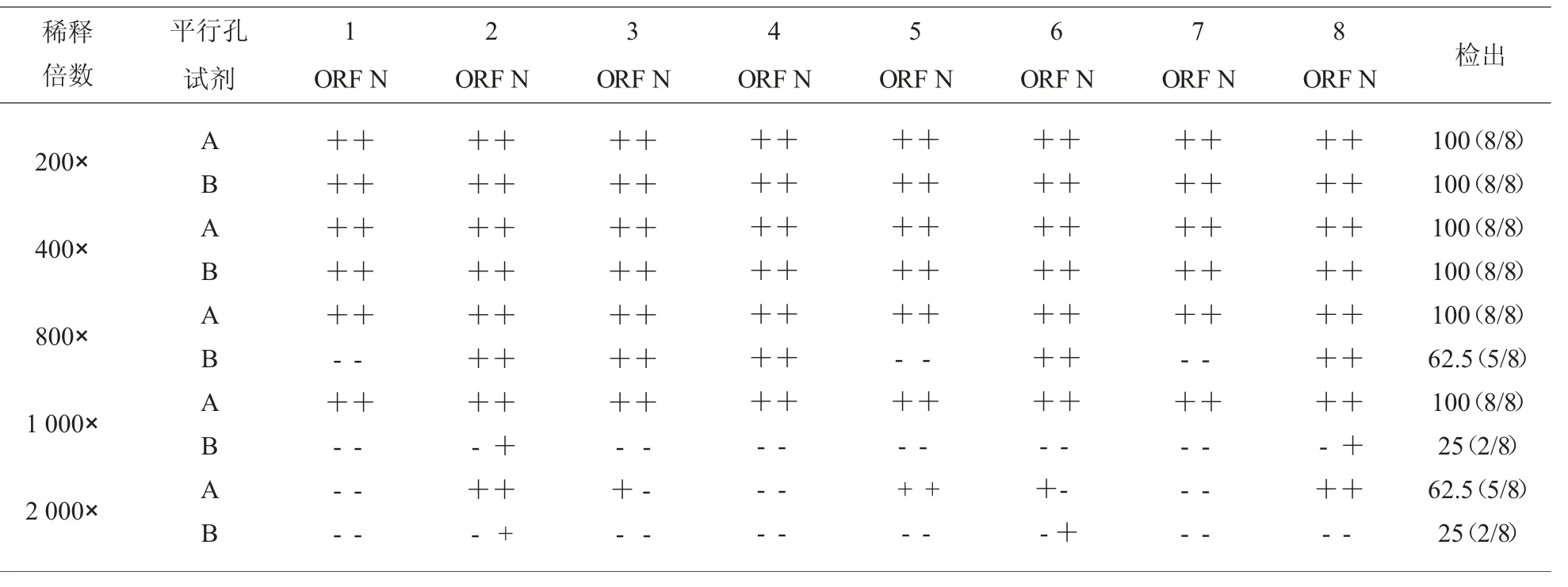
表3 倍比稀释后两种试剂检测结果
2.3 两种试剂精密度实验比较 已知2.2 实验中两种试剂能共同检出的最低浓度是100×稀释后的样本,则将2.2 实验中的样本原液及10×、100×稀释后作为高、中、低3 个浓度,每个浓度每批重复测5次,连续测3 次,统计其Ct 值与CV%。两种试剂检测未稀释的样本各基因精密度之间差异无显著意义(P>0.05)。样本经10×稀释后,试剂A 与B 的N基因CV%值分别为0.7、2.1 (F=8.31,P<0.05),ORF1ab 基因CV%值分别为0.6、2.3(F=15.614,P<0.05);样本经100 ×稀释后,试剂A 与B 的N 基因CV%值分别为3.1、8.9 (F=5.684,P<0.05),ORF1ab基因CV%值分别为1.9、6.0(F=5.846,P<0.05)。试剂B 的精密度均随着样本浓度的降低而降低,而试剂A 的高中低浓度精密度变化不明显,说明试剂A 的精密度优于试剂B。
3 讨论
国家药品监督管理局(NMPA)批准的新型冠状病毒检测试剂中,大部分采用的方法为实时荧光PCR,它具有简便快速、特异性强、灵敏度高等特点[9]。但不同厂家试剂成分不同或引物、探针设计策略不一而可能导致其检测性能上有差异。本研究对不同公司生产的新冠病毒核酸检测试剂A和B 进行了对比,发现试剂B 的双阳率仅79.6%,明显低于试剂A 的90.7%。根据指南要求,单靶标阳性患者需要用不同类型的标本如痰、肺泡灌洗液等进行复查或隔天重新采集同一类型样本进行复查[1]。试剂B 的复检率为20.4%,明显高于试剂A的9.3%。
为避免所选新冠肺炎患者样本中新冠病毒浓度覆盖范围不全而导致实验出现误差,从55 例新冠肺炎样本中取双靶标阳性1 例样本进行10×梯度稀释,用两种试剂盒检测,发现试剂A 的线性范围更广,灵敏度更高,它可以稳定检测到1 000×稀释样本,而试剂B 只能稳定检测到100×稀释的样本。进一步将样本稀释800×、1 000×,每个浓度分装8 管,试剂A 的检出率分别是100%、100%;试剂B 的检出率分别是62.5%、25%。通过以上实验发现,两种试剂对高病毒载量的样本检出率一致,但对低病毒载量样本,试剂A 的检出率明显高于试剂B,充分说明试剂A 的分析灵敏度高于后者。在精密度实验结果中发现,两种试剂检测未稀释的样本(双靶标阳性的样本)ORF1ab 和N 基因检出的精密度差异无显著意义(P>0.05)。但样本经10×与100×稀释后,试剂A 的N 基因(F=8.31,P<0.05,F=5.684,P<0.05)和ORF1ab 基因(F=15.614,P<0.05, F=5.846,P<0.05) 精密度均优于试剂B,差异有统计学意义。试剂B 的精密度均随着样本浓度的降低而降低,而试剂A 精密度随着浓度降低并无明显趋势,这可能因试剂A 灵敏度相对较高,所稀释的样本浓度不适合作为其弱阳性样本。
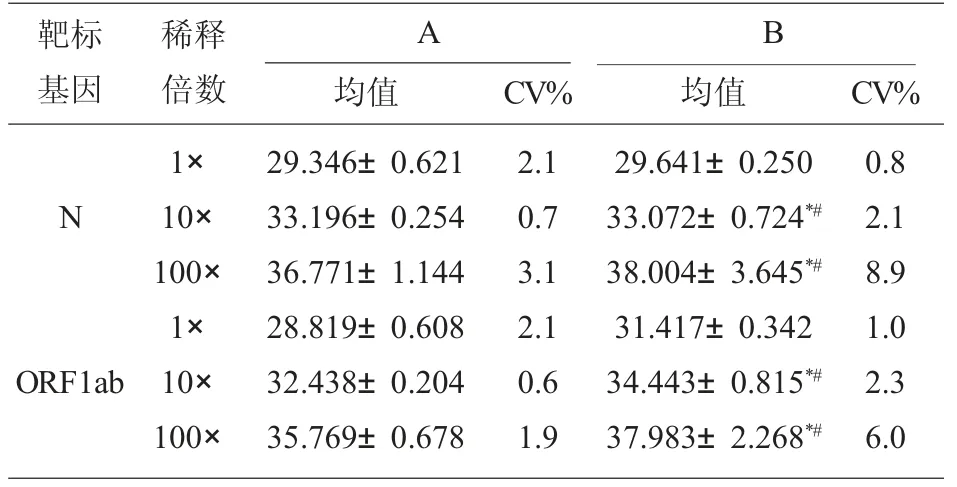
表4 两种试剂对不同浓度样本检测后的Ct 值与CV%结果
综上所述,试剂A 的符合度高,灵敏度与重复性相对较好,且其复检率相对试剂B 要低,整体性能相对占优势。因条件有限,暂无通用标准品进行最低检测限的检测,仅对本实验室所采用过的试剂与耗材进行实验,如阳性标本仅采用的是鄂州市中心医院新冠确诊患者的样本,这可能会导致实验有误差。本研究仅对几种试剂诊断性能进行初步的评估,其更深一层的性能验证,需进一步研究。
