MicroRNA-155 调节Notch 信号通路对TLCs 诱导的急性胰腺炎腺泡细胞的影响
2023-05-09杨亚勤牛丽丹孔令宇陈希妍任芳杨飞云
杨亚勤,牛丽丹,孔令宇,陈希妍,任芳,杨飞云
(新乡医学院第一附属医院急诊科,河南 卫辉 453100)
急性胰腺炎(Acute pancreatitis,AP)是临床上常见的消化系统急性疾病,流行病学研究显示,近年来AP 的发病率呈上升趋势,且死亡率也居高不下,对人类生命安全造成严重威胁[1-2]。然而,由于AP 发病机制并不明确,临床难以取得针对性的治疗方式。研究显示微小RNA(microRNA, miRNA 非编码RNA) 在AP 患者血清中的表达出现明显差异,与AP 的发生发展及临床诊断密切相关[3-4]。郭广洋等人的研究表明,AP 患者血浆miRNA-155表达升高,其表达水平与病情严重程度密切相关[5]。动物实验结果也表明,说明miRNA-155 的表达与AP 的发生密切相关[6]。然而,miRNA-155 在AP 中的作用机制并不明确。本研究利用TLCs 诱导制造AR42J 细胞的AP 模型,检测AP 中miRNA-155 对Notch 信号通路的调控作用,初步探索miRNA-155的作用机制,为临床AP 的治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞 大鼠胰腺AR42J 腺泡细胞购自于中国科学院上海生命科学研究院细胞资源中心。
1.1.2 主要试剂F12K 培养液购自于Sigma 公司,优质胎牛血清购自于Gibco 公司,牛磺胆酸钠盐(TLCs) 购自于Sigma 公司,Notch1 抗体,Bcl-2 抗体,Bax 抗体,Caspase-3 抗体购自于Abcam 公司,GAPDH 抗体购自于Sigma 公司。Lipofectamine 2000 转染试剂,逆转录试剂盒购自于Invitrogen 公司。microRNA-155 inhibitor,microRNA-155 negative control,pcDNA-Notch1,pcDNA negative control购自于苏州吉玛基因公司。
1.2 实验方法
1.2.1 AR42J 细胞的培养 大鼠胰腺AR42J 细胞培养于的F12K 培养液中,培养液中含20%胎牛血清及青霉素100 U/mL,链霉素0.1 mg /mL,置于37℃、5 % CO2的无菌恒温培养箱中培养,2~3 d 传代1 次,实验所用细胞均为对数生长期细胞。
1.2.2 细胞的药物处理,转染及分组 细胞的药物处理:取对数生长期的AR42J 细胞,按照1X106个/mL 的浓度接种于6 孔板中,培养24 h 后用浓度为200 μM 的TLCs 刺激20 min(模型组),收集细胞,用于后续实验。
细胞转染:取对数生长期的AR42J 细胞,按照1X106 个/mL 的浓度接种于6 孔板中,按照使用说明,利用Lipofectamine 2000 将microRNA-155 inhibitor,microRNA -155 negative control,pcDNA -Notch1,pcDNA negative control 转染至AR42J 细胞后,继续培养48 h,用浓度为200 μM 的TLCs 刺激20 min,收集细胞,用于后续实验。
细胞分组:正常对照组 (Normal control group),模型组(TLCs group),TLCs+microRNA-155 inhibitor 组(TLCs+microRNA-155 inhibitor group),TLCs+microRNA-155 negative control 组(TLCs+microRNA-155 NC group),TLCs+microRNA-155 inhibitor+pcDNA negative control 组 (TLCs+microRNA-155 inhibitor +pcDNA NC group),TLCs +microRNA-155 inhibitor+pcDNA-Nocth1 组 (TLCs+microRNA-155 inhibitor+pcDNA-Nocth1 group)。
1.2.3 RT-qPCR 检测 选取正常对照组与模型组细胞,提取细胞的总RNA,检测RNA 浓度与纯度后,利用RT-qPCR 检测细胞中microRNA-155 mRNA,Notch1 mRNA 的表达变化,miRNA-155 Forward: 5′- CGCGTTAATGCTAATCGTGAT-3′;miRNA -155 Reverse: 5′ - CGCGTTAATGCTAATCGTGAT -3′ ,Notch1 Forward: 5′ -TCAATGTTCGAGGACCAGATG-3′; Notch1Reverse: 5′-TCACTGTTGCCTGTCAAGTC-3′,所有步骤均按照试剂盒及仪器的操作说明进行,RNA 逆转录成cDNA 后,进行扩增,反应条件:预变性94,30 s、变性94,5 s、退火55,30 s、延伸72,30 s;共40 个循环。
1.2.4 ELISA 检测 将AR42J 细胞接种于6 孔板中,处理细胞后按照试剂盒说明书检测各组细胞培养液中IL-6,IL-32,IL-1β 及TNF-α 的含量,利用酶标仪检测吸光度值,计算各组细胞培养液中细胞因子的含量(pg/mL)。
1.2.5 Western blot 检测 分别提取各组细胞总蛋白,进行SDS-PAGE 电泳,转膜,10%的脱脂奶粉封闭膜1 h,4℃孵育Ⅰ抗过夜,Ⅰ抗体浓度分别是Bcl-2 抗体(1∶500),Bax 抗体(1∶500),caspase-3(1∶500)及GAPDH 抗体(1∶10000),荧光II 抗(1∶1000)孵育2 h,利用Odyssey 曝光系统曝光,利用Image J 软件分析灰度值。
2 结果
2.1 miRNA-155 与Notch1 在TLCs 诱导的AR42J细胞模型中的表达 正常对照组相比较,TLCs 组AR42J 细胞中miRNA-155 mRNA 的表达显著升高(P<0.01),而Notch1mRNA 及Notch1 蛋白的表达显著上调(P<0.01)。这些结果提示,在TLCs 诱导下,AR42J 细胞中miRNA-155 与Notch1 的表达均上调,见图1。
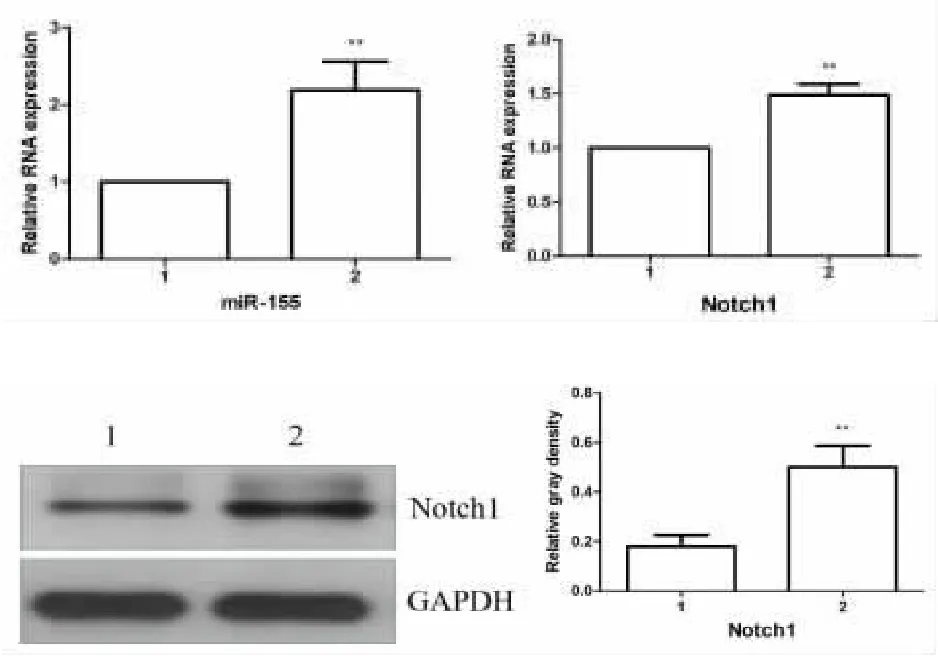
图1 miRNA-155 与Notch1 在TLCs诱导的AR42J 细胞中的表达
2.2 抑制miRNA-155 的表达对Notch1 的影响 与TLCs 组相比较,miRNA-155 inhibitor 组Notch1 mRNA 与蛋白的表达均显著降低 (P<0.01);而miRNA-155 NC 组与TLCs 组相比较,Notch1 mRNA 与蛋白的表达并无明显改变。结果说明,抑制模型组细胞中miRNA-155 的表达后,细胞中Notch1 的表达显著降低,miRNA-155 可正向调节Notch1 的表达,见图2。
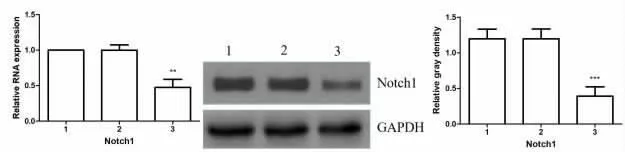
图2 miRNA-155 抑制剂对TLCs 诱导的AR42J 细胞中Notch1 表达的影响
2.3 抑制miRNA-155 的表达对细胞凋亡相关蛋白的影响 正常对照组相比较,TLCs 组细胞中抗凋亡蛋白Bcl-2 的表达显著下降,凋亡蛋白Bax 与Caspase-3 的表达显著升高;而与TLCs 组相比较,TLCs+miRNA-155 inhibitor 组细胞中抗凋亡蛋白Bcl-2 的表达显著下降,凋亡蛋白Bax 与Caspase-3 的表达显著升高。提示,在TLCs 诱导的AR42J细胞模型中,miRNA-155 可促进抗凋亡蛋白Bcl-2 的表达,抑制凋亡蛋白Bax 与Caspase-3 的表达,抑制损伤细胞的凋亡,而抑制miRNA-155 后可促进损伤细胞的凋亡,见图3、表1。
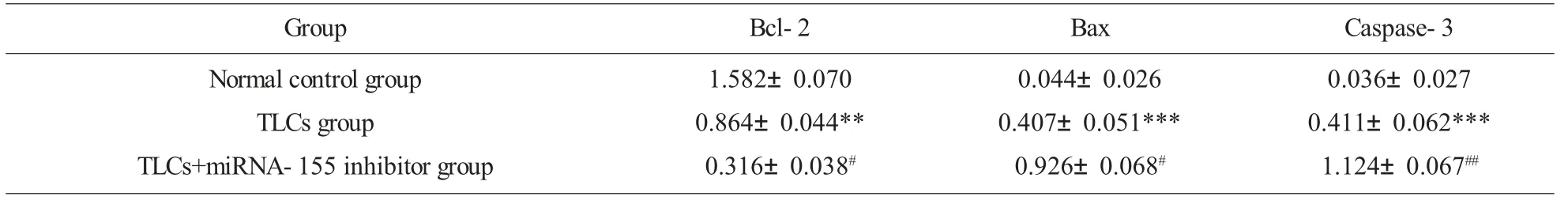
表1 miRNA-155 抑制剂对TLCs 诱导的AR42J 细胞中Bcl-2, Bax 与Caspase-3 表达的影响
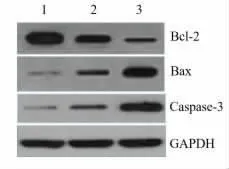
图3 miRNA-155 抑制剂对TLCs 诱导的AR42J细胞中Bcl-2, Bax 与Caspase-3 表达的影响
2.4 抑制miRNA-155 与Notch1 的表达后,对细胞凋亡相关蛋白的影响 TLCs+miRNA-155 NC 组相比较,TLCs+miRNA-155 inhibitor 组AR42J 细胞中抗凋亡蛋白Bcl-2 的表达显著下降,凋亡蛋白Bax与Caspase-3 的表达显著升高;而与TLCs+miRNA-155 inhibitor 相比较,TLCs+microRNA-155 inhibitor+pcDNA-Notch1 组,抗凋亡蛋白Bcl-2 的表达显著升高,凋亡蛋白Bax 与Caspase-3 的表达显著降低。这些结果提示,在TLCs 诱导的AR42J 细胞模型中,抑制miRNA-155 可抑制抗凋亡蛋白Bcl-2 的表达,促进凋亡蛋白Bax 与Caspase-3 的表达,促进损伤细胞的凋亡,而过表达Notch1 可逆转抑制miRNA-155 对损伤细胞的作用,抑制细胞凋亡,见图4。
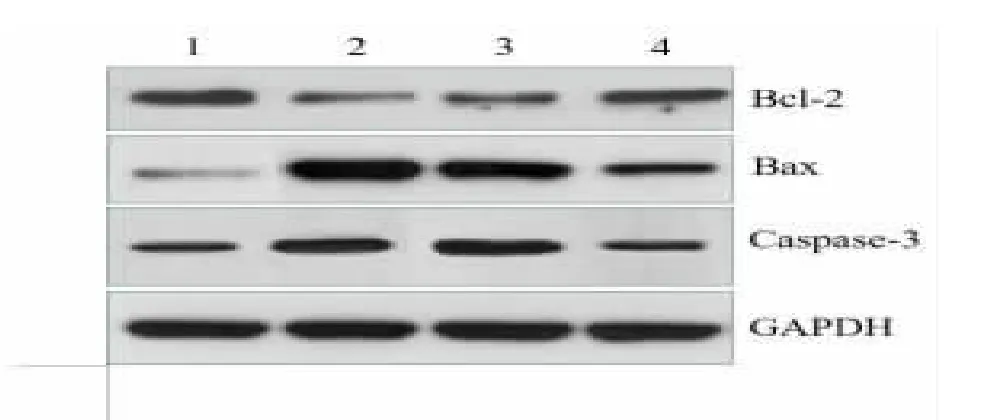
图4 抑制Notch1 可逆转miRNA-155 抑制剂对TLCs 诱导的AR42J 细胞中Bcl-2, Bax 与caspase-3 蛋白表达的影响
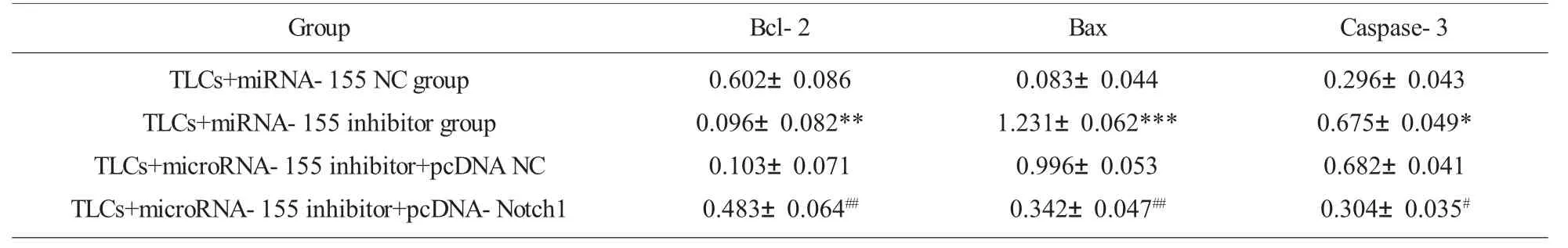
表2 抑制Notch1 可逆转miRNA-155 抑制剂对TLCs 诱导的AR42J 细胞中Bcl-2, Bax 与caspase-3 蛋白表达的影响
2.5 抑制miRNA-155 与Notch1 的表达后对细胞炎性因子的影响 正常对照组相比较,TLCs 模型组细胞中炎性因子IL-6,IL-32,IL-1β 及TNF-α 的含量显著升高;与TLCs 组相比较,TLCs+microRNA-155 inhibitor 组细胞中它们的含量显著下降;与TLCs+microRNA-155 inhibitor 组相比较,TLCs+microRNA-155 inhibitor+pcDNA-Notch1 组细胞中它们含量显著升高。这些结果说明,抑制microRNA-155 可减轻TLCs 诱导的AR42J 细胞损伤,减少炎性因子的释放,而过表达Notch1 可逆转了抑制microRNA-155 对TLCs 诱导的AR42J 细胞损伤的作用,促进炎性因子的释放,见表3。
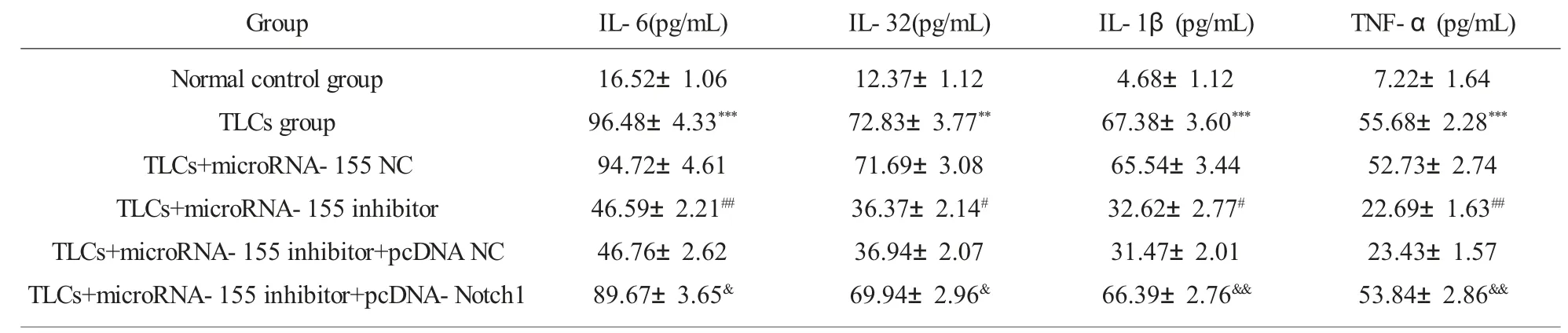
表3 抑制miRNA-155 与过表达Notch1 对TLCs 诱导的AR42J 细胞中炎性因子的影响。
3 讨论
早期的研究显示当AP 发生时,腺泡细胞往往会发生两种情况,即坏死与凋亡,前者与胰腺炎的严重程度呈正相关,后者与胰腺炎严重程度呈负相关,因此,抑制细胞坏死,促进细胞凋亡可减轻AP 的进一步恶化[7]。通过靶向治疗减少腺泡细胞坏死,促进其凋亡可成为临床治疗AP 的新的策略。
Notch 信号通路通过配体与受体的结合,引发细胞内部一系列的蛋白分解,激活其下游靶基因的转录,参与调解细胞的凋亡[8]。动物实验研究显示,Notch 信号通路参与小鼠AP 模型中细胞的凋亡[9],通过过度表达Notch1 可抑制胰腺细胞的凋亡,从而促使AP 的恶化[10]。
近年来,microRNA 的研究显示,多个miRNA参与AP 的发生发展,与诊断和预后相关[11-12,5],其中miRNA-155 的表达与AP 的发生密切相关[6]。本研究的结果也显示,miRNA-155 在模型细胞中的表达显著升高,同时Notch1 的表达也升高,这也与文献报道相一致。房裕钞等人的研究显示,miRNA-155 通过调控Notch 信号通路参与脑缺血-再灌注损伤[13],那么miRNA-155 是否是通过调控Notch信号通路参与对AP 的影响,还未见报道。
本研究中,抑制模型细胞中miRNA-155 表达后,细胞中Notch1 的表达也显著下降;抑制miRNA-155 后抗凋亡蛋白Bcl-2 的表达降低,而凋亡蛋白Bax 与Caspase-3 的表达升高;同时过表达Notch1 后,抗凋亡蛋白Bcl-2 的表达升高,而凋亡蛋白Bax 与Caspase-3 的表达降低。这些结果表明在AP 中,miRNA-155 正向调控Notch 信号通路,抑制miRNA-155 的表达后,可抑制Notch 信号通路的激活,进而促进AR42J 细胞凋亡,而过表达Notch1 后,可逆转抑制miRNA-155 对TLCs 诱导的AR42J 细胞的作用,抑制了细胞凋亡。
血清中TNF-α 及IL-6 等水平与炎性疾病的发展密切相关[14],抑制miRNA-155 通过靶向SIRT1缓解糖尿病小鼠高糖诱导的足细胞炎症[15]。吕芳等人的研究表明,在AP 大鼠模型中,IL-6、TGF-β、IL-32 及TNF-α 水平显示高表达,它们的水平升高也反应了机体的炎性状态,在对AP 诊断中具有重要意义,四项联合检测可以提高诊断效率[16]。本研究中,抑制模型细胞中miRNA-155 表达后,细胞培养液中IL-6、TGF-β、IL-32 及TNF-α 水平显著下降;同时过表达Notch1 后,它们的水平显著升高,表明在AP 中,抑制miRNA-155 的表达后,可减轻TLCs 诱导的AR42J 细胞损伤,而过表达Notch1 后,可逆转抑制miRNA-155 对AR42J 细胞损伤的减轻作用,促进细胞损伤。
综上所述,在TLCs 诱导的AP 模型AR42J 细胞中,通过抑制miRNA-155 可靶向下调Notch1 表达,抑制Notch 信号通路的激活,促进细胞凋亡,抑制炎性因子的释放,从而减轻TLCs 诱导的AP 模型细胞AR42J 的损伤。本研究结果表明,miRNA-155 和Notch 信号通路是AP 的潜在分子靶点,可为临床AP 的治疗提供了新的策略。
