纳米晶Cu-Co 合金在不同浓度H2SO4 溶液中耐蚀性能研究
2023-05-08王秀刘嘉欣范馨月周子力韩漾曹中秋王艳张轲辛士刚
王秀, 刘嘉欣, 范馨月, 周子力, 韩漾, 曹中秋,王艳, 张轲, 辛士刚
(沈阳师范大学化学化工学院,沈阳 110034)
与普通材料相比,纳米材料具有优异的物理和化学性能[1-4]。 在使用纳米材料之前,必须先解决其稳定性的问题。纳米化对材料耐蚀性能的影响如今已成为一个热点问题[5-14]。 MISHRA 等[15]采用电沉积法制备了纳米晶(8~28 nm)金属 Ni 和常规尺寸粗晶 Ni,并测试了它们在1 mol/L H2SO4溶液中的耐蚀性能,发现2 种金属Ni 都具有活性-钝化行为,开路电势、钝化电流密度和击穿电位都随晶粒尺寸的降低而增加,纳米晶金属Ni 的腐蚀速率低于粗晶Ni, 这表明纳米晶金属Ni 表面的阳极溶解存在较大的阻力。LUO 等[16]利用惰性气体冷凝及原位热压法成功制备了3D 大块纳米晶Cu,并研究了其耐蚀性能,发现在含Cl-介质中,纳米晶Cu 和粗晶Cu 表现出不同的极化行为,粗晶Cu 能产生二次钝化现象, 而纳米晶Cu 二次钝化消失。 纳米化后,腐蚀速率增大,耐蚀性能降低等。 CHIANPAIROT 等[17]利用反脉冲电沉积法制备了不同晶粒尺寸的Ni-W 纳米晶合金,并对它们在3.5%NaCl 溶液中的耐蚀性能进行了研究, 发现在碱性条件下,Ni-W 纳米晶合金腐蚀速率随晶粒尺寸的减小而逐渐加快;但在酸性条件下,Ni-W 纳米晶合金的腐蚀速率随晶粒尺寸的减小而逐渐减慢。此外,Ni-W 纳米晶合金还表现出更好的局部耐蚀性能。 MONACO L 等[18]研究了晶粒尺寸对 Ni-Fe 合金在H2SO4溶液中耐蚀性能的影响,发现常规尺寸和纳米晶Ni-Fe 合金表现出相似的活性-钝化-过钝化行为,在活性溶解区晶粒尺寸减小导致腐蚀电位稍微增加, 而腐蚀电流密度几乎不受晶粒尺寸变化的影响,晶粒尺寸降低几乎没有影响Ni-Fe 合金的耐蚀性能,纳米晶Ni-Fe 合金钝化性能略有提高,这归因于电沉积过程中产生的微量硫杂质等。杨学军等[19]研究了经过机械磨损处理表面纳米化的Cu-10Ni 合金在H2SO4溶液中的耐蚀性能,发现表面未经纳米化处理和经纳米化处理的Cu-10Ni 合金都产生了钝化现象,钝化区间相近,但维钝电流密度不同。Cu-10Ni 合金经纳米化处理后,其腐蚀速率明显加快,耐蚀性能降低, 且耐蚀性能随着Cu-10Ni 合金表面纳米化时间的增加而逐渐减弱。
综上所述,纳米化后,合金的腐蚀速率可能出现降低、基本保持不变或增加的情况,但纳米材料的腐蚀机理仍不明晰,尚需进一步的研究。 目前,有关块体纳米晶二元合金的研究依然较少, 仍然主要集中在涂层和表面纳米化上。 合金的耐蚀性能与腐蚀介质有关,H2SO4溶液是工业上常见的腐蚀介质, 破坏性强,H+不仅参与阴极析氢或吸氧反应,有时还可能参与阳极溶解反应,H2SO4溶液浓度对合金的腐蚀速率也会产生一定的影响。 因此,本文研究液相还原法通过热压制备的Cu-50Co (原子百分比) 纳米晶(Nanocrystalline,NC)和 粗 晶 (Coarse Grained,CG)块体合金在H2SO4溶液中的耐蚀性能,以及溶液浓度和纳米化对其耐蚀性能的影响,为进一步探究纳米材料的腐蚀机理、加快其应用提供理论和技术支撑。
1 实 验
实验所用的样品Cu-50Co 纳米晶和粗晶块体合金是通过热压液相还原法制备的粉末而获得。 用4%NaBH4碱溶液调节等物质量的反应物 CoCl2和CuSO4乙醇溶液的pH=11, 恒温60 ℃后加入还原剂水合肼, 通过添加或不添加表面分散剂PVP, 获得Cu-50Co 纳米晶和粗晶合金粉末。 将合金粉末在820 ℃和 86 MPa 下热压 10 min 后, 然后冷却至室温, 排水法测得Cu-50Co 纳米晶和粗晶块体合金的相对密度分别为99.1%和98.6%。 采用X-ray 衍射方法,利用Jade6 软件,测定Cu-50Co 纳米晶块体合金的平均晶粒尺寸约为26.6 nm。
采用电化学方法, 利用PMC 多功能电化学工作站(美国Princeton 公司),在三电极体系中分别测试开路电位随时间变化曲线、极化曲线、Arrhenius 曲线以及电化学阻抗谱。 将Cu-50Co 纳米晶和粗晶块体合金切割大小为1 cm×1 cm×1.5 cm 试样, 与细铜丝焊接固定好后,用环氧树脂将其牢牢封固,切割面露出并用砂纸抛光,酒精清洗后,作为工作电极;辅助电极为与工作电极平行的纯金属铂片;参比电极为靠近工作电极并置于鲁金毛细管内的饱和甘汞电极(SCE)。 腐蚀介质为 H2SO4溶液,其浓度分别为 0.1、0.2、0.4、0.6、0.8 mol/L,所有使用的试剂均为分析纯,所用溶液均为二次去离子水所配制。 用2 mV/s 的扫描速率对动电位极化曲线进行测试, 使用CView 软件拟合动电位极化曲线,获得相应的参数包括腐蚀电流密度、 腐蚀电位以及阴极和阳极的塔菲尔斜率等。从高频100 kHz 到低频0.05 Hz 对电化学阻抗谱进行测试,使用ZView 软件拟合电化学阻抗谱,获得相应的等效电路元件参数包括溶液电阻、电化学反应电阻以及表征常相角元件的常数和指数项。活化能测试在0.1 mol/L H2SO4溶液中进行,实验温度分别为20、40、60、80 ℃
2 实验结果与讨论
2.1 开路电位—时间曲线
图1 给出了在 H2SO4溶液中2 种 Cu-50Co 合金从开始到60 min 的开路电位随时间变化曲线。 可以看出,CG Cu-50Co 和NC Cu-50Co 合金的自腐蚀电位在较短时间内均能很快达到稳态。 图1(a)所示为CG Cu-50Co 合金在H2SO4溶液中从开始到60 min内,其开路电位随时间变化相对应的曲线。 当H2SO4溶液浓度分别为 0.1、0.2、0.4、0.6、0.8 mol/L 时, 其自腐蚀电位依次-354、-363、-369、-389、-517 mV,逐渐变负,腐蚀倾向逐渐变大,这主要是因为H+参与阴极去极化反应,浓度越高,反应活性越高,反应倾向越大,达到稳态后,导致阳极溶解反应的倾向即腐蚀倾向也变大。图1(b)所示为NC Cu-50Co 合金在H2SO4溶液中从开始到60 min 内, 其开路电位随时间发生变化相对应的曲线。 当H2SO4溶液浓度分别为0.1、0.2、0.4、0.6、0.8 mol/L 时,其自腐蚀电位依次为-286、-247、-233、-225、-219 mV,逐渐变正,腐蚀倾向逐渐变小,这主要是因为H+参与阴极去极化反应,浓度越高,反应活性越高,反应倾向越大,达到稳态后,导致阳极溶解反应的倾向变大,但纳米化后如果阳极钝化倾向也变大,腐蚀倾向也可能变小。 图2(a)给出了CG Cu-50Co 和 NC Cu-50Co 合金在 H2SO4溶液内的自腐蚀电位对比图。 可知,H2SO4溶液相同时,NC Cu-50Co 合金的腐蚀倾向低于CG Cu-50Co 合金,这主要是因为当H+浓度相同时, 纳米化后导致表面活性原子数增多,如果阳极反应钝化倾向较大,腐蚀倾向可能变小。

图1 在H2SO4 溶液中两种合金开路电位随时间变化曲线Fig. 1 Curves of open-circuit potential change with time in H2SO4 solutions


图2 在H2SO4 溶液中CG Cu-50Co 和NC Cu-50Co 合金的比较Fig. 2 Comparative diagram for both CG Cu-50Co and NC Cu-50Co alloys in H2SO4 solutions
2.2 极化曲线
图3 给出了在 H2SO4溶液中2 种 Cu-50Co 合金以2 mV/s 扫描速率测定的动电位极化曲线。 利用CView 软件拟合极化曲线,所得到的腐蚀电化学参数列于表 1 中。 可以看出,2 种 Cu-50Co 合金的腐蚀电流密度都随溶液浓度的升高而变大,因此腐蚀速率加快,耐蚀性能减弱。这主要是因为,H+参与阴极去极化反应,H2SO4溶液浓度越高,反应速率越快,通过耦合导致阳极溶解反应加快。 同时,H+也可能直接参与阳极溶解反应,H2SO4溶液浓度越高, 阳极溶解反应速度也越快。

图3 在H2SO4 溶液中2 种合金的极化曲线Fig. 3 Polarization curves of both alloy in H2SO4 solutions
当极化电位较低时, 在H2SO4溶液中2 种Cu-50Co 合金都能产生弱的钝化现象, 维钝电流密度受极化电位的影响。 当极化电位较高时,CG Cu-50Co合 金 在 0.4、0.6、0.8 mol/L H2SO4溶 液 中 ,NC Cu-50Co 合金在0.6、0.8 mol/L H2SO4溶液中均产生了钝化,但钝化区间很短,维钝电流密度不受极化电位的影响而发生改变。 2 种Cu-50Co 合金发生钝化的致钝电位Ep和维钝电流密度Ip也列于表1 中。 由表1可以发现,溶液浓度升高,其维钝电流密度也相应增加,这主要是因为H+对钝化膜有破坏作用,浓度增加,破坏作用加大,相应的维钝电流密度增加。 再有,H2SO4溶液相同时,NC Cu-50Co 合金的维钝电流密度却比CG Cu-50Co 合金小。 这主要是因为一方面,纳米晶中含有许多的晶界, 表面活性原子数增多,这可能使钝性元素更易钝化,从而在合金表面容易形成钝化膜,钝化电流密度变小;另一方面,纳米晶合金形成的钝化膜晶粒尺寸细小,可以加速钝化膜的溶解速率,从而增加钝化电流密度[20-21]。 在 H2SO4溶液中,第一方面占主导。
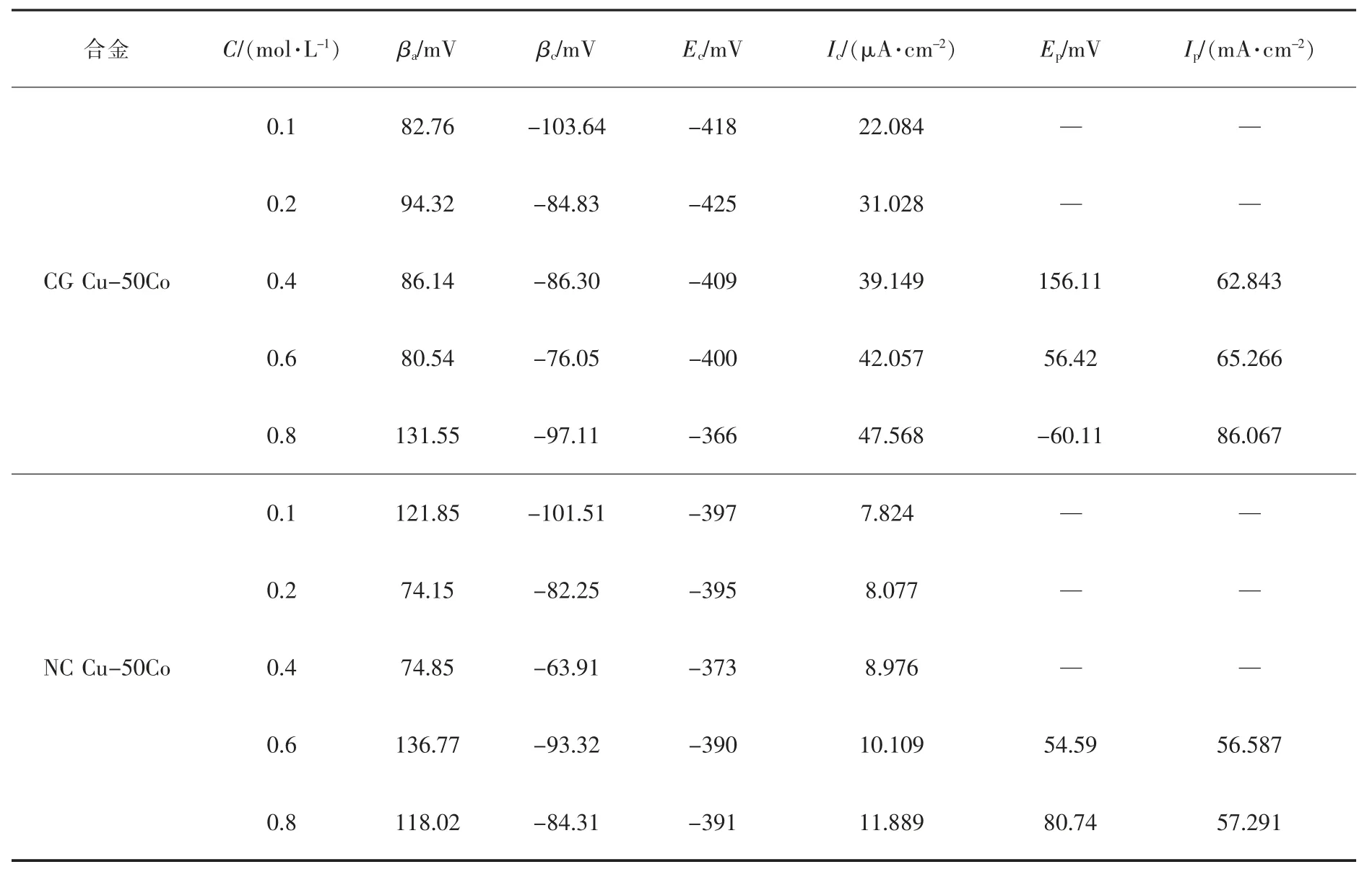
表1 在H2SO4 溶液中CG Cu-50Co 和NC Cu-50Co 合金极化曲线拟合获得电化学参数Table 1 Fitted electrochemical parameters of polarization curves for both CG Cu-50Co and NC Cu-50Co alloys in H2SO4 solutions
图2(b)给出了在 H2SO4溶液中 CG Cu-50Co 和NC Cu-50Co 合金的腐蚀电流密度对比曲线图。 可以看出, 溶液浓度相同,NC Cu-50Co 合金的腐蚀电流密度明显小于CG Cu-50Co 合金,说明其相对应的腐蚀速率更低,也就说明其耐蚀性能更好,即纳米化改善了Cu-50Co 合金的耐蚀性能。 这主要是因为采用液相还原法通过添加表面分散剂能阻止晶粒的长大,晶粒尺寸较小(纳米级),因此合金中产生大量的晶界,晶界原子能量较高,表面活性原子数增多,这可能导致活性元素溶解的速度增加, 使合金的腐蚀速率增大,但这些也能使钝性元素更易钝化,使合金的腐蚀速率降低。 当钝性元素起主导作用时,合金的腐蚀速率将呈现下降趋势。 因此, 纳米化后的Cu-50Co 合金腐蚀速率会降低。
2.3 活化能曲线
为了进一步探究纳米化对Cu-50Co 合金耐蚀性能的影响,分别测定了CG Cu-50Co 和NC Cu-50Co合金在0.1 mol/L H2SO4溶液中不同温度下的极化曲线,拟合获得了相应的腐蚀电流密度Ic,以lgIc对1/T作图, 即为 2 种 Cu-50Co 合金在 0.1 mol/LH2SO4溶液中的 Arrhenius 曲线, 如图 4 所示。 事实上, 依据Faraday 定律,腐蚀反应速率可用腐蚀电流密度Ic表征,腐蚀电流密度Ic越大,腐蚀速率越快。 再有,依据Arrhenius 公式, 腐蚀反应速率与Ae-Ea/RT 成正比,即lgIc与 1/T 呈线性关系,其斜率为-Ea/R。 因此,腐蚀反应的活化能Ea可由直线斜率Ea/R 计算获得。 活化能越大, 合金中活性组元溶解所需的能量越高,其溶解速率越慢,说明合金的腐蚀速率越小。 对图4 中CG Cu-50Co 和 NC Cu-50Co 合金的 Arrhenius 曲线进行线性拟合, 获得的直线斜率分别为-1 027.1和-1 669.6, 经计算它们对应的活化能分别为19.67 kJ/mol 和 31.97 kJ/mol。 与 CG Cu-50Co 合金相比,NC Cu-50Co 合金具有更高的活化能, 这表明NC Cu-50Co 合金腐蚀速率更慢。

图4 CG Cu-50Co 和 NC Cu-50Co 合金在0.1 mol/L H2SO4 溶液中 Arrhenius 曲线Fig. 4 Arrhenius curves of both CG Cu-50Co and NC Cu-50Co alloys in 0.1 mol/L H2SO4 solutions
2.4 电化学阻抗谱
图5 给出了在 H2SO4溶液中 2 种 Cu-50Co 合金的电化学阻抗谱,频率范围为0.05 Hz~100 kHz,图6给出了电化学阻抗谱的等效电路图(Rs为溶液电阻,Rt为电化学反应电阻,CPE 为常相角元件)。 等效电路常相角元件 CPE 值可用 CPE-T 和 CPE-P 表征[22-23],其中 CPE-T 和 CPE-P 值可通过公式 Z=T-1ω-P[cos(Pπ/2)-jsin(Pπ/2)]获得(Z 为阻抗;T 为常数;ω 为角频率;P 为指数;j 为阻抗虚部)。利用ZView软件,根据图6 所示的等效电路图拟合图5 中的电化学阻抗谱,得到的等效电路元件参数列于表2 中。 可以看出,在 0.1、0.2、0.4、0.6、0.8 mol/L H2SO4溶液中,CG Cu-50Co 和NC Cu-50Co 合金的电化学阻抗谱都只出现一个容抗弧,说明腐蚀过程是通过电化学反应所控制。 溶液浓度升高,2 种Cu-50Co 合金的极化电阻都呈递减趋势, 说明其腐蚀速率逐渐增大,耐蚀性能降低。 图7 给出了在H2SO4溶液中2 种Cu-50Co 合金的电化学反应电阻变化对比图。 可见,溶液浓度相同,NC Cu-50Co 合金的电化学反应电阻较CG Cu-50Co 合金大,这表明纳米化后,腐蚀速率变小,与极化曲线所得结论相同。 图8 给出了在0.1 mol/L H2SO4溶液中 CG Cu-50Co 和 NC Cu-50Co 合金的电化学反应电阻(Rt)、腐蚀电流密度(Ic)及活化能(Ea)的对比图。 可以看出,纳米化后,电化学反应电阻和活化能均增加,腐蚀电流密度降低,所以Cu-50Co 合金的腐蚀速率降低,从而提高了其耐蚀性能。

图7 在H2SO4 溶液中CG Cu-50Co 和NC Cu-50Co 合金电化学反应电阻的比较Fig. 7 Comparative diagram of charge transfer resistances for both CG Cu-50Co and NC Cu-50Co alloys in H2SO4 solutions

表2 在H2SO4 溶液中CG Cu-50Co 和NC Cu-50Co 合金电化学阻抗谱拟合获得的等效电路元件参数Table 2 Fitted equivalent circuit parameters of electrochemical impedance microscopies for both CG Cu-50Co and NC Cu-50Co alloys in H2SO4 solutions

图5 在H2SO4 溶液中2 种Cu-50Co 合金从100 kHz 到0.05 Hz 测得电化学阻抗谱Fig. 5 Electrochemical impedance microscopies for two Cu-50Co alloys from 100 kHz to 0.05 Hz in H2SO4 solutions

图6 在H2SO4 溶液中CG Cu-50Co 和NC Cu-50Co 合金等效电路示意Fig. 6 Equivalent circuit diagram of both CG Cu-50Co and NC Cu-50Co alloys in H2SO4 solutions
3 结 论
1) CG Cu-50Co 合金的腐蚀倾向随 H2SO4溶液浓度的升高而逐渐增大,而NC Cu-50Co 合金的腐蚀倾向则逐渐降低;当H2SO4溶液浓度相同时,NC Cu-50Co 合金腐蚀倾向小于CG Cu-50Co 合金。
2) CG Cu-50Co 和 NC Cu-50Co 合金的腐蚀速率均随H2SO4溶液浓度的升高而逐渐加快; 当H2SO4溶液浓度相同时,NC Cu-50Co 合金的腐蚀速率小于CG Cu-50Co 合金。
3) CG Cu-50Co 和 NC Cu-50Co 合金的电化学阻抗谱均仅出现一个单容抗弧,它们的电化学反应电阻均随H2SO4溶液浓度的升高而逐渐降低;当H2SO4溶液浓度相同时,NC Cu-50Co 合金的电化学反应电阻和活化能均大于CG Cu-50Co 合金。 可见,H2SO4溶液浓度升高,Cu-50Co 合金腐蚀速率增加,其耐蚀性能下降; 纳米化后, 降低了Cu-50Co 合金腐蚀速率,提高了其耐蚀性能。
