甘草提取物的生物功能评价及相关质量标志物预测
2023-05-08刘鸣畅杨艳歌吴亚君
杨 悦,刘鸣畅,杨艳歌,吴亚君
(中国检验检疫科学研究院,北京 100176)
甘草是一种用途极其广泛的经济作物,不仅是我国二级保护野生药材资源,还是家畜采食的一种优良牧草,具有巨大的经济价值。此外,甘草具有耐热耐旱的特性,多生长在荒漠草原、沙漠边缘和黄土丘陵地带,是为数不多能够种植于干旱、半干旱区的自然植被,作为草地资源生态系统中重要的一员,甘草具有重要的生态价值。甘草在亚洲、美洲、欧洲等地均有种植,我国西北地区分布最多,作为草药中最典型的一种中药材,甘草是当地一种重要的经济作物[1]。甘草的应用领域日益扩大,除最主要的中药用途外,甘草还广泛应用于食品、烟草添加品及饲料添加剂等。近年来,随着科学研究的深入,甘草优秀的美容护肤功效亦得到挖掘,伴随其作为植物原料所具有的天然、绿色、安全等优点,甘草被越来越多地应用于化妆品领域[2]。
甘草(licorice)是豆科植物乌拉尔甘草(Glycyrrhiza uralensisFisch.)、胀果甘草(G.inflataBat.)和光果甘草(G.glabraL.)的干燥根和根茎[3]。研究表明,甘草提取物中含有大量皂苷类、黄酮类以及多糖类活性成分[4-5],具有保湿[6]、美白[7]、抗氧化[8]、防晒[9]、抑菌[10]、抗炎[11]等作用,且温和、安全性高[12],可广泛应用在化妆品领域。但上述各项护肤功效研究多集中于单一品种甘草或甘草中的活性成分单体,如甘草酸、光甘草定、甘草查尔酮等,而根据国内较权威的美妆全产业链大数据服务平台美丽修行的统计数据显示,各品种甘草的粗提混合物在备案有效商品中的使用次数远远高于活性成分单体,相关研究数据不足严重限制了甘草类植物化妆品的精准开发、正确选用及品质监控,因此,为了指导甘草类化妆品的开发及选用,以及制定更加贴合于市售甘草类化妆品实际情况的质量评价体系,针对不同品种甘草粗提物护肤相关生物功能的比较性评价以及质量标志物(Q-Marker)筛选研究意义重大。
本研究以商品乌拉尔甘草、光果甘草和胀果甘草提取物为研究对象,测定3种甘草提取物中的主要活性成分含量,选取以甘草作为关键词的化妆品主要宣称的保湿、美白提亮等功效,在细胞学水平对3 种甘草提取物的上述生物功能进行评价,并分析各主要活性成分含量与上述生物功能间的相关性,筛选出护肤效果最佳的甘草品种,同时筛选出可指示甘草护肤活性优劣的质量标志物,为甘草作为化妆品原料的开发利用及质量判别提供数据支持。
1 材料与方法
1.1 材料
供试乌拉尔甘草提取物(批号GU202006008)、胀果甘草提取物(批号GI202006003)、光果甘草提取物(批号GG202006014)由青海省青海湖药业有限公司惠赠。供试人永生化角质形成细胞HaCaT、小鼠黑色素瘤细胞B16F10购于中国医学科学院基础医学研究所基础医学细胞中心。
供试GibcoTM DMEM/高糖培养基、0.25%胰蛋白酶溶液、磷酸缓冲盐溶液(Phosphate buffer saline,PBS)购于赛默飞公司。胎牛血清(fetal bovine serum,FBS)购于Hyclone公司。二甲基亚砜(Dimethyl sulfoxide,DMSO)、青霉素-链霉素双抗溶液购于Sigma 公司。细胞活力检测试剂盒(cell counting kit-8,CCK-8)购自日本同仁公司。人水通道蛋白3(aquaporin 3,AQP-3)ELISA 试剂盒、人透明质酸(hyaluronic acid,HA)ELISA 试剂盒购于CUSABIO 科技有限公司。酪氨酸酶活性检测试剂盒(微量法)购于北京索莱宝科技有限公司。D(+)-无水葡萄糖标准品(纯度≥98%,批号S08J6G1)购于上海源叶生物科技有限公司。甘草酸(纯度≥98%,批号D0708AS)、甘草苷(纯度≥98%,批号J1016AS)、光甘草定(纯度≥98%,批号D1204AS)、异甘草苷(纯度≥98%,批号J0637AS)、甘草素(纯度≥98%,批号N0324AS)、甘草次酸(纯度≥98%,批号N1110AS)、异甘草素(纯度≥98%,批号J1109AS)等标准品购于大连美仑生物技术有限公司。HPLC 级试剂(甲醇、乙腈、磷酸溶液)购于国药集团化学试剂有限公司。供试去离子水采用Mili-Q SP Reagent Water系统进行处理。其余化学试剂均为分析纯等级。
1.2 方法
1.2.1 甘草提取物溶液的制备 取甘草提取物粉末,加热水溶解,制成浓度为100 mg·mL-1的水溶液,用0.22 μm滤膜过滤后备用。
1.2.2 甘草提取物中总黄酮、总皂苷及总多糖含量测定 甘草提取物中总黄酮含量测定在冯薇等[13]的方法基础上加以改进。称取甘草苷对照品于10 mL容量瓶中,用甲醇溶解定容至刻度,制得0.5 mg·mL-1的甘草苷储备液。精确吸取甘草苷储备液0,0.5,1.0,1.5,2.0,2.5 mL依次置于10 mL容量瓶中,各加入1 mL 70%甲醇溶液摇匀后,再加入10%NaOH 2.5 mL 显色,10 min 后用70%甲醇溶液定容至刻度,采用多功能酶标仪在410 nm 波长下测定吸光度。以甘草苷浓度(mg·mL-1)为横坐标,吸光度值为纵坐标,绘制标准曲线并计算回归方程。样品测定时,将甘草提取物溶液稀释适当倍数后取0.5 mL 置于10 mL 容量瓶中,后续操作同标准曲线测定,测定吸光值后根据标准曲线和稀释倍数换算样品中的总黄酮含量。
甘草提取物中总皂苷含量测定参考兰霞等[14]的方法,并加以改进。称取甘草酸对照品于10 mL容量瓶中,用甲醇溶解定容至刻度,制得1.5 mg·mL-1的甘草酸储备液。精确吸取甘草酸储备液0,0.1,0.2,0.3,0.4,0.5 mL依次置于10 mL 容量瓶中,70 ℃水浴挥干溶剂,加入0.2 mL 的5%香草醛-冰醋酸溶液,再加入0.8 mL 的高氯酸,摇匀,于55 ℃水浴中反应20 min,立即取出用流水冷却至室温,加入冰醋酸定容至刻度,采用多功能酶标仪在600 nm波长下测定吸光度。以甘草酸浓度(mg·mL-1)为横坐标,吸光度值为纵坐标,绘制标准曲线并计算回归方程。样品测定时,将甘草提取物溶液稀释适当倍数后取0.5 mL 置于10 mL 容量瓶中,后续操作同标曲测定,测定吸光值后根据标准曲线和稀释倍数换算样品中的总皂苷含量。
甘草提取物中总多糖含量测定参考薛薇[15]的方法进行。采用苯酚-硫酸法测定样品中的总糖含量[16],同时采用直接滴定法(葡萄糖作为标准品)测定样品中的还原糖含量[17],最终,用甘草提取物中的总糖含量减掉还原糖含量求得其中总多糖的含量。
1.2.3 高效液相色谱法(HPLC)测定甘草酸等7种主要活性成分含量 甘草提取物中甘草酸、甘草苷、光甘草定、异甘草苷、甘草素、甘草次酸、异甘草素等主要活性成分含量测定参考杨耘等[18]的方法,并加以改进。采用配有2996 光电二极管阵列(photo-diode array,PDA)检测器的Waters 2695 HPLC 液相色谱仪检测3 种甘草提取物中甘草酸、甘草苷、光甘草定、异甘草苷、甘草素、甘草次酸、异甘草素等7种活性成分的含量。色谱柱为C18 色谱柱(4.6 mm×250 mm,5 μm),柱温40 ℃,流速1 mL·min-1,检测波长分别为237 nm(甘草酸、甘草苷、光甘草定、甘草素和甘草次酸)、370 nm(异甘草苷和异甘草素),进样量20 μL,流动相为:乙腈(A)- 0.05%磷酸水溶液(B),按表1中的程序进行梯度洗脱。

表1 梯度洗脱程序Table 1 Gradient elution procedure
1.2.4 甘草提取物的细胞毒性测定 用无血清培养基将各提取物样品配制成一系列梯度剂量组。培养细胞,并铺于96 孔细胞培养板中,待生长24 h 后,将梯度浓度的甘草提取物溶液加入培养好的细胞中,每孔100 μL,在37 ℃,5%CO2的培养箱中培养24 h,采用CCK-8 法检测各组细胞活力,并采用SPSS 22.0 软件计算3 种甘草提取物针对不同细胞株的半数抑制浓度(IC50)以及安全剂量阈值,即细胞90%活率所对应的甘草提取物浓度值(CV90)。
1.2.5 HaCaT细胞AQP3及HA表达量测定 将HaCaT 细胞以每孔2×105个的密度接种于12 孔细胞培养板,于37 ℃,5%CO2的培养箱中培养24 h,去除培养液,加入用无血清培养基配制的梯度浓度的甘草提取物溶液,空白对照组(control)只加入无血清培养基,于37 ℃、5%CO2条件下继续培养24 h,分别收集各试验组的培养细胞和上清液,按照人AQP3 ELISA 试剂盒说明书要求检测细胞中的AQP3表达量,按照人HA ELISA 试剂盒说明书要求检测培养上清液中的HA表达量。
1.2.6 B16F10细胞黑色素抑制率测定 细胞黑色素抑制率参考查雨锋等[19]的方法进行测定。将B16F10 细胞以每孔3×105个的密度接种于6孔细胞培养板,于37 ℃,5%CO2的培养箱中培养24 h,去除培养液,加入用无血清培养基配制的梯度浓度的甘草提取物溶液,空白对照组只加入无血清培养基,于37 ℃,5%CO2条件下继续培养48 h 后,用PBS 清洗细胞2 次,每孔加入400 μL 浓度为1.0 mol·L-1的NaOH,再加入100 μL DMSO,75 ℃水浴1.5 h 以使细胞内的黑色素完全溶解,各吸200 μL 转移至96 孔板中,于450 nm 波长处测定吸光度值,并按照下列公式计算样品对B16F10细胞黑色素合成的抑制率。
1.2.7 B16F10细胞酪氨酸酶抑制率测定 将B16F10 细胞以每孔3×105个的密度接种于6 孔细胞培养板,于37 ℃,5%CO2的培养箱中培养24 h,去除培养液,加入用无血清培养基配制的梯度浓度的甘草提取物溶液,空白对照组只加入无血清培养基,于37 ℃,5%CO2条件下继续培养48 h后收集细胞,根据酪氨酸酶活性检测试剂盒说明书要求检测细胞中的酪氨酸酶活性,并按照下列公式计算样品对细胞酪氨酸酶活性的抑制率。
1.3 数据处理统计分析
使用SPSS 22.0进行t检验和单因素方差分析,认为p≤0.05具有统计学意义。所有试验均重复3次,数据以平均值±标准差(mean±SD)表示。使用SPSS 22.0进行双变量相关性分析,相关系数选择Pearson,显著性检验选择双尾检验。采用WPS及GraphPad Prism 9软件进行图表处理。
2 结果与分析
2.1 甘草提取物中总黄酮、总皂苷及总多糖含量
本研究定量了3 种甘草提取物中总黄酮、总皂苷及总多糖的含量,以及甘草酸、甘草苷、光甘草定、异甘草苷、甘草素、甘草次酸、异甘草素等7种主要活性单体的含量,定量结果表明(表2),以干燥提取物中所含活性成分的质量来计算,乌拉尔甘草中的总皂苷、甘草苷、甘草酸及异甘草素含量具有显著优势(p≤0.01),光果甘草中的总黄酮、异甘草苷和光甘草定含量具有显著优势(p≤0.01),胀果甘草中的总多糖、甘草素和甘草次酸含量具有显著优势(p≤0.01)。
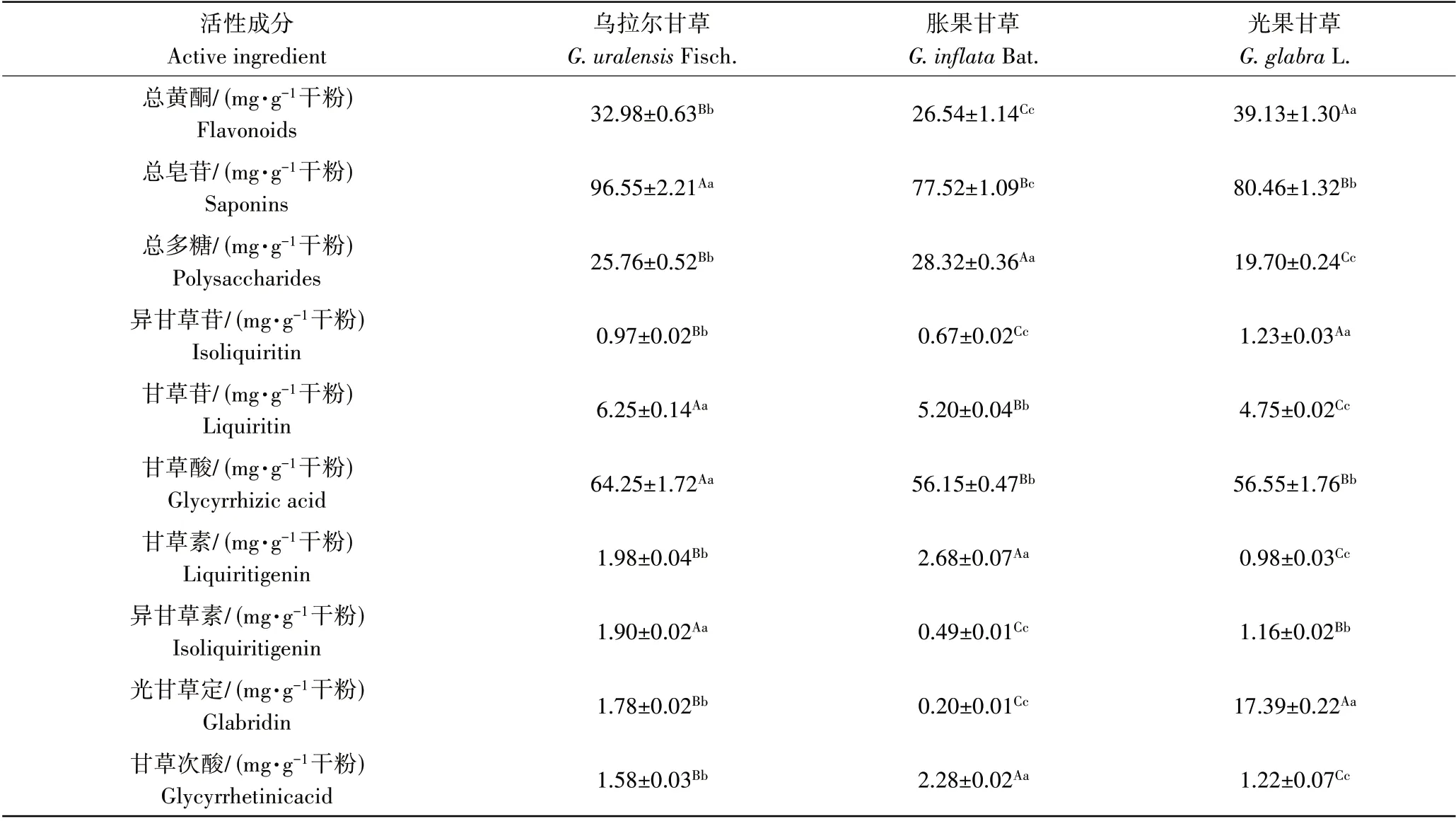
表2 3种甘草提取物中总黄酮、总皂苷及总多糖含量Table 2 Contents of flavonoids, saponins and polysaccharides in three kinds of licorice extracts
2.2 甘草提取物的细胞毒性
3 种甘草提取物分别作用于HaCaT 细胞以及B16F10 细胞24 h 后,采用CCK-8 法检测细胞活力,进而计算出3 种甘草提取物针对不同细胞株的IC50 以及CV90,结果表明(表3),以IC50 表示甘草提取物的细胞毒性,IC50越低,细胞毒性越大。以CV90表示甘草提取物作用于细胞的安全浓度阈值,认为在该阈值范围内的药物浓度不会对细胞增殖产生显著影响,可作为后续指标测定的药物浓度阈值参考。试验结果显示,针对HaCaT细胞以及B16F10 细胞,光果甘草均表现出最强的细胞毒性,针对HaCaT 细胞胀果甘草的细胞毒性最弱,针对B16F10细胞乌拉尔甘草的细胞毒性最弱。上述试验结果之间均具有统计学显著性差异(p≤0.01)。
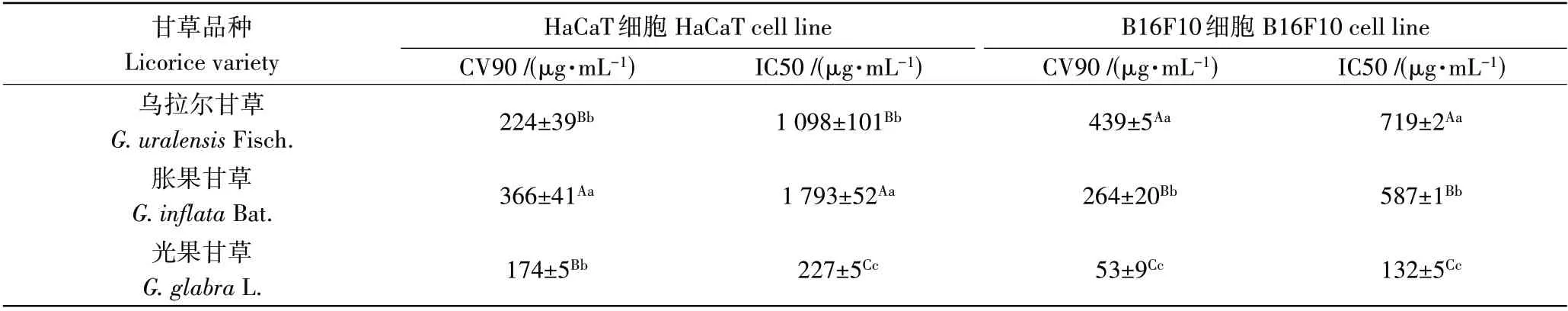
表3 3种甘草提取物对不同细胞系的毒性效应Table 3 Toxic effects of three kinds of licorice extracts on different cell lines
2.3 甘草提取物的保湿活性
本研究将安全浓度阈值(表3)内的3 种甘草提取物作用于HaCaT 细胞,测试细胞培养物中的AQP3 和HA表达量,利用上述指标可表征甘草提取物的保湿活性。受试物处理后,细胞中AQP3和HA表达量越高,说明受试物的保湿活性越强[20]。由图1A 可知,3 种甘草提取物均能够显著上调细胞AQP3 表达量(p≤0.01),且具有浓度依赖性。在测试浓度范围内,乌拉尔甘草、胀果甘草、光果甘草分别在100,100,50 μg·mL-1时达到最佳作用效果,在最佳作用浓度下,3 种受试物处理组的细胞AQP3 表达量分别为4.06,3.98,2.97 ng·mL-1,3 种甘草提取物的AQP3上调活性排序为:乌拉尔甘草>胀果甘草>光果甘草,乌拉尔甘草和胀果甘草的最佳作用效果显著优于光果甘草(p≤0.01),而此二者之间无显著性差异。由图1B 可知,3 种甘草提取物对细胞HA 表达量的影响不明显,仅在最佳作用浓度(乌拉尔甘草50 μg·mL-1、胀果甘草25 μg·mL-1、光果甘草50 μg·mL-1)条件下能观察到显著的HA 上调活性(p≤0.05)。最佳作用浓度下,3 种受试物处理组的细胞HA 表达量分别为4.33,4.69,4.32 ng·mL-1,3种甘草提取物的HA上调活性排序为:胀果甘草>乌拉尔甘草>光果甘草,3种甘草提取物的最佳作用效果之间无显著性差异。根据上述试验结果推断,3种甘草提取物均具有皮肤保湿生物功能,其保湿活性可能更加依赖于对细胞AQP3含量的调节,3种甘草中乌拉尔甘草和胀果甘草的保湿活性优于光果甘草。
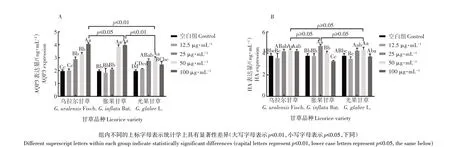
图1 3种甘草提取物对HaCaT细胞AQP3(A)和HA(B)表达量的影响Figure 1 Effects of three kinds of licorice extracts on AQP3(A)and HA(B)expressions in HaCaT cells
2.4 甘草提取物的美白活性
用安全浓度阈值内的3 种甘草提取物处理B16F10 细胞(表3),测试受试物的细胞黑色素及酪氨酸酶抑制率,利用上述指标可表征甘草提取物的美白活性,细胞黑色素及酪氨酸酶抑制率越高,说明受试物的美白活性越强[21-22]。由图2A 可知,3 种甘草提取物均能够显著抑制细胞黑色素表达(p≤0.01),且具有浓度依赖性。在测试浓度范围内,乌拉尔甘草、胀果甘草、光果甘草均在50 μg·mL-1时达到最佳黑色素抑制效果,最佳作用浓度下,3 种受试物的细胞黑色素抑制率分别为12.1%、5.1%和36.1%,3 种甘草提取物的细胞黑色素抑制活性排序为:光果甘草>乌拉尔甘草>胀果甘草,光果甘草的最佳黑色素抑制活性显著优于其他品种甘草(p≤0.01)。由图2(B)可知,光果甘草提取物能够显著抑制细胞酪氨酸酶活性(p≤0.01),且具有浓度依赖性,其最佳作用浓度为50 μg·mL-1,此浓度下光果甘草提取物的细胞酪氨酸酶抑制率为28.9%。乌拉尔甘草提取物对细胞酪氨酸酶的抑制作用较弱,仅在浓度为50 μg·mL-1时表现出显著的酪氨酸酶抑制活性(p≤0.01),此浓度下乌拉尔甘草提取物的细胞酪氨酸酶抑制率为4.8%。而胀果甘草提取物在测试浓度范围内未显示细胞酪氨酸酶抑制活性。3种受试物的细胞酪氨酸酶抑制活性排序为:光果甘草>乌拉尔甘草>胀果甘草,与其他品种相比,光果甘草的酪氨酸酶抑制活性具有显著优势(p≤0.01)。根据上述结果推断,3 种受试样品中光果甘草提取物的美白活性最强,而胀果甘草提取物几乎不具备美白活性。
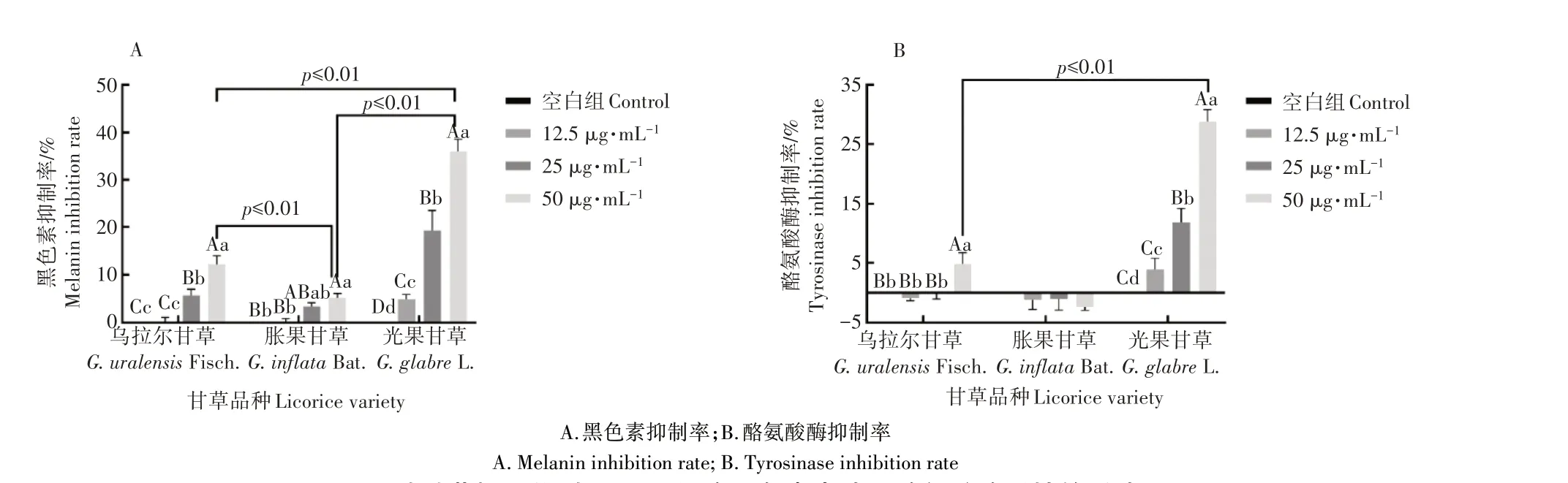
图2 3种甘草提取物对B16F10细胞黑色素表达和酪氨酸酶活性的影响Figure 2 Effects of three kinds of licorice extracts on melanin expression and tyrosinase activity in B16F10 cells
2.5 甘草提取物中主要活性成分含量与护肤相关生物功能之间的相关性分析
上述研究结果显示,3种甘草提取物中总黄酮、总皂苷、总多糖、异甘草苷、甘草苷、甘草酸、甘草素、异甘草素、光甘草定及甘草次酸等活性成分的含量有显著差异,其保湿和美白生物活性也不尽相同。为了研究不同甘草提取物中各活性成分含量与美白、保湿生物功能之间的相关性,并进一步筛选出可用于指示各项生物功能优劣的质量标志物,本研究在保证3 种甘草提取物浓度相同的前提下,针对不同的护肤相关生物功能,从受试物各浓度组中挑选出活性最优的浓度组别。以受试物中各种活性成分的含量为自变量,所选组别的AQP3表达量、HA 表达量、黑色素抑制率和酪氨酸酶抑制率为因变量,分析各活性成分含量与各生物功能评价指标间的Pearson 相关系数(绝对值越接近1,则相关程度越强,而相关系数的绝对值越接近0,相关程度越弱,绝对值为0.8~1为强相关)[23]。本研究中用于相关性分析的特征参数如表4所示,相关性分析结果见表5。保湿生物功能方面,AQP3 表达量与总多糖及甘草素呈强正相关,但相关性不显著;HA 表达量与甘草次酸呈强正相关,但相关性不显著;与AQP3 表达量和HA 表达量同时呈现正相关性的有总多糖、甘草素和甘草次酸等,且Pearson相关系数绝对值均超过0.6,说明相关性较强,指示上述成分可能具有比较明确的保湿活性。美白生物功能方面,光甘草定与细胞黑色素及酪氨酸酶抑制率均呈显著正相关(p≤0.05),与之类似,总黄酮和异甘草苷亦与细胞黑色素及酪氨酸酶抑制率呈现强正相关性,但相关性不显著,说明光甘草定具有明确的美白活性,总黄酮和异甘草苷具有比较明确的美白活性。根据以上相关性分析结果推断,总多糖、甘草素和甘草次酸等成分与保湿生物功能评价指标具有较强正相关性,判断上述成分有潜力作为指示甘草原料保湿活性的质量标志物。另一方面,光甘草定、总黄酮和异甘草苷等成分与美白生物功能评价指标具有强正向关联,判断上述成分有潜力作为指示甘草原料美白活性的质量标志物。

表4 相关性分析的特征参数Table 4 Characteristic parameters for correlation analysis
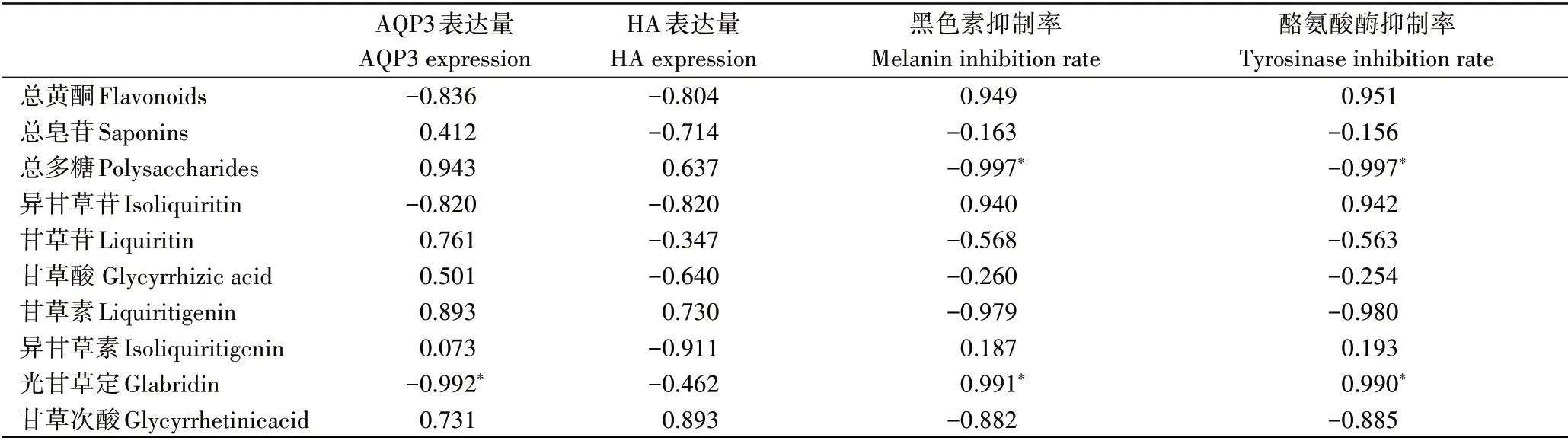
表5 活性成分含量与各项护肤生物功能评价指标之间的Pearson相关系数Table 5 Pearson correlation coefficients between active ingredient contents and various skin care effects
3 讨论与结论
据英敏特全球新产品数据库(GNPD)统计,以保湿/补水宣称的化妆品在2010-2015 年亚洲护肤品中排名第一,可知保湿化妆品仍然是消费者的第一需求[24]。据调查,补水保湿是市售甘草类化妆品的主要功效宣称之一,因此对于甘草提取物的保湿生物功能进行深入探究具有现实意义。文献调研显示甘草提取物具有保湿活性[25],但目前对于该功能活性报道不多,仅李影影[6]通过体外重量法,利用物质在特定的相对湿度环境下对水分的保持力测定了甘草多糖的保湿性,结果表明甘草多糖保湿性优于甘油的保湿性,可作为潜在的天然化妆品保湿剂进行开发。此外,甘草提取物保湿相关的报道多见于中药组方的产品开发[26-27],然而组方的保湿功效无法准确代表甘草的保湿活性。本研究对于甘草提取物保湿生物功能的比较性评价结果显示,乌拉尔甘草和胀果甘草的保湿活性显著优于光果甘草,提示乌拉尔甘草和胀果甘草提取物更适合用于保湿类化妆品开发。本研究结果从一定程度上充实了该领域的研究数据。
甘草提取物的美白生物活性数据是本研究的主要关注点。美白作为甘草提取物的主打护肤相关生物功能,已被大量验证和报道,研究者们普遍认为甘草中发挥美白作用的代表性活性物质是从光果甘草中分离提取的光甘草定[28-29]。研究结果表明,光果甘草直接作用于酪氨酸酶后对酶活具有抑制作用[30]。一项1998 年的报告显示0.1~1.0 μg·mL-1的光甘草定能够抑制B16 黑色素瘤细胞的酪氨酸酶活性,在豚鼠皮肤上局部应用0.5%的光甘草定可减少UVB 引起的红斑和色素沉着[31]。张兴琪等[32]针对乌拉尔、光果、胀果等不同品种甘草粗提物进行了美白活性的差异研究,结果显示3种甘草乙醇提取物对酪氨酸酶活性有良好的抑制效果,抑制效果为:光果甘草>乌拉尔甘草>胀果甘草。本研究测得3 种甘草提取物在细胞水平的酪氨酸酶抑制活性排序为光果甘草>乌拉尔甘草>胀果甘草,与张兴琪等[32]的研究结果一致。此外,通过抑制黑色素细胞的增殖也可以达到皮肤美白的作用[33]。在本研究的3种甘草提取物中,光果甘草对B16F10细胞活力的抑制作用最强,且其对于B16F10 的IC50 仍处于对HaCaT 细胞的安全浓度阈值内,推测光果甘草提取物在抑制黑色素细胞活力的同时并不会对角质细胞造成影响,此结果也许可以从另一个角度说明光果甘草具有美白作用。本研究结果显示,3种甘草提取物均具有不同程度的美白活性,其中光果甘草的美白活性具有显著优势,提示光果甘草提取物更适合用于美白类化妆品开发。光果甘草提取物在细胞水平具有显著抑制黑色素含量和酪氨酸酶活性的作用,在特定浓度下对黑色素细胞的增殖具有抑制作用且不会损伤角质形成细胞,说明其在细胞水平表现出良好的美白作用,所涉及机制可能与抑制黑色素细胞增殖以及抑制酪氨酸酶活性有关。
通过查阅统计中国知网及NCBI公开报道的文献发现,目前关于甘草提取物中活性成分与护肤生物功能之间相关性的数据基本未见,已有研究多集中于活性成分的药用功效,以及与地缘分布、培育方式等方面的相关性[34-36]。本研究首次报道了甘草中主要活性成分与各项护肤生物功能间的相关性,结果显示甘草提取物中总多糖、甘草素和甘草次酸等成分与保湿活性评价指标具有较强正相关,有潜力作为指示甘草提取物保湿活性的质量标志物,而光甘草定、总黄酮和异甘草苷等成分与美白活性评价指标具有较强正相关,有潜力作为指示甘草提取物美白活性的质量标志物。
综上所述,本研究所采用的乌拉尔甘草、胀果甘草和光果甘草提取物均具有不同程度的保湿及美白生物功能,其中,乌拉尔甘草和胀果甘草的保湿活性更优,而光果甘草的美白活性更优。上述生物功能与提取物中的活性成分含量具有很大相关性,对活性成分含量与护肤生物功能进行相关性分析,初步筛选出总多糖、甘草素和甘草次酸可作为指示甘草提取物保湿活性的质量标志物,光甘草定、总黄酮和异甘草苷可作为指示甘草提取物美白活性的质量标志物。本研究为甘草提取物作为化妆品原料的开发利用及质量判别提供了更加充分的数据支持。
