乌拉草提取物对大鼠皮肤烫伤后金黄色葡萄球菌感染的抑菌作用
2023-05-06孙宏宇陈子涵崔佰吉冯宪敏
孙宏宇, 陈子涵, 崔佰吉, 冯宪敏, 刘 迪
(吉林医药学院基础医学院病原生物学教研室,吉林 吉林 132013)
金黄色葡萄球菌(Staphylococcus aureus,S.aureus)是一种重要的病原菌,可引起皮肤蜂窝组织炎、关节炎、骨髓炎和心内膜炎等感染性疾病,重度感染者可因败血症和脓毒血症等导致死亡[1-2]。研究[3]表明:S.aureus是引起社区获得性感染和院内感染的常见耐药病原菌。自1961 年英国首次发现耐甲氧西林金黄色葡萄球菌(methicilin-resistantStaphalococcusaureus,MRSA)以来,MRSA 已在全世界范围内广泛传播[4]。调查数据[5-6]显示:MRSA 感染常伴随着死亡率、发病率和住院时间增加,尽管近年来MRSA 的发病率在一些地区有所下降,但MRSA发病率和死亡率仍然居高不下,对临床治疗构成了巨大的威胁。因此,探索S.aureus的致病机制、开发疫苗和新的抗菌药物逐渐成为研究的热点[7-8]。乌拉草,又称靰鞡草,是莎草科薹草属植物的全草[9]。胡敏等[10]研究发现:乌拉草具有多数植物不具备的终身抵御细菌和真菌侵蚀及寄生的能力。利用乌拉草编织制备成草鞋或鞋垫,可用于吸湿、保暖或防治脚部感染等[11-12],已有几百年的历史。有关乌拉草的抗菌和抗真菌研究仅限于其有效成分的体外抑菌试验,未对其在体抗感染作用及其抑菌机制进行深入研究。迄今为止,国内外有关乌拉草的化学成分、质量控制指标和药理药效研究报道较少。本研究通过牛津杯法抑菌试验和大鼠Ⅱ度烫伤模型等方法,验证乌拉草有效成分体外和在体抑菌作用,同时对其作用机制进行了初步探讨,为乌拉草抗感染机制的研究奠定基础,为新型抗感染中药前瞻性研究开拓新视角。
1 材料与方法
1.1 菌株、实验动物、主要试剂和仪器S.aureus(ATCC6538)、大肠埃希菌 (Escherichia coli,E.coli,ATCC25922)和 白 色 念 珠 菌 (Monilia albicans,M.albican,ATCC10231),由 本 室 冻存。24 只清洁级SD 大鼠购自长春市亿斯实验动物技术有限公司,动物生产许可证号:SCXK(吉)2020-0002,所有动物实验操作符合动物实验伦理 (SN:2022-LW001)。乌拉草由吉林吾本草乌拉草制品有限公司馈赠,产地为长白山。芦丁 (批号:20200718)购自成都普菲德科技有限公司,LB 肉汤培养基等细菌培养基购自杭州滨河微生物试剂有限公司,抗生素药敏纸片购自中国药品生物制品鉴定所,白细胞介素10(interleukin-10,IL-10)、白 细 胞 介 素1β (interleukin-1β,IL-1β)和 肿 瘤 坏 死 因 子α (tumor necrosis factor-α,TNF-α)酶 联 免 疫 吸 附 试 验 (enzyme-linked immunosorbent assay,ELISA)试剂盒购自武汉基因美科技有限公司,青霉素钠(penicillin sodium,NaBP)(1 666 U·mg-1)购自山东鲁抗医药股份有限公司。I-250 恒温培养箱 (美国 Thermo Fisher公司),1525EF 半制备高效液相色谱仪 (美国沃特世Waters 公司),LC20AT 液相色谱仪和UV1800 紫外分光光度计(日本岛津公司),MS104TS/02 电子天平(瑞士梅特勒-托利多国际贸易有限公司),KQ2500D 超声波清洗仪(昆山超声仪器有限公司),SHZ-DⅢ循环水式真空泵(上海力辰邦西仪器科技有限公司),冷冻离心机(美国赛默飞世尔科技公司),移液器(德国艾本德股份有限公司)。
1.2 乌拉草提取物的制备取乌拉草粉末,用70%乙醇溶液加热回流提取3 次,过滤,合并滤液,减压浓缩,冷冻干燥,获得70%乙醇乌拉草CM-70 提取物。
1.3 乌拉草CM-70 提取物总黄酮含量的测定对照品溶液的制备:精密称取芦丁对照品10 mg 置10 mL 容量瓶中,加入甲醇溶解、定容,得对照品储备液。分别量取对照品储备液适量,加甲醇稀释至 浓 度 分 别 为0.1、0.2、0.3、0.4、0.5 和0.6 g·L-1的对照品溶液。供试品溶液的制备:取乌拉草CM-70 提取物粉末0.5 g 置50 mL 的三角瓶中,精密加入70%乙醇溶液30 mL,称定质量,超声 (250 W,40 Hz)提取30 min,冷却至室温,再次称定质量,用70%乙醇补足减失的质量,过滤取续滤液,即得供试品溶液。总黄酮含量的测定:分别精密量取各对照品溶液和供试品溶液1 mL 置10 mL 量瓶中,加入5%的亚硝酸钠溶液0.6 mL 混匀,放置6 min;加入10%硝酸铝溶液0.6 mL 混匀,放置6 min;加入4%氢氧化钠溶液4 mL 混匀,放置15 min;最终用70%的乙醇溶液定容至刻度、混匀。按照紫外分光光度法,在510 nm 波长处分别测定吸光度(A)值。以对照品溶液绘制浓度(X)-A 值(Y)标准曲线。将供试品溶液A 值代入标准曲线,计算供试品溶液总黄酮的含量。
1.4 菌悬液的制备将S.aureus、E.coli和M.albican活化后,挑取单个菌落,接种到5 mL MH 培养液中,35 ℃、150 r·min-1振荡培养 24 h,取适量菌液加至肉汤培养基中,配制成约 1×108CFU·mL-1的菌悬液备用。
1.5 抑菌活性的测定MH 琼脂培养基分别涂布接种200 μLS.aureus、E.coli和M.albican(1×108CFU·mL-1),随后在培养基表面垂直摆放牛津杯,轻轻加压,使其与培养基接触无空隙。在杯中加 入200 μL 不 同 稀 释 浓 度 (0.312 5、0.625 0、1.250 0、2.500 0、5.000 0 和10.000 0 g·L-1)供试品溶液,35 ℃培养16 h。用游标卡尺量取抑菌圈直径(diameters of bacterial inhibition zone,DIZ)。
1.6 最 低 抑 菌 浓 度 (minimum inhibitory concentration,MIC)的测定取1 mL 无菌MH 肉汤培养基加至1~7 号试管中,取1 mL 20 g·L-1供试品溶液加至1 号试管,按照体积比1∶1 倍比稀释至6 号试管,混匀后,取1 mL 弃去。7 号试管为不含供试品溶液的肉汤培养基对照管。各设3 个平行管。将制备好的菌悬液 (1×108CFU·mL-1)稀释成浓度为1×106CFU·mL-1,每支试管内分别加入稀释后的菌悬液1 mL (1×106CFU·mL-1),置35 ℃温箱中培养20 h,观察是否有细菌生长,以肉眼观察无细菌生长的试管所含的最低供试品浓度为MIC。
1.7 大鼠Ⅱ度烫伤S.aureus感染大鼠模型的构建、分组和用药方法清洁级SD 大鼠24 只,体质量190~210 g,实验前1 d,所有大鼠采用6% 硫化钠进行背部脱毛,面积约2.5 cm2。烫伤感染前,采用戊巴比妥钠进行腹腔注射麻醉(40 mg·kg-1),将脱毛部位皮肤消毒后,于自制烫伤仪(底部开口50 mL 离心管)内注入100 ℃沸水,贴于大鼠背部脱毛部位并固定10 s,以干纱布拭去多余水分,裸眼观其皮肤发红,局部水肿,出现散在水疱,即可证明大鼠Ⅱ度烫伤模型造模成功。将模型大鼠随机分为生理盐水对照组、NaBP 对照组和乌拉草CM-70 提取物治疗组,每组8 只。3 组大鼠创面皮内 多 点 注 射 接 种20 μL (1.0×108CFU·mL-1)S.aureus。次日给药治疗,生理盐水对照组大鼠烫伤创面涂抹无菌生理盐水(0.5 g 无菌脱脂棉吸附生理盐水0.5 mL·cm-2),NaBP 对照组大鼠烫伤创面涂抹NaBP(0.5 g 无菌脱脂棉吸附NaBP,按体质量5 000 U·kg-1),乌拉草CM-70 提取物治疗组大鼠烫伤创面涂抹10 g·L-1乌拉草供试品稀释液(0.5 g 无菌脱脂棉吸附,0.5 mL·cm-2)。3 组大鼠烫伤创面均以无菌纱布包扎,每24 h 换药1 次,连续14 d。观察各组大鼠一般情况、皮肤创面感染和创面愈合情况。
1.8 各组大鼠创面痂下细菌定量各组大鼠分别于接种细菌后第1、2、3、4、5、6 和7 天取创面中心少许组织,称定质量后放入匀浆仪中,加入1 mL 生理盐水,电动搅拌器充分匀浆,分别稀释至1×10-4、1×10-3、1×10-2和 1×10-1,最后3 个浓度各取100 μL 稀释液接种于琼脂平板[13],每个稀释度做3 个重复,37 ℃温箱孵育24 h 后进行菌落计数。细菌数 (CFU·g-1)=平均 菌落数×10×10n/组织质量 (g)。
1.9 ELISA 法检测各组大鼠血清中炎性因子水平各组大鼠分别于烫伤前及烫伤后第1、3 和7 天,尾部取血,室温放置20 min,3 000 r·min-1离心15 min,收集血清,保存于-20 ℃备用。采用ELISA 试剂盒测定各组大鼠血清中炎性因子IL-1β、IL-10 和TNF-α 水平,实验方法严格按照试剂盒说明书进行。
1.10 统计学分析采用 SPSS 26.0 统计软件进行统计学分析。不同稀释浓度供试品溶液针对S.aureus、E.coli、M.albican的DIZ,各组大鼠不同时间创面痂下细菌数,各组大鼠血清中IL-10、IL-1β 和TNF-α 水 平 均 服 从 正 态 分 布,以±s表示,多组间样本均数比较采用单因素方差分析,组间均数两两比较采用LSD-t检验,不同时间点多组间样本均数比较采用重复测量方差分析,方差不齐采用Tamhane’s T2 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 乌拉草CM-70 提取物中总黄酮含量本研究获得乌拉草CM-70 提取物 9.82 g。以对照品溶液绘制浓度(X)-A 值(Y)标准曲线,计算得线性回归方 程:Y=13.455X-0.006 9,拟 合 系 数(R2)=0.996 6,表明在0.1~0.6 g·L-1浓度范围内线性关系良好。经测定乌拉草CM-70 提取物总黄酮含量为72.4 mg·g-1。
2.2 乌拉草CM-70 提取物体外抑菌活性试验不同稀释浓度乌拉草CM-70 提取物溶液针对S.aureus的DIZ 见表1,针对E.coli和M.albican未形成抑菌圈。S.aureus的DIZ 值大小为:高剂量>中剂量>低剂量。
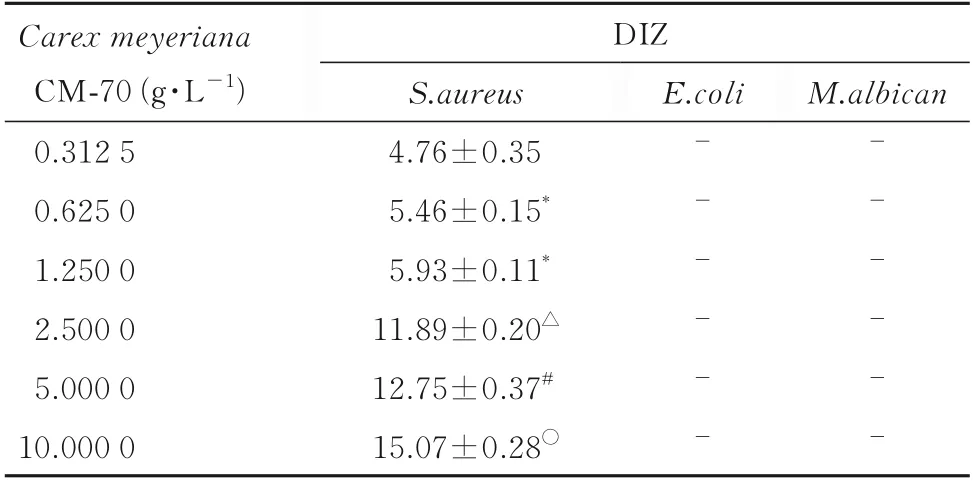
表1 不同稀释浓度乌拉草CM-70 提取物对各种细菌的抑菌效果Tab.1 Becteriostatic effects ofCarex meyerianaCM-70 extract with different dilution concentrations on various bacteria (n=3,x±s,d/mm)
2.3 乌拉草有效成分的MIC试管稀释法测定乌拉草有效成分的MIC,肉眼观察无细菌生长的试管所含的最低供试品浓度为2.5 g·L-1,即为乌拉草有效成分对S.aureus的MIC 值。
2.4 各组大鼠烫伤创面感染和愈合情况分别记录大鼠Ⅱ度烫伤S.aureus感染模型给药后第3、7和14 天烫伤伤口情况。与生理盐水对照组比较,感染后第3 天,乌拉草CM-70 提取物治疗组大鼠伤口浆液渗出较少,感染后第7 天,伤口浆液渗出减少,红肿减轻,伤口面积缩小,感染后第14 天,伤口创面已完全干燥,无浆液渗出,表面形成痂皮,伤口愈合良好,与青霉素G 钠对照组相近。见图1。
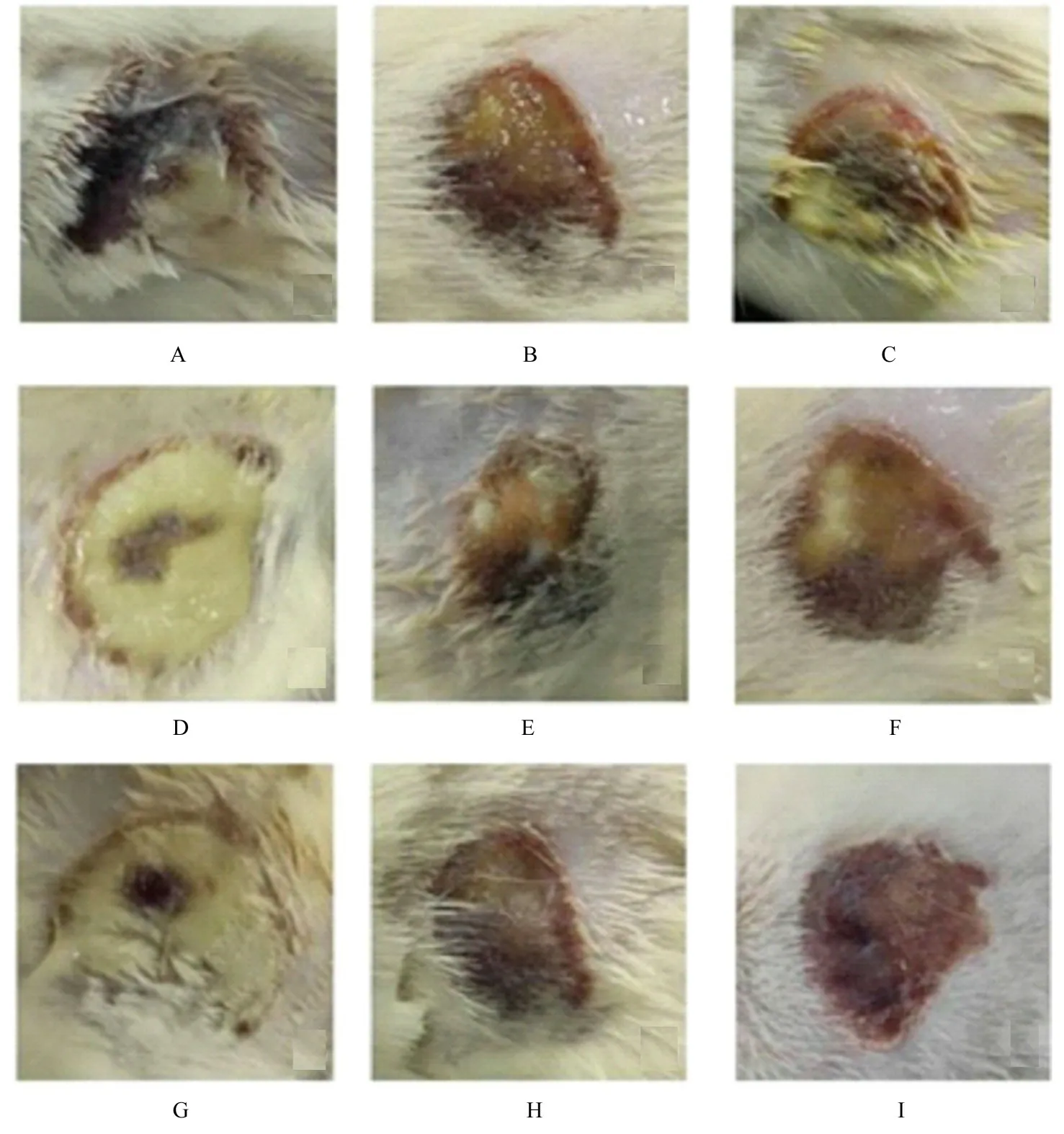
图1 不同时间点各组大鼠皮肤Ⅱ度烫伤后S.aureus感染模型大鼠体内抑菌实验结果Fig.1 Results ofin vivobecteriostatic experiment ofS.aureusinfection model rats in various groups after Ⅱ degree skin scalding at different time points
2.5 各组大鼠烫伤创面痂下细菌数各组大鼠烫伤创面痂下细菌数组间两两比较差异均有统计学意义(P<0.01)。与生理盐水对照组比较,同一时间乌拉草CM-70 提取物治疗组大鼠烫伤创面痂下细菌数明显减少(P<0.01)。见表2。
表2 不同治疗时间点各组大鼠烫伤创面痂下细菌数Tab.2 Number of bacteria under scalding wound scab of rats in various groups at different time points(n=8,±s,×108CFU·g-1)

表2 不同治疗时间点各组大鼠烫伤创面痂下细菌数Tab.2 Number of bacteria under scalding wound scab of rats in various groups at different time points(n=8,±s,×108CFU·g-1)
*P<0.01 compared with normal control group;△P<0.01 compared with NaBP control group.
Group Number of bacteria 2 3 4 5 6 7 Normal control NaBP control Carex meyeriana Kunth(t/d) 1 5.89±0.26 2.15±0.21*8.85±0.36 1.98±0.29*11.33±0.24 1.93±0.02*8.63±0.21 1.87±0.10*7.58±0.28 1.82±0.08*6.85±0.22 1.78±0.11*5.86±0.31 1.56±0.10*extract CM-70 treatment 3.98±0.21*△3.41±0.18*△3.28±0.15*△2.94±0.26*△2.81±0.29*△2.66±0.28*△2.52±0.10*△
2.6 各组大鼠血清中IL-10、IL-1β 和TNF-α 水平不同时间点各组大鼠血清中炎性因子IL-10 水平比较差异有统计学意义(P<0.05)。与生理盐水对照组比较,NaBP 对照组和乌拉草CM-70 提取物治疗组大鼠IL-10 水平在烫伤后第1 和3 天明显升高(P<0.01),在第7 天明显降低;在烫伤后第14 天,与生理盐水对照组比较,乌拉草CM-70 提取物治疗组大鼠IL-10 水平明显降低(P<0.05),与NaBP 对照组比较,乌拉草CM-70 提取物治疗组大鼠IL-10 水平差异无统计学意义(P>0.05)。
不同时间点各组大鼠血清中炎性因子IL-1β 水平比较差异有统计学意义(P<0.05)。与生理盐水对照组比较,在烫伤后第1、3、7 和14 天,乌拉草CM-70 提取物治疗组大鼠IL-1β 水平显著降低(P<0.05);与NaBP 对照组比较,在烫伤后第3、7 和14 天,乌拉草CM-70 提取物治疗组大鼠IL-1β水平明显升高 (P<0.05)。
不同时间点各组大鼠血清中炎性因子TNF-α水平比较差异有统计学意义(P<0.01)。与生理盐水对照组比较,在烫伤后第1、3、7 和14 天,乌拉草CM-70 提取物治疗组大鼠TNF-α 水平明显降低(P<0.05);与NaBP 对照组比较,乌拉草CM-70 提取物治疗组大鼠TNF-α 水平明显升高(P<0.05)。见表3。
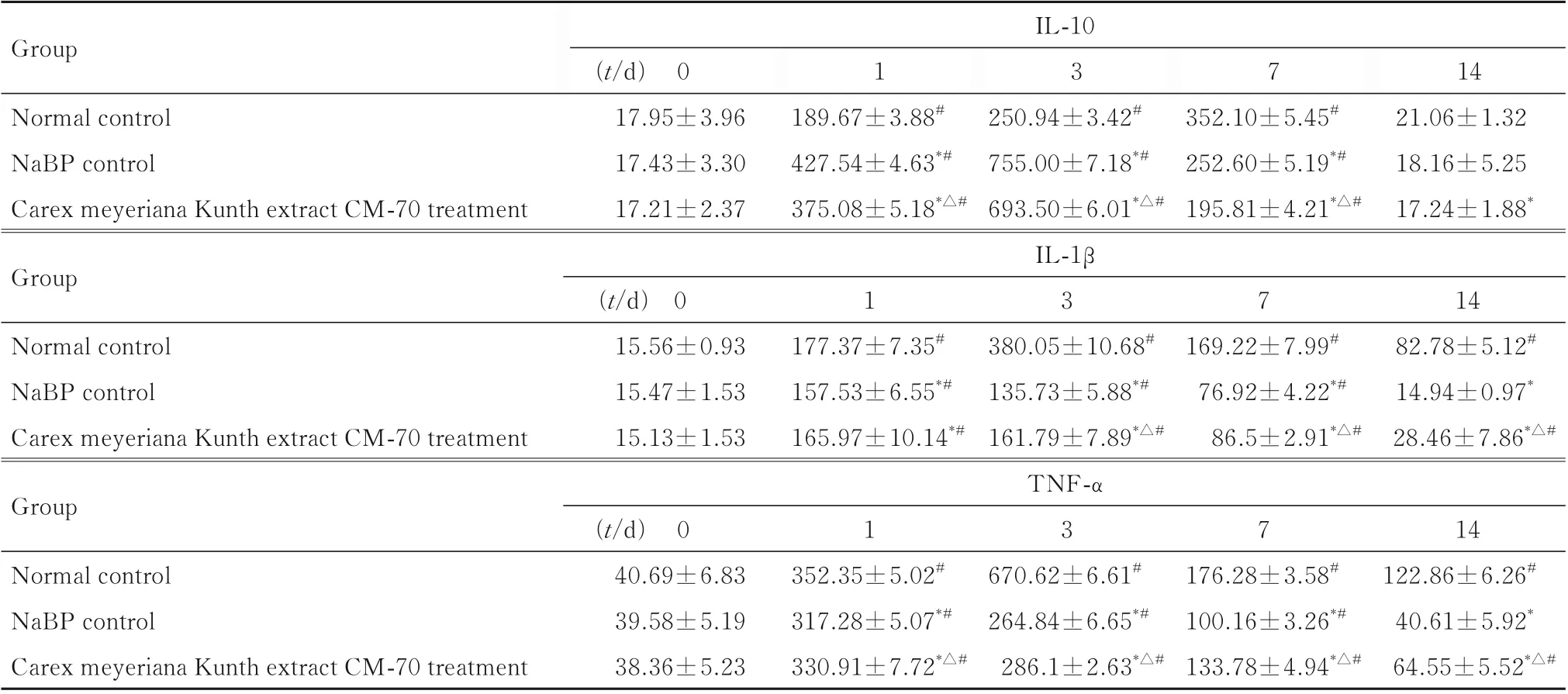
表3 各组大鼠不同时间点血清中IL-10、IL-1β 和TNF-α 水平Tab.3 Levels of serum IL-10,IL-1β, and TNF-α of rats in various groups at different time points[n=8,x±s, ρB/(ng·L-1)]
3 讨 论
S.aureus是引起人类化脓性感染最常见的病原菌,随着MRSA 的出现,S.aureus的致病性已成为卫生机构和社区环境中的一个重大问题[14]。研究[15]表明:预计到2050 年,耐药细菌导致的死亡人数将超过癌症。因此,研发抑菌机制独特、不易产生耐药性的抗菌药势在必行。
余克娇[16]研究表明:通过对乌拉草提取液进行浓缩提纯,确定纯化后的黄酮类抗菌物质为木犀草素。苏婷[9]研究表明:通过对乌拉草组分分析,黄酮类化合物有20 种,其中包括木犀草素、棕矢车菊素和汉黄芩苷等抗炎抑菌成分。本研究结果表明:乌拉草有效成分在体外对S.aureus具有明显的抗菌活性;乌拉草CM-70 提取物对Ⅱ度烫伤大鼠感染S.aureus具有一定的抑制作用,同时可有效促进创口愈合,具有抗感染作用。
研究[17-19]显示:烫伤后创面由于机体应激及细菌感染等因素,引发全身炎症反应,刺激炎症因子的分泌,其中TNF-α、IL-1 和IL-10 等重要炎性因子水平升高,从而引发并加重全身炎症反应。IL-10 是一种强大的抗炎因子,可抑制促炎因子IL-1 和TNF-α 的作用产物前列腺素的分泌,还可抑制损伤引起的继发炎性反应和细胞因子表达,在烫伤后抗感染和抑制炎性反应方面发挥关键作用[20-21]。TNF-α 是创伤、感染后机体最早出现的促炎因子之一,可刺激单核巨噬细胞合成和分泌IL-1及IL-8 等炎症介质,并能协同扩大其生物学效应[22-23]。
综上所述,在大鼠烫伤初期,乌拉草CM-70提取物可刺激免疫细胞产生IL-10,且可将IL-10 水平峰值提前,调控促炎因子IL-1β 和TNF-α 水平下降,表明乌拉草可通过调节炎性因子的释放,进而发挥抗炎作用,有效减轻炎症反应,发挥抑菌抗炎作用,促进创面愈合。本研究为进一步乌拉草抗感染机制的研究奠定了基础,为开发乌拉草的现代药用价值提供了理论依据和新思路。
