鼠尾草酸对慢性不可预见性轻度应激诱导的抑郁大鼠的抗抑郁作用及其SIRT1/ERS 调控机制
2023-05-06谭东明尹红英邓祥敏
谭东明, 尹红英, 邓祥敏, 丁 旭
(1.江苏护理职业学院药学与中药学院药理药化教研室,江苏 淮安 223001;2.江苏省淮安市第五人民医院肿瘤科,江苏 淮安 223300;3.江苏护理职业学院药学与中药学院中药教研室,江苏 淮安 223001)
抑郁症是一种慢性和反复发作的严重精神障碍,其特征是快感丧失、情绪障碍和自杀倾向,影响着世界10%以上的人口,并造成了巨大的社会负 担[1]。最 近 研 究[2]表 明:内 质 网 应 激(endoplasmic reticulum stress,ERS)通路在抑郁症中不断被激活,是慢性不可预见性轻度应激(chronic unpredictable mild stress,CUMS)诱发的抑郁症发病机制中的关键步骤。因此,ERS 可以作为抑郁症的新治疗靶标。鼠尾草酸(carnosic acid,CA)是一种重要的抗氧化剂,具有良好的神经调节作用,可通过在压力条件下激活与细胞存活相关的信号通路发挥神经保护作用[3-4]。CA 通过调节大鼠海马中成纤维细胞生长因子9 改善中风后抑郁大鼠的抑郁样症状[5],但CA 对抑郁症的作用机制尚未完全明确。CA 可能通过抑制氧化应激和ERS 发挥其神经保护作用[6]。研究[7]显示:CA 以剂量和时间依赖性方式诱导ERS 标记蛋白的表达,包 括 C/EBP 同 源 蛋 白 (C/EBP-homologous protein,CHOP)和葡萄糖调节蛋白78 (glucose regulated protein 78,GRP78),诱导人肾癌细胞Caki 细胞凋亡,提示CA 可调节ERS。然而,CA的抗抑郁机制是否与ERS 有关还未明确。沉默信息 调 节 因 子1 (silence information regulator 1,SIRT1)是一种去乙酰化酶,具有神经保护特性,是一种抗抑郁样因子。研究[8-9]显示:CUMS 引起的抑郁症可降低海马区SIRT1 活性,升高海马ERS 水平;而SIRT1 的激活可通过降低ERS 程度来发挥抗抑郁效应。CA 可通过激活SIRT1 发挥对蛛网膜下腔出血后的早期脑损伤[10]、肝纤维化[11]和慢性酒精性肝损伤[12]等疾病的保护作用,是一种潜在的SIRT1 激活剂。因此,本研究旨在探讨CA 的抗抑郁机制是否与SIRT1 介导的ERS 通路有关,阐明CA 发挥抗抑郁活性的可能机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器66 只SPF 级雄性SD 大鼠,6~8 周龄,体质量(200~220)g,购自昭衍(苏州)新药研究中心有限公司,动物生产许可证号:SCXK(苏)2018-0006,在12 h 光照/12 h 黑暗周期、温度20 ℃~24 ℃和湿度40%~60%下饲养,自由获取食物和水。CA(纯度≥98%,北京Solarbio 公司,批号:SC8120),盐酸氟西汀胶囊[商品名称:百优解,法国PATHEON FRANCE 公司(礼来苏州制药有限公司分装),国药 准 字:HJ20160501],SIRT1 抑 制 剂EX527(SC0281)和脱氧核糖核苷酸末端转移酶介导的缺口 末 端 标 记 法 (terminal-deoxynucleotidyl transferase mediated nick end labeling,TUNEL)细胞凋亡检测试剂盒(C1098)均购自碧云天生物科技有限公司,兔抗大鼠SIRT1 抗体(ab189494)、兔抗大鼠GRP78 抗体(ab21685)、小鼠抗大鼠CHOP 抗体(ab11419)、兔抗大鼠caspase-12 抗体(ab62484)、Alexa Fluor®647 标记的山羊抗兔IgG(ab150079)和Alexa Fluor®647 标记的山羊抗小鼠IgG (ab150115)二 抗 均 购 自 英 国Abcam 公 司。TM-Vision 行为学实验系统及自发活动视频分析软件(成都泰盟软件有限公司),TCS SP2 激光共聚焦显微镜(德国Leica 公司),BX53 光学显微镜(日本Olympus 公司),Mx3005P 实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)仪(美国Stratagene公司);ChemiDocTMMP 全能型成像仪(美国Bio-Rad 公司)。
1.2 实验动物的模型制备、分组和给药66 只大鼠随机分为对照组(n=12)和CUMS 组(n=54),CUMS 组 采 用CUMS 联 合 孤 养[13]建 立 抑 郁模型。大鼠暴露于各种轻度压力源:①在5 ℃下冷水中游泳5 min;②24 h 禁食;③24 h 禁水;④约束2 h;⑤24 h 光/暗循环逆转;⑥夹尾1 min;⑦频闪仪(每分钟120 次闪光)2 h;⑧悬尾5 min;⑨不可预测的足部电击(0.4 mA,电击1 次/10 s,共电击10 次);⑩热应激(40 ℃,5 min)。大鼠按照上述顺序每天随机接受3 个压力源,持续4 周。为了避免被大鼠预测,不会连续施加相同的压力源。实验过程中观察大鼠一般状态及体质量,并于造模前1 d 和造模结束后,进行糖水偏好实验(sucrose preference test,SPT)。观察到大鼠毛色暗淡发黄、反应迟钝、自主活动减少、体质量降低和糖水偏好度降低,表明建模成功。取48 只建模成功大鼠分为模型组、氟西汀(3.17 mg·kg-1)组[13]、CA (40 mg·kg-1)组[5,14]和CA (40 mg·kg-1)+EX527(5 mg·kg-1)组[15],每 组12 只。CA 组 大鼠给予40 mg·kg-1的CA 灌胃,氟西汀组大鼠给予3.17 mg·kg-1氟西汀灌胃,CA+EX527 组大鼠在给予40 mg·kg-1CA 灌胃的同时腹腔注射EX527 5 mg·kg-1,对照组和模型组大鼠给予等量的生理盐水灌胃和腹腔注射,每日1 次,连续3 周。
1.3 大鼠抑郁样行为学评估①旷场实验(openfield test,OFT)[16]:为了评估药物对自发运动活动的影响,将大鼠单独置于旷场箱(100 cm×100 cm×45 cm)中,旷场箱四面和底部均为黑色,适应12 min 后允许自由探索。在5 min 测试中记录中间停留时间和运动总距离。同时,每只大鼠实验后用乙醇清洗箱体,以消除异味的影响。使用自发活动视频分析软件对大鼠的活动进行分析。②强迫游泳实验(forced swimming test,FST):按照参考文献[15]中方法,将大鼠置于装有30 cm 水的透明塑料容器(直径30 cm,高度50 cm,水温23 ℃~25 ℃)中游泳,每只大鼠被迫游泳5 min,并在5 min 内测量不动时间。不动的定义是除了保持大鼠头部高于水面所需的运动外,没有其他运动。该实验模拟抑郁症患者核心症状之一的“行为绝望”。③SPT[16]:将2 个装有1%蔗糖的饮用水瓶同时放入动物笼中,训练动物适应含葡萄糖的饮用水24 h。禁食禁水8 h 后,每只大鼠给予1 瓶纯净水和1 瓶含1% 蔗糖的水,外观和体积一致。24 h 后,分别测量剩余液体体积;计算每只大鼠的物的糖水偏好度,糖水偏好度=(蔗糖水消耗量/总液体消耗量)×100%,糖水偏好度代表动物的快感行为程度。
1.4 TUNEL 法检测各组大鼠大脑海马组织CA1区TUNEL 阳性细胞百分率每组随机选取6 只大鼠,处死后断头取脑,4%多聚甲醛中固定,石蜡包埋,使用TUNEL 细胞凋亡检测试剂盒对4 μm厚度的石蜡包埋切片进行TUNEL 测定。组织切片在二甲苯中脱蜡,再水化,并浸入3% H2O2中。切片在冰上用蛋白酶K 溶液处理5 min,并进一步与50 μL TUNEL 反 应 混 合 物 在37 ℃条 件 下 孵 育60 min,DAB 染色,苏木精复染。光学显微镜下观察海马CA1 区TUNEL 阳性细胞,计算TUNEL阳性细胞百分率,代表细胞凋亡率。每个切片随机选择3 个视野,取平均值。TUNEL 阳性细胞百分率=TUNEL 阳性细胞数/细胞总数×100%。
1.5 免疫荧光法检测各组大鼠海马组织中GRP78和CHOP 阳性表达强度取大鼠大脑组织石蜡切片,通过二甲苯脱蜡和乙醇水化后,用0.3% H2O2溶液封闭15 min;切片用柠檬酸缓冲液(pH 6.0)进行微波抗原修复;10%牛血清白蛋白封闭2 h;切片与GRP78 抗 体(1∶200)和CHOP 抗 体(1∶100)在4 ℃下孵育过夜;将切片与Alexa Fluor®647 标记的山羊抗兔或小鼠IgG 二抗(红色,1∶200)在37 ℃下避光孵育30 min;DAPI 用于在室温下对细胞核(蓝色)染色1 h;采用激光共聚焦显微镜观察荧光强度代表海马组织CA1 区中目的蛋白阳性表达强度,每个切片随机选择3 个视野,结果以平均荧光强度来表示。每张切片随机选取3 个视野,取平均值。
1.6 RT-qPCR 法检测各组大鼠大脑海马组织中SIRT1、GRP78、CHOP 和caspase-12 mRNA 表达水平每组剩余6 只大鼠,处死后解剖大鼠大脑海马组织,使用Trizol 试剂从海马组织中提取总RNA,使用PrimeScriptTMRT 试剂盒进行逆转录。通过SYBR Premix Ex TaqTM进行RT-qPCR,反应条件:95 ℃预变性10 min,95 ℃、5 s,55 ℃、30 s,72 ℃、20 s,共40 个循环。引物序列见表1。每组重 复3 次,以β-actin 为 内 参。采 用2-ΔΔCt法 计 算 目的基因表达水平。∆Ct=目的基因Ct-内参Ct,∆∆Ct=实验组∆Ct-对照组∆Ct。
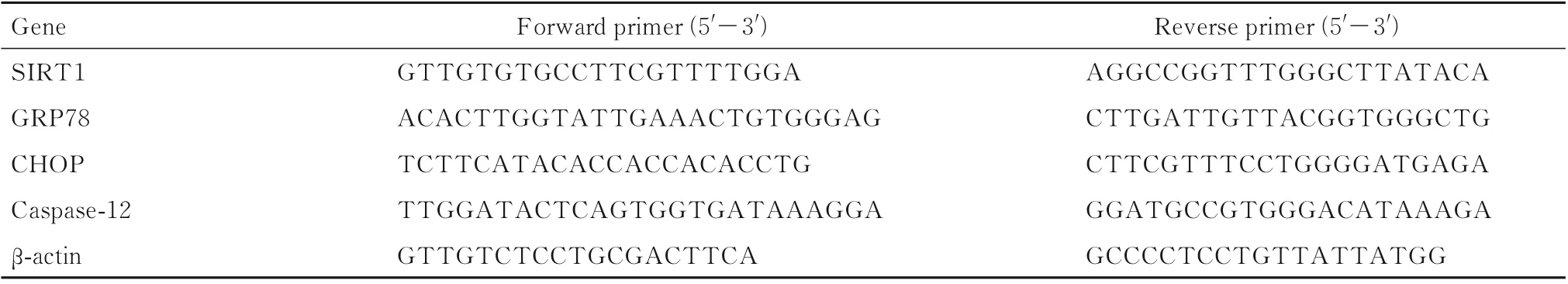
表1 RT-qPCR 引物序列Tab.1 Primer sequences of RT-qPCR
1.7 Western blotting 法检测各组大鼠海马组织中SIRT1、GRP78、CHOP、Caspase-12 和裂解的Caspase-12(cleaved Caspase-12)蛋白表达水平取各组大脑的海马组织,在含有蛋白酶抑制剂的RIPA 缓冲液中裂解,收集上清液。采用BCA 法检测蛋白含量,十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳后转移至聚 偏 二 氟 乙 烯(polyvinylidenefluoride,PVDF)膜。转移过蛋白质的膜在室温下用5%脱脂牛奶封闭2 h。与 一 抗SIRT1 (1 ∶1 000)、GRP78(1∶1 000)、CHOP (1∶1 000)、Caspase-12(1 ∶1 000)和β-actin(1∶2 000)在4 ℃冰箱过夜,采用二抗(1∶5 000)在室温下孵育2 h。通过增强的化学发光试剂显示蛋白质条带,并通过成像仪可视化。采用Image J 软件分析灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参条带灰度值。
1.8 统计学分析采用GraphPad Prism 8.0 软件进行统计学分析。各组大鼠OFT 中的运动总距离和中间停留时间,强迫游泳时的不动时间和糖水偏好度,大脑海马组织CA1 区TUNEL 阳性细胞百分率,大脑海马组织中GRP78 和CHOP 的阳性表达 率,SIRT1、GRP78、CHOP 和Caspase-12 的mRNA 及蛋白表达水平以及cleaved Caspase-12 蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠抑郁样行为与对照组比较,模型组大鼠OFT 中运动总距离、中间停留时间和糖水偏好度均明显降低(P<0.05),强迫游泳时的不动时间明显延长(P<0.05);与模型组比较,氟西汀组和CA 组大鼠OFT 中运动总距离、中间停留时间和糖水偏好度明显增加(P<0.05),强迫游泳时的不动时间明显缩短(P<0.05);与CA 组比较,CA+EX527 组大鼠OFT 中运动总距离、中间停留时间和糖水偏好度均明显降低(P<0.05),强迫游泳时的不动时间明显延长(P<0.05)。见表2。
表2 各组大鼠OFT 中运动总距离、中间停留时间、强迫游泳时的不动时间和糖水偏好度Tab.2 Total exercise distance, intermediate residence time, immobility time during forced swimming and sugar water preference in OFT of rats in various groups (n=12,±s)

表2 各组大鼠OFT 中运动总距离、中间停留时间、强迫游泳时的不动时间和糖水偏好度Tab.2 Total exercise distance, intermediate residence time, immobility time during forced swimming and sugar water preference in OFT of rats in various groups (n=12,±s)
*P<0.05vscontrol group;△P<0.05vsmodel group;#P<0.05vsCA group.
Group Control Model CA Fluoxetine CA+EX527 Sugar water preference(η/%)67.80±7.24 25.31±4.69*43.54±5.81*△52.72±6.35*△27.43±4.06*#Total exercise distance (l/m)10.45±1.37 5.12±0.86*7.33±0.91*△7.84±1.15*△5.50±0.76*#Intermediate residence time (t/s)68.39±9.26 32.27±5.40*49.58±6.35*△56.42±8.16*△35.07±6.24*#Immobility time during forced swimming (t/s)20.30±3.48 76.74±5.19*45.29±4.62*△39.61±5.07*△70.43±6.25*△#
2.2 各组大鼠大脑海马组织CA1 区TUNEL 阳性细胞百分率与对照组比较,模型组大鼠海马组织CA1 区TUNEL 阳性细胞百分率明显升高(P<0.05);与模型组比较,氟西汀组和CA 组大鼠大脑海马组织CA1 区TUNEL 阳性细胞百分率明显降低(P<0.05);与CA 组比较,CA+EX527 组大鼠大脑海马组织CA1 区TUNEL 阳性细胞百分率明显升高(P<0.05)。见图1 和表3。
表3 各组大鼠大脑海马组织CA1 区TUNEL 阳性细胞百分率Tab.3 Percentages of TUNEL-positive cells in CA1 region of hippocampus tissue in brain of rats in various groups (n=6,±s,η/%)
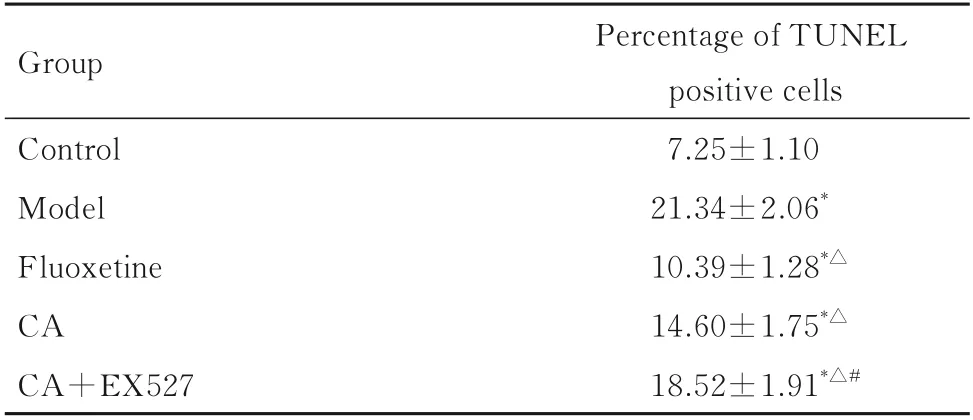
表3 各组大鼠大脑海马组织CA1 区TUNEL 阳性细胞百分率Tab.3 Percentages of TUNEL-positive cells in CA1 region of hippocampus tissue in brain of rats in various groups (n=6,±s,η/%)
*P<0.05vscontrol group;△P<0.05vsmodel group;#P<0.05vsCA group.
Percentage of TUNEL positive cells 7.25±1.10 21.34±2.06*10.39±1.28*△14.60±1.75*△18.52±1.91*△#Group Control Model Fluoxetine CA CA+EX527
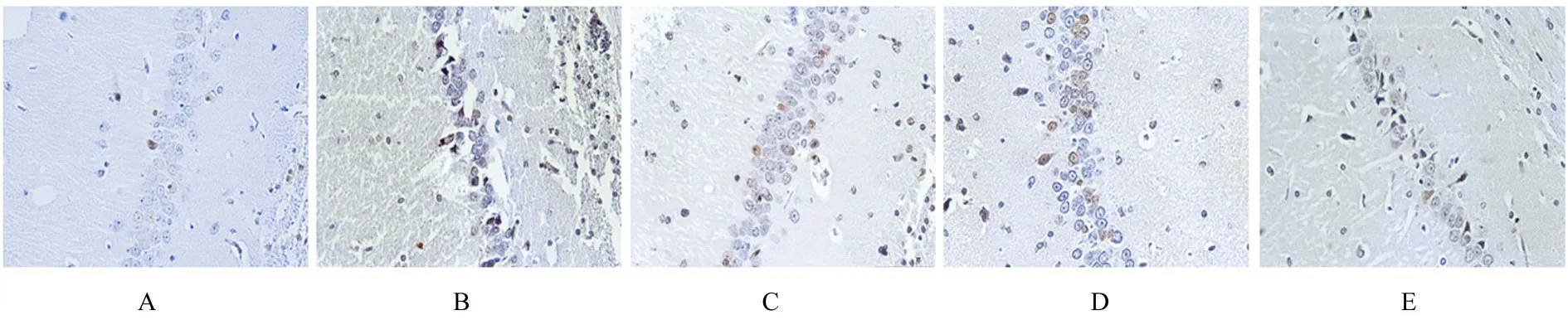
图1 各组大鼠大脑海马组织中神经元凋亡形态表现 (TUNEL,×200)Fig.1 Apoptotic morphology of neurons in hippocampus tissue in brain of rats in various groups (TUNEL,×200)
2.3 各组大鼠大脑海马组织CA1 区GRP78 和CHOP 阳性表达与对照组比较,模型组大鼠海马CA1 区GRP78 和CHOP 阳性表达强度明显升高(P<0.05);与模型组比较,氟西汀组和CA 组大鼠大脑海马组织CA1 区GRP78 和CHOP 阳性表达强度明显降低(P<0.05);与CA 组比较,CA+EX527 组大鼠大脑海马组织CA1 区中GRP78 和CHOP阳性表达强度明显升高(P<0.05)。见表4和图2。
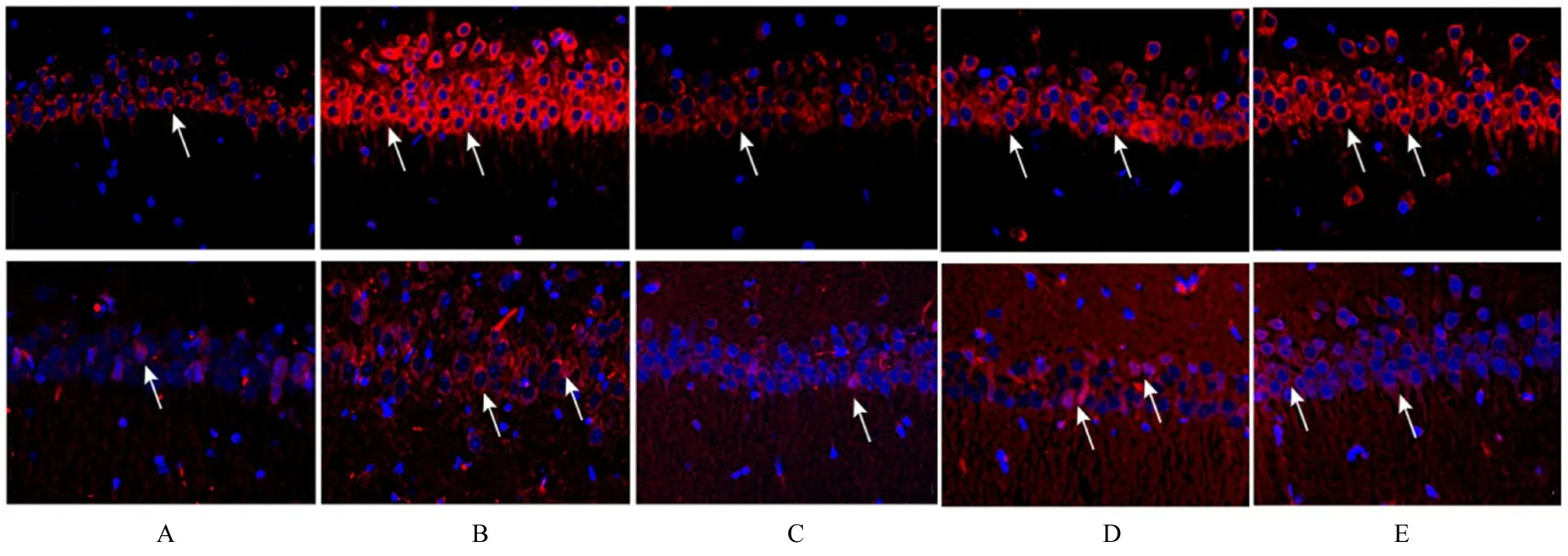
图2 各组大鼠大脑海马组织CA1 区中GRP78 和CHOP 阳性表达情况(免疫荧光,×200)Fig.2 Positive expressions of GRP78 and CHOP in CA1 region in hippocampus tissue in brain of rats in various groups(Immunofluorescence,×200)
表4 各组大鼠大脑海马组织CA1 区GRP78 与CHOP 平均荧光强度Tab.4 Average fluorescence intensities of GRP78 and CHOP in CA1 region of hippocampus tissue in brain of rats in various groups (n=6,±s)
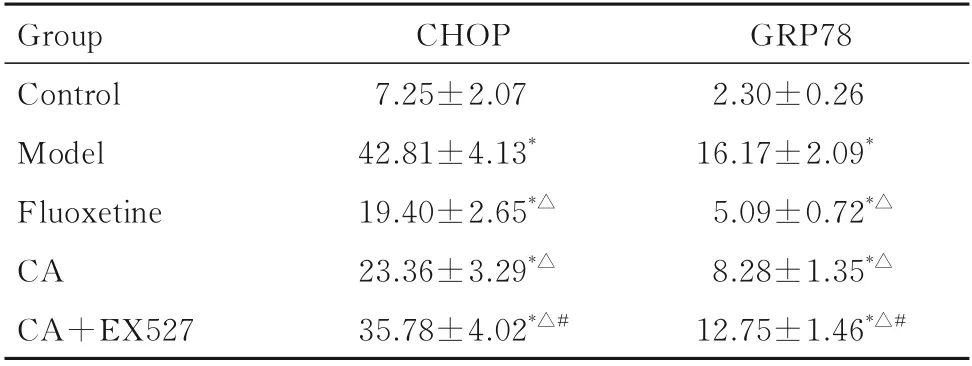
表4 各组大鼠大脑海马组织CA1 区GRP78 与CHOP 平均荧光强度Tab.4 Average fluorescence intensities of GRP78 and CHOP in CA1 region of hippocampus tissue in brain of rats in various groups (n=6,±s)
*P<0.05vscontrol group;△P<0.05vsmodel group;#P<0.05vsCA group.
GRP78 2.30±0.26 16.17±2.09*5.09±0.72*△8.28±1.35*△12.75±1.46*△#Group Control Model Fluoxetine CA CA+EX527 CHOP 7.25±2.07 42.81±4.13*19.40±2.65*△23.36±3.29*△35.78±4.02*△#
2.4 各组大鼠大脑海马组织CA1 区SIRT1、GRP78、CHOP 和Caspase-12 mRNA 表达水平与对照组比较,模型组大鼠大脑海马组织CA1 区中SIRT1 mRNA 表达水平明显降低(P<0.05),GRP78、CHOP 和Caspase-12 mRNA 表 达 水 平 明显升高(P<0.05);与模型组比较,氟西汀组和CA 组大鼠大脑海马组织CA1 区中SIRT1 mRNA表达水平明显升高(P<0.05),GRP78、CHOP和Caspase-12 mRNA 表达水平明显降低(P<0.05);与CA 组比较,CA+EX527 组大鼠大脑海马组织CA1 区中SIRT1 mRNA 表达水平明显降低(P<0.05),GRP78、CHOP 和Caspase-12 mRNA表达水平明显升高(P<0.05)。见表5。
表5 各组大鼠大脑海马组织CA1 区中SIRT1、GRP78、CHOP 和Caspase-12 mRNA 表 达 水 平Tab.5 Expression levels of SIRT1, GRP78, CHOP, and Caspase-12 mRNA in CA1 region in hippocampus tissue in brain of rats in various groups (n=6,±s)
*P<0.05vscontrol group;△P<0.05vsmodel group;#P<0.05vsCA group.
Group Control Model Fluoxetine CA CA+SIRT1 mRNA 1.01±0.12 0.35±0.05*0.79±0.08*△0.64±0.07*△GRP78 mRNA 0.98±0.10 2.43±0.28*1.57±0.21*△1.81±0.25*△CHOP mRNA 1.02±0.14 2.18±0.25*1.45±0.18*△1.59±0.20*△Caspase-12 mRNA 1.00±0.09 2.05±0.22*1.33±0.15*△1.46±0.19*△EX527 0.45±0.06*#2.26±0.29*#1.92±0.23*#1.80±0.20*#
2.5 各组大鼠大脑海马组织CA1 区中SIRT1、GRP78、CHOP、Caspase-12 和cleaved Caspase-12蛋白表达水平与对照组比较,模型组大鼠大脑海马组织CA1 区中SIRT1 蛋白表达水平明显降低(P<0.05),GRP78、CHOP、Caspase-12 和cleaved Caspase-12 蛋白表达水平明显升高(P<0.05);与模型组比较,氟西汀组和CA 组大鼠大脑海马组织CA1 区中SIRT1 蛋白表达水平明显升高(P<0.05),GRP78、CHOP、Caspase-12 和cleaved Caspase-12 蛋白表达水平明显降低(P<0.05);与CA 组比较,CA+EX527 组大鼠大脑海马组织CA1 区中SIRT1 蛋白表达水平明显降低(P<0.05),GRP78、CHOP、Caspase-12 和cleaved Caspase-12 蛋白表达水平明显升高(P<0.05)。见图3 和表6。
表6 各组大鼠大脑海马组织CA1 区中SIRT1、GRP78、CHOP、Caspase-12 和cleaved Caspase-12 蛋白表达水平Tab.6 Expression levels of SIRT1,GRP78, CHOP,Caspase-12, and cleaved Caspase-12 proteins in CA1 region in hippocampus tissue in brain of rats in various groups (n=6,±s)
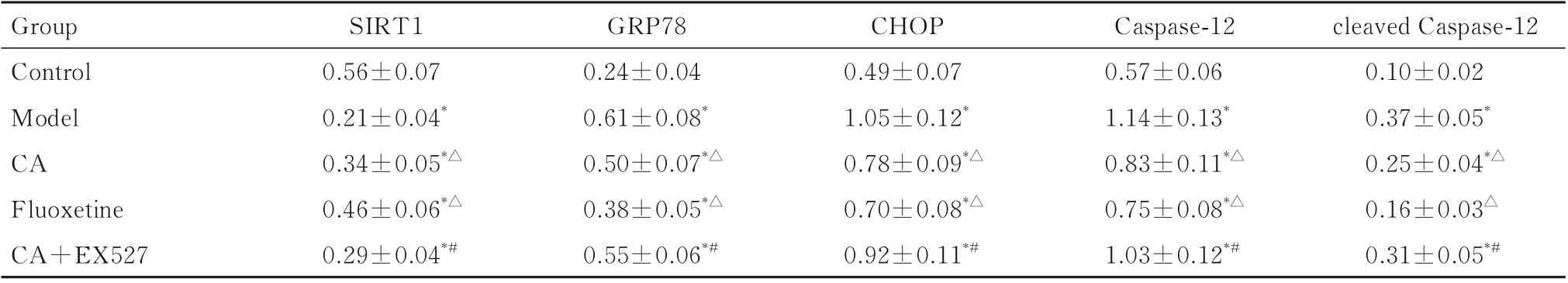
表6 各组大鼠大脑海马组织CA1 区中SIRT1、GRP78、CHOP、Caspase-12 和cleaved Caspase-12 蛋白表达水平Tab.6 Expression levels of SIRT1,GRP78, CHOP,Caspase-12, and cleaved Caspase-12 proteins in CA1 region in hippocampus tissue in brain of rats in various groups (n=6,±s)
*P<0.05vscontrol group;△P<0.05vsmodel group;#P<0.05vsCA group.
Group Control Model CA Fluoxetine CA+EX527 cleaved Caspase-12 0.10±0.02 0.37±0.05*0.25±0.04*△0.16±0.03△0.31±0.05*#SIRT1 0.56±0.07 0.21±0.04*0.34±0.05*△0.46±0.06*△0.29±0.04*#GRP78 0.24±0.04 0.61±0.08*0.50±0.07*△0.38±0.05*△0.55±0.06*#CHOP 0.49±0.07 1.05±0.12*0.78±0.09*△0.70±0.08*△0.92±0.11*#Caspase-12 0.57±0.06 1.14±0.13*0.83±0.11*△0.75±0.08*△1.03±0.12*#
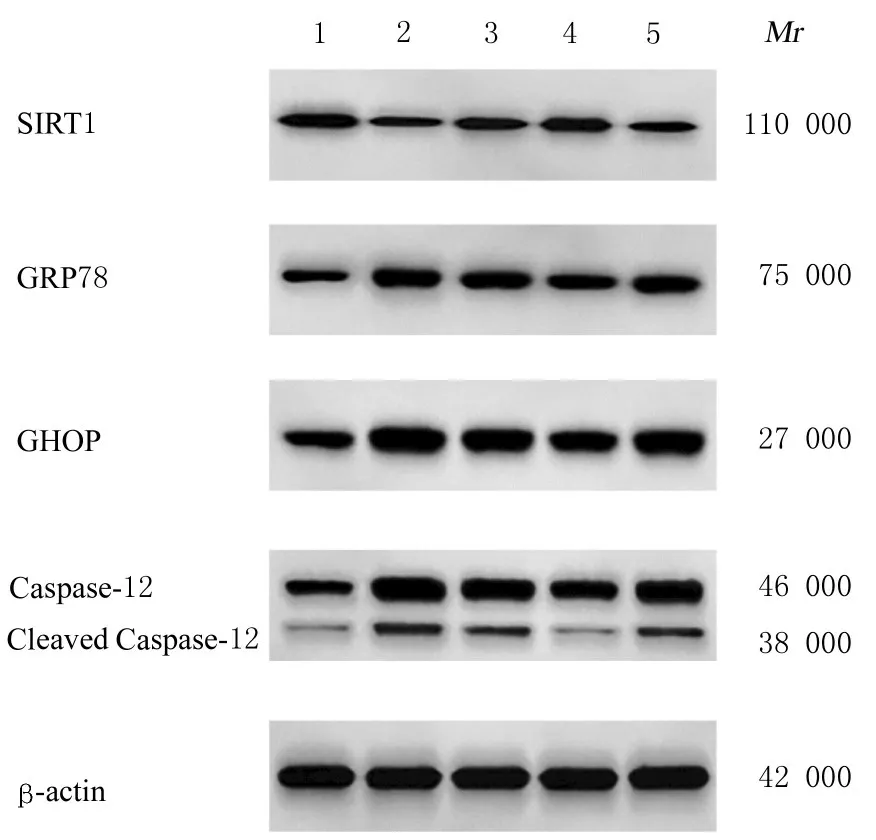
图3 各组大鼠大脑海马组织CA1 区中SIRT1、GRP78、CHOP、Caspase-12 和cleaved Caspase-12 蛋白表达电泳图Fig.3 Electrophoregram of expressions of SIRT1,GRP78, CHOP, Caspase-12, and cleaved Caspase-12 proteins in CA1 region in hippocampus tissue in brain of rats in various groups
3 讨 论
本研究结果再次证明了CA 在CUMS 诱导的抑郁模型中的抗抑郁作用,主要表现为CA 可使暴露于CUMS 的大鼠的抑郁样行为(OPT、FST 和SPT)趋向正常化,表明CA 是CUMS 诱导的抑郁样行为的潜在抑制剂。CA 还可以上调SIRT1 表达,减轻CUMS 诱导的抑郁大鼠海马ERS,提示CA 的抗抑郁机制可能与SIRT1 信号通路激活有关。
CUMS 模型是一种成熟且广泛应用的抑郁症动物模型,可以模拟抑郁症患者在临床观察中遇到的慢性压力,与啮齿动物的快感缺失行为密切相关[17]。本研究中,在暴露于CUMS 的大鼠中可观察到大鼠的饮食和饮水减少,糖水偏好度明显降低,反映了抑郁症的核心症状,即快感缺失;同时,该模型还模拟了重度抑郁障碍的其他症状表现,如运动能力和探索行为能力下降及行为绝望等,表明抑郁症模型制备成功。给予CA 干预后,抑郁大鼠显示出明显的蔗糖偏好和FST 中更短的不动时间,表明CA 具有抗抑郁活性,结果与先前的研究[5]一致。
ERS,即未折叠和错误折叠的蛋白质积累影响细胞正常生理功能的状态,是指内质网功能障碍引起的过度应激。ERS 是神经退行性疾病病理学[18-19]以及CUMS 诱发的抑郁症[20]发病机制中的关键步骤。近 来 研 究[21]证 实:SIRT1 为ERS 的 防 御 者,是治疗ERS 相关器官损伤的关键调控靶点,并参与抑郁症的发病。ABE-HIGUCHI 等[22]研究显示:抑制海马SIRT1 功能会导致抑郁样行为的增加。在CUMS 诱导的大鼠抑郁模型中,激活SIRT1 可降低ERS 标志物(CHOP 和GRP78 蛋白)蛋白表达 发 挥 抗 抑 郁 作 用[9]。GRP78、Caspase-12 和CHOP 是ERS 的关键指标,其上调或下调可以反映ERS。在本研究中,CUMS 诱导的抑郁大鼠海马组织中SIRT1 mRNA 和蛋白表达水平降低,而ERS 标 志 物CHOP、GRP78 和Caspase-12 蛋 白 表达水平升高,与以往的研究[8-9]结果一致,表明ERS 可能与SIRT1 的降低有关。因此,推测上调SIRT1 介导的ERS 抑制可能是抗抑郁药的潜在靶点。
CA 是迷迭香和鼠尾草叶中主要的酚类化合物之一,具有多种药理特性,包括抗细胞凋亡、抗氧化和抗肿瘤活性。SIRT1 可以被植物多酚激活,如丹酚酸B[9]、白藜芦醇[23]和槲皮素[24-25],并具有抗抑郁活性;同样,SIRT1 也可被CA 激活[10]。本研究结果显示:CA 干预逆转了由CUMS 引起的抑郁大鼠海马组织中SIRT1 表达下调,并降低了CHOP、GRP78 和Caspase-12 蛋白表达水平,抑制了ERS;TUNEL 染色结果证实:CA 抑制了CUMS 大鼠海马神经元变性和细胞凋亡。过度或持续的ERS 可通过激活CHOP,诱导Caspase-12的激活和裂解,触发Caspase 级联反应,导致细胞凋亡。Caspase-12 在内质网中特异表达,其裂解对于ERS 诱导的细胞凋亡是必不可少的[26]。本研究结果表明:CUMS 大鼠大脑海马组织CA1 区中cleaved Caspase-12 蛋白表达水平明显升高,而CA可降低cleaved Caspase-12 蛋白表达水平,与TUNEL 染色结果一致,表明CA 可抑制ERS 诱导的海马细胞凋亡。为了进一步验证CA 的抗抑郁机制,本研究在CA 干预的基础上应用SIRT1 特异性抑制剂EX527 抑制SIRT1 表达,结果显示:EX527 诱导ERS,减弱CA 对CUMS 诱导的抑郁大鼠抑郁样行为的抑制作用,提示CA 可能通过激活SIRT1,抑制ERS,进而抑制神经元凋亡。
综上所述,CA 可减轻CUMS 引起的大鼠抑郁样行为,其抗抑郁机制可能与上调SIRT1,抑制ERS 有关。但本研究中也存在一些局限性。首先,本研究主要观察大鼠大脑海马组织CA1 区中的神经元损伤,CA 是否对CA3 区和DG 区的神经元损伤产生影响,有待进一步分析。其次,本研究主要关注CA 对ERS 诱导的细胞凋亡的作用,不能完全排除神经炎症和氧化应激参与CA 的神经保护作用的可能性。因此,在后续的研究中将深入探讨CA在抗抑郁中的作用机制。
