LncRNA SNHG17 通过miR-384 靶向AEG1 对非小细胞肺癌细胞生物学行为的调控作用
2023-05-06刘韵鹏刘子豪康伯铭杨志广
刘韵鹏, 刘子豪, 康伯铭, 杨志广
(1.吉林大学第一医院胸外科,吉林 长春 130021;2.吉林大学药学院药学系,吉林 长春 130021)
在世界范围内,肺癌已经成为最常见的癌症之一,目前已有针对肺癌高风险特定患者群体的重点治疗策略,但多数非小细胞肺癌(non-small cell lung cancer,NSCLC)病例被诊断为晚期或已发生转移,总体预后仍然很差[1]。因此,识别新的预后生物标志物已成为NSCLC 研究中最紧迫的挑战之一。长链非编码RNA (long non-coding RNA,lncRNA)是长度超过200 个核苷酸的非编码RNA转录体家族,其失调在NSCLC、乳腺癌和胃癌等癌症发生发展过程中发挥重要作用[2-4]。NSCLC 的发生发展与lncRNAs 和微小RNA (microRNA,miRNA)的表达失调有关,异常表达的非编码RNA 可以作为NSCLC 的治疗靶点及诊断和预后标志物[5]。lncRNA 参与调控细胞增殖、迁移、侵袭、凋亡和耐药等多种生理病理过程[6]。lncRNA 小核仁RNA 宿 主 基 因17 (lncRNA small nucleolar RNA host gene 17,lncRNA SNHG17)是 长 度 为1 186 个核苷酸的lncRNA,是SNHG 家族的成员,位于人类染色体20q11.23 上,在癌症中发挥重要的 致 病 作 用[7]。MA 等[8]首 先 发 现SNHG17 在 结直肠癌中的过表达促进细胞增殖。SNHG17 在NSCLC[9]、肝 癌[10]、骨 肉 瘤[11]和 其 他 肿 瘤 组 织中过度表达,其表达水平与预后不良有关。SNHG17 可作为竞争性内源性RNA (competing endogenous RNA,ceRNA)吸附miRNAs,影响其他基因与该miRNAs 的结合,从而发挥调节基因表达的作用。目前,有研究[9]显示:SNHG17 在NSCLC 中过表达。然而,目前尚不清楚SNHG17在NSCLC 中发挥作用的具体机制。本研究通过生物信息学方法分析miR-384 与SNHG17 和星形细胞上调基因1 (astrocyte elevated gene 1,AEG1)3′端非编码区(3′-untranslated region,3′-UTR)之间的结合位点,探讨SNHG17、miR-384 和AEG1在NSCLC 中的功能和调控关系,阐明lncRNA SNHG17 通过miR-384/AEG1 轴调控NSCLC 细胞生物学行为的机制,为寻找NSCLC 有价值的治疗靶点提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器NSCLC 细胞系(A549 和H1299 细胞)均购于中国典型培养物保藏中心。RPMI 1640 培养基和胎牛血清(FBS)购自美国Hyclone 公司,青链霉素混合液(×100)、Hieff TransTM脂质体核酸转染试剂、第一链cDNA合成试剂盒、实时定量PCR 扩增预混液和BCA 蛋白质定量试剂盒均购自翌圣生物科技(上海)股份有限公司,TRIpure 总RNA 提取试剂盒购自北京百泰克生物技术有限公司,miRNA 快速提取试剂盒和miRNA 第一链cDNA 合成试剂盒购自北京全式金生物技术股份有限公司,Transwell 小室和基质凝胶购自美国Corning 公司,SNHG17 过表达质粒(pcDNA3.1-SNHG17)、SNHG17 小干扰RNA(si-SNHG17)、miR-384 模 拟 物 (miR-384 mimics)、miR-384 抑 制 剂(miR-384 inhibitor)和相应的阴性对照(NC)均购自上海GenePharma 公司。微量分光光度计购自美国Thermo Scientific 公司,实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)仪购自德国耶拿公司,奥林巴斯CKX31 倒置光学显微镜购自日本奥林巴斯公司。
1.2 细胞培养A549 和H1299 细胞在含有10%FBS、100 U·mL-1青霉素和100 mg·L-1链霉素的RPMI 1640 培养基中,于37 ℃、5%CO2条件下培养。
1.3 RT-qPCR 法检测A549 和H1299 细胞中SNHG17、miR-384 和AEG1 mRNA 表达水平收集各组细胞,按照总RNA 提取试剂盒说明书操作,检测RNA 浓度及纯度,并将RNA 逆转录为cDNA。根 据Hieff®qPCR SYBR Green Master Mix(No Rox)试剂盒说明书完成RT-qPCR 操作。分别以GAPDH 和U6 为内参,采用2-△△Ct法分别计算目的基因和目的miRNA 表达水平。引物序列:SNHG17 上 游 引 物,5′-TGAATCTCTTGGTGGTGTTTGTG-3′,SNHG17 下 游 引 物,5′-TGTCTGGACCCCGAATCTTG-3′;AEG1 上 游 引 物,5′-CCAGTTTCTCAGTCTACCACTT-3′,AEG1下 游 引 物 ,5′-CCCAGACCATTCATCATCGATA-3′;GAPDH 上 游 引 物,5′-CCTTCATTGACCTCAACTACATGG-3′,GAPDH 下 游 引 物,5′-CTCGCTCCTGGAAGATGGTG-3′;miR-384上游引物,5′-CTGCCGCGATTCCTAGAAATTGTTCA-3′,miR-384 下游引物为试剂盒通用下游引 物;U6 上 游 引 物,5′-GGTCGGGCAGGAAAGAGGGC-3′,U6 下游引物为试剂盒通用下游引物。实验重复3 次。
1.4 细胞转染A549 和H1299 细胞接种于6 孔细胞培养板,每孔5×104个细胞,待细胞密度达到60%~70%时,按照Hieff TransTM脂质体核酸转染试剂说明书步骤操作,根据不同实验的分组要求,分 别 将 pcDNA3.1-NC、pcDNA3.1-SNHG17、si-NC、si-SNHG17、mimics NC、miR-384 mimics、inhibitor NC、miR-384 inhibitor、pcDNA3.1-AEG1和si-AEG1 转 染 至A549 或H1299 细 胞,采 用RT-qPCR 法检测细胞转染是否成功。
1.5 预测miR-384 与SNHG17 和AEG1 之间的靶向性采用ENCORI 数据库(https://starbase.sysu.edu.cn/index.php)预 测miR-384 与SNHG17和AEG1 之间的靶向性。
1.6 CCK-8 法检测各组细胞的细胞活力收集各组细胞,离心重悬后稀释至1×104mL-1的密度,在96 孔细胞培养板中接种100 μL 细胞悬液,放入培养箱孵育24 h 后,每孔加入CCK-8 溶液10 μL,培养箱内孵育1 h,酶标仪检测450 nm 处的吸光度(A)值。细胞活力=(干预组A 值-空白组A值)/(对照组A 值-空白组A 值)×100%。
1.7 Transwell 实验检测各组细胞迁移细胞数和侵袭细胞数在Transwell 迁移和侵袭实验中,收集用0.25%胰蛋白酶处理的细胞,离心并用无血清培养基重悬,将200 μL 细胞(4×104mL-1)悬液加入无涂层或涂有基质凝胶的小室上层,将700 μL含15% FBS 的培养基加入下室。将细胞在37 ℃培养24 h。Transwell 膜用4%多聚甲醛固定20 min,用0.1%结晶紫染色,采用光学显微镜对迁移细胞数和侵袭细胞数进行计数。
1.8 Western blotting 法检测各组细胞中AEG1 蛋白表达水平用预冷的RIPA 裂解液裂解细胞并在冰上孵育20 min,4 °C、13 000 r·min-1离 心15 min。收集上清液,使用BCA 蛋白质定量试剂盒对蛋白质进行定量。调节蛋白质浓度后,将蛋白质与SDS蛋白上样缓冲液混合,在沸水中加热5 min 并变性,然后行Western blotting 电泳。用5%脱脂奶粉封闭膜。将膜与稀释的一抗孵育:AEG1抗体(1∶1 000,ABclonal)和 GAPDH 抗 体 (1∶2 000,ABclonal)在4 ℃下过夜,然后与二抗(1∶2 000,ABclonal)在室温下孵育1 h。最后,TBST 洗膜3 次后,条带使用显影剂进行显影。条带灰度值使用Image J 软件计算。以GAPDH 为内参,目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 蛋白条带灰度值。
1.9 统计学分析采用SPSS 17.0 统计软件进行统计学分析。各组细胞中lncRNA SNHG17、miR-384 和AEG1 mRNA 表达水平,各组细胞活力、迁移细胞数、侵袭细胞数及AEG1 蛋白表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 A549 和H1299 细胞中lncRNA SNHG17 表达水平H1299 细胞中lncRNA SNHG17 表达水平(0.66±0.09)明显低于A549 细胞(1.01±0.11)(P<0.01)。因此,本研究选择沉默A549 细胞中的lncRNA SNHG17 和过表达H1299 细胞中的lncRNA SNHG17 进行后续实验。
2.2 沉默或过表达lncRNA SNHG17 实验各组细胞中lncRNA SNHG17 表达水平、细胞活力、迁移细胞数和侵袭细胞数在A549 细胞中,与si-NC 组比较,si-SNHG17 组细胞中SNHG17 表达水平和细胞活力明显降低(P<0.01),迁移细胞数和侵袭细胞数明显减少(P<0.01);在H1299 细胞中,与pcDNA3.1-NC 组比较,pcDNA3.1-SNHG17 组细胞中SNHG17 表达水平和细胞活力明显升高(P<0.01),迁移细胞数和侵袭细胞数明显增加(P<0.01)。见表1。
表1 沉默或过表达lncRNA SNHG17 后各组细胞中lncRNA SNHG17 表达水平、细胞活力、迁移细胞数和侵袭细胞数Tab.1 Expression levels of lncRNA SNHG17, cell viabilities and numbers of migration and invasion cells in various groups after silencing lncRNA SNHG17 or over-expression of lncRNA SNHG17 (n=3,±s)
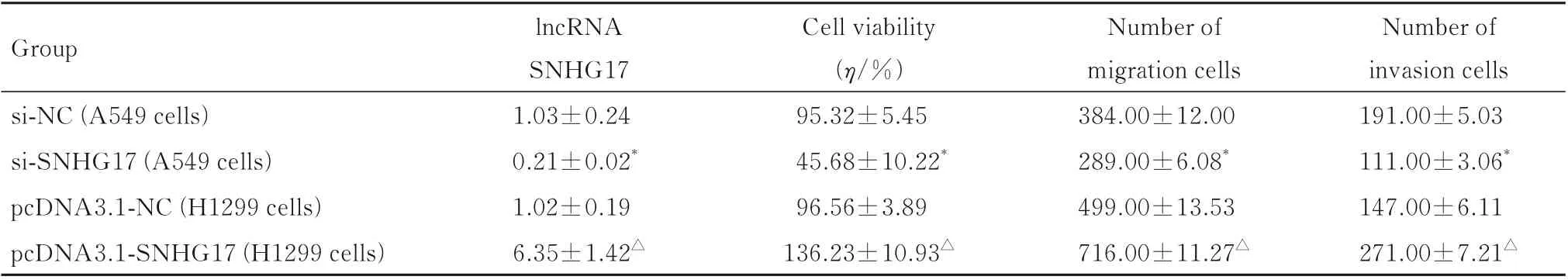
表1 沉默或过表达lncRNA SNHG17 后各组细胞中lncRNA SNHG17 表达水平、细胞活力、迁移细胞数和侵袭细胞数Tab.1 Expression levels of lncRNA SNHG17, cell viabilities and numbers of migration and invasion cells in various groups after silencing lncRNA SNHG17 or over-expression of lncRNA SNHG17 (n=3,±s)
*P<0.01 compared with si-NC group;△P<0.01 compared with pcDNA3.1-NC group.
Group si-NC (A549 cells)si-SNHG17 (A549 cells)pcDNA3.1-NC (H1299 cells)pcDNA3.1-SNHG17 (H1299 cells)Number of invasion cells 191.00±5.03 111.00±3.06*147.00±6.11 271.00±7.21△lncRNA SNHG17 1.03±0.24 0.21±0.02*1.02±0.19 6.35±1.42△Cell viability(η/%)95.32±5.45 45.68±10.22*96.56±3.89 136.23±10.93△Number of migration cells 384.00±12.00 289.00±6.08*499.00±13.53 716.00±11.27△
2.3 沉默或过表达lncRNA SNHG17 后各组细胞中miR-384 和AEG1 mRNA 表达水平在A549 细胞中,与si-NC 组比较,si-SNHG17 组细胞中miR-384 表达水平明显升高(P<0.01),AEG1 mRNA 表达水平明显降低(P<0.01);在H1299细胞中,与pcDNA3.1-NC 组比较,pcDNA3.1-SNHG17 组细胞中miR-384 表达水平明显降低(P<0.01),AEG1 mRNA 表 达 水 平 明 显 升 高(P<0.01)。见表2。
表2 沉默或过表达lncRNA SNHG17 后各组细胞中miR-384 和AEG1 mRNA 表 达 水 平Tab.2 Expression levels of miR-384 and AEG1 mRNA in cells in various groups after silencing lncRNA SNHG17 or over-expression of lncRNA SNHG17 (n=3,±s)
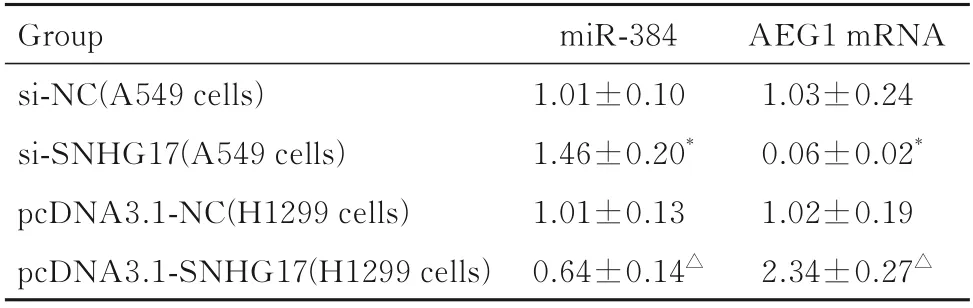
表2 沉默或过表达lncRNA SNHG17 后各组细胞中miR-384 和AEG1 mRNA 表 达 水 平Tab.2 Expression levels of miR-384 and AEG1 mRNA in cells in various groups after silencing lncRNA SNHG17 or over-expression of lncRNA SNHG17 (n=3,±s)
*P<0.01 compared with si-NC group;△P<0.01 compared with pcDNA3.1-NC group.
AEG1 mRNA 1.03±0.24 0.06±0.02*1.02±0.19 2.34±0.27△Group si-NC(A549 cells)si-SNHG17(A549 cells)pcDNA3.1-NC(H1299 cells)pcDNA3.1-SNHG17(H1299 cells)miR-384 1.01±0.10 1.46±0.20*1.01±0.13 0.64±0.14△
2.4 抑制或增强miR-384 后各组细胞中miR-384表达水平、细胞活力、迁移细胞数和侵袭细胞数在A549 细胞中,与inhibitor NC 组比较,miR-384 inhibitor 组细胞中miR-384 表达水平明显降低(P<0.01),细胞活力明显升高(P<0.01),迁移细胞数和侵袭细胞数明显增加(P<0.01);在H1299细胞中,与mimics NC 组比较,miR-384 mimics 组细胞中miR-384 表达水平明显升高(P<0.01),细胞活力明显降低(P<0.01),迁移细胞数和侵袭细胞数明显减少(P<0.01)。见表3。
表3 各组细胞中miR-384 表达水平、细胞活力、迁移细胞数和侵袭细胞数Tab.3 Expression levels of miR-384, cell viabilities, numbers of migration and invasion cells in various groups (n=3,±s)
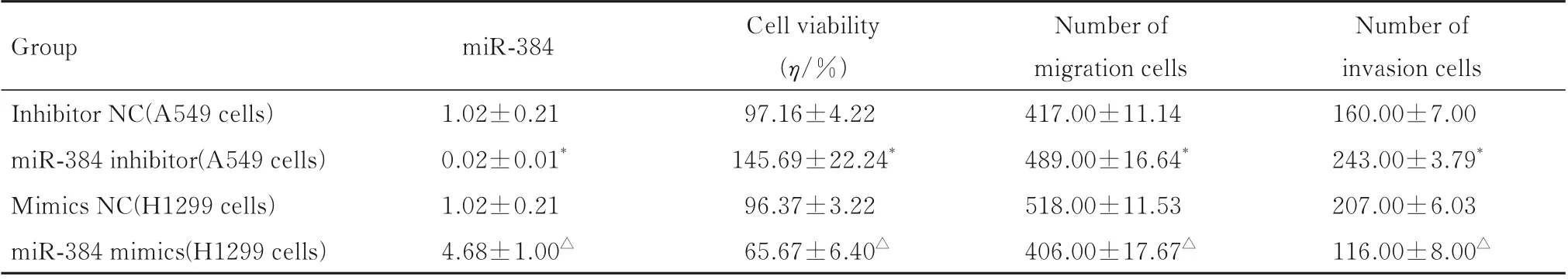
表3 各组细胞中miR-384 表达水平、细胞活力、迁移细胞数和侵袭细胞数Tab.3 Expression levels of miR-384, cell viabilities, numbers of migration and invasion cells in various groups (n=3,±s)
*P<0.01 compared with inhibitor NC group;△P<0.01 compared with mimics NC group.
Group miR-384 Inhibitor NC(A549 cells)miR-384 inhibitor(A549 cells)Mimics NC(H1299 cells)miR-384 mimics(H1299 cells)Number of invasion cells 160.00±7.00 243.00±3.79*207.00±6.03 116.00±8.00△1.02±0.21 0.02±0.01*1.02±0.21 4.68±1.00△Cell viability(η/%)97.16±4.22 145.69±22.24*96.37±3.22 65.67±6.40△Number of migration cells 417.00±11.14 489.00±16.64*518.00±11.53 406.00±17.67△
2.5 抑制或增强lncRNA SNHG17 和miR-384 后各组AEG1 蛋白表达水平、细胞活力、迁移细胞数和侵袭细胞数采用ENCORI 数据库预测SNHG17与miR-384 有2 个结合位点(图1)。在A549 细胞中,与si-NC+inhibitor NC 组比较,si-SNHG17+inhibitor NC 组细胞中AEG1 蛋白表达水平和细胞活力明显降低(P<0.01),迁移细胞数和侵袭细胞 数 明 显 减 少(P<0.01);与si-SNHG17+inhibitor NC 组 比 较,si-SNHG17+miR-384 inhibitor 组细胞中AEG1 蛋白表达水平和细胞活力明显升高(P<0.01),迁移细胞数和侵袭细胞数明 显 增 加(P<0.01)。在H1299 细 胞 中,与pcDNA3.1-NC+mimics NC 组比较,pcDNA3.1-SNHG17+mimics NC 组细胞中AEG1 蛋白表达水平和细胞活力明显升高(P<0.01),迁移细胞数和 侵 袭 细 胞 数 明 显 增 加 (P<0.01);与pcDNA3.1-SNHG17+mimics NC 组 比 较,pcDNA3.1-SNHG17+miR-384 mimics 组细胞中AEG1 蛋白表达水平和细胞活力明显降低(P<0.01),迁移细胞数和侵袭细胞数明显减少(P<0.01)。见表4 和图2。

图1 lncRNA SNHG17 与miR-384 的 结 合 位 点Fig.1 Binding sites of lncRNA SNHG17 and miR-384
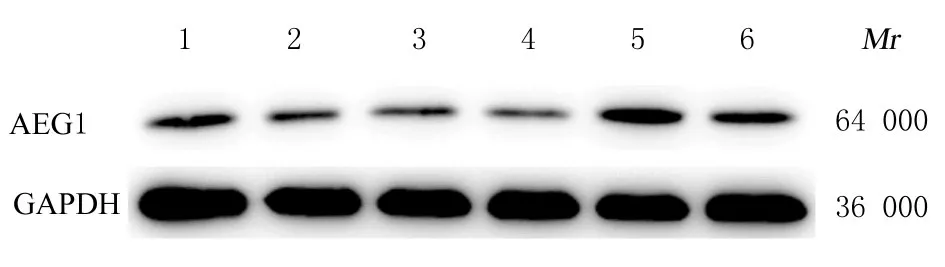
图2 抑 制 或 增 强 lncRNA SNHG17 和 miR-384 后Western blotting 法检测各组细胞中AEG1 蛋白表达电泳图Fig.2 Electrophoregram of expressions of AEG1 protein in cells in various groups detected by Western blotting method after inhibiting or enhancing lncRNA SNHG17 and miR-384
表4 抑制或增强lncRNA SNHG17 和miR-384 后各组细胞活力、迁移细胞数及侵袭细胞数Tab.4 Cell viabilities and numbers of migration and invasion cells in various groups after inhibiting or enhancing lncRNA SNHG17 and miR-384 (n=3,±s)
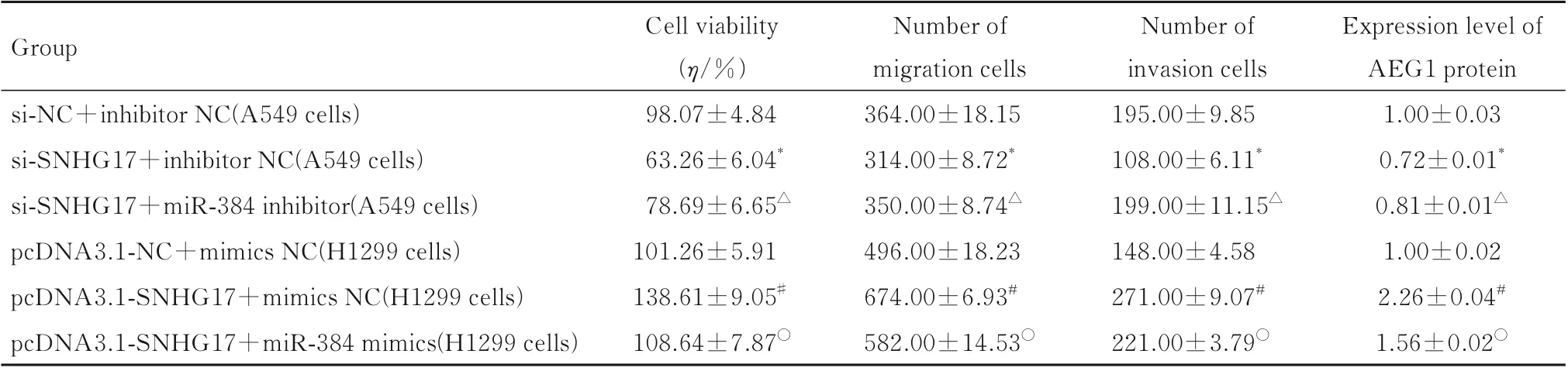
表4 抑制或增强lncRNA SNHG17 和miR-384 后各组细胞活力、迁移细胞数及侵袭细胞数Tab.4 Cell viabilities and numbers of migration and invasion cells in various groups after inhibiting or enhancing lncRNA SNHG17 and miR-384 (n=3,±s)
*P<0.01 compared with si-NC+inhibitor NC group;△P<0.01 compared with si-SNHG17+inhibitor NC group;#P<0.01 compared with pcDNA3.1-NC+mimics NC group;○P<0.01 compared with pcDNA3.1-SNHG17+mimics NC group.
Expression level of AEG1 protein 1.00±0.03 0.72±0.01*0.81±0.01△1.00±0.02 2.26±0.04#1.56±0.02○Group si-NC+inhibitor NC(A549 cells)si-SNHG17+inhibitor NC(A549 cells)si-SNHG17+miR-384 inhibitor(A549 cells)pcDNA3.1-NC+mimics NC(H1299 cells)pcDNA3.1-SNHG17+mimics NC(H1299 cells)pcDNA3.1-SNHG17+miR-384 mimics(H1299 cells)Cell viability(η/%)98.07±4.84 63.26±6.04*78.69±6.65△101.26±5.91 138.61±9.05#108.64±7.87○Number of migration cells 364.00±18.15 314.00±8.72*350.00±8.74△496.00±18.23 674.00±6.93#582.00±14.53○Number of invasion cells 195.00±9.85 108.00±6.11*199.00±11.15△148.00±4.58 271.00±9.07#221.00±3.79○
2.6 抑制或增强AEG1 后各组细胞中AEG1 mRNA 表达水平、细胞活力、迁移细胞数和侵袭细胞数在A549 细胞中,与si-NC 组比较,si-AEG1组细胞中AEG1 mRNA 表达水平和细胞活力明显降低(P<0.01),迁移细胞数和侵袭细胞数明显减 少 (P<0.01);在 H1299 细 胞 中,与pcDNA3.1-NC 组 比 较,pcDNA3.1-AEG1 组 细 胞中AEG1 mRNA 表达水平和细胞活力明显升高(P<0.01),迁移细胞数和侵袭细胞数明显增加(P<0.01)。见表5。
表5 抑制或增强AEG1 后各组细胞中AEG1 mRNA 表达水平、细胞活力、迁移细胞数和侵袭细胞数Tab.5 Expression levels of AEG1 mRNA in cells, cell viabilities and numbers of migration and invasion cells in various groups after inhibiting or enhancing AEG1 (n=3,±s)
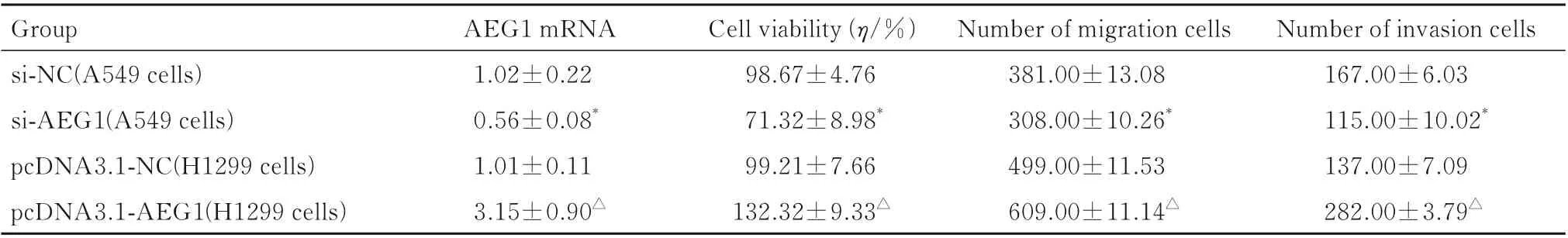
表5 抑制或增强AEG1 后各组细胞中AEG1 mRNA 表达水平、细胞活力、迁移细胞数和侵袭细胞数Tab.5 Expression levels of AEG1 mRNA in cells, cell viabilities and numbers of migration and invasion cells in various groups after inhibiting or enhancing AEG1 (n=3,±s)
*P<0.01 compared with si-NC group;△P<0.01 compared with pcDNA3.1-NC group.
Group si-NC(A549 cells)si-AEG1(A549 cells)pcDNA3.1-NC(H1299 cells)pcDNA3.1-AEG1(H1299 cells)Number of invasion cells 167.00±6.03 115.00±10.02*137.00±7.09 282.00±3.79△AEG1 mRNA 1.02±0.22 0.56±0.08*1.01±0.11 3.15±0.90△Cell viability (η/%)98.67±4.76 71.32±8.98*99.21±7.66 132.32±9.33△Number of migration cells 381.00±13.08 308.00±10.26*499.00±11.53 609.00±11.14△
2.7 抑制或增强miR-384 和AEG1 mRNA 后各组细胞活力、迁移细胞数和侵袭细胞数ENCORI 数据库中显示:TargetScan 预测miR-384 与AEG1 有1 个结合位点(图3)。在A549 细胞中,与inhibitor NC+si-NC 组 比 较,miR-384 inhibitor+si-NC 组 细胞中细胞活力明显升高(P<0.01),迁移细胞数和侵袭细胞数明显增加(P<0.01);与miR-384 inhibitor+si-NC 组 比 较,miR-384 inhibitor+si-AEG1 组细胞中细胞活力明显降低(P<0.01),迁移细胞数和侵袭细胞数明显减少(P<0.01)。在H1299 细 胞 中,与mimics NC+pcDNA3.1-NC 组比较,miR-384 mimics+pcDNA3.1-NC 组细胞中细胞活力明显降低(P<0.01),迁移细胞数和侵袭细胞数明显减少(P<0.01);与miR-384 mimics+pcDNA3.1-NC 组 比 较,miR-384 mimics+pcDNA3.1-AEG1 组细胞中细胞活力明显升高(P<0.01),迁移细胞数和侵袭细胞数明显增加(P<0.01)。见表6。
表6 抑制或增强miR-384 和AEG1 mRNA 后各组细胞活力、迁移和侵袭细胞数Tab.6 Cell viabilities and numbers of migration and invasion cells in various groups after inhibiting or enhancing miR-384 and AEG1 mRNA (n=3,±s)
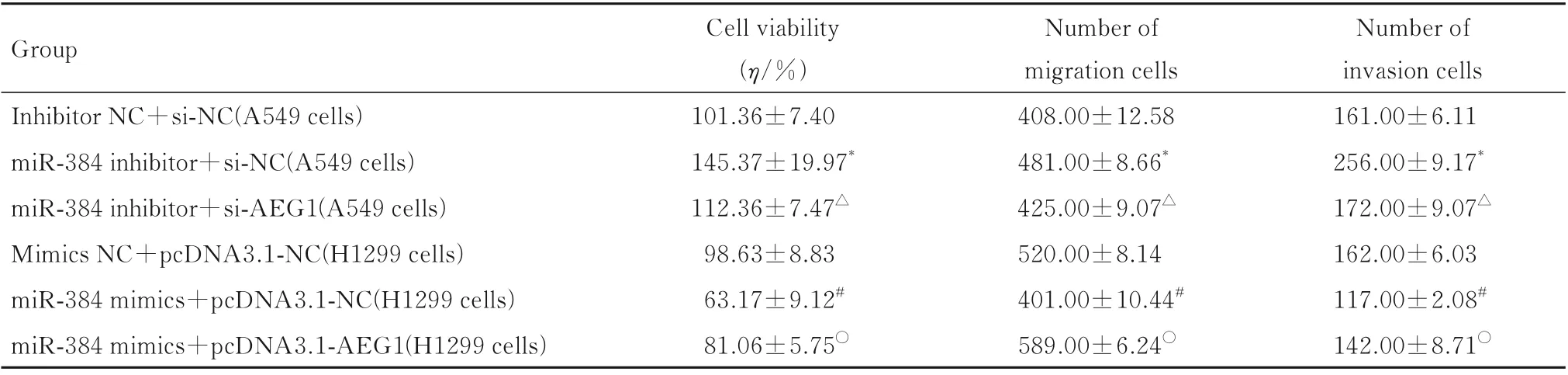
表6 抑制或增强miR-384 和AEG1 mRNA 后各组细胞活力、迁移和侵袭细胞数Tab.6 Cell viabilities and numbers of migration and invasion cells in various groups after inhibiting or enhancing miR-384 and AEG1 mRNA (n=3,±s)
*P<0.01 compared with inhibitor NC+si-NC group;△P<0.01 compared with miR-384 inhibitor+si-NC group;#P<0.01 compared with mimics NC+pcDNA3.1-NC group;○P<0.01 compared with miR-384 mimics+pcDNA3.1-NC group.
Number of invasion cells 161.00±6.11 256.00±9.17*172.00±9.07△162.00±6.03 117.00±2.08#142.00±8.71○Group Inhibitor NC+si-NC(A549 cells)miR-384 inhibitor+si-NC(A549 cells)miR-384 inhibitor+si-AEG1(A549 cells)Mimics NC+pcDNA3.1-NC(H1299 cells)miR-384 mimics+pcDNA3.1-NC(H1299 cells)miR-384 mimics+pcDNA3.1-AEG1(H1299 cells)Cell viability(η/%)101.36±7.40 145.37±19.97*112.36±7.47△98.63±8.83 63.17±9.12#81.06±5.75○Number of migration cells 408.00±12.58 481.00±8.66*425.00±9.07△520.00±8.14 401.00±10.44#589.00±6.24○

图3 miR-384 与AEG1 的 结 合 位 点Fig.3 Binding sites of miR-384 and AEG1
3 讨 论
肺癌的发病率和死亡率逐年上升,对人类健康构成严重威胁,其中约85%为NSCLC[12]。分子靶向疗法和免疫疗法明显改善了NSCLC 患者的预后[13]。近年来,大量研究报道lncRNA 在癌症中发挥至关重要的作用,受到广泛关注。lncRNA 在NSCLC 发生发展过程中具有重要意义,如长非编码RNA 巨人皂甙(lnc-GAN1)在NSCLC 中的表达与患者良好的存活率相关,并通过吸附miR-26a-5p激活磷酸酶和张力蛋白同源物(phoshatase and tensin homolog,PTEN)信号传导来抑制肿瘤进展[14]。本研究结果显示:在A549 细胞中SNHG17表达量高于H1299 细胞,过表达SNHG17 可以促进NSCLC 细胞的增殖、迁移和侵袭,而沉默SNHG17 抑制NSCLC 细胞的增殖、迁移和侵袭,表明SNHG17 在NSCLC 中发挥重要作用,为其作为NSCLC 治疗靶点提供理论依据。
与其他lncRNA 相似,lncRNA SNHG17 也可以作为ceRNA 与几种miRNA 相互作用,从而对癌细胞产生影响。因此,研究lncRNAs 和miRNAs 在NSCLC 进展中的作用,深入探讨其分子机制,为NSCLC 的治疗提供潜在的治疗靶点。lncRNA SNHG17 可以通过调节miRNA-375/配对盒6(paired box 6,PAX6)轴促进口腔鳞状细胞癌的进 展[15];lncRNA SNHG17 还 可 以 通 过 靶 向miRNA-338-3p/SRY-box 转 录 因 子4 (SRY-box transcription factor 4,SOX4)轴调控食管鳞状细胞癌的细胞增殖和侵袭[16]。本研究结果显示:lncRNA SNHG17 还可以通过靶向miR-384/AEG1轴调控NSCLC 的细胞增殖、迁移细胞数和侵袭细胞数。SNHG17 在NSCLC 组织和细胞系中上调并与晚期TNM 分期和较短的总生存期相关[17-18]。在本研究中,过表达或沉默lncRNA SNHG17 后,AEG1 mRNA 表达水平会随lncRNA SNHG17 的过表达或沉默而升高或降低,而miR-384 的表达水平会随lncRNA SNHG17 的过表达或沉默而降低或升高,与FAN 等[19]的相关研究结果一致。ENCORI数据库是一个开源平台,用于从CLIP-seq、degradome-seq 和RNA-RNA 相互作用数据中研究miRNA-ncRNA、miRNA-mRNA、ncRNA-RNA、RNA-RNA、RBP-ncRNA 和RBP-mRNA 相 互 作用。采用ENCORI 数据库预测SNHG17 与miR-384的结合位点以及miR-384 与AEG1 的结合位点,说明SNHG17 与miR-384 以 及miR-384 与AEG1 之 间靶向性良好。miR-384 可以影响胃癌和胶质瘤等细胞的生物学功能[20-21]。研究[22-23]显示:miR-384 还可以影响NSCLC 细胞的增殖、转移、化疗耐药性、凋亡和自噬。在本研究中通过对miR-384 进行过表达和抑制,结果显示:其表达水平升高与NSCLC 的细胞活力降低及迁移细胞数和侵袭细胞数减少有关。AEG1 在各种癌症类型中具有多方面的功能,其差异表达具有重要的临床病理学意义,有作为治疗靶点开发分子抑制剂的潜力。AEG1 参与调控NSCLC 的增殖、迁移、侵袭、化疗耐药和放射耐药[24]。本研究通过对AEG1 进行过表达或抑制,结果显示:AEG1 表达水平降低与NSCLC的细胞活力降低,迁移细胞数和侵袭细胞数减少有关。虽然lncRNA SNHG17、miR-384 和AEG1 分别在NSCLC 中均有相关研究,但相关数据资料仍旧较少,而且三者之间的调控机制在NSCLC 中尚无相关报道,因此本研究对lncRNA SNHG17/miR-384/AEG1 轴对NSCLC 细胞生物学功能影响进行了深入研究。本实验结果表明:miR-384 inhibitor 部分逆转了si-SNHG17 抑制细胞增殖、迁移和侵袭的作用,miR-384 mimics 部分逆转了pcDNA3.1-SNHG17 促进细胞增殖、迁移和侵袭的作 用,说 明SNHG17 可 以 通 过miR-384 调 控NSCLC 细胞的增殖、迁移和侵袭。si-AEG1 部分逆转了miR-384 inhibitor 促进细胞增殖、迁移和侵袭的作用,pcDNA3.1-AEG1 部分逆转了miR-384 mimics 抑制细胞增殖、迁移和侵袭的作用,说明miR-384 可以通过AEG1 调控NSCLC 细胞增殖、迁移和侵袭。lncRNA SNHG17 可以通过miR-384靶向AEG1 调控NSCLC 细胞的增殖、迁移和侵袭[25],表 明lncRNA SNHG17/miR-384/AEG1 轴在NSCLC 基因靶向治疗中具有巨大潜力。
综上所述,本研究证明了lncRNA SNHG17 通过miR-384/AEG1 轴调节NSCLC 细胞的增殖、迁移和侵袭,进而促进NSCLC 的进展。本研究通过对NSCLC 进展的分子机制进行深入研究,为NSCLC 患者的治疗提供了一个潜在的治疗靶点,为疾病的治疗开发了潜在的生物标志物。
