转位蛋白配体XBD173 对香烟烟雾提取物诱导小鼠肺炎症反应的减轻作用及其机制
2023-05-06高兴洪唐红梅李月蛟王孝芸袁谢芳
高兴洪, 唐红梅, 李月蛟, 王孝芸, 王 星, 袁谢芳, 吴 敏
(西南医科大学附属医院炎症与变态反应实验室,四川 泸州 646000)
自1956 年RICHARD-DOLL 阐述了吸烟与肺癌高度相关[1],吸烟的危害已经被广泛研究。烟雾暴露可参与机体多种疾病的发生发展,巨噬细胞在受到香烟烟雾提取物(cigarette smoke extract,CSE)刺激时,可极化为M1 型巨噬细胞,分泌多种炎症因子,在CSE 诱导的肺部炎症反应中具有重 要 作 用[2],转 位 蛋 白(translocator protein,TSPO)广泛分布于线粒体外膜,具有调节胆固醇转运、类固醇类激素合成、卟啉转运、血红素合成、细胞凋亡、细胞增殖、离子运输、线粒体功能调节和免疫调节等多种功能[3]。XBD173 为人工合成的TSPO 配体,研究[4]显示:XBD173 具有良好的抗炎作用和神经保护作用,但XBD173 对CSE诱导的肺炎症反应和巨噬细胞极化是否有作用及其可能机制,国内外尚未见相关报道。因此本研究以C57BL/6 小鼠和RAW264.7 细胞为研究对象,探讨XBD173 对CSE 所致小鼠肺部炎症反应和CSE诱导的巨噬细胞M1 型极化的影响及其可能分子机制,以期为吸烟者的肺炎症治疗提供新思路。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器18 只8 周龄SPF 级C57BL/6 雄性小鼠购于重庆腾鑫生物技术有限公司,动物使用许可证号:SYXK (川)2018-065,体质量(20±2)g。12 h 交替照明,温度保持在22 ℃~26 ℃,自由获取食物和水,按照《实验动物许可管理办法》和《实验动物管理条例》的相关规定进行实验;香烟(娇子牌)购自成都卷烟厂;小鼠Raw264.7 巨噬细胞购于中国科学院细胞库;血清购于澳大利亚Bovogen Biological 公司,高糖DMEM 培养基购于上海源培生物科技股份有限公司,XBD173 购于美国MedChemExpress 生物科技公司,CD80、CD86 和诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)流式抗体均购于赛默飞世尔科技(中国)有限公司,活性氧(reactive oxygen species,ROS)检测试剂盒购于上海碧云天生物技术有限公司,凋亡检测试剂盒购于四正柏生物有限公司,逆转录试剂盒和逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒购于南京诺维赞生物科技有限公司,Western blotting 抗体GADPH、核因子κB/p65 (nuclear factor-κB/p65,NF-κB/p65)和磷酸化NF-κB/p65(phosphorylated NF-κB/p65,p-NF-κB/p65)均 购 于 美 国 Cell Signal Technology 公司,ECL 超敏化学发光试剂盒购自四正柏生物有限公司,TSPO 转染慢病毒、转染试剂和嘌呤霉素购于吉凯基因,HE 染色试剂盒、RIPA 裂解液和SDS-PAGE 凝胶配制试剂盒均购于碧云天生物技术公司。凝胶成像分析仪购自美国BIO-RAD 公司,Leica DM2000 显微镜购自德国Leica Microsystems 公 司,Centrifuge 5810R 离 心 机购自德国艾本德公司,Nano400 微量分光光度计购自北京原平皓生物技术有限公司,LightCycler480 Ⅱ实时荧光定量PCR 系统购自瑞士罗氏医学仪器公司。
1.2 CSE 制备参 照NAKAMURA 等[5]方 法 制备:将香烟烟嘴与泵连接,通过泵的抽气作用吸取香烟燃烧后的烟雾,按每支香烟烟雾溶解于2 mL PBS 液制成悬液。悬液经NaOH 调节pH 值为7.4,经孔径为0.2 μm 滤膜过滤除去细菌和大颗粒后备用。
1.3 实验动物分组、肺炎症模型制备及处理18 只小鼠随机分为对照组、CSE 组和CSE+XBD173 组,每组6 只。CSE 组和CSE+XBD173组小鼠给予CSE 滴鼻,每 次20 μ L,连 续28 d,2 次 间 隔24 h;在 第22~28 天,CSE+XBD173 组小鼠在CSE 刺激前0.5 h 给予10 mg·kg-1XBD173腹腔注射。第29 天处死小鼠。
1.4 HE 染色观察各组小鼠肺组织病理形态表现处死小鼠后取新鲜肺组织,4%多聚甲醛固定20 h。脱水、透明、浸蜡和包埋,将包埋好的肺组织蜡块切片,厚度为4 μm,按HE 染色试剂盒进行后续步骤。染色完成后,显微镜下观察各组小鼠肺组织病理形态表现。
1.5 PAS 染色观察各组小鼠肺组织病理形态表现 处死小鼠后取新鲜肺组织,10% 甲醛固定,石蜡包埋,2 μm 厚度切片后常规脱蜡至水,PAS染色后中性树胶封固。显微镜下观察各组小鼠肺组织病理形态表现。
1.6 RAW264.7 细胞TSPO 蛋白敲低和筛选将处于对数生长期的RAW264.7 细胞经细胞刮刮下,完全培养基制成细胞密度为(3~5)×104mL-1的细胞悬液,6 孔细胞培养板铺板,每孔2 mL,培养24 h 后,采用感染复数(multiplicity of infection,MOI)为20 的慢病毒感染RAW264.7 细胞以敲低TSPO 基因,培养12 h 后完全培养基换液继续培养,在完全培养基中加入2 mg·L-1嘌呤嘧啶筛选,当病毒载体上的绿色荧光蛋白(green fluorescent protein,GFP)阳性表达率大于80%时,收集细胞进行后续实验。TSPO 基因敲低序列,上游引物:5′-ACCATTGGGCC-3′,下 游 引 物:5′-CTGGTCTA-3′。
1.7 RT-qPCR 法检测各组RAW264.7 细胞中白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)mRNA 表达水平将实验处理后的细胞按照RNA 提取试剂盒说明书提取RNA;采用微量分光光度计测定总RNA纯度,检测RNA 样本在波长260 和280 nm 处的吸光度(A)值,控制A(260)/A(280)在1.9~2.1,RNA 电泳检测其完整性。检测浓度及纯度后取2 μg 总RNA,采用逆转录试剂盒合成cDNA。逆转录条件:37 ℃反应15 min,85 ℃反应5 s。将逆转录所得cDNA 纯化后应用RT-qPCR 仪进行PCR 扩增。反应总体积为20 μL:2 μ L cDNA 模板,2 μ L 引 物,10 μL SYBR qPCR Master Mix,6 μL H2O。PCR 反应条件:95 ℃预变性30 s,扩增循环95 ℃、5 s,56 ℃、34 s,共40 个 循 环。以β-actin 为 参 照,采 用2-ΔΔCt法 计 算IL-6 和TNF-α mRNA 相对表达水平。引物序列见表1。
1.8 Western blotting 法检测各组RAW264.7 细胞中NF-κB/p65 和p-NF-κB/p65 蛋白表达水平细胞刺激结束后,吸去培养基,PBS 缓 冲 液 洗 涤1 次,加入200 μL RIPA 强裂解液,检测蛋白浓度;加入含SDS 上样缓冲液,煮10 min;进行SDSPAGE 凝胶配制,上样电泳;采用PVDF 膜转膜;5%脱脂奶粉进行封闭;按照抗体说明书稀释一抗,4 ℃过夜孵育。TBST 洗涤3 次,进行二抗孵育,4 ℃孵育2 h,TBST 洗涤3 次后,采用ECL 超敏化学底物试剂盒上机检测拍照分析;Image J 软件分析各蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 蛋白条带灰度值。
1.9 流式细胞术检测各组RAW264.7 细胞CD80、CD86、iNOS 和ROS 表达水平将各组细胞分装入5 mL 流式细胞管内,离心细胞,弃上清,CD80、CD86 和iNOS 抗体用孵育缓冲液按照1∶1 000 稀释,加入100 μL 含抗体的孵育缓冲液,重悬细胞;在冰上孵育30 min。1 200 r·min-1离心5 min,弃上清液;加入100 μL 孵育缓冲液重悬细胞,使用流式细胞分析仪检测分析。ROS 按照试剂盒说明书检测。CD80 和CD86 表达水平以各组荧光阳性细胞数量占总细胞数百分比表示,iNOS 和ROS 表达水平以各组细胞的平均荧光强度表示。
1.10 流式细胞术检测各组RAW264.7 细胞凋亡率收集已处理好的细胞至离心管内,1 000 g 离心5 min,弃上清,收集细胞,用PBS 缓冲液轻轻重悬细胞并计数,取(5~10)×104个万重悬的细胞,1 000 g 离心5 min,弃上清,加入195 μL Annexin Ⅴ-FITC 结合液轻轻重悬细胞;加入5 μL Annexin Ⅴ-FITC,混匀;加入10 μL 碘化丙啶染色液,混匀;室温避光孵育10 min,流式细胞仪检测,按说明书分析。
1.11 统计学分析采用SPSS 24.0 软件进行统计学分析。各组细胞中CD80、CD86、iNOS 和ROS表达水平,IL-6 和TNF-α mRNA 表达水平,细胞凋亡率,NF-κB/p65 和p-NF-κB/p65 蛋白表达水平均符合正态分布,以x±s 表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠肺组织病理形态表现HE 染色和PAS 染色结果显示:对照组小鼠肺组织中支气管结构完整,肺泡腔结构清晰,肺泡壁厚度均匀,无增宽和渗出等现象,肺泡间隔无水肿、无炎症细胞浸润、无分泌物渗出。CSE 组小鼠肺组织中支气管管腔变窄,管壁增厚,有分泌物渗出,可见大量炎症细胞浸润,肺泡结构不完整。CSE+XBD173组小鼠肺组织中炎症表现减轻。见图1。
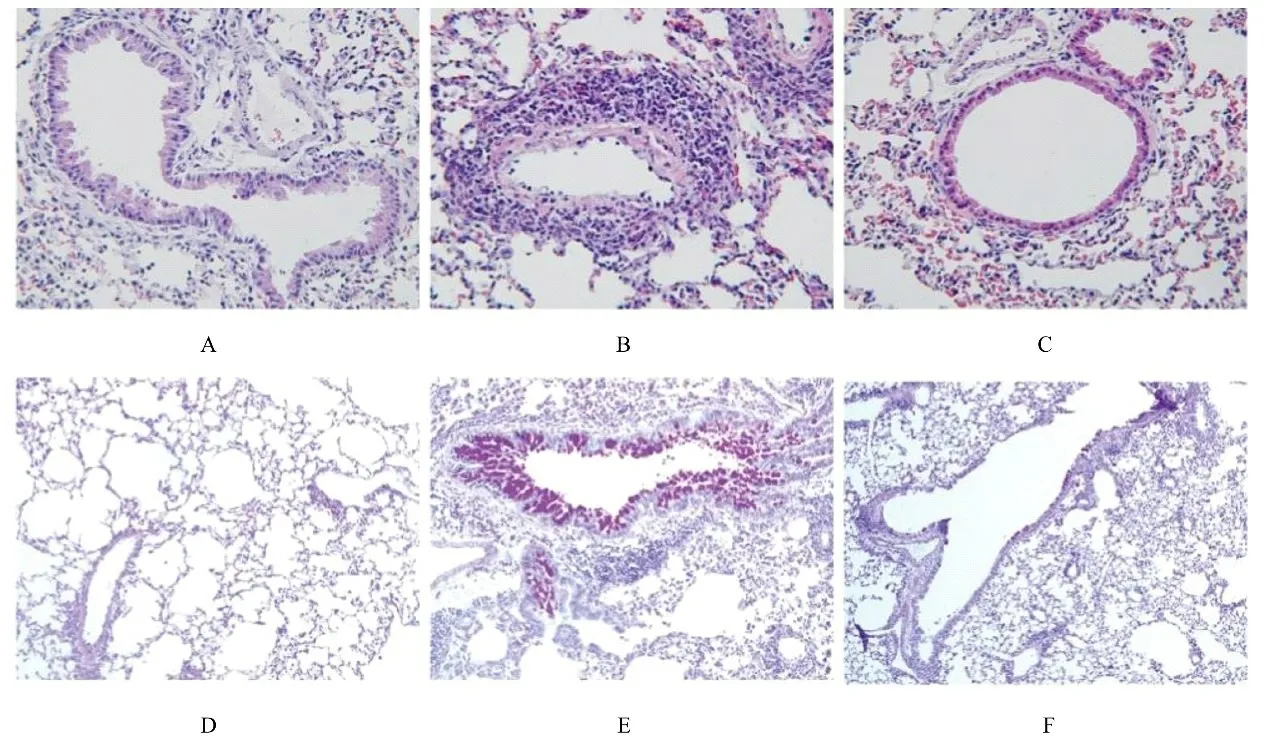
图1 各组小鼠肺组织病理形态表现(×200)Fig.1 Pathomorphology of lung tissue of mice in various groups(×200)
2.2 各组RAW264.7 细胞中M1 表面标志物CD80、CD86 和iNOS 表达水平与对照组比较,CSE 组RAW264.7 细 胞 中CD80、CD86 和iNOS 表达水平明显升高(P<0.05或P<0.01);与CSE组比较,CSE+XBD173 组RAW264.7 细 胞 中CD80、CD86 和iNOS 表 达 水 平 明 显 降 低(P<0.05)。见图2。
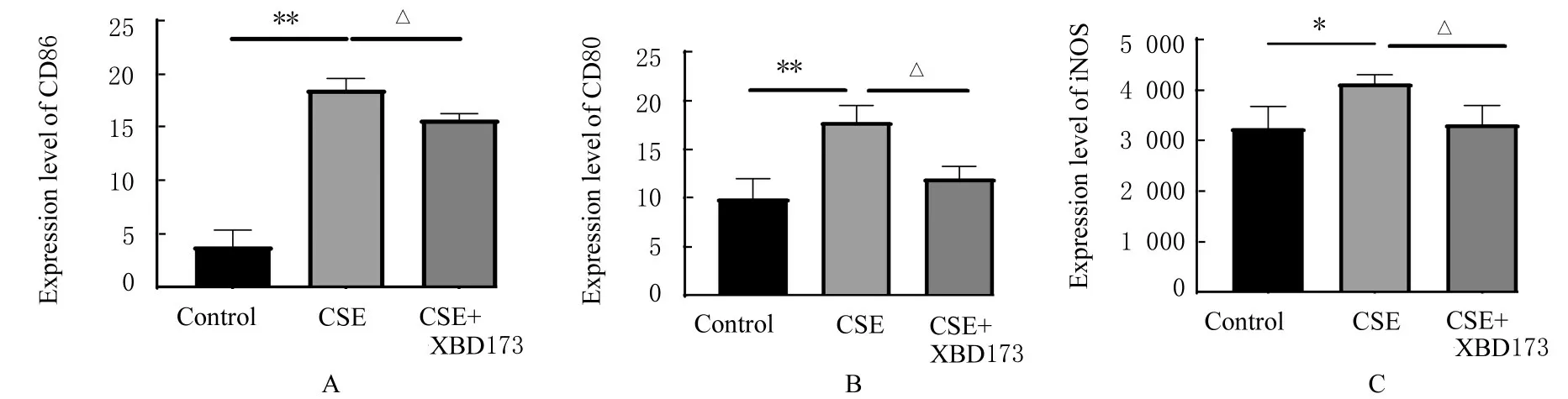
图2 流式细胞术检测各组细胞中CD80、CD86 和iNOS 表达水平Fig.2 Expression levels of CD80, CD86,and iNOS in cells in various groups detected by flow cytometry
2.3 各组RAW264.7 细胞中ROS 表达水平与对照组(19 290±2 906)比较,CSE 组RAW264.7细胞中ROS 表达水平(26 789±3 980)明显升高(P<0.05);与CSE 组 比 较,CSE+XBD173 组RAW264.7 细胞中ROS 水平(20 120±4 114)明显降低(P<0.05)。
2.4 各组RAW264.7 细胞凋亡率与对照组(8.80%±0.42%)比较,CSE 组RAW264.7 细胞凋亡率(28.96%±1.73%)明显升高(P<0.05);与CSE 组 比 较,CSE+XBD173 组RAW2647 细 胞凋亡率(22.94%±2.2%)明显降低(P<0.05)。见图3。

图3 流式细胞术检测各组细胞凋亡率Fig.3 Apoptotic rates of cells in various groups detected by flow cytometry
2.5 各组RAW264.7 细胞中IL-6 和TNF-α mRNA表达水平与对照组比较,CSE 组RAW264.7 细胞 中IL-6 和TNF-α mRNA 表 达 水 平 明 显 升 高(P<0.05);与CSE 组 比 较,CSE+XBD173 组RAW264.7 细 胞 中IL-6 和TNF-α mRNA 表 达 水 平明显降低(P<0.05)。当RAW264.7 细胞TSPO蛋白敲低后,在TSPO KD+control 组、TSPO KD+CSE 组 和 TSPO KD+CSE+XBD173 组RAW264.7 细 胞 中IL-6 和TNF-α mRNA 表 达 水 平差异无统计学意义(P>0.05)。见表2。
表2 RT-qPCR 法检测各组细胞中IL-6 和TNF-α mRNA 表达水平Tab.2 Expression levels of IL-6 and TNF-α mRNA in cells in various groups detected by RT-qPCR method (n=3,±s)

表2 RT-qPCR 法检测各组细胞中IL-6 和TNF-α mRNA 表达水平Tab.2 Expression levels of IL-6 and TNF-α mRNA in cells in various groups detected by RT-qPCR method (n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with CSE group.
TNF-α 1.09±0.13 1.61±0.22*0.65±0.14△1.00±0.10 0.91±0.06 0.75±0.13 Group Control CSE CSE+XBD173 TSPO KD+control TSPO KD+CSE TSPO KD+CSE+XBD173 IL-6 0.95±0.07 2.75±0.98*0.87±0.30△0.32±0.18 0.14±0.07 0.14±0.11
2.6 各组 RAW264.7 细胞中 NF-κB/p65 和p-NF-κB/p65 蛋白 表达水平3 组RAW264.7 细 胞中NF-κB/p65 蛋白表达水平比较差异无统计学意义 (P>0.05);与 对 照 组 比 较,CSE 组RAW264.7 细胞中p-NF-κB/p65 蛋白表达水平明显升高(P<0.05);与CES组比较,CSE+XBD173组RAW264.7 细胞中p-NF-κB/p65 表达水平明显降低(P<0.05)。见图4。
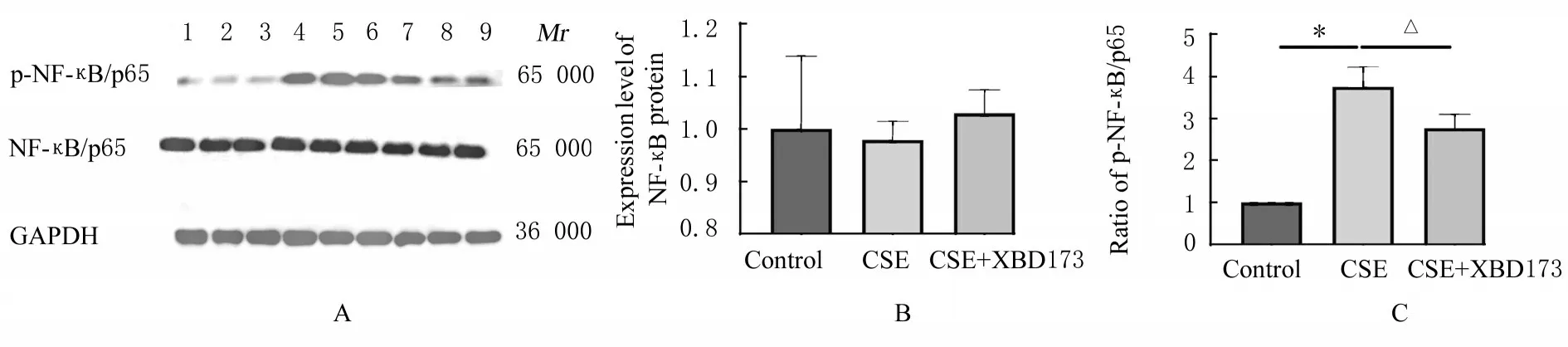
图4 Western blotting 法检测各组细胞中NF-κB/p65 和p-NF-κB/p65 蛋白表达电泳图(A)及直条图(B 和C)Fig.4 Electrophoregram (A) and histograms (B,C) of expressions of NF-κB/p65 and p-NF-κB/p65 proteins in cells in various groups detected by Western blotting method
3 讨 论
香烟是一种具有多重毒性的成瘾物,与全身多个器官的损害有关[6]。香烟烟雾对心血管具有严重的损伤作用,可表现为内皮功能障碍氧化应激增加、心血管发病率和死亡率增加等[7]。TSPO 首先由BRAESTRUP 于1977 年发现,被认为与外周的苯二氮卓类结合位点有高亲和性[8]。正常情况下,TSPO 在中枢神经系统中表达较低,仅限于星形胶质细胞和小胶质细胞,但当脑损伤或炎症时,其表达水平明显升高[9-10]。在急性肺炎模型中,TSPO可作为衡量炎症损伤的指标[11-12]。研究[13-14]表明:TSPO 配体XBD173 可有效缓解视网膜缺血模型中的神经退行性变,还可减轻视网膜色素上皮细胞的炎症反应。本研究结果显示:XBD173 可有效抑制CSE 诱导的肺部炎症反应。
巨噬细胞是重要的免疫细胞,其主要的功能包括:①吞噬病原体、感染细胞、碎片和死亡细胞;②呈递抗原;③分泌各种细胞因子[15]。当巨噬细胞受到刺激时,会极化为M1 型巨噬细胞和M2 型巨噬细胞,M1 型巨噬细胞作为一种促炎症细胞存在,主要参与体内的1 型辅助T 细胞(T helper 1 cell,TH1)介 导 的 免 疫 反 应,可 分 泌TNF-α、IL-1β、IL-12 和IL-6 等 炎 症 因 子[15-16],M1 型 巨 噬细胞参与多种疾病的病理过程。在小鼠蛛网膜下腔出血模型中,TSPO 配体处理可降低小胶质细胞活化 和 增加抗炎因子的产生[17],TSPO 配体2-(2-氯苯基)喹唑啉-4-基二甲基氨基甲酸酯(2-Cl-MGV-1)和2-苯基喹唑啉-4-基二甲基氨基甲酸酯(MGV-1)可降低脂多糖(lipopolysaccharide,LPS)诱导的小 胶 质 细 胞 炎 症 因 子TNF-α、IL-6 和IL-1β 表达[18]。本研究结果显示:CSE 刺激使RAW264.7细胞增加M1 极化水平和细胞因子分泌,XBD173处理可抑制巨噬细胞M1 极化和细胞因子分泌,与小鼠肺组织的病理结果一致;而在TSPO 敲低组中,各组之间无明显变化,提示TSPO 对巨噬细胞功能起重要的调控作用。
ROS 既是一种重要的抗菌介质,也是重要的信号分子[19],在细胞增殖、缺氧适应和细胞信号传递决定中起重要作用,但过量的ROS 会导致不可逆的细胞损伤甚至细胞死亡,许多疾病的发生和发展与ROS 生产过剩有密切关联[20]。在视网膜损伤模型中,XBD173 可降低巨噬细胞的吞噬能力,减少ROS 产生从而发挥保护作用[21]。本研究结果显示:XBD173 可抑制CSE 诱导的ROS 产生。细胞产生过量ROS 会导致细胞凋亡。本研究结果同时显示:XBD173 可抑制CSE 诱导的细胞凋亡水平。凋亡的巨噬细胞通过释放代谢产物和炎症因子,激活MAPK 信号通路,导致巨噬细胞M1 极化增加和炎性因子释放[22]。年龄相关黄斑变性模型的 研 究[13]结 果 显 示:XBD173 可 通 过NADPH 氧化酶2 (NADPH oxidase 2,NOX2)通路或钙离子减少ROS 的产生,降低小胶质细胞激活。研究[23]显 示:TSPO 可 与NOX2 亚 基gp91phox 和p22phox 结合,其机制可能与NOX2 通路相关。
NF-κB 于1986 年作为结合B 细胞的κ 轻链增强子 的 转 录 因 子 被 发 现[24]。NF-κB 家 族 是 真 核 转 录因子结构相关的蛋白家族,包括5 个成员:NF-κB1(p50 及其前体p105)、NF-κB2(p52 以及其前体p100)、RelA (p65)、c-Rel 和RelB,5 个成员在正常状态下通常在细胞质中与NF-κB 抑制因子(inhibitory of NF-κB,IκB)家族结合保持未激活状态,在其经典激活途径中,当受到相应信号分子刺激时,IκB 首先被磷酸化,继而降解,从而促使NF-κB 异二聚体(RelA-p50 二聚体)从细胞质中转移至细胞核,调控巨噬细胞向M1 型极化,进 而 促 进IL-1β、TNF-α 和IL-6 等 促 炎 因 子 的 释放[25-26]。研究[27]显示:NF-κB 通 路参与小胶质细胞炎症的激活。本研究结果显示:CSE 处理组细胞中p-NF-κB/p65 蛋白表达水平升高,而XBD173可降低其表达水平,提示XBD173 可能通过调节NF-κB 通路而发挥抗炎作用。
综上所述,TSPO 配体XBD173 可减轻CSE 诱导的小鼠肺部炎症反应,TSPO 可调控巨噬细胞M1 极化和炎症因子的产生,其机制可能与NF-κB通路有关,但其具体机制仍需进一步研究。本研究为XBD173 对香烟烟雾诱导的肺部炎症反应的保护作用提供了理论和实验依据,未来应进一步结合动物实验和临床试验探索XBD173 的炎症抑制作用机制,为香烟烟雾引起的肺部炎症的改善提供新思路。
