NAC对血糖波动诱导的内皮损伤的保护机制
2023-05-05张微彭观景黄春李青黄云飞李洁周波刘雅雯李艳
张微 ,彭观景,黄春,李青 ,黄云飞,李洁,周波 ,刘雅雯,李艳
1.湛江中心人民医院内分泌科,广东湛江 524000;2.湛江中心人民医院肝脏外科,广东湛江 524000;3.中国医科大学附属第一医院干诊科,辽宁沈阳 110000
在正常人体内,通过神经、内分泌等精细的调节,血糖会维持在一个相对稳定的范围内,避免过度的波动,因为体内的氧化应激和炎症反应会随着血糖的波动而逐渐增加,而且这种危害是远远大于持续性高血糖的[1]。众多的研究证实血糖波动会导致糖尿病患者大血管和微血管发生病变的风险以及死亡的危险显著升高,并且已经明确早期的病理生理改变基础就是内皮细胞功能障碍[2-3]。乙酰半胱氨酸具有很强的粘液溶解作用,它作为祛痰剂已经在临床广泛应用多年,无明显不良反应。近年来很多基础实验发现N-乙酰半胱氨酸(N-acetylcysteine,NAC)具有显著的抗氧化作用。2008年1月—2009年12月本研究选取雄性Wistar大鼠24只应用间断从静脉输注50%葡萄糖溶液的方式建立大鼠动物模型,同时加用抗氧化剂NAC干预,以便进一步探讨NAC是否可以减轻氧化应激和炎症反应。现报道如下。
1 材料与方法
1.1 材料
健康雄性清洁度Ⅰ级的Wistar大鼠24只购于中国医科大学实验动物中心,体质量280~330 g,随机分为A组(对照组)、B组(急性血糖波动组)、C组(NAC干预组1)、D组(NAC干预组2),每组6只,应用常规饲料及自由饮水[1]。
1.2 方法
1.2.1 主要试剂及仪器 ①NO、GSH-PX测定比色法检测试剂盒从南京建成生物工程研究所购买。
②Elisa法检测TNF-α、IL-6试剂盒购自晶美公司。
③应用免疫组化方法检测诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)试剂盒及细胞凋亡TUNEL法检测试剂盒从武汉博士德公司购买。
1.2.2 建立动物模型 所有大鼠先经过3~5 d的环境适应,然后麻醉后行颈部动静脉插管术,实验中应用动脉置管采血,静脉置管输液[4]。大鼠恢复3 d后开始输液。
①对照组(A组),应用0.9%生理盐水,保持血糖在5.5 mol/L左右;②急性血糖波动组(B组),通过50%葡萄糖注射液的间断输注,保持血糖5.5~20.0 mmol/L;③NAC干预组1(C组),持续输入NAC(0.35 mg/kg·min)及间断50%葡萄糖注射液输注,血糖保持在B组水平;④NAC干预组2(D组),持续输入 NAC(0.7 mg/kg·min)及间断50%葡萄糖注射液输注,血糖保持在B组水平。输液总共48 h。
1.2.3 标本采集 输液结束后,各组所有动物称重,应用10%水合氯醛(0.3 mL/100 g)通过腹腔注射麻醉动物,迅速分离主动脉,部分主动脉称重后与预冷的生理盐水以1:9的比例进行混合,应用高速组织匀浆机在冰水浴中制成10%混悬液,4℃ 3 500 rpm离心10 min,取上清液-20℃冰箱保存以备检测NO、GSH-PX、 TNF-α及IL-6。取部分组织制成蜡块,连续切4 μm厚切片以备检测iNOS的表达及凋亡。
1.3 观察指标
①血糖:采用葡萄糖氧化酶电极法。
②一氧化氮(nitric oxide,NO)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX):采用比色法。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白细胞介素-6(interleukin-6,IL-6)测定:采用Elisa(Enzyme linked immunosorbent assay)法。
③用免疫组化的方法测定主动脉内iNOS的表达。
④应用TUNEL(TdT-mediated dUTP Nick-End Labeling)法检测主动脉内皮细胞的凋亡。
1.4 统计方法
采用SPSS 25.0统计学软件处理数据,分析方法为单因素方差分析,符合正态分布的计量资料以(±s)表示,组间差异比较以t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 4组大鼠主动脉匀浆中GSH-PX、NO、TNF-α、IL-6的比较
B组大鼠主动脉匀浆中GSH-PX水平较A组明显降低,差异有统计学意义(P<0.05),NO、TNF-α、IL-6水平较A组明显增加,差异有统计学意义(P<0.05),C组与D组和B组比较,差异有统计学意义(P<0.05),C组与D组和A组比较,差异无统计学意义(P>0.05)。见表1。
表1 4组大鼠主动脉匀浆中GSH-PX、NO、TNF-α、IL-6水平比较(±s)

表1 4组大鼠主动脉匀浆中GSH-PX、NO、TNF-α、IL-6水平比较(±s)
注:* 与A组比较P<0.05,#与B组比较P<0.05
组别A(n=6)B(n=6)C(n=6)D(n=6)GSH-PX(nmol/mgprot)10.02±1.10(6.26±0.38)*(9.89±1.06)#(9.20±1.91)#NO(μmol/L)1.11±0.14(2.83±0.48)*(1.24±0.15)#(1.16±0.18)#TNF-α(pg/mL)17.66±1.09(35.13±2.16)*(17.13±1.01)#(16.98±0.97)#IL-6 (pg/mL)9.82±0.61(20.56±3.78)*(9.33±0.55)#(9.27±0.49)#
2.2 4组大鼠主动脉匀浆中iNOS的比较结果
B组大鼠主动脉中iNOS相对表达量(0.41±0.05)较A组(0.14±0.03)明显增加,差异有统计学意义(P<0.05),C组(0.15±0.01)与D组(0.16±0.03)和B组比较差异有统计学意义(P<0.05),C组与D组和A组比较,差异无统计学意义(P>0.05)。见图1、图2。
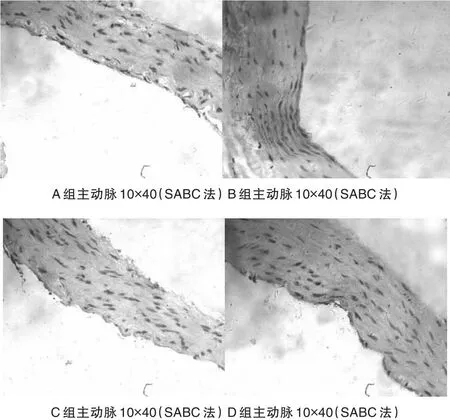
图1 免疫组化检测4组大鼠主动脉内iNOS表达
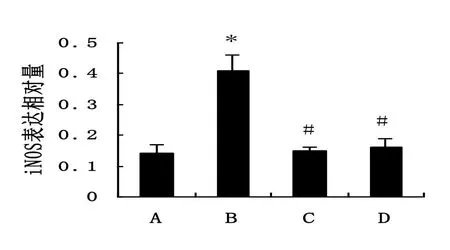
图2 4组大鼠主动脉匀浆中iNOS表达的比较
2.3 4组主动脉内皮细胞凋亡检测结果
B组在主动脉内皮细胞发现凋亡细胞,凋亡细胞的细胞核中有棕黄色颗粒,在其余3组中未见细胞凋亡。见图3。
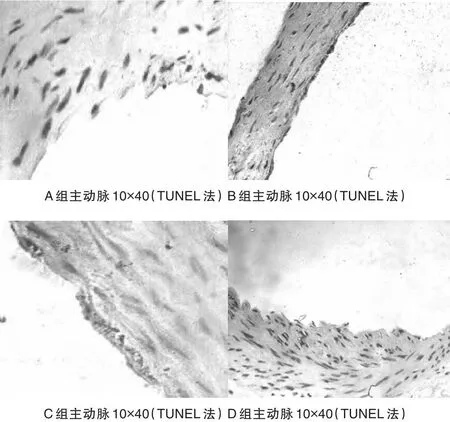
图3 TUNEL检测4组主动脉内皮细胞凋亡
3 讨论
虽然大众对糖尿病并不陌生,但是其实很多人并不是很了解该疾病的危害,即使是已经确诊糖尿病的患者,也是只关注于血糖的控制,殊不知,糖尿病更可怕的地方就是它的并发症,比如糖尿病肾病、糖尿病足、大血管病变和微血管病变等等,而在这些并发症中目前研究认为心血管并发症仍然是糖尿病患者主要的死亡原因[5-6]。从既往大量的研究中已经确认氧化应激和炎症是血管病变的重要原因和中心环节[7-8]。
目前人们已经了解清楚血管病变的发生就是从血管内皮损伤开始的,在以往的实验中把内皮细胞放到高糖环境中进行培养会发现细胞出现了凋亡,也就是内皮损伤[9-10]。而且,血糖的浓度波动和内皮细胞的凋亡都是息息相关的,血糖波动的危害大于持续的高血糖[1]。
人体内部是一个复杂的调节系统,在很多方面都需要保持一个平衡的状态,如果人体内的氧化物增多,抗氧化物减少,那么就会出现氧化应激从而导致组织的损伤[11]。血糖水平的升高可激活机体内多元醇信号通路,从而消耗了机体内大量的抗氧化物比如还原型谷胱甘肽,那么相对来说氧化物比如活性氧自由基就会积累增多,导致氧化与抗氧化之间失去平衡,这种不平衡进一步导致氧化应激,血糖水平升高还会使抗氧化酶糖基化GSH-PX活性降低。本研究发现在急性血糖波动组中GSH-PX的水平明显降低提示存在氧化与抗氧化之间平衡失调,应用抗氧化剂NAC后这种情况得到了改善,这种平衡的恢复也进一步证实了氧化应激的存在。
在人体的酶系统中NOS系统是比较重要的,在这个系统中iNOS可以催化精氨酸脱氨基产生NO,NO的众多作用当中有一项很重要就是调节血管舒张,这种作用对维持心血管功能的稳态也非常重要,它在体内还会参与很多生理、病理的过程[12-13]。有研究对糖尿病小鼠和非糖尿病小鼠进行比较会发现糖尿病小鼠的iNOS活性明显增加,本研究的发现也一样,血糖波动使iNOS活性增强,NO水平也出现升高。
在众多的炎症因子中,TNF-α和IL-6是非常经典也是非常重要的,如果检测2型糖尿病患者的血清就会发现TNF-α和IL-6的水平是升高的,TNF-α和IL-6的作用非常广泛,它可以促进机体内的炎症反应,调节自身免疫,还可以增加自由基,促进活性氧簇的增多,这种变化又和氧化应激联系起来,最终导致机体内的线粒体功能紊乱[14]。TNF-α和IL-6还可以通过调节白细胞与血管内皮细胞的粘附作用这两种方式影响内皮功能。正如实验结果所示应用Ellisa法在急性血糖波动组检测IL-6水平为(20.56±3.78)pg/mL,为本实验4组中水平最高的,和其他3组比较差异有统计学意义(P<0.05),对照组的水平只有(9.82±0.61)pg/mL,这和宋华静等[15]的研究结果一致,宋华静等研究血糖浓度波动对IL-6的影响时发现葡萄糖浓度波动组IL-6浓度的结果为(204.99±25.08)ρ/(ng·L),和对照组(122.41±18.19)ρ/(ng·L)比较差异有统计学意义(P<0.05)。同样本实验中TNF-α水平也明显增加,可以认为血糖波动诱导了内皮细胞的炎症反应,应用抗氧化剂NAC后这种情况可以得到改善。
综上所述,本研究成功建立了在体血糖波动的动物模型,并进一步研究证实血糖波动能增加主动脉内皮内的炎症和氧化应激,应用NAC后可以显著改善炎症和氧化应激。从本研究中也看到了血糖波动尤其是急性血糖波动的危害,本研究也为改善血糖波动的危害提供了新的治疗思路。
