听阈正常耳鸣患者听性脑干反应研究*
2023-05-04张剑宁
李 刚,李 明,张剑宁△
(1. 云南中医药大学,云南 昆明 650500;2. 上海中医药大学附属岳阳中西医结合医院,上海 200437)
听阈正常主观特发性耳鸣(subjective idiopathic tinnitus,SIT)是指通过对耳鸣患者进行耳和全身的体格检查、听力学检查、影像学检查以及实验室检查等均未发现明显异常,或异常检查结果与耳鸣之间缺少明确因果关系的一类原因不明的且不伴有听力障碍的主观性耳鸣,常伴或不伴有不同程度认知功能障碍[1]。有30%的耳鸣患者听阈显示在正常范围内[2],其病因尚不清楚,外周或中枢神经系统都可能参与发病。近年来,伴有耳蜗突触病变的“隐匿性听力损失”被认为是该类型耳鸣潜在的病理生理机制。声创伤后恢复听阈的小鼠高频区域的内毛细胞(inner hair cells,IHC)和耳蜗神经纤维的外周终末之间的带状突触可能显著丢失而毛细胞完整[3]。同样,在小鼠耳蜗老化的过程中,耳蜗神经突触的丢失远远早于毛细胞,80 周时突触损失达到25%[4]。然而,动物实验证明,在安静环境下80%的突触缺失并不影响听阈[5]。因此,根据动物实验推测正常的听阈并不一定反映耳鸣患者耳蜗或听觉神经没有损伤。国内虽有研究[6-7]结果显示,与健康耳和健康者相比,此类耳鸣患者ABR I 波明显下降,提示耳蜗结构有损伤,但未区分性别,ABR 的振幅是由神经输出量决定的,且耳蜗响应时间越快,耳蜗输出的神经同步性就越大[8],女性耳蜗反应时间比男性短13%[9],故女性ABR 的振幅要大于男性;其次,ABR结果在每个性别中,不同受试者之间的振幅差异大于受试者内部的差异[10]。为进一步研究及保证研究结果的可靠性,本文选取了同一性别的听阈正常SIT 患者进行健康耳与耳鸣耳ABR 检测结果的对比,并与性别、年龄匹配的健康对照组进行比较,尝试阐述此类耳鸣的发病机制,期望有利于耳鸣的临床和基础研究。
1 资料与方法
1.1 资料 回顾性分析2018 年7 月-2020 年6 月期间就诊于上海中医药大学附属岳阳中西医结合医院耳鼻咽喉科的耳鸣专科门诊的以耳鸣为第一主诉,符合纳入标准的耳鸣患者20 例为研究对象;年龄20~45 岁,平均(31.85±7.4)岁;右耳鸣9 例(45%),左耳11 例(55%);耳鸣病程6 个月~20 年。
选取本科室男性实习学生作为健康对照组15例;年龄21~40 岁,平均(27.40±4.97)岁。
纳入标准:①男性单侧持续性耳鸣;②病程>6 个月;③125~8 000 Hz 各频率纯音测听气骨导听阈≤25 dB HL;④500~8 000 Hz 耳声发射(DPOAE)检查正常和声导抗鼓室图曲线为A 型;⑤ABR 测试80 dB nHL 刺激声能够清晰引出I、III、V 波且左右 耳ABR 引出反应阈≤35 dB nHL。排除标准:①耳源性耳鸣,即外耳及中耳病变引起的耳鸣;②客观性耳鸣;③全身重要器官系统的急慢性疾病所致的耳鸣。剔除标准:病历资料不完整者。
1.2 检查方法 所有患者和正常人均行病史采集、体格检查及耳鼻咽喉科检查,纯音听阈检测、声导抗、耳鸣检查、DPOAE 和听性脑干反应(ABR)检测。
1.2.1 纯音听阈及声导抗检测 进行常规倍频程气导与骨导纯音听阈测试,常规测试频率为0.125 kHz、0.25 kHz、0.5 kHz、1 kHz、2 kHz、4 kHz、8 kHz。测试设备为经校准的临床听力计(Astera 1066,丹麦尔听美/GN OTOMETRICS A/S)和声阻抗听力计(AT235h,丹麦国际听力/Interacoustics)。
1.2.2 DPOAE 检测 DPOAE:频比值f1/f2、f1/f=1.22,纯音强度为:L1=65 dB SPL、L2=55 dB SPL,各频率点叠加16 次,记录时间为90 s,记录f0(2f1-f2)在0.5 kHz、1 kHz、2 kHz、4 kHz、6 kHz、8 kHz 的幅值及信噪比(SNR),由电脑绘出DPOAE 图。DPOAE 的引出标准以本底噪声≥3 dB SPL 为通过测试标准。听觉诱发电位仪(Eclipse,丹麦国际听力/Interacoustics)。
1.2.3 ABR 测试 记录电极置于前额正中发际,接地电极置于前额下方眉间,参考电极置于双耳乳突,极间电阻小于5 kΩ。刺激声采用短声(click),给声刺激重复率为21.1 次/s,叠加1 400 次。本研究只选取刺激为80 dB nHL 时I、III、V 波的潜伏期和振幅。听觉诱发电位仪(EcliPse,丹麦国际听力/Interacoustics)。测试环境:所有测试均在声电屏蔽室[本底噪声小于25 dB(A)]。
1.3 统计学分析 检查结果表示为平均值±标准差。采用SPSS 26.0 统计软件进行数据处理和统计分析。计量资料服从正态分布用t 检验,不服从则用非参数检验;计数资料用χ2检验,检验水准α=0.05。
2 结果
2.1 纯音测听听阈和DPOAE 阈值 健康对照组、耳鸣耳和非耳鸣耳纯音测听在0.125 kHz、0.25 kHz、0.5 kHz、1 kHz、2 kHz、4 kHz、8 kHz 各频率阈值均≤25 dB HL,各组相对应频率之间听阈差异不明显,无统计学意义(P>0.05),见表1;健康对照组、听阈正常耳鸣耳和非耳鸣耳在0.5 kHz、1 kHz、2 kHz、4 kHz、6 kHz、8 kHz 的DPOAE 的幅值(信噪比)均≥3 dB,各组相对应频率之间差异不明显,无统计学意义(P>0.05),见表2。
表1 各频率听力阈值(±s,dB HL)
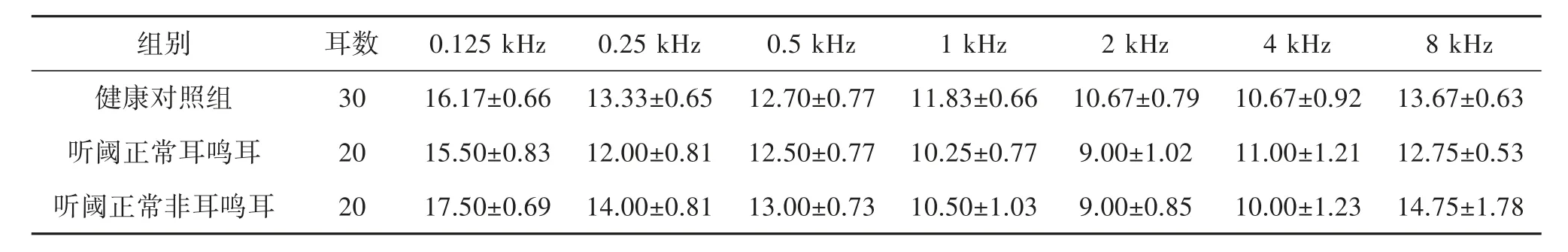
表1 各频率听力阈值(±s,dB HL)
组别 耳数 0.125 kHz 0.25 kHz 0.5 kHz 1 kHz 2 kHz 4 kHz 8 kHz健康对照组 30 16.17±0.66 13.33±0.65 12.70±0.77 11.83±0.66 10.67±0.79 10.67±0.92 13.67±0.63听阈正常耳鸣耳 20 15.50±0.83 12.00±0.81 12.50±0.77 10.25±0.77 9.00±1.02 11.00±1.21 12.75±0.53听阈正常非耳鸣耳 20 17.50±0.69 14.00±0.81 13.00±0.73 10.50±1.03 9.00±0.85 10.00±1.23 14.75±1.78
表2 各频率DPOAE 阈值(±s,dB)
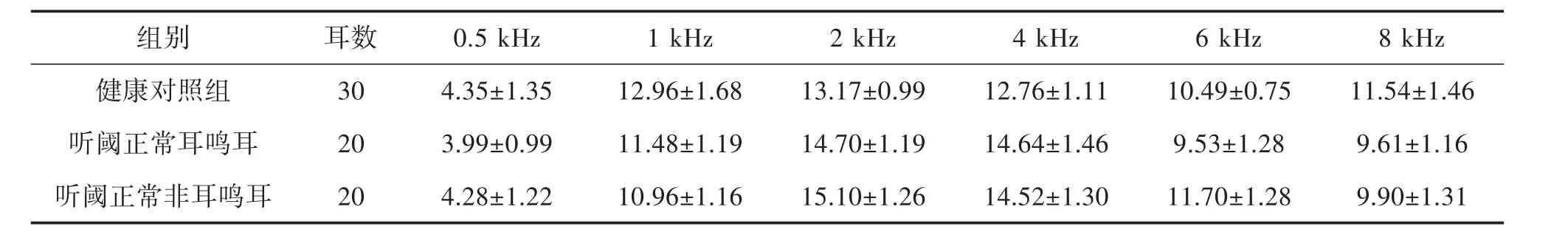
表2 各频率DPOAE 阈值(±s,dB)
组别 耳数 0.5 kHz 1 kHz 2 kHz 4 kHz 6 kHz 8 kHz健康对照组 30 4.35±1.35 12.96±1.68 13.17±0.99 12.76±1.11 10.49±0.75 11.54±1.46听阈正常耳鸣耳 20 3.99±0.99 11.48±1.19 14.70±1.19 14.64±1.46 9.53±1.28 9.61±1.16听阈正常非耳鸣耳 20 4.28±1.22 10.96±1.16 15.10±1.26 14.52±1.30 11.70±1.28 9.90±1.31
2.2 ABR 各波振幅及III/I 和V/I 波振幅比 与健康对照组相比,听阈正常耳鸣耳和非耳鸣耳ABR I 波振幅明显下降,统计有显著性差异(t=-2.621,P=0.012和t=-2.087,P=0.042);耳鸣耳与非耳鸣耳相比,ABR I 波振幅无明显差异;各组之间ABR III、V 波振幅均无明显差异;听阈正常耳鸣耳ABR III/I 波振幅比明显高于健康对照组和非耳鸣耳,差异具有统计学意义(t=3.512,P=0.001 和t=2.585,P=0.014);健康对照组与非耳鸣耳相比无明显差异;各组之间ABR V/I 波振幅比无明显差异。见表3。
表3 ABR 振幅(80 dB nHL 短声刺激)(±s,μV)
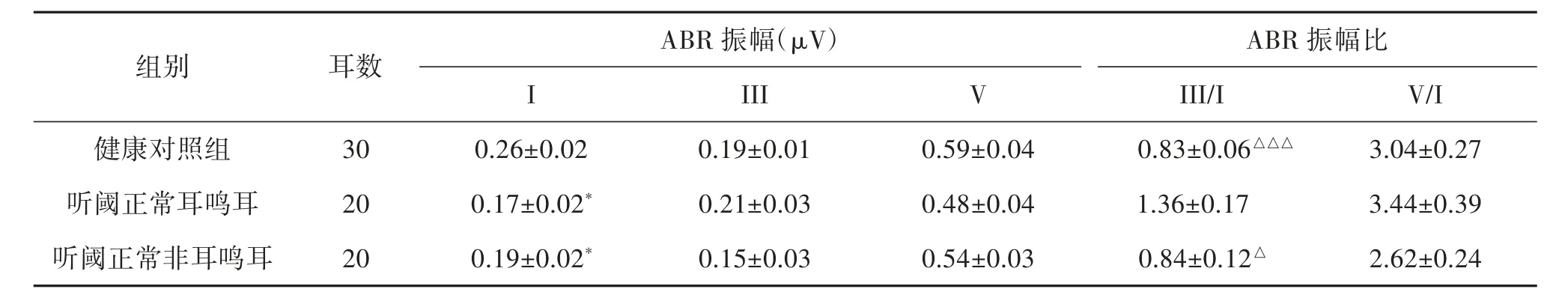
表3 ABR 振幅(80 dB nHL 短声刺激)(±s,μV)
注:听阈正常耳鸣耳和听阈正常非耳鸣耳与健康对照组比较,I 波振幅有显著差异,*P<0.05;听阈正常耳鸣耳与健康对照组和听阈正常非耳鸣耳比较,III/I 振幅比有显著差异,△P<0.05,△△△P<0.001。
ABR 振幅(μV) ABR 振幅比组别 耳数III V III/I V/I健康对照组 30 0.26±0.02 0.19±0.01 0.59±0.04 0.83±0.06△△△ 3.04±0.27 I听阈正常耳鸣耳 20 0.17±0.02* 0.21±0.03 0.48±0.04 1.36±0.17 3.44±0.39听阈正常非耳鸣耳 20 0.19±0.02* 0.15±0.03 0.54±0.03 0.84±0.12△ 2.62±0.24
2.3 ABR 各波潜伏期、波间期 对受试者ABR 各波潜伏期及波间期进行分析,发现与健康对照组和听阈正常非耳鸣耳相比,听阈正常耳鸣耳的I 波潜伏期都明显缩短,统计有显著性差异(t=-3.715,P=0.001 和t=-2.049,P=0.047);健康对照组与听阈正常非耳鸣耳I 波潜伏期比较无显著差异;III、V、I~III、III~V、I~V潜伏期无明显差异。见表4。
表4 ABR 潜伏期(80 dB nHL 短声刺激)(±s,ms)
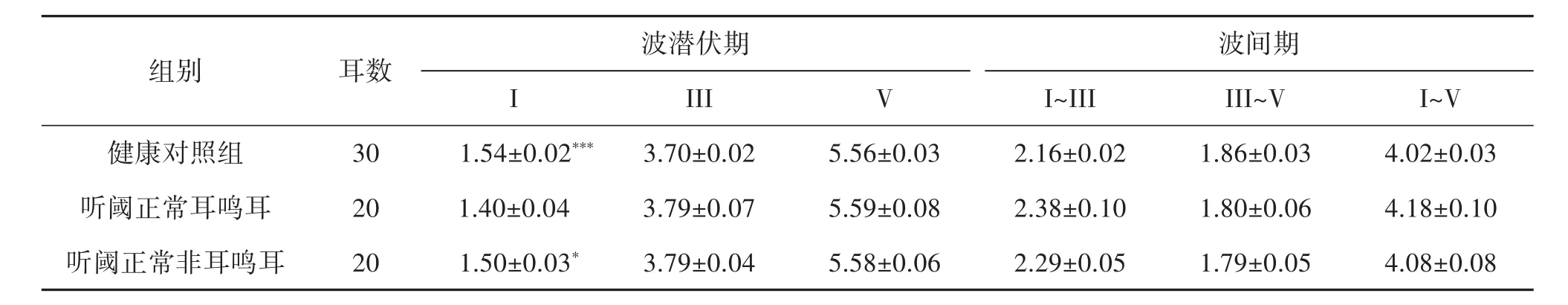
表4 ABR 潜伏期(80 dB nHL 短声刺激)(±s,ms)
注:听阈正常耳鸣耳与健康对照组和听阈正常非耳鸣耳比较,I 波潜伏期有显著差异,*P<0.05,***P≤0.001。
波间期I~III 2.16±0.02 2.38±0.10 2.29±0.05波潜伏期组别 耳数III III~V I~V健康对照组 30 1.54±0.02*** 3.70±0.02 1.86±0.03 4.02±0.03 I V 5.56±0.03听阈正常耳鸣耳 20 1.40±0.04 3.79±0.07 1.80±0.06 4.18±0.10 5.59±0.08听阈正常非耳鸣耳 20 1.50±0.03* 3.79±0.04 1.79±0.05 4.08±0.08 5.58±0.06
3 讨论
耳鸣的发生与多因素相关,各种机制可以在听阈正常的患者中诱导耳鸣。然而,中枢增益的加对突触或听觉神经的损失减少的输入信号的补偿仍然是耳鸣发展中的一种可能机制。本研究结果显示,正常听阈的耳鸣耳和非耳鸣耳与健康对照组相比,ABR I 波振幅明显降低,但ABR V 波振幅两者无明显差异。ABR I 波来源于听神经的兴奋性活动,不同反应阈值的耳蜗听神经纤维通过带状突触与内毛细胞相连,故听神经纤维和或突触病变均可引起ABR I 波形态的改变。新近研究表明,适度的噪声暴露和老龄化均可导致耳蜗听神经纤维和毛细胞之间的突触连接显著退化,而毛细胞本身不会发生改变[4,11],这种突触病变可以在噪声暴露后立即发生,且偏向于内毛细胞的蜗轴侧突触即低SR 神经纤维突触的分布区域[12],随后细胞体和中央轴突会缓慢退化。耳蜗低SR 神经纤维选择性丢失及突触病变后,听神经纤维虽在处理阈上声音方面增加了难度,由于高SR 神经纤维的完整性,病变并不会改变正常听阈[11-12],但耳蜗低SR 纤维的丢失减少了听觉神经中的信息含量,这种部分去传入导致听觉中枢兴奋-抑制作用的平衡被打破,从而减少侧向抑制、增加自发活动,或可能诱导中枢听觉通路或听觉皮层的同步放电引起耳鸣。事实上,这种机制似乎与ABR V 波电位的追赶增长相对应,作为对I 波电位振幅下降的响应[13]。因此,本研究推测此类耳鸣ABR I 波振幅下降可能与低SR 神经纤维及突触病变密切相关。
另外,本研究发现耳鸣耳与非耳鸣耳的I 波振幅无明显差异,这与国外研究结果一致[14],但两者均明显低于无耳鸣正常人,我们认为可能与外侧橄榄耳蜗系统(lateral olivocochlear system,LOC)相关。研究[15]表明LOC 可平衡两耳之间的耳蜗神经输出,当外周听觉信息传入减少时,LOC 调节传出突触的乙酰胆碱和多巴胺的释放,从而反馈性地使同侧耳鸣耳的听神经传入神经纤维的自发性放电率升高,对侧非耳鸣耳传入神经纤维放电率相对减少,以维持神经元回路的稳定,故可能出现耳鸣耳与非耳鸣耳的I 波振幅无差异,但显著低于无耳鸣正常人的结果。国内有研究结果表明耳鸣耳的I 波振幅明显低于非耳鸣耳[7],有异于本研究结果,原因可能与耳鸣患者纳入标准和样本量的不同有关,其有待进一步研究。
本研究结果示与正常人和非耳鸣耳相比,耳鸣患者和耳鸣耳III 波振幅相对于I 波(III/I 振幅比)明显增强,其原因可能与耳蜗腹侧核(ventral cochlear nucleus,VCN)的调节密切相关。研究表明,ABR III波是由VCN 的球形丛细胞(spherical bushy cell,SBC)产生的,而V 波是由接受来自SBCs 的直接投射的神经元产生的,例如内侧上橄榄(MSO)的主要神经元投射到下丘[16-17](MSO 的投射完全来自耳蜗前腹侧核吻侧和背侧的SBCs),这些SBCs 主要接受耳蜗低SR 神经纤维的输入[18]。动物实验也表明,耳蜗腹侧核SCC(small cell cap)区域广泛分布着低SR 听神经纤维分支[19]。III/I 振幅比能有效地量化降低的听神经活动在SBC 通路的后续群体的活动中反映的程度。最近的动物神经生理学数据也支持了声创伤后VCN 中SBC 兴奋性增加的存在[20]。另有研究显示,诱发耳鸣的药物水杨酸盐能使VCN 中表达一氧化氮合酶的神经元数量增加,表明VCN 特有的兴奋过程上调[21]。因此,本研究推测耳鸣患者III/I 振幅比增加是由于SBCs 活动增加和接受SBC 输入的神经元的活性升高,从而使得耳蜗低SR 神经纤维输出的缺失在SBC途径中得到了补偿,而且这种由于输出信号的减少使得脑干中的中枢增益增加被认为是听阈正常患者耳鸣的潜在发病机制[22]。
本研究发现耳鸣患者和耳鸣耳I 波潜伏期均明显缩短,可能与内毛细胞传入神经突触区谷氨酸的过度释放使得听神经自发性放电率的升高,从而加快神经传导速度有关。目前认为噪声、老年性聋和外周性耳鸣等均与谷氨酸的异常释放有关[23],谷氨酸过度释放对神经系统的兴奋毒性仅限于IHC 区域[24],因为耳蜗螺旋神经纤维II 型末端不表达与I 型末端相同的AMPA 型谷氨酸受体;而且谷氨酸过度释放诱导细胞基底侧传入突触区球囊毛细胞的大量钙离子(Ca2+)内流[25],引起一系列化学反应,如线粒体功能异常,而线粒体又是Ca2+缓冲能力的关键来源[26],所以含线粒体较少的低SR 纤维比含线粒体多的高SR 纤维更易优先损伤,耳蜗低SR 神经纤维或其突触病变后,外毛细胞可通过其主动机制,对内毛细胞产生驱动效应,提高内毛细胞的灵敏度,传入神经纤维放电率增加而导致初级听觉神经元去同步,进而引起初级听觉神经元对声音的敏感度降低,提高神经传导速度[27]。
综上所述:(1)听阈正常主观特发性耳鸣患者ABR 的异常可能与耳蜗低SR 神经纤维或其突触病变相关。动物实验研究表明不管是噪声、老龄化还是药物,首先影响耳蜗低SR 纤维及突触,但与之相对应的螺旋神经元需要几个月到几年的时间才会缓慢死亡;对人类颞骨的观察表明,在正常衰老的人类中,IHC 突触的丢失明显大于螺旋神经节细胞的丢失[28],这些数据表明,耳蜗低SR 纤维及突触病变可能是导致人类年龄相关性听力损失功能损害和耳鸣的主要原因。(2)耳蜗腹侧核和外侧橄榄耳蜗系统在正常听阈特发性耳鸣ABR 的异常中可能起重要调节作用。传统医学研究[29]证明电针耳穴可以刺激橄榄耳蜗纤维使耳蜗核中超氧化物歧化酶活性升高,增强听觉中枢抗自由基氧化的能力,从而改善听力;可以提高神经营养因子BDNF 和GAP-43 的表达,GAP-43 是一种神经特异性的轴突膜蛋白,在神经元发育和再生过程中参与神经元的外生长及突触形成和神经细胞的再生[30]。但还需动物实验的证实及大样本的临床观察,以期望其有利于耳鸣治疗和老年性聋的预防。
