茵陈蒿的化学成分及其药理活性研究*
2023-05-04何静怡舒腾云苏丽花
何静怡,舒腾云,苏丽花,许 敏
(昆明理工大学生命科学与技术学院,云南 昆明 650500)
茵陈是中国传统中药中用于治疗肝病的要药,来源于菊科植物滨蒿Artemisia scoparia Waldst. et Kit.或茵陈蒿Artemisia capillaris Thunb. 的干燥地上部分。春季幼苗高6~10 cm 时采收或秋季花蕾长成至花初开时采割,除去杂质和老茎,晒干。春季采收的习称“绵茵陈”,秋季采割的称“花茵陈”[1]。茵陈味苦、辛,微寒。归脾、胃、肝、胆经。关于茵陈药理活性的记载最早见于《神农本草经》中,谓其能除“热结黄疸,久服轻身益气耐老”。茵陈作为民间用于治疗肝病单验方中使用频次最多的中药,中医认为其气芳香,有清湿热、退黄疸的功效,临床上主要用来治疗黄疸尿少、湿疮瘙痒、黄疸型传染性肝炎和肝内胆汁淤积等症状[2-3]。
茵陈蒿作为抗肝病中药茵陈的主要植物来源之一,除传统的保肝利胆作用外,还具有抗炎抗病毒等多种功效,其药理作用多样,机制复杂[4]。现代药理学研究表明,茵陈蒿的药理作用主要包括保肝[5-6],利胆[7],调脂降压[8],降血糖,抗动脉粥样硬化[9],抗肿瘤[10-11],抗氧化等。为阐明其活性成分,自20 世纪70年代以来,国内外学者对其化学成分进行了大量研究,从中分离鉴定了香豆素[12]、黄酮[13]、烯炔类[14]、有机酸类化合物[15-16]等120 余个化合物,但是迄今为止依然无法解释茵陈蒿作为治疗肝病之要药的科学依据,且现有文献针对其萜类化合物的研究较少,缺乏对茵陈蒿中单体化合物抑制肝癌细胞活性的系统性研究。因此,为了进一步研究茵陈蒿中化学成分及其药理活性,探究中药材茵陈蒿作为治疗肝病之要药的科学依据,该文应用传统的植物化学研究方法,对茵陈蒿的95%乙醇提取物中,萜类化合物含量最多的流份进行了化学成分研究,经分离纯化共得到10 个单体化合物(图1),分别鉴定为(R,Z)-deca-8-en-4,6-diyne-1,3-diol(1);methyl(S)-8-(5-oxo-2,5-dihydrofuran-2-yl)octanoate(2);gymnasterkoreayne A(3);(S)-deca-4,6,8-triyne-1,3-diol(4);dehydrovomifoliol(5);loliolide(6);(3S,5R,6S,7E)3,5,6-trihydroxy-7-megastigmen-9-one(7);(6R,9R)-3-oxo-α-ionol(8);trans-4-hydroxylinalool 3,6-oxide(9);methyl(S)-9-hydroxy-10-undecenoate(10),其中化合物1和2 为新化合物。此外,采用MTT 法测定分离得到的化合物对肝癌细胞的抑制作用,且基于前期文献调研工作,发现茵陈蒿中炔类化合物具有一定抗HBV 活性[14],本研究论文采用MTT 法和ELISA 法进一步针对茵陈蒿中分离得到的炔类化合物进行抗HBV 活性测试。
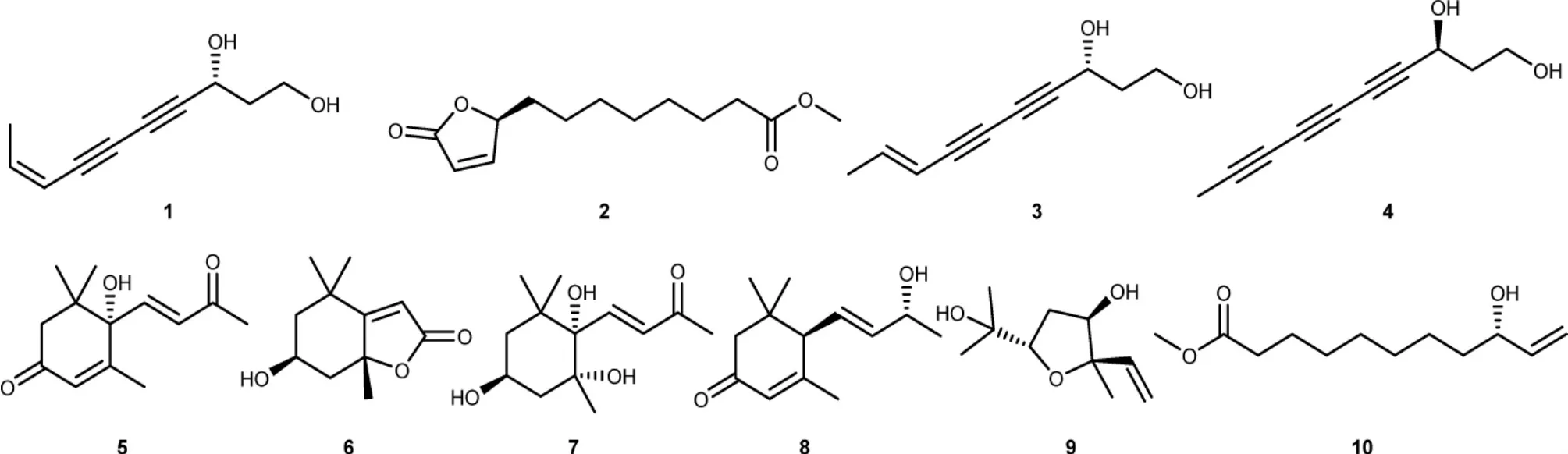
图1 茵陈蒿中分离得到的化合物(1-10)
1 实验仪器与材料
1.1 仪器 用Jasco P-1020 数字旋光仪测量旋光度;用KBr 微球在Thermo NICOLET iS10 上测定了红外光谱;高分辨质谱用Agilent 6500 系列Q-TOF液质联用仪检测;核磁共振光谱用Bruker DRX-600核磁共振波谱仪(Bruker Bio-Spin group,Germany)进行测量,使用TMS 作为内标;分析型液相色谱仪Waters 2695/2996(Waters 公司,美国);制备型液相色谱仪Waters 1525/2998(Waters 公司,美国);多功能酶标仪(Infinite M200Po,瑞士ECAN 公司)。
正相柱层析采用的材料有200~300 和500~800目的硅胶(青岛海洋化工厂);反向柱层析采用的材料有MCI-gel-CHP-20P(75~150 μm,三菱化学工业有限公司);ODS-A(40~63 μm,日本);薄层色谱采用硅胶板(青岛海洋化工有限公司),显色剂为10%H2SO4-EtOH 溶液;半制备柱采用ACE C18-PFP 和Waters sunfire-C18 色谱柱(5 μm,250 mm × 10 mm)。
1.2 材料 茵陈蒿于2020 年10 月采自中国山西省运城县,经贵州中医药大学吴之坤博士鉴定,确定为茵陈蒿(Artemisia capillaris Thunb.)药材,植物标本已存放在昆明理工大学生命科学与技术学院,标本编号为KMUST-BS-0116。
2 方法与结果
2.1 提取与分离 茵陈蒿全草100 kg,粉碎后用95%的乙醇室温提取3 次,提取时间分别为3 h、2 h、1 h。将该提取物(20 kg)经减压浓缩后悬浮于水中,用乙酸乙酯萃取3 次,经浓缩,得到乙酸乙酯萃取物5 kg。采用D101 大孔树脂柱层析进行分离,分别用水、30%、50%、70%、90%、100%甲醇洗脱,得到7 个流份Fr.A~Fr.G。为进一步促进茵陈蒿中萜类化合物的研究进展,本文结合薄层色谱TLC 显色结果和LC-MS 数据,选取萜类化合物较多的流份Fr.E 作进一步分离纯化研究工作。
Fr.E(113 g)经硅胶柱色谱进行分离,用二氯甲烷和甲醇系统梯度洗脱(100 ∶0-0 ∶1),得到13 个流份Fr.E1-Fr.E13。Fr.E5(1.34 g)经ODS 柱层析进行分离,用甲醇-水系统梯度洗脱(30%~70%),得到11 个流份Fr.E5-1~Fr.E5-11。Fr.E5-4(500 mg)经半制备HPLC(乙腈-水25%)分离得到化合物5(2.5 mg,tR=17 min),6(5 mg,tR=20 min),7(5 mg,tR=25 min)。Fr.E5-5(76 mg)经半制备HPLC(乙腈-水30%)分离得到化合物4(2.8 mg,tR=10 min),9(3 mg,tR=16 min)。Fr.E6(2.6 g)经硅胶柱层析进行分离,用石油醚和乙酸乙酯系统梯度洗脱(30 ∶1-0 ∶1),得到23 个流份Fr.E6-1~Fr.E6-23。Fr.E6-12(100 mg) 经半制备HPLC(乙腈-水45%)分离得到化合物2(4 mg,tR=17 min)。Fr.E6-17(189 mg)经半制备HPLC(乙腈-水18%)分离得到化合物1(3 mg,tR=27 min),3(2 mg,tR=29 min),8(7 mg,tR=32 min)。Fr.E7(2.8 g)经硅胶柱层析进行分离,用石油醚和乙酸乙酯系统梯度洗脱(40 ∶1-0 ∶1),得到14 个流份Fr.E7-1~Fr.E7-14。Fr.E7-7(102 mg)经半制备HPLC(乙腈-水38%)分离得到化合物10(16 mg,tR=14 min)。
2.2 肝癌细胞活性测试 采用MTT 法测定分离得到的10 个化合物对肝癌细胞HepG2 的抑制作用。用含10%胎牛血清的培养液(DMEM)配成单个细胞悬液,以每孔3 000~15 000 个细胞接种到96 孔板,每孔加入100 μL 细胞悬液,在37 ℃,5% CO2的培养箱中孵育24 h,使细胞贴壁。吸去旧培养基后,待测化合物用DMSO 溶解,30 μM 为初筛浓度加入板中,继续在培养箱中孵育72 h。吸去培养基,加入配好的MTT 溶液(5 mg/mL),每孔加入20 μL,培养箱中孵育4 h,然后每孔加入200 μL DMSO(二甲基亚砜)避光震摇12 min,使用酶标仪在490 nm 波长下测量吸光度值,记录结果。紫杉醇作为阳性对照化合物。按公式计算细胞抑制率:细胞抑制率=([空白组-实验组)/空白组]×100%。
2.3 HBV 活性测试 采用MTT 法测定化合物1,3 和4 对HepG2.2.15 细胞的毒性,用ELISA 法检测细胞上清液中的HBeAg 和HBsAg 抗原分泌。HepG2.2.15细胞接种于48 孔板,3×104细胞每孔,加入生长培养基,于37 ℃,5% CO2培养箱中培养24 h,使细胞贴壁。吸除原培养基,将稀释好的样品加入板中,继续在培养箱中孵育72 h。用MTT 法检测药物细胞毒性,用ELISA 法测定样品对HBeAg 和HBsAg 抗原分泌抑制率,以拉米夫定作为阳性对照。按公式计算细胞存活率和抗原抑制率:细胞存活率=(实验组/空白组)×100%;抗原抑制率=([空白组-实验组)/空白组]×100%。
2.4 结构鉴定 化合物1:淡黄色油状。[α]2D3-20.0(c 0.10,MeOH)。ESI-MS m/z:187.0729 [M+Na]+(计算值为187.0735 [M+Na]+),推测分子式为C10H12O2,不饱和度为5。红外光谱(KBr)显示有羟基信号(3403 cm-1),炔基信号(2230 cm-1)和碳-碳双键信号(1613 cm-1)。紫外光谱(λmax:239,252,267,283 nm)与烯炔类化合物的紫外吸收吻合。1H-NMR(600 MHz,CD3OD)δ:6.21(dq,J=10.8,6.9 Hz,1H,H-9),5.55(d,J=10.8 Hz,1H,H-8),4.60(t,J=6.3 Hz,1H,H-3),3.71 (m,2H,H-1),1.89 (d,J=6.9 Hz,3H,H-10),1.89(m,2H,H-2)。13C-NMR 数据见表1,显示10 个碳信号,包括4 个季碳,3 个次甲基,3 个亚甲基,与化合物gymnasterkoreayne A[17]对比1H-NMR,13C-NMR 数据基本一致,除了H-8 和H-9 之间耦合常数由15.8 Hz 变为10.8 Hz,故判断8 位双键的构型为Z 型。由于该化合物具有一个手性碳(C-3),为进一步判定其绝对构型,我们对其比旋光度进行了测定,结果为 [α]23D-20.0(c 0.10,MeOH),与原文献[α]2D3-14.0(c 0.1,MeOH)基本吻合,综上所述,化合物1 鉴定为(R,Z)-deca-8-en-4,6-diyne-1,3-diol.
化合物2:无色油状。[α]2D44.30(c 0.25,CHCl3)。ESI-MS m/z:263.1247 [M+Na]+(计算值为263.1259[M+Na]+),推测分子式为C13H20O4,不饱和度为4。红外光谱(KBr)显示有羰基信号(1756 cm-1)和碳-碳双键信号(1601 cm-1)。1H-NMR(600 MHz,CD3OD)δH:7.72(dd,J=5.8,1.5 Hz,1H,H-3),6.13(d,J=5.8 Hz,1H,H-2),5.14(m,1H,H-4),3.65(s,3H,H-13),2.32(t,J=7.4 Hz,2H,H-11),1.86-1.29(m,12H,H-5-H-10)。13C-NMR 数据见表1,显示13 个碳信号,包括2个季碳,3 个次甲基,7 个亚甲基,1 个甲氧基,与化合物maritolide[18]对比1H-NMR,13C-NMR 数据基本一致,主要区别在于化合物2 少了一个连氧亚甲基信号,出现了一个甲氧基信号。HMBC 谱中OMe(δH3.65)与C-12(δC175.7)相关,进一步支持上述推测。为进一步判定C-4 位的绝对构型,我们对其比旋光度进行了测定,结果为[α]2D4+4.30(c 0.3,CHCl3),与原文献[α]2D4-3.4(c 0.2,CHCl3)相反,从而确定其绝对构型为4S。综上所述,化合物2 鉴定为methy(lS)-8-(5-oxo-2,5-dihydrofuran-2-yl)octanoate。
化合物3:淡黄色油状。MS m/z:187.1 [M+Na]+,分子式:C10H12O2。1H-NMR(600 MHz,CD3OD)δ:6.30(dq,J=16.3,6.9 Hz,1H,H-9),5.59 (d,J=16.3 Hz,1H,H-8),4.57(t,J=6.9 Hz,1H,H-3),3.79(t,J=5.6 Hz,2H,H-1),1.94(m,2H,H-2),1.72(d,J=6.9 Hz,3H,H-10)。13C-NMR 数据见表1。以上数据与文献[17]报道基本一致,故鉴定化合物3 为gymnasterkoreayne A。
化合物4:无色油状。MS m/z:185.1 [M+Na]+,分子式:C10H10O2。1H-NMR(600 MHz,CD3OD)δ:4.57(td,J=6.1,5.8 Hz,1H,H-3),3.74(m,2H,H-1),1.97(s,3H,H-10),1.87(m,2H,H-2)。13C-NMR 数据见表1。以上数据与文献[14]报道基本一致,故鉴定化合物4 为(S)-deca-4,6,8-triyne-1,3-diol。
化合物5:无色油状。MS m/z:245.1 [M+Na]+,分子式:C13H18O3。1H-NMR(600 MHz,CD3OD)δ:7.00(d,J=15.8 Hz,1H,H-7),6.44(d,J=15.8 Hz,1H,H-8),5.94(s,1H,H-4),2.62(d,J=17.1 Hz,1H,H-2a),2.31(s,3H,H-10),2.28(d,J=17.1 Hz,1H,H-2b),1.89(s,3H,H-13),1.06(s,3H,H-11),1.02(s,3H,H-12)。13C-NMR 数据见表1。以上数据与文献[19]报道基本一致,故鉴定化合物5 为dehydrovomifoliol。
化合物6:淡黄色油状。MS m/z:219.1 [M+Na]+,分子式:C11H16O3。1H-NMR(600 MHz,CD3OD)δ:5.76(s,1H,H-7),4.22(m,1H,H-3),2.42(dd,J= 13.5,2.6 Hz,1H,H-4a),1.99(dd,J=14.4,2.6 Hz,1H,H-2a),1.76(s,3H,H-10),1.74(dd,J=13.5,2.6 Hz,1H,H-4b),1.53(dd,J=14.4,2.6 Hz,1H,H-2b),1.47(s,3H,H-9),1.28(s,3H,H-11)。13C-NMR 数据见表1。以上数据与文献[20]报道基本一致,故鉴定化合物6为loliolide。
化合物7:无色油状。MS m/z:265.1 [M+Na]+,分子式:C13H22O4。1H-NMR(600 MHz,CD3OD)δ:7.18(d,J=15.8 Hz,1H,H-8),6.18(d,J=15.8 Hz,1H,H-7),3.76(m,1H,H-3),2.31(dd,J=14.3,9.2 Hz,1H,H-4a),2.29(s,3H,H-10),1.65(dd,J=14.3,9.2 Hz,1H,H-4b),1.58(m,1H,H-2a),1.27(m,1H,H-2b),1.19(s,3H,H-11),1.18 (s,3H,H-13),0.96 (s,3H,H-12)。13C-NMR 数据见表1。以上数据与文献[21]报道基本一致,故鉴定化合物7 为(3S,5R,6S,7E)3,5,6-trihydroxy-7-megastigmen-9-one。
化合物8:无色油状。MS m/z:231.1[M+Na]+,分子式:C13H20O2。1H-NMR(600 MHz,CD3OD)δ:5.89(s,1H,H-4),5.69 (dd,J=15.3,6.0 Hz,1H,H-8),5.58(dd,J=15.3,9.3 Hz,1H,H-7),4.28 (m,1H,H-9),2.66(d,J=9.3 Hz,1H,H-6),2.42(d,J=16.8 Hz,1H,H-2a),2.05(d,J=16.8 Hz,1H,H-2b),1.96(s,3H,H-13),1.24(d,J=6.5 Hz,3H,H-10),1.03(s,3H,H-11),0.96(s,3H,H-12)。13C-NMR 数据见表1。以上数据与文献[22]报道基本一致,故鉴定化合物8 为(6R,9R)-3-oxo-α-ionol。
化合物9:无色油状。MS m/z:209.1 [M+Na]+,分子式:C10H18O3。1H-NMR(600 MHz,CDCl3)δ:5.88(dd,J=17.3,10.8 Hz,1H,H-2),5.25(dd,J=17.3,1.8 Hz,1H,H-1a),5.04(dd,J=10.8,1.8 Hz,1H,H-1b),3.82(m,1H,H-4),3.83(dd,J=9.4,3.4 Hz,1H,H-6),2.22(ddd,J=14.0,9.4,5.5 Hz,1H,H-5a),1.87 (ddd,J=13.5,5.5,3.4 Hz,1H,H-5b),1.27(s,3H,H-8),1.24(s,3H,H-10),1.14(s,3H,H-9)。13C-NMR 数据见表1。以上数据与文献[23]报道基本一致,故鉴定化合物9 为trans-4-hydroxylinalool-3,6-oxide。

表1 化合物1-10 的13C-NMR 数据
化合物10:黄色油状。MS m/z:237.1 [M+Na]+,分子式:C12H22O3。1H-NMR(600 MHz,CDCl)3δ:5.86(ddd,J=16.9,10.4,6.3 Hz,1H,H-2),5.21 (dt,J=16.9,1.4 Hz,1H,H-1a),5.10(dt,J=10.4,1.4 Hz,1H,H-1b),4.09(m,1H,H-3),3.66(s,3H,H-12),2.30(t,J=7.5 Hz,2H,H-10),1.61(m,2H,H-9),1.52(m,2H,H-4),1.30(m,8H,H-5-H-8)。13C-NMR 数据见表1。以上数据与文献[24]报道基本一致,故鉴定化合物10为methy(lS)-9-hydroxy-10-undecenoate。
2.5 抗肝癌活性 本文对茵陈蒿中分离得到的化合物进行抗肝癌活性测试,以浓度为3 μM 的紫杉醇作为阳性对照,细胞毒活性如表2 所示,研究结果表明,在30 μM 浓度下,上述化合物对肝癌细胞株(HepG2)未显示出抑制活性。
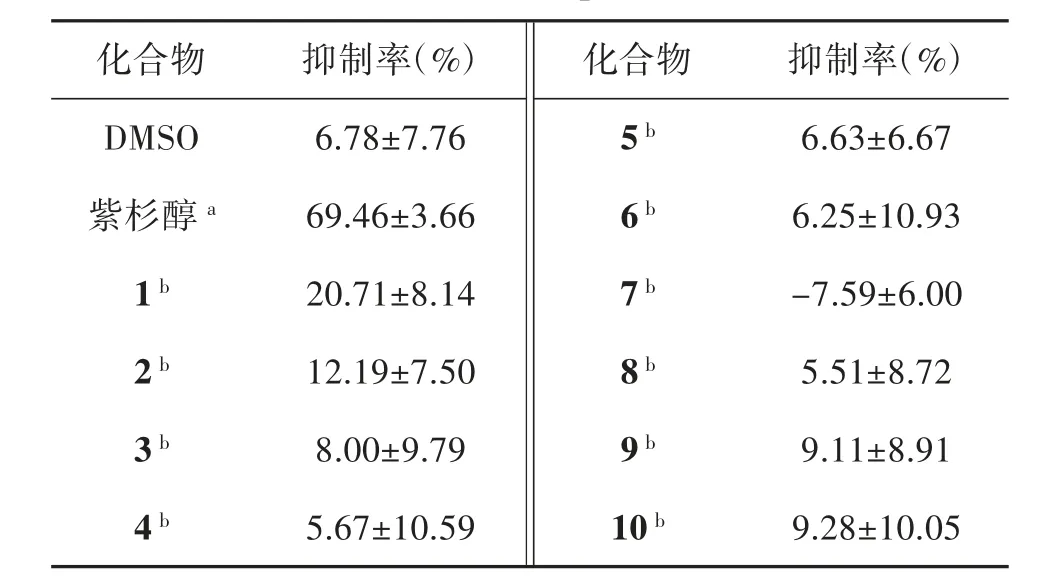
表2 化合物1-10 对HepG2 的细胞毒活性
2.6 抗HBV 活性 本文对茵陈蒿中分离得到的烯炔类化合物(1,3,4)进行抗HBV 活性测试,以浓度为30 μM 的拉米夫定作为阳性对照,结果如表3 所示,研究结果表明,在30 μM 和100 μM 浓度下,化合物1,3,4 均未显示出抗HBV 活性。

表3 化合物1,3,4 在30 μM 和100 μM 浓度下抗HBV 活性
3 结论与讨论
肝病是我国高发病率的病种,常见的肝病有肝炎、肝纤维化、脂肪肝、肝癌等。基于前期文献调研显示,茵陈蒿是传统抗肝病中药茵陈的主要植物来源之一,临床上用于治疗各种肝胆疾病的复方方剂中均含有茵陈蒿,例如茵陈蒿汤可通过抑制JAK2/STAT3 信号通路促进肝癌细胞死亡,从而发挥抗肝癌作用[25],茵陈蒿汤加味临床上可用于治疗慢性乙型肝炎[26]。但目前有关茵陈蒿中化学成分及其活性研究大多集中于有机酸类,黄酮类和香豆素类化合物[27],针对萜类化合物的研究较少,且缺乏茵陈蒿中单体化合物对肝癌细胞增殖的研究报道。本文从茵陈蒿的95%乙醇提取物中,萜类化合物含量最多的流份里分离出10 个化合物,并对其化学结构进行鉴定,包括5 个萜类,3 个烯炔类,2 个脂肪酸类化合物,其中化合物1 和2 为新化合物。体外抗肝癌活性的实验结果表明,这些化合物对HepG2 细胞无显著抑制作用。此外,根据文献报道,茵陈蒿中烯炔类化合物具有一定抗HBV 活性[14],本研究论文针对分离得到的烯炔类化合物1,3,4 进行抗HBV活性检测,结果表明这三个化合物均无抗HBV 活性。现代药理学研究表明,茵陈蒿汤还具有抗肝硬化,肝纤维化等活性[28],后续将对分离得到的化合物进行抗肝病相关活性测试,并对活性化合物的作用机制进行解析,为其治疗肝病的药用价值提供科学依据和基础。本研究丰富了茵陈蒿的化学成分,并为其药理学研究奠定了物质基础。
