安徽某三级医院金黄色葡萄球菌的分子流行病学
2023-04-29张慧敏曹嘉欣何知恩赵杭孙宝林
张慧敏 曹嘉欣 何知恩 赵杭 孙宝林

收稿日期:2022-11-24
基金项目:国家自然科学基金项目(32070132)。
作者简介:张慧敏,硕士研究生,主要从事病原微生物毒力与耐药研究。
*通讯作者:孙宝林,教授,主要从事病原微生物毒力与耐药研究。
摘要:目的 为研究安徽省金黄色葡萄球菌的流行病学特征,收集了安徽某三级医院100株临床金黄色葡萄球菌,以期为预防和治疗金黄色葡萄球菌感染提供理论依据。方法 2021年9月—12月期间,收集来自安徽某三级医院不同患者临床产生的100株金黄色葡萄球菌分离株,通过Vitek2 Compact System 3鉴定分离株,并用多位点序列分型(MLST)进行分子分型。结果 本研究对100株金黄色葡萄球菌分离株做了17种抗生素的药敏实验,结果显示对青霉素的耐药率最高,高达93%。统计学分析法证明大部分对耐甲氧西林金黄色葡萄球菌(MRSA)比甲氧西林敏感金黄色葡萄球菌(MSSA)的耐药率高;并发现28个ST型,ST59、ST6697分型数量分布最多,CC5检出率均高于其他克隆群。结论 安徽某三级医院的金黄色葡萄球菌分离株具有独特的分子特征和抗生素耐药性特征,抗生素耐药性特征可能与当地抗生素使用趋势有关。
关键词:金黄色葡萄球菌;流行病学分析;多位点序列分型;MLST分型;MRSA
中图分类号:R978.1 文献标志码:A 文章编号:1001-8751(2023)06-0417-07
Molecular Epidemiology of Staphylococcus aureus in a
Tertiary Care Hospital in Anhui
Zhang Hui-min1,2, Cao Jia-xin1,2, He Zhi-en2,3, Zhao Hang1,2, Sun Bao-lin1,2
(1 Mudanjiang Normal University, Mudanjiang 157011;
2 Life Sciences and Medicine, University of Science and Technology of China, Hefei 230022;
3 The First Hospital of the University of Science and Technology of China, Hefei 230002)
Abstract: Objective To develop a theoretical framework for the prevention and treatment of S. aureus, 100 clinical S. aureus isolates from the tertiary care hospital in Anhui were gathered to examine the epidemiological characteristics of the disease in Anhui Province. Methods 100 clinical S. aureus isolates from patients in tertiary care hospital in Anhui were gathered between September 2021 and November 2021. By using the VITEK2 Compact System 3, the isolates were recognized, and their genotypes were molecularly typed using multi-locus sequence typing (MLST). Results In this study, 17 antibiotic sensitivity tests were done on 100 S. aureus isolates, of which the highest resistance rate to penicillin was 93%. Statistical analysis was used to prove that most MRSA had a higher resistance rate than MSSA; and 28 ST types were found, with the largest distribution of ST59 and ST6697 typing numbers, and all CC5 detection rates were higher than other clonal groups. Conclusion Staphylococcus aureus isolates from a tertiary care hospital in Anhui have unique molecular and antibiotic resistance characteristics, and the antibiotic resistance characteristics may be related to local antibiotic use trends.
Key words: Staphylococcus aureus; epidemiological analysis; multilocus sequence typing; MLST typing;
MRSA
金黄色葡萄球菌(Staphylococcus aureus)是一种易引发临床感染的革兰阳性菌,主要定植在人类皮肤和黏膜表面。患者通常会在社区和医疗保健环境中受到金黄色葡萄球菌的感染[1-2]。金黄色葡萄球菌是社区获得性感染(Community-acquired infections,CAI)和医院获得性感染(Hospital-acquired infections,HAI)的常见病原体之一[3]。临床上,从青霉素开始到更多抗生素的出现,人类已经和金黄色葡萄球菌斗争多年[4],但是金黄色葡萄球菌很快就对新型抗菌药物产生了耐药性,并且耐药性发展迅速。其中,对甲氧西林耐药的金黄色葡萄球菌(MRSA)是最常见的多药耐药金黄色葡萄球菌,是医疗保健相关感染的主要病原菌之一,已被世界卫生组织列为超级细菌[5],成为临床治疗的一大难题[6]。
研究金黄色葡萄球菌流行病学,目的是揭示金黄色葡萄球菌克隆的起源、传播和进化途径,对于评估现有预防措施和规划预防措施至关重要。研究金黄色葡萄球菌流行病学的技术有很多,包括多位点序列分型(MLST),葡萄球菌蛋白A(spa)分型,葡萄球菌盒染色体mec(SCCmec)分型,辅助基因调节剂(agr)分型和毒素基因谱分析[7]。
目前,常见的分子分型方法是MLST,通过MLST已经鉴定出几种克隆复合物,主要有CC5、CC8和CC80,不同地区的流行病学差异比较大,在北美,ST5、ST8、ST36和ST45是最常见的分型[8];欧洲,ST5、ST8和ST22是最常见的分型[9];亚洲,ST5和ST239一直是亚洲医院中两种主要的金黄色葡萄球菌克隆[10]。
随着时间的推移,国内金黄色葡萄球菌流行的基因型已经发生改变,2012年ST239和ST7是最常见的基因型[11];从2013年—2016年,我国最流行的基因型是ST59和ST239[12],然而2018年,我国流行的金黄色葡萄球菌分型是ST5和ST188[13]。鉴于流行病学的变化,及时更新当地和异地金黄色葡萄球菌流行性的信息对于预防和控制这种病原体至关重要[14]。为了进一步探究安徽省金黄色葡萄球菌的流行病学特征,本研究以安徽某三级医院2021年检出的100株金黄色葡萄球菌为研究对象,进行基因组流行病学与耐药性分析。
1 材料与方法
1.1 菌株来源
收集 2021年9月—12月安徽省合肥市安徽某三级医院分离的各类临床标本中的金黄色葡萄球菌菌株100株,接种在血琼脂板上并在37 ℃下培养以分离细菌克隆。Vitek2 Compact System 3用于药敏实验,鉴定阳性菌株。
1.2 实验材料和试剂
1.2.1 试剂
实验培养基:TSB培养基,1 L ddH2O中加入30 g TSB 粉末。
分子克隆相关的酶:2× Rapid Taq Master Mi × (Vazyme) 用于PCR检测。基因组提取试剂盒(StarPrep Plasmid Miniprep Kit)、中和缓冲液苯酚、氯仿、异戊醇(生工公司)。
1.2.2 仪器
超净工作台(上海智诚分析仪器制造公司)、摇床(上海智诚分析仪器制造公司)、普通PCR仪(Thermo)、离心机(Beckman)等。
1.3 提金黄色葡萄球菌的基因组
提前摇好的菌液放在离心管中,12 000 r/min,离心2 min,倒掉上清,收集菌体。用溶葡球菌酶(2×LSA)重悬菌体,放置37 ℃,220 r/min的摇床进行消化。消化后放置离心机,重复上述步骤,取细胞悬浮液继续重悬菌体,重悬后加细胞裂解液,上下颠倒;再去通风橱处加500 μL苯酚:氯仿:异戊醇(25:24:1),剧烈摇晃,12 000 r/min,离心10 min, 吸上清至吸附柱中,静置3 min,12 000 r/min,离心3 min。倒掉吸附柱中废液,向收集管中加入500 μL WB漂洗液(Wash BufferFor Western Blot),12 000 r/min,离心1 min,漂洗两次,漂洗后空,12 000 r/min,离心5 min,将吸附柱套在1.5 mL的EP管中,加入100 μL提前预热好的无菌ddH2O,静置后,12 000 r/min,离心1 min。在-4 ℃或者-20 ℃环境下保存。
1.4 目标DNA片段的扩增
对金黄色葡萄球菌进行MLST分型,一共需要7个管家基因arcC、aroE、glpf、gmk、pta、tpi、yqil,在PubMLST(https://pubmlst.org/organisms/staphylococcus-aureus/primers)中找到7个相应的测序引物,结合相应PCR聚合酶说明书要求进行体系配置。100株菌均提取DNA,提取DNA后进行目的DNA片段扩增;扩增后的未纯化的DNA片段,送测序公司正向测序,测序片段的长度在300~800 bp之间。
1.5 分子分型
测序结果需在SanpGene中分析,在MLST数据库(http://saureus.mlst.net)中将序列与相应等位基因谱的序列进行比较,从而确定序列类型,并用Search by locus combinations(https://pubmlst.org/bigsdb?db=pubmlst)确定ST类型及克隆群。确定分型后,应用Phyloviz online 网站(http://online.phyloviz.net/index)建立系统发育树,更直观地看到种群结构图。
1.6 统计学统计方法
统计分析,使用SPSS Statistics 26.0执行的。卡方检验用于比较不同样本来源之间甲氧西林敏感金黄色葡萄球菌(MSSA)和MRSA的数量,MSSA和MRSA分离株之间的耐药率以及性别、年龄与克隆复合物之间的关系。P<0.05表明存在统计学上显著差异。
2 结果
2.1 金黄色葡萄球菌样本来源
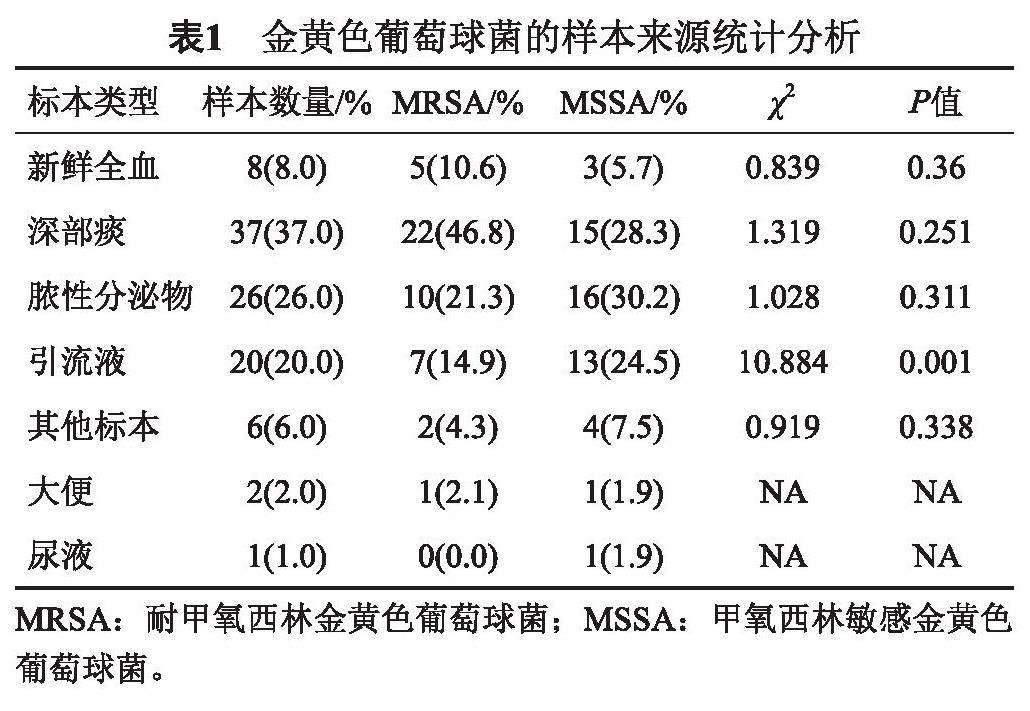
2021年9月—12月从安徽某三级医院随机收集金黄色葡萄球菌100株,其中样本来源于新鲜血液、深部痰液、脓性分泌物、引流液、其他标本、各种穿刺液、尿液。金黄色葡萄球菌的主要标本来源是深部痰液和脓性分泌物,见表1。MRSA与MSSA的标本来源分析比较,除了引流液以外无统计学意义P>0.05。
2.2 金黄色葡萄球菌耐药情况
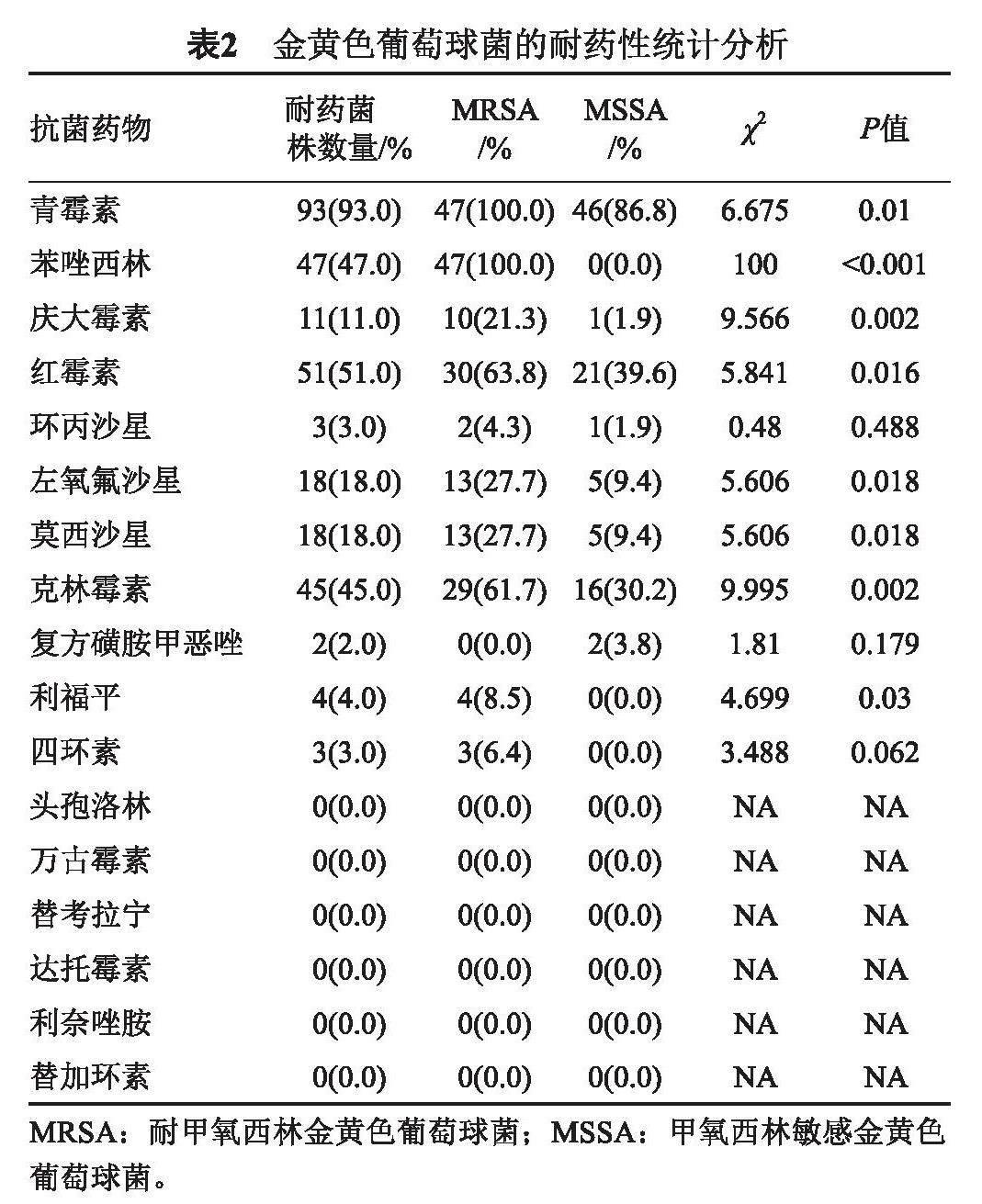
本研究对100株金黄色葡萄球菌分离株做了17种抗菌药物的药敏实验,所有MRSA分离株均对苯唑西林和青霉素耐药。一般而言,MRSA菌株对测试抗菌药物的耐药率远高于MSSA菌株;本研究中除环丙沙星、复方磺胺甲恶唑和四环素耐药率差异无统计学意义外,其他耐药率差异均有统计学意义(P<0.05),见表2。
2.3 金黄色葡萄球菌MLST分型
在100株临床金黄色葡萄球菌中有ST1:5株;ST5:6株;ST6:3株;ST7:5株;ST59:11株;ST15:4株;ST22:4株;ST25:4株;ST59:11株;ST72:2株;ST88:2株;ST121:1株;ST188:3株;ST239:3株;ST338:1株;ST537:1株;ST630:4株;ST764:2株;ST789:1株;ST950:1株;ST1281:1株;ST3074:1株;ST3821:1株;ST4894:1株ST5468:1株;ST6697:15株;ST6763:1株;ST7063:1株;ST7397:1株;NA14株。金黄色葡萄球菌分离株在基于MLST的7个管家基因位点中的5个或更多具有同一性,被称为克隆复合体(CC)。见表3,ST1和ST5的位点差异最大,因此没有紧密相关。ST5和ST6仅在两个位点上彼此不同,因此,ST5和ST6密切相关。
100株金黄色葡萄球菌有11种克隆复合体,多位点序列分型详见表4。
图1系统发育树为ST分型之间的关系,该图说明了极其多样化的金黄色葡萄球菌种群结构,同种克隆复合物的金黄色葡萄球菌的ST分型位点靠得更近。
2.4 MRSA与MSSA克隆复合物的比较
克隆复合体CC1:MSSA 7株,MRSA 1株;CC5:MSSA 9株,MRSA 10株;CC7:MSSA 6株;CC8:MSSA 3株;MRSA 9株;CC15:MSSA 5株;CC20:MSSA 1株;CC22:MSSA 2 株,MRSA 2株;CC59:MSSA 1株,MRSA 12株;CC88:MSSA 1株,MRSA 1株;CC121:MSSA 1株;CC181:MSSA 8株,MRSA 7株。其中克隆复合体CC5的MRSA株最多,见图2。
2.5 克隆复合物类型与年龄和性别无关
本研究中男性患者70人、女性患者30人,老年人感染金黄色葡萄球菌的居多,影响感染的因素有很多。为了分析不同的CC克隆复合物与患者的性别与年龄的相关性。将常见的CC克隆复合物(CC1、CC5、CC7、CC8、CC15、CC22、CC59、CC181)与性别、年龄两因素相关联。发现CC5克隆复合物与性别、年龄两因素有相关性,患者年龄越大感染CC1、CC59的可能性越大(P<0.005),但是与性别无关;虽然存在克隆复合物与两因素相关联的可能性,但是调查的患者人数有限,不能说明不同种类的克隆复合物与年龄、性别呈相关性。见表5。
2.6 金黄色葡萄球菌来源的科室
100株金黄色葡萄球菌主要来自重症医学科、儿童危重症科、血管外科、关节外科、皮肤科、老年呼吸内科、急诊医学科、口腔颌面外科、创伤骨科、普通外科、综合老年医学科、综合儿科、老年内分泌科、小儿外科神经外科、肾内科、其他科、耳科、儿童呼吸科、烧伤整形外科、综合肿瘤放疗科、心脏大血管外科、肝脏外科、弥漫性结缔组织病科以及综合泌尿外科,其中重症医学科(Department of critical care medicine)金黄色葡萄球菌的数量最多,有NA 2 株、ST5CC5 1株、ST6CC5 1株、ST7CC7 2株、ST25CC5 1株、ST59CC59 1株、ST239CC8 1株、ST764CC5 1株、ST6697CC184 1株、ST7063CC7 1株、ST7397CC5 1株;而肝脏外科(Liver surgery)有ST59CC59 1株;弥漫性结缔组织病科(Diffuse connective tissue disease)有ST88CC88 1株;以及综合泌尿外科(General urology)有ST59CC59 1株,这三个科室只有一种ST 型,见图3。
3 讨论
目前,金黄色葡萄球菌是医院内常见的机会病原体,大部分健康人群都会携带金黄色葡萄球菌,不表现临床症状,但当宿主免疫力低下,金黄色葡萄球菌则会引发感染性疾病[15-16]。本研究在所采集的临床样本中,深部痰液样本占据37%,推测金黄色葡萄球菌在医院主要引起呼吸道感染,因而要注意呼吸科室的感染预防。
通过对感染金黄色葡萄球菌患者年龄及性别调查发现,男性老年患者感染金黄色葡萄球菌的数量最多,可能与老年患者有其他患病史及身体抵抗力低下等有关。医院不同科室感染情况不同;为了方便医生制定有效的治疗方案,有必要确定不同科室的金黄色葡萄球菌感染情况。根据从医院科室收集的数据,本课题发现在重症医学科金黄色葡萄球菌的检出率最高。这可能是由于这个科室的大多数患者病情严重,身体免疫力低下,容易感染金黄色葡萄球菌,因此需要有效的治疗。
据CHINET数据云(www.chinets.com)统计显示:2021年,国内54家医院收集的18398株MSSA对万古霉素的耐药率为0,7882株MRSA对万古霉素的耐药率为0[17-18]。与本次采集的100株临床金黄色葡萄球菌对万古霉素抗生素均无耐药性,与文献报道一致。通过本次研究数据并结合文献分析[18],万古霉素对MRSA的效果与标准治疗对MRSA的治疗效果一样,虽然有罕见的对万古霉素耐药的金黄色葡萄球菌,但是出现的概率很小,说明万古霉素依然是治疗耐药性金黄色葡萄球菌的特效药。
数据云监测(CHINET)数据显示:从2011年—2021年,中国MRSA分离株的检出率逐年下降,从50.6%下降到30.0%。与这些数据相比,本研究中100株金黄色葡萄球菌对苯唑西林的耐药率为47%,约与2011年报告的比率相近,比2021年报告的比率高。从地域角度分析,沈阳、广州、江苏等城市的金黄色葡萄球菌临床分离株的MRSA检出率与本研究的MRSA检出率相近,但是其他地区的MRSA检出率与本研究存在差异性,造成差异的原因可能和当地的抗生素使用有关。
微生物分型通常用于确定感染的来源和途径、确认或排除疫情爆发、追踪医疗相关病原体的交叉传播、识别毒株和评估控制措施的有效性[19-20]。MLST已成为流行病学调查的主要工具,因为它具有鉴别力,易于应用和分析结果,且已有较为全面的数据库,可以轻松访问所有现有的遗传图谱并进行比较[21-22]。这种工具在临床环境中具有优势,尤其是在微生物感染的诊断方面[23-24]。目前,据CHINET云统计数据显示:2021年,30 1917株菌株中,金黄色葡萄球菌占8.93%,仅次于大肠埃希菌和肺炎克雷伯菌,位列第三位。由于菌株的多样性和临床医疗的影响,MLST数据库中金黄色葡萄球菌的ST型数量还在增加,目前可确定的有ST有4 800个,此次研究的100株临床分离株中发现有28个ST型,10个克隆群(CC),其中ST59和ST6697的数量占据前两位,克隆复合体CC5的数量最多。研究显示:55岁以上老年人主要感染的金黄色葡萄球菌分型类型是ST59,而幼儿、年轻人感染金黄色葡萄球菌ST6697最多,推测金黄色葡萄球菌ST59在安徽省老年人群体中传播能力较强,金黄色葡萄球菌ST6697在安徽省幼儿与年轻人群体中传播能力较强。另外本研究还统计了安徽某三级医院科室分离的金黄色葡萄球菌的分型结果,其中重症医学科的金黄色葡萄球菌分型种类以及菌株的数量最多,推测主要原因是重症患者的免疫力低下,容易感染金黄色葡萄球菌。
安徽某三级医院金黄色葡萄球菌分离株具有独特的分子特征和抗生素耐药性特征,本研究仅对安徽某三级医院的金黄色葡萄球菌进行分析,具有一些局限性。为此提出有效控制感染的策略,以期为临床医疗做出贡献。
参 考 文 献
Monaco M, Pimentel de Araujo F, Cruciani M, et al. Worldwide epidemiology and antibiotic resistance of Staphylococcus aureus[J]. Curr Top Microbiol, 2017, 409: 21-56.
Kwiecinski J M, Horswill A R. Staphylococcus aureus bloodstream infections: pathogenesis and regulatory mechanisms[J]. Curr Opin Microbiol, 2020, 53: 51-60.
Argudín M A, Deplano A, Nonhoff C, et al. Epidemiology of the Staphylococcus aureus CA-MRSA USA300 in belgium[J]. Eur J Clin Microbiol Infect Dis, 2021, 40(11): 2335-2347.
Schaumburg F, Alabi A S, Peters G, et al. New epidemiology of Staphylococcus aureus infection in Africa[J]. Clin Microbiol Infect, 2014, 20(7): 589-596.
Hassoun A, Linden P K, Friedman B. Incidence, prevalence, and management of MRSA bacteremia across patient populations-a review of recent developments in MRSA management and treatment[J]. Crit Care, 2017, 21(1):211.
Burgin D J, Liu R, Hsieh R C, et al. Investigational agents for the treatment of methicillin-resistant (MRSA) bacteremia: progress in clinical trials[J]. Expert Opin Inv drug, 2022, 31(3): 263-279.
Deurenberg R H S,tobberingh E E. The evolution of Staphylococcus aureus[J]. Infect Genet Evol, 2008, 8(6): 747-763.
Chatterjee S S, Otto M. Improved understanding of factors driving methicillin-resistant Staphylococcus aureus epidemic waves[J]. Clin Epidemiol, 2013, 5: 205-217.
Deplano A, Dodemont M, Denis O, et al. European external quality assessments for identification, molecular typing and characterization of Staphylococcus aureus[J]. J Antimicrob Chemoth, 2018, 73(10): 2662-2666.
Chen C J, Huang Y C. New epidemiology of Staphylococcus aureus infection in Asia[J]. Clin Microbiol Infect, 2014, 20(7): 605-623.
He W, Chen H, Zhao C, et al. Population structure and characterisation of Staphylococcus aureus from bacteraemia at multiple hospitals in China: association between antimicrobial resistance, toxin genes and genotypes[J]. Int Jantimicrob Ag, 2013, 42(3): 211-219.
Li S, Sun S, Yang C, et al. The Changing pattern of population structure of from bacteremia in China from 2013 to 2016: ST239-030-MRSA replaced by ST59-t437[J]. Front Microbiol, 2018, 9: 332.
Li X, Fang F, Zhao J, et al. Molecular characteristics and virulence gene profiles of Staphylococcus aureus causing bloodstream infection[J]. Braz J Infect Dis, 2018, 22(6): 487-494.
Aloba B K, Kinnevey P M, Monecke S, et al. An emergingPanton-Valentine leukocidin-positive CC5-meticillin-resistantStaphylococcus aureus-IVc clone recovered from hospital andcommunity settings over a 17-year period from 12 countriesinvestigated by whole-genome sequencing[J]. J Hosp Infect, 2023,132:8-19.
Htun H L, Kyaw W M, de Sessions P F, et al. Methicillin-resistant Staphylococcus aureus colonisation: epidemiological and molecular characteristics in an acute-care tertiary hospital in Singapore[J]. Epidemiol Infect, 2018, 146(14): 1785-1792.
Aspiroz C, Mama O M, Martínez-?lvarez R M, et al. Penicillin-susceptible Staphylococcus aureus bacteremia: epidemiological and clinical relevance. Possible therapeutic implications[J]. Enferm Infec Micr Cl, 2020, 38(9): 434-437.
Li X, Huang T, Xu K, et al. Molecular characteristics and virulence gene profiles of Staphylococcus aureus isolates in Hainan, China[J]. Bmc Infect Dis, 2019, 19(1): 873.
Giulieri S G, Tong S Y C, Williamson DA. Using genomics to understand meticillin-and vancomycin-resistant infections[J]. Microbiol Genomics, 2020, 6(1).
Levine D P. Vancomycin: a history[J]. Clin Infect Dis, 2006, 42(Suppl 1): S5-S12.
Gazel D, Erinmez M, Büyükta? Manay A, et al. Investigation of heteroresistant vancomycin intermediate Staphylococcus aureus among MRSA isolates[J]. J Infect Dev Countr, 2021, 15(1): 89-94.
Ranjbar R, Karami A, Farshad S, et al. Typing methods used in the molecular epidemiology of microbial pathogens: a how-to guide[J]. New Microbiol, 2014, 37(1).
Bai Z, Chen M, Lin Q, et al. Identification of methicillin-resistant Staphylococcus aureus from methicillin-sensitive Staphylococcus aureus and molecular characterization in Quanzhou, China[J]. Front Cell Dev Biol, 2021, 9: 629681.
Mendoza M V, Rivera W L. Application of simplified MLST scheme for direct typing of clinical samples from human leptospirosis cases in a tertiary hospital in the Philippines[J]. PloS One, 2021, 16(10): e0258891.
王俊, 史玉敏. 大环内酯类化合物的抗耐甲氧西林金黄色葡萄球菌活性研究进展[J].国外医药(抗生素分册), 2023, 44(05):306-313.
