小湾库区微生物群落结构多样性与水质状况分析
2023-04-29吴嘉伟谭凤霞祁梅张潇峮何杰秋吴泽成张峰柴毅
吴嘉伟 谭凤霞 祁梅 张潇峮 何杰秋 吴泽成 张峰 柴毅
摘要:为了解小湾库区不同水域的微生物多样性及微生物群落与生态环境的关系,2019年在库区选取6个采样点(W1~W6),通过16S rDNA基因扩增和高通量测序,分析库区微生物群落结构组成与多样性差异及水质状况。结果显示,小湾库区水体整体呈偏碱性,COD含量为14.79~24.47 mg/L,TN浓度为0.53~2.39 mg/L,TP浓度为0.14~1.17 mg/L。不同采样点的微生物Chao1指数、覆盖率均较高,Shannon指数为3.42~4.48,Simpson指数为0.030~0.092,反映出各采样点微生物群落多样性丰富,其中群落丰富度以W6区域最高。各采样点的微生物主要有变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi),丰度之和达90%以上,以变形菌门为优势菌;在属水平上,以不动杆菌属(Acinetobacter)为第一优势菌属。PCoA分析发现,W5和W6聚为一类,W1~W4聚为另一类,并具有显著差异。研究表明,小湾库区水质整体良好,但部分区域已出现富营养化现象,且有扩散趋势,需采取环境治理措施。建议通过合理放养、适度捕捞的方式充分利用水域天然饵料资源,在保证小湾库区正常水力发电的前提下,适度开发库区渔业资源。
关键词:微生物群落;高通量测序;多样性分析;环境因子;小湾库区
中图分类号:Q938.1,X524 文献标志码:A 文章编号:1674-3075(2023)06-0122-06
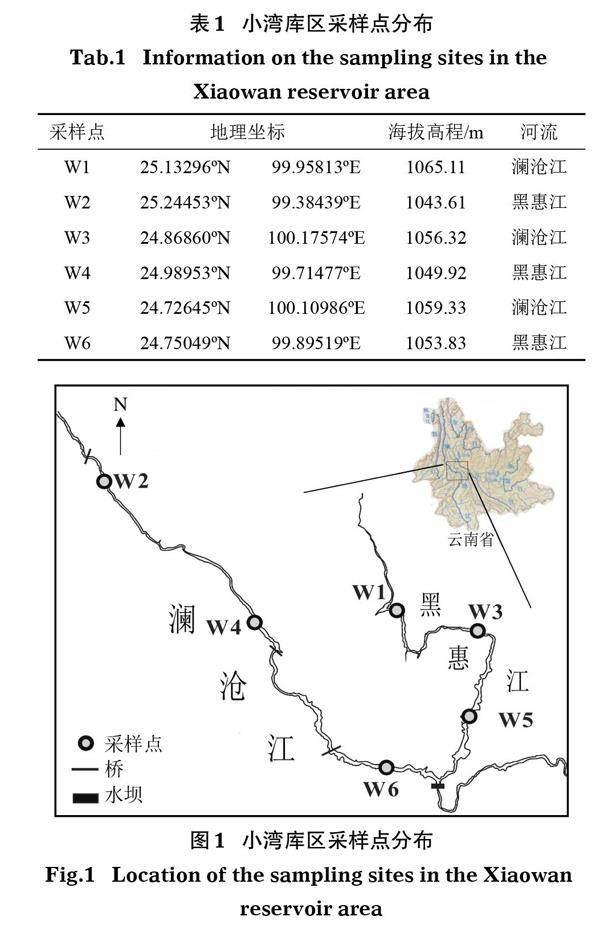
小湾水库位于云南临沧市与大理白族自治区和保山市交界处,是澜沧江中下游河段段梯级水电规划中的龙头电站,也是我国“西电东送”的主力电源之一;水库正常蓄水水位1 240 m,总面积189.1 km2,总库容151 亿m3。大型水利工程修建之后,水生态系统格局一般都会发生巨大变化,包括环境格局和生物格局,如三峡大坝修建以来,许多库湾和支流均暴发了不同程度的水华(蔡庆华和胡征宇,2006)以及重金属污染事件(张代均等,2005);丹江口库区也长期存在严重的总氮污染(朱艳容等,2020),极易引起水体富营养化等环境问题。
微生物群落是水生态系统化学循环的基础结构,其群落丰度和多样性直接受水环境影响,能在一定程度上反映水生态系统的健康情况(钱玮等,2018),因此对微生物群落丰度及多样性研究与评价非常重要。目前,关于小湾水库的研究多集中于地质分析及水体变化等方面,而针对库区水质及水生态系统的研究仅见水生生物相关调查(何琳剑等,2020),鲜见有关水体微生物的研究。高通量测序技术因其测序快速、测序通量高,且可对多样品的多个可变区同时测序,近年来常用于水体微生物群落分析(Langille et al, 2013;Yuan et al, 2014)。本研究通过16S rRNA高通量测序技术,对小湾库区水体微生物群落特征及多样性进行分析,旨在为环境监测和水生态系统评价提供基础数据。
1 材料与方法
1.1 样点设置及水样采集
项目组于2019年7月采集小湾库区水样,根据库区及周边的地形特征,分别在澜沧江干流和黑惠江支流自上游至下游设置了6个采样点,样点具体信息见表1及图1。根据样点水深不同分3个采样层次:水深<1 m,取样点距水面≥0.3 m、距河底≥0.3 m;水深1~5 m,在水面下0.5 m处取样;水深>5 m,在水面下0.5 m水深处及距河底0.5 m处分别取样。使用HQM-1型有机玻璃采水器在每个采样点采水1 L。测定各项水质指标后,加入10~15 mL鲁哥氏液固定。
1.2 水质指标测定
采用便携式pH计现场测定水温(WT)及pH值,塞氏盘法测定透明度(SD)。溶解氧(DO)、化学需氧量(COD)、总氮(TN)和总磷(TP)等水质指标,通过多参数水质分析仪(HQ40D,Hach Loveland, USA)现场测定。
1.3 基因组DNA提取与PCR扩增
水样进行微生物采集后,使用E.Z.N.A.? Soil DNA Kit试剂盒(Omega Bio-tek, USA)提取水样微生物总DNA,然后使用Nano Drop Lite微量核酸检测仪进行浓度测定。对微生物16S rRNA基因进行PCR扩增,使用通用引物:515F:5'-GTGCCAGCMGCCGCGG-3'和907R:5'-CCGTCAATTCMTTTRAGTTT-3'。
对PCR产物采用QuantiFluor?-ST蓝色荧光定量系统在Promega QuantiFluor上进行文库定量,合格PCR产物浓度在2 nmol/L以上。
1.4 测序及数据分析
将合格PCR产物按照样本测序量要求进行相应比例的混合。使用Illumina PE250测序仪进行2×300 bp的双端测序,得到的PE reads首先根据overlap关系进行拼接,同时质控和过滤序列质量,区分样本后进行OTU聚类和物种分类。基于OTU聚类结果,计算ɑ-多样性(Chao1,覆盖率,Shannon,Simpson);多样性以及PCoA聚类均使用QIIME流程。
2 结果
2.1 水质理化指标
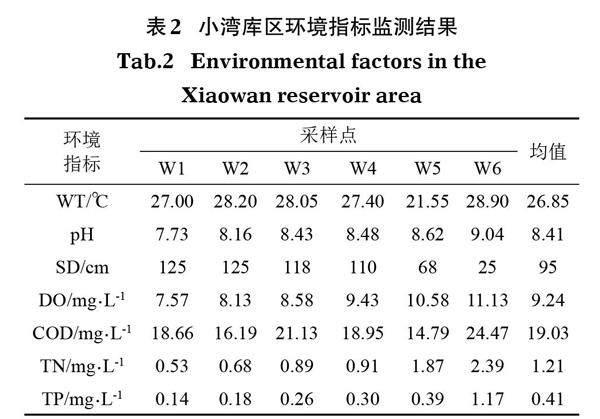
环境指标分析检测结果(表2)表明,小湾库区各采样点水温差异不明显;pH均值为8.41,水质呈偏碱性;W1~W4区域的水体透明度较高,SD≥110 cm;各采样点DO含量较高,均值达9.24 mg/L。COD含量差异不大,在14.79~24.47 mg/L,W5相对含量较低;TN浓度在0.53~2.39 mg/L,最高值在W6,最低值在W1;TP浓度在0.14~1.17 mg/L,整体含量较高,最高值在W6,最低值在W1。
2.2 微生物群落ɑ-多样性
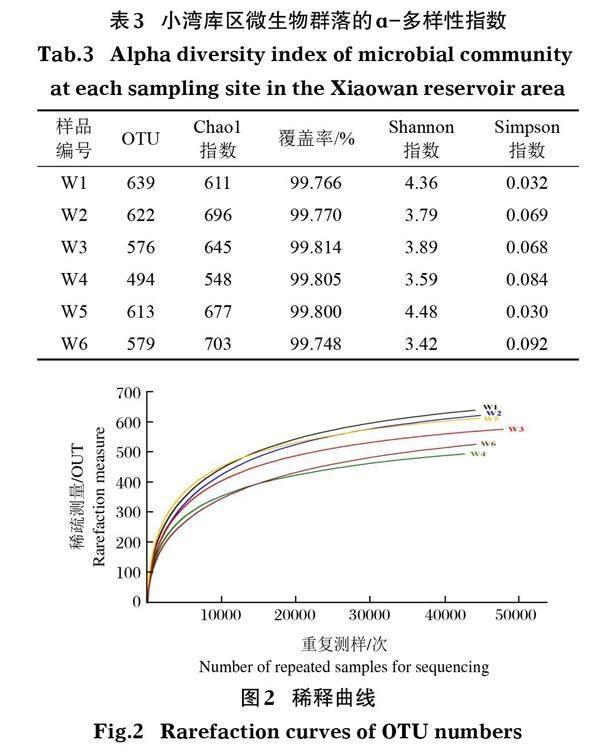
使用Illumina PE250测序,获得细菌序列总数为276 405,总碱基数为103 973 473 bp,平均长度为376.16 bp,其中99.91%分布于351~400 bp。ɑ-多样性指数可以反映出样本内的微生物群落多样性。Chao1指数用于物种总数评价,其值越高,则说明微生物丰富度越高。由表3可以看出,小湾库区整体微生物群落丰富度较高,其中W6区域微生物丰富度最高,W4的丰富度最低。覆盖率代表测序对物种的覆盖度,表3中覆盖率均大于99%,说明样本测序结果可以反映样品的真实情况。Shannon指数为3.42~4.48,Simpson指数为0.030~0.092,差异较大。这两项指标通常都可用来评价微生物群落多样性,其指数均反映W6区域的微生物多样性最高,W5最低。稀释曲线(图2)基本趋于平缓,也反映出测序深度达到要求,可信度较高。
2.3 微生物群落结构特征
小湾库区微生物序列主要分布于8个菌门(图3)。其中,变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi)之和在前5种样品中可达90%以上,较为特殊的是W6样品中浮霉菌门(Planctomycetes)较多,为第二优势菌,丰度高达19.96%;但在其他采样点,该菌含量均较低。各采样点中,蓝细菌门为采样点W1、W2、W4和W5的第一优势门类,占全细菌群落的37.49%~43.50%;变形菌门在W3和W6的第一优势门类,占全细菌群落的48.31%~55.30%。其他被检测到的主要优势菌门还有厚壁菌门(Firmicutes)。
2.4 微生物分类Heatmap图谱
根据测序结果和注释OTU数据进行样本间丰度和相似性聚类,构建小湾库区微生物属层次的物种分类Heatmap图谱(图4),以颜色梯度变化表现丰度值的高低。不动杆菌属(Acinetobacter)的丰度最高,其次为未分类的Chloroplast_norank,再依次为原绿丝蓝细菌属(Prochlorothrix)、细鞘丝藻亚科未鉴定菌种(Leptolyngbyaceae_uncultured)、微小杆菌属(Exiguobacterium)和蓝菌属(Cyanobium)。
2.5 样品PCoA聚类分析
基于Weighted unifrac距离的PCoA分析,比对个样本间相似性,结果如图5所示。PC1贡献度为44.96%,PC2贡献度为13.49%。从图5可以看出,W5、W6样品聚为一类,而W1~W4样品聚为另一类,且两类有显著差异。
3 讨论
3.1 小湾库区各采样点的水质差异及其成因
本次研究结果表明,小湾库区水体溶氧整体较高,说明水体具备较强自净能力(Tao et al, 2015)。水体中各类浮游植物对pH反应敏感(丁蕾和支崇远,2006),丰富的TN、TP也会造成浮游植物大量繁殖(况琪军等,2000;董旭辉等,2004)。分析发现小湾库区整体呈碱性,W5和W6较其他区域水质更偏碱性,且TN和TP含量也相对偏高,适合微生物和浮游植物大量繁殖,进而导致这2个区域的水体透明度较低;此结果也与何琳剑等(2020)对小湾库区水生生物的调查结果类似。W6的pH、DO、TN、TP指标较高,推测其原因是流域梯级水电站开发改变了江河的水文水力特性,水体流速变慢,水位升高,且靠近水电站的区域所受影响更加明显(蔡庆华和胡征宇,2006;傅一迪和赵玉新,2011);W6在澜沧江流域下游,最接近坝区,因此水域湖库化程度最高,加速了营养物质的堆积速率,该水域各项水质指标明显高于其他采样水域也符合这一规律。
3.2 微生物群落结构反映小湾库区的富营养状态
ɑ-多样性指数是反映微生物多样性的综合指标。本次研究发现,小湾库区各采样点丰富度指数和多样性指数均较高,且差异不大,可见小湾库区为微生物繁殖生存提供了适宜环境,且微生物分布均匀。W6区域的Chao1指数、Simpson指数最高,而Shannon指数最低,说明W6水域微生物丰富度和多样性均为最高;从水质分析结果也可看出,该水域的富营养化程度较高,更有利于微生物的大量繁殖(张瑜斌等,2012)。
高通量测序发现,小湾库区各水域微生物群落组成结构相似,优势菌门主要有变形菌门、蓝细菌门、放线菌门、拟杆菌门和绿弯菌门,这些均为典型淡水细菌门类,与其他学者的研究结果相似(Bart et al, 2009;Parfenova et al, 2013;刘亚军等,2019)。变形菌门是水环境中普遍存在的一种原核生物,虽然从总体生物量看,变形菌门在小湾库区以第一优势门存在,但在多个采样水域,蓝细菌门均为优势菌门。Shu等(2011)研究表明,库区水体出现蓝细菌广泛分布的状况,大多是由于水体流动性变差,浮游植物大量繁殖,使水体溶氧增高、营养物质快速沉积所致,而蓝细菌作为水生态环境的指示物种,其大量分布也说明水体已处在富营养化进程中,水体TN、TP含量较高(Yan et al, 2017;Spring et al, 2000;Wakana et al, 2020)。但所调查水域未见厌氧性厚壁菌大量繁殖,说明尚未有工业、生活废水排污等情况出现(Amarja et al, 2008)。Niftrik等(2009)研究发现,浮霉菌为好氧菌,而浮霉菌门的大量繁殖则对溶氧、pH、总氮、总磷等环境因子有较高要求(李红晓等,2016;Spring et al, 2018),W6区域浮霉菌门为第二优势菌,与该区域各项水质指标相关性较高。
PCoA分析表明,W5与W6聚为一类,W1~W4聚为一类。环境微生物多样性反映群落生态组成的主要特征,也是环境优劣评估的重要指标(李红晓等,2016)。W6区域属于澜沧江下游江段;此次调查结果表明,该区域水体已处于富营养化进程中,而W5区域属于黑惠江支流下游江段,W5与W6聚为一类,说明水体富营养化状况已呈扩散趋势,需对澜沧江下游水域采取水质管控措施。
3.3 发展生态渔业可有效控制小湾库区富营养化
除2个下游江段外,小湾库区整体水质较好,溶氧充分,氮磷营养盐水平为中等偏高。本次调查中未见小湾库区的规模化渔业养殖,但检测结果表明,小湾库区整体COD含量较低,水体初级生产力充足(何琳剑等,2020),说明具备养殖业开发潜力(Shinichi et al, 2004)。鉴于小湾库区多处水体有富营养化趋势,而已有研究表明(Guo et al, 2015),适量放养草食性和滤食性鱼类,是控制浮游植物密度、调控水体微生物群落结构、减缓水体富营养化的重要途径之一(王宇庭等,2017)。因此,建议通过合理放养、适度捕捞的方式,充分利用水域天然饵料资源,在保证小湾库区水力正常发电的前提下,可适度发展生态渔业。小湾库区的浮游植物、浮游动物及鱼类资源组成及其渔产力的合理评价,尚有待后期深入研究。
参考文献
蔡庆华,胡征宇,2006. 三峡水库富营养化问题与对策研究[J]. 水生生物学报, 30(1):7-11.
丁蕾,支崇远,2006. 环境对硅藻的影响及硅藻对环境的监测[J]. 贵州师范大学学报(自然科学版), 24(3):13-16.
董旭辉,羊向东,潘红喜,等,2004. 长江中下游地区湖泊现代沉积硅藻分布基本特征[J]. 湖泊科学, 12(4):298-304.
傅一迪,赵玉新,2011. 中小型水电站库区富营养化变化趋势探析——以红岩水电站为例[J]. 环境科学与管理, 36(4):57-60.
何琳剑,薛飞,杨鸿,等,2020. 小湾库区水生生物调查与评价研究[J]. 环境科学与管理, 45(5):137-142.
况琪军,谭渝云,张家玉,等,2000. 汉江中下游二段藻类现状调查及“水华”成因分析[J]. 长江流域资源与环境,9(1):63-70.
李红晓,张殿朋,郝雅荞,2016. 青海固沙草根际微生态体系中微生物多样性分析[J]. 沈阳师范大学学报, 34(2):227-233.
刘亚军,刘欣,牟晓真,等,2019. 大型浅水湖泊鄱阳湖湿地微生物的研究现状[J]. 微生物学通报, 46(12):3453-3460.
钱玮,张济凡,张铭连,等,2018. 太湖湖滨湿地浮游细菌群落结构及时间动态[J]. 基因组学与应用生物学,37(12):5325-5331.
王宇庭,叶金云,郑荣泉,2017. 防止和修复湖泊水库富营养化渔业操纵的探讨[J]. 大连海洋大学学报, 32(4):451-456.
张代均,许丹宇,任宏洋,等,2005. 长江三峡水库水污染控制若干问题[J]. 长江流域资源与环境, 14(5):605-610.
张瑜斌,章洁香,孙省利,2012. 海水富营养化对海洋细菌影响的研究进展[J]. 生态学报, 32(10):3225-3232.
朱艳容,甄航勇,赵旭,等,2020. 丹江口水库水体氨氮浓度时空变化特征[J]. 人民长江, 51(S1):20-23.
Amarja A J, Pradnya P K, Anita S K, et al, 2008. Cultivable Bacterial Diversity of Alkaline Lonar Lake, India[J]. Microbial Ecology, 55:163-172.
Bart W, Giovanni R, Jacob Parnell, et al, 2009. Microbial biodiversity of Great Salt Lake, Utah[J]. Natural Resources and Environmental Issues, 15(1):15-22.
Guo L G, Wang Q, Xie P, et al, 2015. A non-classical biomanipulation experiment in Gonghu Bay of Lake Taihu: control of Microcystis blooms using silver and bighead carp[J]. Aquaculture Research, 46(9):2211-2224.
Langille M G, Zaneveld J, Caporaso J G, et al, 2013. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J]. Nature Biotechnology, 31(9):814-821.
Parfenova V V, Gladkikh A S, Belykh O I, 2013. Comparative analysis of biodiversity in the planktonic and biofilm bacterial communities in Lake Baikal[J]. Microbiology, 82(1):91-101.
Shinichi A, Yasuro F, Etsu Y, 2004. Determinations of Humic Substances and Other Dissolved Organic Matter and Their Effects on the Increase of COD in Lake Biwa[J]. Analytical Sciences, 20(1):159-64.
Shu H T, Karina Y H G, 2011. The dynamics of cyanobacteria and microcystin production in a tropical reservoir of Singapore[J]. Harmful Algae, 10(3):319-329.
Spring S, Bunk B, Spr?er C, et al, 2018. Genome biology of a novel lineage of Planctomycetes widespread in anoxic aquatic environments[J]. Environmental Microbiology, 20(7):2438-2455.
Spring S, Schulze R, Overmann J, et al, 2000. Identification and characterization of ecologically significant prokaryotes in the sediment of freshwater lakes: molecular and cultivation studies[J]. FEMS Microbiology Reviews, 24(5):573-590.
Tao H, Hong J Z, Wei P H, et al, 2015. Research on self-purification capacity of Lake Taihu[J]. Environmental Science and Pollution Research, 22:8201-8215.
van Niftrik L, Geerts W J, van Donselaar E G, et al, 2009. Cell division ring,a new cell division protein and vertical inheritance of a bacterial organelle in anammox planctomycetes[J]. Molecular Microbiology, 73(6):1009-1019.
Wakana O, Ikuo K, Nowaki H, 2020. Inactivation kinetics modeling of Escherichia coli in concentrated urine for implementing predictive environmental microbiology in sanitation safety planning[J]. Journal of Environmental Management, 268(15):110672.
Yan G, Cheng C W, Wei G Z, et al, 2017. Vertical and horizontal assemblage patterns of bacterial communities in a eutrophic river receiving domestic wastewater in southeast China[J]. Environmental Pollution, 270:469-478.
Yuan S, Xie Y H, Zhang H X, et al, 2014. The application of PCR-DGGE technique in sheep intestinal microbial diversity research [J]. Advanced Materials Research, 885:540-543.
(责任编辑 万月华)
Microbial Community Diversity and Analysis of Water Quality Status
in Xiaowan Reservoir
WU Jia‐wei1,2, TAN Feng‐xia1,2, QI Mei2, ZHANG Xiao‐qun3, HE Jie‐qiu4,
WU Ze‐cheng4, ZHANG Feng4, CHAI Yi1,2,
(1. Hubei Key Laboratory of Waterlogging Disaster and Agricultural Use of Wetland ,
Yangtze University, Jingzhou 434025, P.R. China;
2. College of Animal Science, Yangtze University, Jingzhou 434025, P.R. China;
3. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, P.R. China;
4. Yunnan Xiaowan Ecological Fishery Co. Ltd., Fengqing 677000, P.R. China)
Abstract: Xiaowan reservoir is located in the middle-lower reaches of Lancang River. In this study, we explored the microbial diversity of different waters in the Xiaowan reservoir area and analyzed the relationship of the microbial community with the local ecological environment. Our aim was to provide basic environmental monitoring data for aquatic ecosystem evaluation. Water samples were collected at six sampling sites (W1-W6) during 2019 in Xiaowan reservoir, along the main stem of Lancang River and one tributary, Heihui River. Gene amplification of 16S rDNA and high-throughput sequencing were used to analyze the structural composition, diversity differences of the microbial communities and water quality in the reservoir area. The water in Xiaowan reservoir was alkaline, high oxygen levels, a COD range of 14.79-24.47 mg/L, TN range of 0.53-2.39 mg/L and TP range of 0.14-1.17 mg/L. The Chao1 indices and coverage rates of the microbial communities at different sampling sites were high, and the Shannon and Simpson indices were in the range of 3.42-4.48 and 0.030-0.092, respectively, indicating that the diversity of microbial community in the Xiaowan reservoir area was rich, and highest at the W6 site. The microbial community primarily consisted of Proteobacteria, Cyanobacteria, Actinobacteria, Bacteroidetes and Chloroflexi, accounting for more than 90% of the total abundance, and Acinetobacter was the most dominant group at the genus level. Proteobacteria was the most dominant taxon at W3 and W6, accounting for 48.31% -55.30% of the total abundance at both sites. Cyanobacteria was the most dominant taxon at W1, W2, W4 and W5, accounting for 37.49%-43.50% of the total abundance at these sites. Principal Component Analysis (PCoA) shows that the microbial communities at W5 and W6 were clustered into a single group, while the microbial communities at W1, W2, W3 and W4 were clustered into another significantly different group. The overall water quality of Xiaowan reservoir was good, but eutrophication has occurred in some areas and is tending to spread. Therefore, prevention and control measures should be taken immediately, and environmental monitoring should be carried regularly out in Xiaowan reservoir. We also suggest moderate development of the fishery resource with appropriate fish release and fishing to make use of the natural small fish resources in the investigated area.
Key words:microbial community structure; high-throughput sequencing; diversity analysis; environmental factors; Xiaowan reservoir area
收稿日期:2020-08-22 修回日期:2023-06-15
基金项目:长江大学湿地生态与农业利用教育部工程研究中心开放基金(KF202006);澜沧江小湾库区生态渔业发展规划项目(云南小湾生态渔业有限公司,2017)。
作者简介:吴嘉伟,1996年生,男,硕士研究生,研究方向为水域生态学。E-mail: 1609991711@qq.com
通信作者:柴毅,1978年生,女,副教授,主要从事水生生物学研究。E-mail: chaiyi123456@126.com
