济南济西湿地公园浮游动物功能类群及其对环境因子的响应
2023-04-29商书芹贾丽王帅帅殷旭旺白海锋
商书芹 贾丽 王帅帅 殷旭旺 白海锋
摘要:研究济南济西湿地公园浮游动物的功能类群及其与环境因子的关系,了解湿地生态系统的结构与功能,可为城市湿地环境状况的评价及管理提供理论依据。于2020年4月至2021年3月在济西湿地公园6个采样点开展了浮游动物群落结构及环境因子调查,并分析了影响浮游动物功能群的主要环境因子。结果表明:济西湿地公园全年共采集到浮游动物4个大类66种,平均密度为181.8个/L,平均生物量为0.210 mg/L;浮游动物划分为7个功能群,春季、夏季、冬季均以功能群轮虫滤食者(RF)和原生动物滤食者(PF)为主,RF最高占比为62.86%(冬季)、PF最高占比为20.75%(春季),秋季以功能群RF和小型浮游动物滤食者(SCF)为主,占比分别为58.54%、12.20%;浮游动物Shannon-Wiener多样性指数、Pielou均匀度指数和Margalef丰富度指数平均值分别为2.504、0.708、2.307;综合营养状态指数水质评价结果显示济西湿地公园水质整体处于中营养化水平;环境因子与生物典范对应分析表明WT、COND、和PO[3-4]是显著影响浮游动物功能群分布的主要环境因子。
关键词:浮游动物;功能群;多样性评价;济西湿地公园
中图分类号:Q178.1 文献标志码:A 文章编号:1674-3075(2023)06-0113-09
浮游动物依赖水流作用在水体中营浮游生活,作为水生态系统的初级消费者,通过“上行下效”作用进行着系统内营养转化、能量流动和信息传递等生态过程,其种类和数量的变动会影响水体中其他水生生物的群落结构。浮游动物具有种类多、世代时间短、对环境敏感和方便采集等特点,常被选作指示河流、湖泊等水体受污染的指示生物类群(Elijah et al,2011),如在富营养化水体中,臂尾轮虫(Brachionus)、龟甲轮虫(Keratella)、剑水蚤(Cyclops)等一般作为优势种群出现(朱浩等,2020)。浮游动物对水温、溶解氧、pH、营养盐以及水体营养化程度等环境因子的变化极其敏感,能很好地评价水体质量(冯世敏等,2017;白海锋等,2021)。功能群是指存在相似结构或功能的一类物种集合体,是基于系统内相似特征或相似行为进行的物种归类(龚森森等,2022),通过功能群的研究,可以更直接地反映生态环境影响生物群落的生态过程。因此,对浮游动物功能群的研究能够更深入了解浮游动物在水体能量流动中的作用,对于分析评价水域生态系统健康状况具有重要意义(Hoeinghaus et al,2007)。
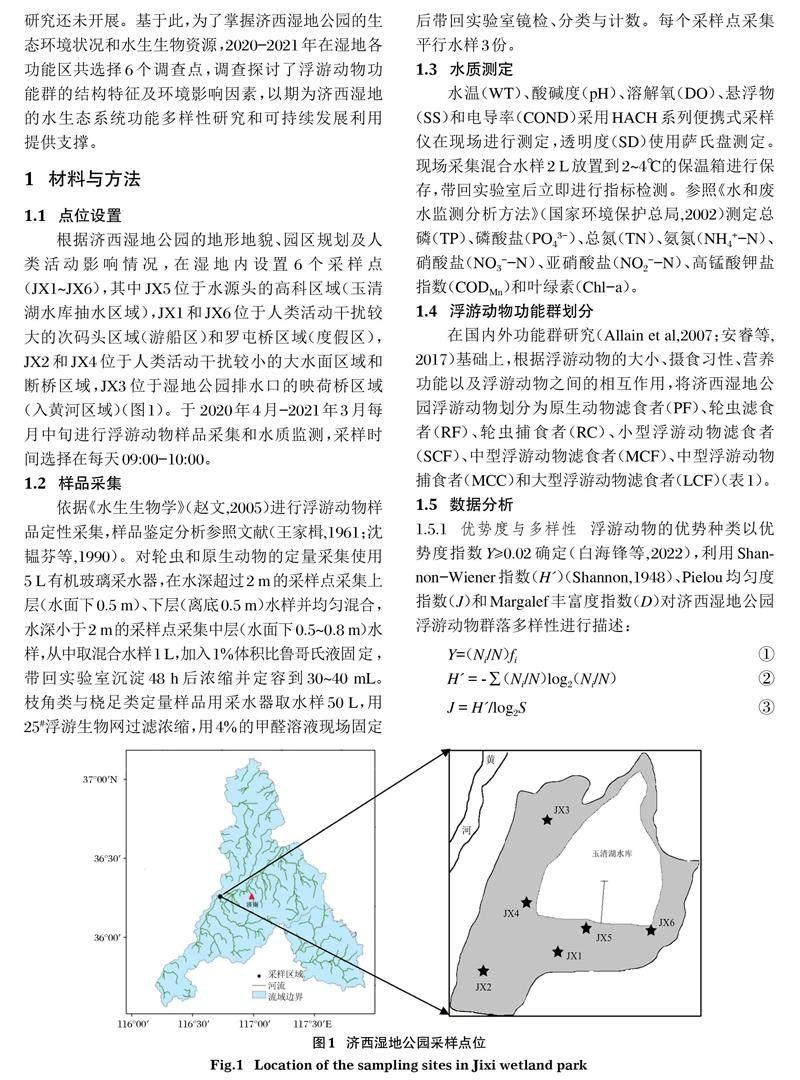
济西国家湿地公园位于山东省济南市西部城区,南临南水北调济平干渠,东临玉清湖水库,西北临黄河,属黄河流域济南段典型的城市湿地。地理坐标116°46'51.9"~116°48'53.6" E,36°38'22.2"~36°40'2.3" N,总面积约33.4 km2,一期建设已完成11.3 km2。济西湿地是平原型积水洼地,汇集了黄河、济平干渠、玉符河等丰富的地表水资源,水质清澈,湿地内河流、港汊交织形成大小岛屿近100座,水生生物丰富多样。济西湿地承担着济南市的饮用水源保护、防洪安全、生态涵养等重要功能,被称为“城市之肾”,根据规划济西湿地划分为保育区、恢复重建区、宣教展示区、合理利用区和管理服务区等区域。研究表明湿地生态系统是物质循环与能量转换的重要生态载体,亦是受人类活动干扰最为强烈的生态系统之一,特别是城市湿地(Wang et al, 2019)。因此,济西湿地的建设和维护不仅在城市生态文明建设中具有重要作用,而且在南水北调中线的生态环境保护中具有突出的地位。目前关于济西湿地水生生物资源研究报道相对较少,而对湿地浮游动物功能群的划分及分析研究还未开展。基于此,为了掌握济西湿地公园的生态环境状况和水生生物资源,2020-2021年在湿地各功能区共选择6个调查点,调查探讨了浮游动物功能群的结构特征及环境影响因素,以期为济西湿地的水生态系统功能多样性研究和可持续发展利用提供支撑。
1 材料与方法
1.1 点位设置
根据济西湿地公园的地形地貌、园区规划及人类活动影响情况,在湿地内设置6个采样点(JX1~JX6),其中JX5位于水源头的高科区域(玉清湖水库抽水区域),JX1和JX6位于人类活动干扰较大的次码头区域(游船区)和罗屯桥区域(度假区),JX2和JX4位于人类活动干扰较小的大水面区域和断桥区域,JX3位于湿地公园排水口的映荷桥区域(入黄河区域)(图1)。于 2020年4月-2021年3月每月中旬进行浮游动物样品采集和水质监测,采样时间选择在每天09:00-10:00。
1.2 样品采集
依据《水生生物学》(赵文,2005)进行浮游动物样品定性采集,样品鉴定分析参照文献(王家楫,1961;沈韫芬等,1990)。对轮虫和原生动物的定量采集使用5 L有机玻璃采水器,在水深超过2 m的采样点采集上层(水面下0.5 m)、下层(离底0.5 m)水样并均匀混合,水深小于2 m的采样点采集中层(水面下0.5~0.8 m)水样,从中取混合水样1 L,加入1%体积比鲁哥氏液固定,带回实验室沉淀48 h后浓缩并定容到30~40 mL。枝角类与桡足类定量样品用采水器取水样50 L,用25#浮游生物网过滤浓缩,用4%的甲醛溶液现场固定后带回实验室镜检、分类与计数。每个采样点采集平行水样3份。
1.3 水质测定
水温(WT)、酸碱度(pH)、溶解氧(DO)、悬浮物(SS)和电导率(COND)采用HACH系列便携式采样仪在现场进行测定,透明度(SD)使用萨氏盘测定。现场采集混合水样2 L放置到2~4℃的保温箱进行保存,带回实验室后立即进行指标检测。参照《水和废水监测分析方法》(国家环境保护总局,2002)测定总磷(TP)、磷酸盐(PO43-)、总氮(TN)、氨氮(NH4+-N)、硝酸盐(NO3--N)、亚硝酸盐(NO2--N)、高锰酸钾盐指数(CODMn)和叶绿素(Chl-a)。
1.4 浮游动物功能群划分
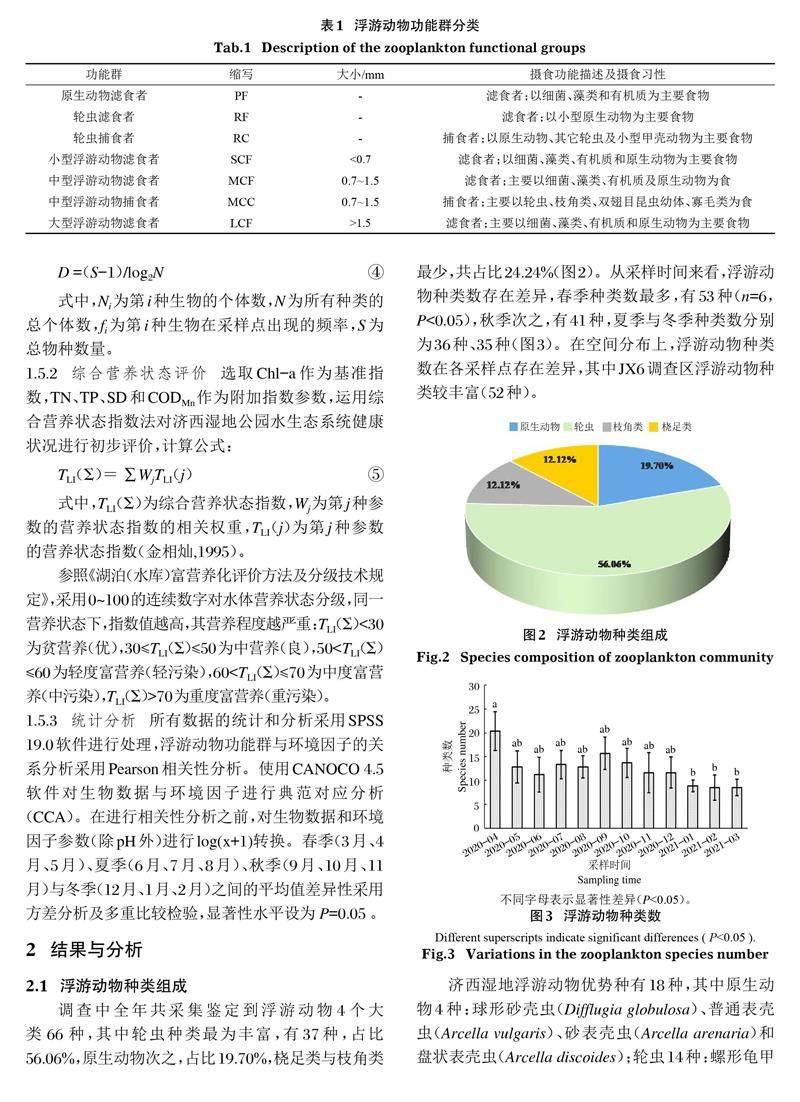
在国内外功能群研究(Allain et al,2007;安睿等,2017)基础上,根据浮游动物的大小、摄食习性、营养功能以及浮游动物之间的相互作用,将济西湿地公园浮游动物划分为原生动物滤食者(PF)、轮虫滤食者(RF)、轮虫捕食者(RC)、小型浮游动物滤食者(SCF)、中型浮游动物滤食者(MCF)、中型浮游动物捕食者(MCC)和大型浮游动物滤食者(LCF)(表1)。
1.5 数据分析
1.5.1 优势度与多样性 浮游动物的优势种类以优势度指数Y≥0.02确定(白海锋等,2022),利用Shannon-Wiener指数(H')(Shannon,1948)、Pielou均匀度指数(J)和Margalef丰富度指数(D)对济西湿地公园浮游动物群落多样性进行描述:
式中,Ni为第i种生物的个体数,N为所有种类的总个体数,fi为第i种生物在采样点出现的频率,S为总物种数量。
1.5.2 综合营养状态评价 选取Chl-a作为基准指数,TN、TP、SD和CODMn作为附加指数参数,运用综合营养状态指数法对济西湿地公园水生态系统健康状况进行初步评价,计算公式:
式中,TLI(Σ)为综合营养状态指数,Wj为第j种参数的营养状态指数的相关权重,TLI(j)为第j种参数的营养状态指数(金相灿,1995)。
参照《湖泊(水库)富营养化评价方法及分级技术规定》,采用0~100的连续数字对水体营养状态分级,同一营养状态下,指数值越高,其营养程度越严重:TLI(Σ)<30为贫营养(优),30≤TLI(Σ)≤50为中营养(良),50
1.5.3 统计分析 所有数据的统计和分析采用SPSS 19.0软件进行处理,浮游动物功能群与环境因子的关系分析采用Pearson相关性分析。使用CANOCO 4.5软件对生物数据与环境因子进行典范对应分析(CCA)。在进行相关性分析之前,对生物数据和环境因子参数(除pH外)进行log(x+1)转换。春季(3月、4月、5月)、夏季(6月、7月、8月)、秋季(9月、10月、11月)与冬季(12月、1月、2月)之间的平均值差异性采用方差分析及多重比较检验,显著性水平设为 P=0.05 。
2 结果与分析
2.1 浮游动物种类组成
调查中全年共采集鉴定到浮游动物4个大类66种,其中轮虫种类最为丰富,有37种,占比56.06%,原生动物次之,占比19.70%,桡足类与枝角类最少,共占比24.24%(图2)。从采样时间来看,浮游动物种类数存在差异,春季种类数最多,有53种(n=6,P<0.05),秋季次之,有41种,夏季与冬季种类数分别为36种、35种(图3)。在空间分布上,浮游动物种类数在各采样点存在差异,其中JX6调查区浮游动物种类较丰富(52种)。
不同字母表示显著性差异(P<0.05)。
济西湿地浮游动物优势种有18种,其中原生动物4种:球形砂壳虫(Difflugia globulosa)、普通表壳虫(Arcella vulgaris)、砂表壳虫(Arcella arenaria)和盘状表壳虫(Arcella discoides);轮虫14种:螺形龟甲轮虫(Keratella cochlearis)、矩形龟甲轮虫(Keratella quadrala)、缘板龟甲轮虫(Keratella ticinensis)、针簇多肢轮虫(Polyarthra trigla)、长肢多肢轮虫(Polyarthra dolichoptera)、唇形叶轮虫(Notholon labis)、颤动疣毛轮虫(Synchacta tremula)、卜氏晶囊轮虫(Asplanchna brightwelli)、长三肢轮虫(Filinia longisela)、暗小异尾轮虫(Trichocerca pusilla)、萼花臂尾轮虫(Brachionus calyciflorus)、角突臂尾轮虫(Brachionus angularis)、裂足臂尾轮虫(Brachionus diversicornis)、剪形臂尾轮虫(Brachionus forficula)。浮游动物种类优势度最大的是螺形龟甲轮虫(Y=0.438),在各调查点出现次数最多的是螺形龟甲轮虫和针簇多肢轮虫。
2.2 浮游动物功能群
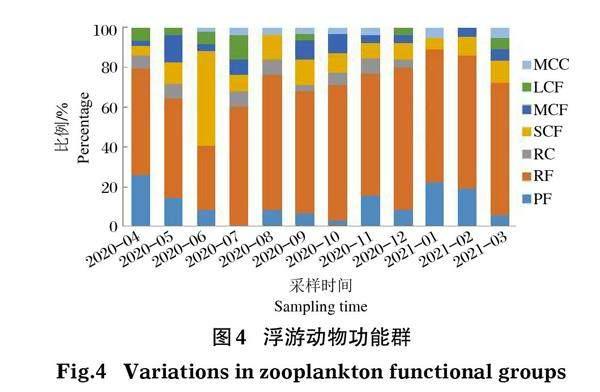
1月-12月调查中济西湿地各采样点采集到的浮游动物划分为7个功能群,其中PF13种,占比19.70%,RF34种,占比51.52%,RC3种,占比4.55%,SCF6种,占比9.09%,MCF5种,占比7.58%,LCF4种,占比6.06%,MCC1种,占比1.52%。浮游动物功能群在时间上呈季节性变化,春季以功能群RF和PF占优势,种类数占比分别为52.83%、20.75%;夏季与春季一致,RF和PF占优势,种类数占比分别为58.33%、11.11%;秋季功能群RF和SCF占优势,分别为58.54%、12.20%;冬季与春夏2季保持一致,以功能群RF和PF占优势,种类数占比分别为62.86%、17.14%。春夏季LCF多于秋冬季,MCC在4个季节中占比最小(图4)。
浮游动物密度变化范围为16.0~824.0个/L,年平均值为181.8个/L。其中,夏季浮游动物平均密度显著高于秋季(P<0.05),冬季浮游动物平均密度显著高于春季(P<0.05),密度变化趋势呈现出冬季>夏季>秋季>春季,密度最大值出现在7月份(322.2个/L)(图5)。4个季节浮游动物生物量为0.004~1.667 mg/L,年平均值为0.210 mg/L,各采样点生物量的变化趋势与密度变化趋势存在差异。其中,春季浮游动物平均生物量显著高于夏、秋、冬季浮游动物平均生物量(P<0.05),生物量变化趋势呈现出春季>秋季>夏季>冬季,生物量最大值出现在4月份(0.556 mg/L)(图6)。
2.3 浮游动物多样性
济西湿地公园浮游动物生物多样性分析结果如图7所示。浮游动物Shannon-Wiener多样性指数(H')变化范围为1.990~3.045,平均值为2.504,多样性指数季节变化趋势表现出秋季(2.656)>春季(2.595)>夏季(2.493)>冬季(2.273),季节差异不显著,4月生物多样性指数最大。Pielou均匀度指数(J)的变化范围为0.642~0.779,平均值为0.708,季节变化特征为秋季(0.715)>冬季(0.710)>春季(0.703)>夏季(0.702),差异不显著,3月均匀度指数最小。Margalef丰富度指数(D)的变化范围为1.451~3.791,平均值为2.307,季节变化特征为秋季(2.649)>夏季(2.331)>春季(2.322)>冬季(1.925),冬季与春季、夏季和秋季均存在显著差异(n=6,P<0.05),丰富度指数最大值出现在4月。
2.4 环境因子与营养状态
济西湿地公园环境因子的变化如表2所示,DO和NH4+-N全年平均达Ⅰ类水质标准,TP和CODMn全年平均达Ⅱ类水质标准,TN全年平均达Ⅲ类水质标准。随着时间变动,WT存在季节性显著差异(P<0.05),NO2--N季节差异不显著。DO、pH、COND和SD冬季均高于其他季节,SS、TN和NO3--N秋季均大于其他季节,CODMn春季最高,夏季TP、Chl-a、NH4+-N相对较高,氮磷比值年平均大于16。综合营养状态指数评价显示,济西湿地公园水体夏季处于轻度富营养化水平,春季、秋季和冬季,均处于中营养化水平。从整体来看,济西湿地公园水体呈现中营养化,污染程度为轻度,季节差异不显著。
2.5 浮游动物功能群与环境因子相关性
浮游动物功能群之间Pearson相关分析显示浮游动物7个功能群之间的相关性不明显(表3),而浮游动物功能群与环境因子之间Pearson相关分析显示浮游动物功能群密度与14个环境因子中的WT、COND、DO、NO2- -N、TP、PO43-、SS及Chl-a具有显著的相关性(P<0.05)。其中,浮游动物功能群SCF同COND 为极显著负相关(n=6,P<0.01),同NO2- -N为极显著正相关(P<0.01),WT和TP与浮游动物功能群SFC为显著正相关(P<0.05),DO与浮游动物功能群SFC为显著负相关(P<0.05);浮游动物功能群LCF同PO43--P为显著正相关(P<0.05),浮游动物功能群MCF同SS为显著负相关(P<0.05),浮游动物功能群PF同Chl-a为显著负相关(P<0.05)(表4)。
对浮游动物功能群的时空分布进行去趋势分析(DCA),排序结果显示4个轴最大长度大于4,属于单峰型模型,使用典范对应分析(CCA)对浮游动物功能群与Pearson相关分析筛选出来的8个主要环境因子进行分析。CCA排序表明2个排序轴物种与环境因子之间的相关系数均为1,表明排序结果可靠,能够很好地反映出浮游动物与环境因子之间的相互关系。排序分析结果显示,环境因子中WT、COND和PO43-是显著影响浮游动物功能群时空变化的主要环境因子(P<0.05)(图8)。
3 讨论
3.1 浮游动物群落结构变化特征
本研究结果显示济西湿地公园浮游动物物种组成以普生性小型浮游动物(轮虫―原生动物)为主,占总种类数的3/4,大型浮游动物种类数所占比例相对较低,这与国内许多水体浮游动物种类组成结构相似,具有典型的湖泊、湿地浮游动物群落结构特征(李强等,2015;白海锋等,2022),而且与济南地区水域调查结果(种类组成)存在一致性(曹龙智等,2019;刘麟菲等,2019;相华等,2021)。有研究表明在相对静态的水体中,浮游动物存在小型化趋势及季节性演替特征,小型浮游动物中的轮虫类生活史为孤雌生殖,此方式能在较短的时间内达到较高的繁殖率,使其在适宜温度下种类数量能够快速增加,从而首先占据更多的生态空间,成为群落优势种,因此在水域生态系统中浮游动物通常以轮虫类占主导(Pandey & Upadhyay,2013)。济西湿地浮游动物趋于小型化,主要与水体的营养变化和鱼类的摄食压力相关,已有研究表明水体富营养化和营养盐结构的改变使水域浮游植物群落构成趋于小型化,进而通过食物链的传递效应引起摄食者浮游动物的小型化(Lee et al,2015)。鱼类摄食压力大的水体浮游动物主要以小型轮虫和小型枝角类为主,而鱼类摄食压力较小的水体以大型桡足类和枝角类占优势(苗腾等,2013;习丽红等,2015)。济西湿地公园每年对观赏鱼类(如锦鲤、金鱼等)进行增殖放流,由于其食性为杂食性和滤食性,可通过食物链对浮游动物群落的演替产生较大影响。在季节变化中,夏冬季浮游动物种类组成相对较简单,这主要与夏季人类频繁的活动增加了水体中营养盐和有机质含量,以及冬季较低的水温和夏季持续的降水改变了浮游动物生存环境,进而对浮游生物的群落结构造成影响(赵睿智等,2020)。桡足类无节幼体是济西湿地公园浮游动物中出现频率较多的一类,无节幼体主要以水体中悬浮的细菌为食,细菌资源量的多寡直接影响无节幼体的生物量(Lewandowska et al,2014)。调查研究显示,无节幼体在春夏季占据优势,其现存量也相对较大,主要因为春秋季适宜的温度促进了细菌的生长,大量繁殖的细菌为无节幼体提供了丰富食物。
3.2 浮游动物功能群特征及多样性
从时间上看,济西湿地公园浮游动物功能群季节变化不显著,春季、夏季和冬季均以功能群RF和PF为主,秋季SCF替代了PF成为了优势功能群,功能群RF在全年4个季节均出现。浮游动物功能群PF适宜生活在寡污性水体中,在春季、夏季和冬季功能群PF占优势,说明秋季湿地公园水质相对较好,主要由于秋季水温很适合大部分藻类的生长繁殖,尤其是硅藻和绿藻。浮游动物功能群SCF以滤食细菌、藻类、有机质和原生动物为主,其滤食效率取决于食物粒径,尤其与藻类的大小(粒径)有关。秋季浮游藻类主要以单细胞绿藻为主,其适口性(粒径范围2~5 μm)促进了功能群SCF占优势。在浮游动物群落结构研究中,通常用多样性指数来判断水质状况,多样性指数、均匀度指数和丰富度指数越高,水生态系统越稳定,水质越好(刘钢等,2018)。调查显示,浮游动物多样性存在季节差异,春季随着温度的升高,光照强度增加,浮游生物的生长速度加快,休眠卵漂浮水面孵化,种类数量迅速增加,促进了多样性提高。在济西湿地公园的浮游动物优势种群中,出现了多种富营养水体的耐污种,如臂尾轮虫、龟甲轮虫和多肢轮虫等(白海锋等,2022),这表明济西湿地公园水体受到了一定污染,存在富营养化问题。依据营养状态指数和多样性指数对济西湿地公园水体进行评价(金相灿,1995;郑丙辉等,2007),结果显示济西湿地公园水体处于中营养水平,水体污染程度为轻度,其水质状况相对优于济南大明湖水体和小清河流域(李莹,2022)。地理位置差异、自净能力大小和人类活动干扰强弱对城市水体的水质污染程度和营养化水平都存在很大的影响。
3.3 浮游动物功能群与环境因子的关系
水生态系统中环境因子的改变,驱动浮游动物的群落不断进行适应性演替,借助演替模型可有效预警水环境的变化。本研究典范对应分析表明,水温是影响济西湿地公园浮游动物功能群时空分布的主要环境因子之一,这与王帅帅等(2017)对济南地区主要水域的浮游动物调查研究结果一致。水温是水域生态系统中影响生物群落结构组成的主要影响因子,水温的变化对浮游动物的生长、繁殖以及休眠卵的孵化等影响极为显著(彭水秀等,2019)。此外,水温通过影响浮游植物的生长和分布,上行效应到浮游动物,驱动浮游动物群落结构和时空分布。本研究显示浮游动物密度和生物量在春冬季相对较高,这可能是不同类群的浮游动物对水温的适应性存在差异,适宜的温度可缩短其发育时间,超出适宜温度反而会对其生长繁殖产生影响。电导率一般用来反映水中溶解的无机物和有机物含量,与浮游植物的叶绿素浓度具有显著相关性(Jiang et al,2017),电导率通过影响水体中浮游植物的群落结构来驱动浮游动物的时空分布(陆欣鑫等,2014;Zhao et al,2020)。有学者研究认为,电导率与湿地周边土地利用类型(居民用地、商业用地等)有极高的相关性,能够较好地反映出通过径流进入水体的离子总量,在城镇化发展较快的地区特别显著(Ren et al,2003)。调查显示,电导率春、冬季高,夏、秋季低,与季节温度变化呈负相关。电导率的季节变化可能与水位及水体的更换量有关,夏、秋季水量充沛,降雨和径流对水体的离子含量起到了稀释作用,而春、冬季较高浓度的离子对维持浮游动物细胞的酸碱平衡和渗透压具有重要影响。磷是浮游植物生长代谢所必需的元素,水体中其含量的升高或降低都会影响浮游植物的生长及群落的演替,通过浮游植物的上行效应间接影响浮游动物的生长及时空分布。济西湿地公园具有生态服务的功能,其价值大小存在季节性,春、夏、秋季较强的人类活动和相对较多的径流注入,导致水体中营养盐含量增加,为浮游动物的生长繁殖提供了有利条件,促进了浮游动物的数量增加,但也导致一些耐污性小型浮游甲壳动物成为优势种群(温周瑞和谢平,2013),增加了生物群落结构单一化风险,对湿地水生态和水资源安全构成威胁,这与济西湿地公园周边城市快速化发展有关。因此,减少水污染、降低人为干扰、提高湿地生境多样性是提高生物群落稳定性和保护湿地生态环境的重要举措。
参考文献
安睿,王凤友,于洪贤,等,2017. 三环泡湿地浮游动物功能群季节变化及其影响因子[J]. 生态学报,37(6):1851-1860.
白海锋,孔飞鹤,王怡睿,等,2021. 北洛河流域浮游动物群落结构时空特征及其与环境因子相关性[J]. 大连海洋大学学报, 36(5):785-795.
白海锋,宋进喜,龙永清,等,2022. 红碱淖浮游动物群落结构特征及其与环境因子的关系[J]. 生态与农村环境学报,38(8):1064-1075.
曹龙智,郭伟,王帅帅,等,2019. 黄河流域和淮河流域济南段浮游动物群落结构多样性及水质健康评价[J]. 水产科技情报,46(4):230-233,240.
冯世敏,吴明姝,熊莲,等,2017. 太平湖浮游动物动态演替与环境因子的相关性研究[J]. 水生生物学报,41(3):700-711.
龚森森,李雪梅,吴嘉伟,等,2022. 湖北长湖夏、秋季浮游生物功能群特征及主要影响因子[J]. 水生生物学报,46(5):707-717.
国家环境保护总局,2002. 水和废水监测分析方法[M]. 北京:中国环境科学出版社.
金相灿,1995. 中国湖泊环境[M]. 北京:海洋出版社.
李强,田华,姜民,等,2015. 淀山湖浮游动物群落结构特征及其影响因子[J]. 水生态学杂志,36(4):69-77.
李莹,2022. 济南典型水生态系统浮游生物群落结构及水生态健康评价[D]. 大连: 大连海洋大学.
刘钢,孟云飞,吴丹,等,2018. 青藏高原可鲁克湖浮游动物群落结构特征及水质评价[J]. 大连海洋大学学报,33(3):379-386.
刘麟菲,徐宗学,殷旭旺,等,2019. 济南市不同区域水生生物与水环境因子的响应关系[J]. 湖泊科学,31(4):998-1011.
陆欣鑫,刘妍,范亚文,2014. 呼兰河夏秋两季浮游植物功能分组演替及其驱动因子[J]. 生态学报,34(5):1264-1273.
苗腾,高健,陈炳辉,等,2013. 惠州西湖生态修复对浮游甲壳动物群落结构的影响[J]. 生态科学,32(3):324-330.
彭水秀,张坤,邓道贵,等,2019. 南漪湖春夏季浮游植物群落结构及其与环境因子的关系[J]. 生物学杂志,36(1):35-38,47.
沈韫芬,章宗涉,龚循矩,等,1990. 微型生物监测新技术[M]. 北京:中国建筑工业出版社.
王家楫,1961. 中国淡水轮虫志[M]. 北京:科学出版社.
王帅帅,王博涵,金文,等,2017. 济南地区丰水、枯水期浮游动物的群落结构特征[J]. 水产学杂志,30(2):26-30.
温周瑞,谢平,2013. 太湖梅梁湾、贡湖湾水质与浮游甲壳动物密度季节变化[J]. 长江大学学报(自然科学版),10(17):36-51.
习丽红,李慧明,林秋奇,等,2015. 热带富营养水库敞水区浮游动物群落结构与季节变化:以广东大沙河水库为例[J]. 湖泊科学,27(6):1049-1058.
相华,贾丽,冯新华,等,2021. 济南地区浮游动物群落结构与环境因子关系研究[J]. 人民黄河,43(S1):80-82,84.
赵睿智,赵红雪,邱小琮,2020. 黑河干流浮游动物与水环境因子关系的多元分析[J]. 水生态学杂志,41(6):81-88.
赵文,2005. 水生生物学[M]. 北京:中国农业出版社.
郑丙辉,田自强,张雷,等,2007. 太湖西岸湖滨带水生生物分布特征及水质营养状况[J]. 生态学报,27(10):4214-4223.
朱浩,刘兴国,陈晓龙,等,2020. 鲥鯸淀浮游动物群落特征及水质评价[J]. 水生生物学报,44(6):1313-1321.
Allain J B, Kerri F, Beatrix E B, 2007. Functional diversity of crustacean zooplankton communities: towards a trait-based classification[J]. Freshwater Biology,52:796-813.
Elijah O O, Mucai M, Charles C N, et al, 2011. Zooplankton partitioning in a tropical alkaline-saline endorheic Lake Nakuru, Kenya: Spatial and temporal trends in relation to the environment[J]. Lake & Reservois: Research and management, 16:35-47.
Hoeinghaus D J, Winemiller K O, Agostinho A A, 2007. Landscape-scale hydrologic characteristics differentiate patterns of carbon flow in large-river food webs[J]. Ecosystems,10(6):1019-1033.
Jiang W, Zhou C, Ji D B, et al, 2017. Comparison of relationship between conduction and algal bloom in Pengxi River and Modao River in Three Gorges Reservoir[J]. Environmental Science,38(6):2326-2335.
Lee Y C, Park M O, Jung J, et al, 2015. Taxonomic variability of phytoplankton and relationship with production of CDOM in the polynya of the Amundsen Ses, Antarctica[J]. Deep-Sea Research II,123:30-41.
Lewandowska A M, Hillebrand H, Lengfellner K, et al, 2014. Temperature Effects on Phytoplankton Diversity: The Zooplankton Link[J]. Journal of Sea Research,85:359-364.
Pandey A, Upadhyay H C, 2013. Studies on zooplankton diversity of western Ramganga River in Almora (Uttarakhand) India[J]. Int J Sci Res,5(5):1192-1194.
Ren W W, Zhong Y, Meligrana J, et al, 2003. Urbanization, landuse, and water quality in Shanghai 1947-1996[J]. Environment International,29:649-659.
Shannon C E,1948. The mathematical theory of communication [J]. Bell System Technical Journal,27(3):379-423.
Wang M Y, Liu R H, Wang Y, et al, 2019. Temporal and spatial distribution of main contaminations and eutrophication assessment in wetlands of Ziya River Basin[J]. Periodical of Ocean University of China,49:93-100.
Zhao G N, Pan B Z, Li Y P, et al, 2020. Phytoplankton in the heavy sediment-laden Weihe River and its tributaries from the northern foot of the Qinling Mountains: Community structure and environmental drivers[J]. Environmental Science and Pollution Research International,27(8):8359-8370.
(责任编辑 张俊友 熊美华)
Zooplankton Functional Groups and Their Response to Water Physiochemical
Factors in Jixi Wetland Park in Jinan
SHANG Shu‐qin1, JIA Li1, WANG Shuai‐shuai1, YIN Xu‐wang2, BAI Hai‐feng3,4
(1. Jinan Hydrology Center, Jinan 250014, P.R. China;
2. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, P.R. China;
3. Shaanxi Institute of Geo-environment Monitoring, Xi'an 710054, P.R. China;
4. Yellow River Institute of Shaanxi Province, Xi'an 710127, P.R. China)
Abstract:Jixi wetland park is a typical urban wetland located in the urban area of west Jinan City, providing drinking water for Jinan City, flood control and ecological conservation. In this study, we explored the characteristics of zooplankton functional groups as well as their relationship with the physiochemical factors in Jixi wetland park. The objectives were to understand the structure and function of the wetland ecosystem and provide theoretical support for evaluating and managing water quality in Jixi wetland. From April 2020 to March 2021, zooplankton sampling and environmental monitoring was conducted monthly at six representative sampling sites (JX1-JX6) in Jixi wetland. A total of 66 zooplankton species were collected during the investigation and divided into 7 functional groups (PF: protozoan filter feeders, RF: rotifer filter feeders, RC, rotifer carnivores; SCF: small copepods and cladocera filter feeders, MCF: middle copepods and cladocera filter feeders, MCC: middle copepods and cladocera carnivores, LCF: large copepods and cladocera carnivores). Zooplankton density and biomass were in the ranges of 16.0 -824.0 ind/L and 0.004 -1.667 mg/L, with average annual values of 181.8 ind/L and 0.210mg/L. Groups RF (rotifer filter feeders) and PF (protozoan filter feeders) were dominant in spring, summer and winter, and the highest proportion of group RF (62.86%) was in winter, and the highest proportion of group PF (20.75%) was in spring, and group RF (rotifers filter feeders) (58.54%) and SCF (small copepods and cladocera filter feeders) (12.20%) were dominant in autumn. The mean value of the Shannon-Wiener diversity index, Pielou evenness index and Margalef richness index of the zooplankton community were 2.504, 0.708 and 2.307, respectively. The water quality was evaluated using the comprehensive trophic level index and the results show that the water quality of Jixi wetland was mesotrophic. Canonical correspondence analysis shows that WT, COND and PO43- were the environmental factors significantly affecting zooplankton functional groups. This study will help guide ecological effect assessment and water resource protection of Jixi wetland.
Key words:zooplankton; functional groups; diversity assessment; Jixi wetland park
收稿日期:2022-09-27 修回日期: 2023-06-19
基金项目:国家自然科学基金项目(41977193)。
作者简介:商书芹,女,1978年生,高级工程师,从事水文生态学研究。E-mail: 316796647@qq.com
通信作者:殷旭旺。E-mail: yinxuwang@dlou.edu.cn
白海锋。E-mail: baihaifeng2002@126.com
