三江并流区澜沧江干流捕食线虫真菌的水陆分布模式探究
2023-04-29张欣张发邓巍杨晓燕李娜肖文
张欣 张发 邓巍 杨晓燕 李娜 肖文

摘要:为研究三江并流区澜沧江干流水、陆生境中的捕食线虫真菌(Nematode-Trapping Fungi,NTF)多样性分布差异,在该区域布设9个采样区对NTF进行调查,并分析NTF在澜沧江流域不同空间尺度下的水陆分布模式。每个样区设置水、陆对称采样点各5个,每个采样点用5点法采集水、陆样品各1份,共采集90份样品。采用单孢子挑离法获得NTF纯培养,结合形态学和分子生物学方法鉴定物种。共获得2属13种76株NTF,其中陆生土壤中检出2属11种49株,水体底泥中检出1属6种27株。结果显示,NTF物种组成在三江并流区澜沧江干流水、陆生境间存在较大差异,具有水陆异质性分布模式,干流陆地上具有比水生环境中更高的物种检出率和物种多样性;此外,与之前对澜沧江支流NTF的水陆分布研究结果相比,NTF在干流上水陆分布差异比支流更大,表明在流域生态系统中,NTF的监测结果同时也能反映不同空间尺度下的环境异质性,以流域为研究单元,以NTF为研究对象,可能更有助于了解微生物的空间分布格局。
关键词:捕食线虫真菌;多样性分布;水陆关系;澜沧江流域
中图分类号:Q938.1 文献标志码:A 文章编号:1674-3075(2023)06-0128-08
微生物多样性的空间分布模式一直是生态学以及生物地理学尝试回答的问题。此前已有研究从纬度、海拔、区域、全球等视角下探究了许多微生物类群的多样性空间分布格局(Tedersoo et al, 2014;Hu et al,2019;Hu et al,2020;Kraemer et al,2020),但由于微生物自身的特性,微生物多样性的空间格局研究相较动植物更易受到研究区域、空间尺度、研究技术和研究类群选择等因素的影响,导致目前对微生物的空间分布格局及其驱动机制还未能形成相对统一的认识。
传统生态位理论认为,高度的环境异质性能够塑造更丰富的生物多样性,生物多样性是探究生物空间分布格局的重要前提,而环境异质性也是形成生物异质性地理分布的先决条件(陈玉福和董鸣,2001;苏婕,2019)。基于此,有学者提出在空间异质性强、生物多样性高的区域,以流域为单元开展微生物多样性格局的研究可能有助于更好理解微生物空间格局及驱动机制(Carnevali et al,2021;Yang et al,2021)。流域的形成既能反映历史地质变迁过程、河流的屏障和联通作用(Clark et al,2004;Oliveira et al,2017),又能体现水流造成的环境异质性,因此,以流域为单元开展生物多样性研究不仅能综合反映驱动生物多样性形成、维持的各种复杂生物与非生物因素之间的综合作用,还能够耦合水、陆地生态系统(邓红兵等,1998;陈求稳和欧阳志云,2005)。有研究发现,微生物在流域尺度下是存在异质性分布格局的(Liu et al,2015;Yang et al,2021),流域尺度下水生生态系统和陆地生态系统间的环境异质性的差异很可能也会对微生物的分布造成影响,而捕食线虫真菌(Nematode-Trapping Fungi,NTF)在高环境异质性和生物多样性的三江并流区的澜沧江支流上是存在水陆分布差异的(张欣等,2022)。考虑到NTF是全球广泛分布的微生物类群,在该区域存在这种支流上的水陆分布差异,不仅说明选择以流域尺度开展微生物空间格局研究的科学性,也体现了高环境异质性和生物多样性对微生物空间格局研究的重要性。
尽管现代分子生物学技术的发展在一定程度上解决了微生物多样性评估问题,但即便是采用最精确的测序技术也仍然无法很好解决稀有微生物类群的问题(Oono,2017)。因此,结合传统的微生物纯培养技术开展一些微生物小类群的多样性格局分析并理解驱动机制,也是推进微生物生态学研究的必要手段(Chase & Marting,2018)。选择一个生态功能重要、与其他类群相互作用力强,易于分离纯化和鉴别的微生物类群,是开展纯培养视角下微生物空间格局研究的关键(Chase & Marting,2018)。NTF是一类兼具腐生和肉食特性,可直接调控水陆环境中线虫密度,间接影响细菌和土壤尿素含量的小类群广布真菌(Wang et al,2014),该类真菌易分离纯化,低倍镜下可见,容易鉴别(Zhang et al,2014),是纯培养视角下微生物多样性空间分布格局研究的理想对象。
本研究在前期对三江并流区澜沧江支流NTF分布格局研究(张欣等,2022)的基础上,继续探究该区域澜沧江干流NTF多样性的水、陆间分布模式,进一步比较澜沧江干、支流生境中NTF水、陆分布差异,以验证流域视角下开展微生物分布格局研究的科学性。
1 材料与方法
1.1 研究区域概况
澜沧江(21°08′~29°15′ N, 98°36′~102°19′ E)发源于青海省唐古拉山北麓,由德钦县佛山乡进入云南境内,与怒江、金沙江上游共同构成了三江并流奇观。其流经的横断山区,是世界生物多样性热点区域之一,该区域云集了多种气候类型,地形地貌复杂,整体物种多样性和丰富度均处于较高水平(陈矼等,2004;庄鸿飞,2018)。处于三江并流区的澜沧江流域海拔落差大,垂直立体气候明显,环境异质性较高,被认为是世界上生物多样性最丰富的地区之一(顾纯等,2019),也是流域视角下探究微生物空间分布格局的理想区域。
1.2 样品采集
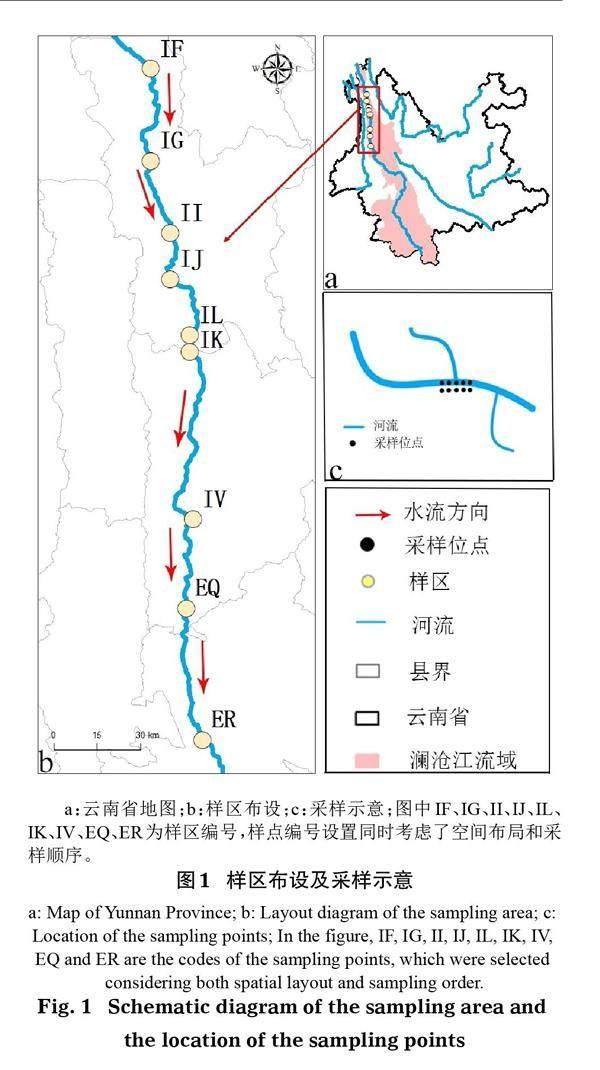
经过系统的样区布设和实地观察,于三江并流区澜沧江干流设置了9个采样区,于枯水期进行了样品采集。每个采样区选取后,以其地理坐标为原点,在其上游10、20 m和下游10、20 m处布设陆地采样点,同时设置与陆地采样点距离不小于5 m的水体采样点(图1)。每个样点用五点采样法采集样品1份,即每个样区采集水体底泥和陆地土壤样品各5份,所有样区共采集90份样品。样品置于一次性自封袋,标记样点编号、采样时间、海拔、经纬度、水陆等样品信息,采集好的样品立刻送回实验室后一周内完成土壤样品的撒样。
1.3 NTF分离、纯化
1.3.1 培养基的制备 本研究所需培养基主要为玉米培养基(CMA,Cornmal Agar Medium)、土豆培养基(PDA,Potato Dextrose Agar Medium)以及燕麦培养基,配制方法参照文献(Zhang et al,2014)进行。
1.3.2 诱饵线虫的培养及线虫悬浮液的制备 将全齿复活线虫(Panagrellus redivivus)接入燕麦培养基,放恒温培养箱(26.5±1)℃培养1周,直到观察到线虫爬壁即可取出备用或放4℃冰箱保存。采用贝尔曼氏漏斗法制备线虫悬浮液(Giuma & Cooke, 1972)。
1.3.3 NTF的分离纯化 取直径为90 mm的CMA培养基平板,取土壤样本0.5~1 g均匀地撒在CMA上(撒样时,应注意在样品之间留有空隙),加入线虫悬浮液2 mL(约5 000条),每份土样设3个重复。室温下培养4周,体视显微镜下进行镜检。
观察到NTF孢子后,用无菌牙签挑取单个真菌孢子到直径为60 mm的CMA培养基上,用自制保鲜膜封口,置于(26.5±1)℃恒温培养箱中培养1周。
1.4 NTF鉴定
1.4.1 形态学鉴定 采用插片法制作NTF临时装片(苏鸿雁等,2006),用奥林巴斯BX53微分干涉显微镜拍取分生孢子、孢子梗、厚垣孢子和捕食器官等形态特征。参照《Nematode-Trapping Fungi》(Zhang et al, 2014)和《中国真菌志·三十三卷》(张克勤和莫明和,2006)进行形态学鉴定。
1.4.2 分子生物学鉴定 NTF菌丝在PDA上富集培养后,参照文献(Jeewon et al, 2002)进行DNA的提取,以真菌通用引物ITS1 / ITS4(White et al, 1990)和RPB1-DF2asc(Hofstetter et al, 2007)/ RPB1-G2R(Stiller & Hall, 1997)分别扩增ITS(internal transcribed spacer region of the ribosomal RNA gene,核糖体RNA上的非转录间隔区)和RPB2(RNA polymerase II core subunit,RNA聚合酶II核心亚基编码基因)序列。获得测序结果后,在美国国家生物技术信息中心NCBI(https://www.ncbi.nlm.nih.gov/)中通过ITS及RPB2序列同源性比对进行分子生物学鉴定。
1.5 数据处理
使用EXCEL和R语言对数据进行整理及分析。计算水、陆及全部样品中的物种检出率,计算公式为:
总检出率=(检出NTF的样品数/总样品数)×100%
水检出率=(检出NTF的水体底泥样品数/总水体底泥数)×100%
陆检出率=(检出NTF的陆地土壤数/总陆地土壤数)×100%
物种检出率=(检出某物种的样品数/总样品数)×100%
对水、陆及总体NTF物种多样性指数进行计算,比较水、陆间物种多样性差异,Shannon-Wiener多样性指数(H′)计算公式为:
式中:H′为物种多样性指数;Pi 为第i个种所占百分数;S为采样点的物种数。
应用RStudio1.3.1093中的“VennDiagram”包绘制水陆间物种组成韦恩图,使用Adobe Photoshop 2019将所得韦恩图组合在一张图上,比较各样区对称水、陆采样点间物种组成差异。
2 结果
2.1 研究区域内NTF检出概况
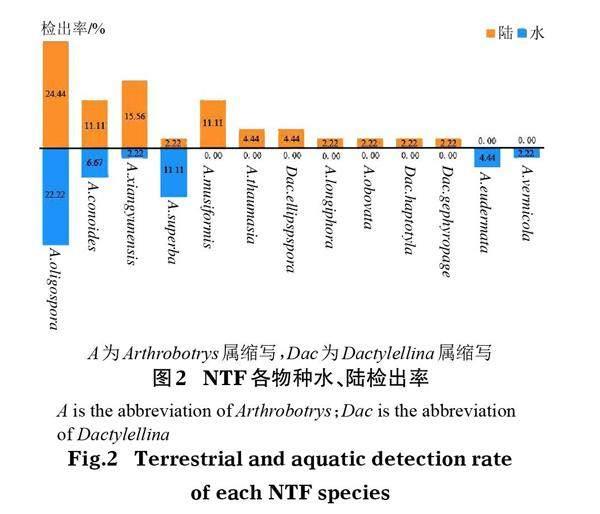
经过形态学与分子生物学鉴定(表1),在澜沧江流域干流中,共分离到2属13种76株NTF。其中,陆地土壤中共检出2属11种49株,水体底泥中共检出1属6种27株(图2)。
2.2 各样区水陆物种检出率和多样性比较
研究区域内,陆地土壤中总检出率为55.56%,物种多样性指数为1.91;水体底泥中总检出率为46.67%,物种多样性指数为1.45。其中,IF样区水陆样品的物种检出率相等,IK、IL、ER 3个样区水体底泥中的物种检出率高于陆地土壤,II、IJ、IG、IV、EQ 5个样区陆地土壤的物种检出率高于水体底泥;所有样区陆地土壤中的物种多样性均高于水体底泥(表2)。
2.3 澜沧江干流各样区对称水陆间物种组成差异
干流各样区的对称水、陆样点间的物种组成存在较大的差异:ER、IL两个样区水、陆间物种组成完全不同,且ER陆地土壤中检出物种数高于水体底泥,IL样区的对称水、陆间检出物种数相同;IJ、IF、IK和II 4个样区的对称水陆间物种组成存在差异的同时也存在一定的相似性,且均为陆地土壤中的物种数高于水体底泥;IV、IG和EQ 3个样区水体底泥中的物种是陆地土壤中物种的子集(图3)。
3 讨论
3.1 三江并流区澜沧江干流的NTF水陆分布差异
研究结果显示,三江并流区澜沧江干流的NTF在种、属层面都存在明显的水陆分布差异,陆地土壤中NTF的物种检出率和多样性明显高于水体底泥。在巨大的海拔落差(1 200~5 000 m)(游珍等,2014)下,该区域澜沧江干流的流速较快,河流营养物沉积困难,微生物不易停留和定植,再加上海拔落差导致的水流不均质性等可能是驱动该区域NTF水陆分布差异较大的主要环境因素。而陆生土壤可以容纳几乎所有的微生物,对于微生物的生长繁殖极为重要(李德新,2003),因此,在澜沧江干流陆地上具有较水体底泥更高的NTF物种多样性。在属水平上,产黏性菌网的Arthrobotrys属真菌是绝大多数生境中的优势属,A.oligospora则是相应生境的优势物种(Niu & Zhang,2011;Zhang et al,2014),本研究结果也支持了这一点。Arthrobotrys属真菌在澜沧江干流陆地土壤和水体底泥均有分布,而黏球和非收缩环的Dactylellina属NTF只出现在陆地土壤中,该属真菌具有营养要求高、腐生能力弱、生长缓慢等特点,生物量小且多分布在土壤深层,所以其被带入水生生态系统的概率就比较小,检出率也随之减小,表明与水生环境相比,陆地环境可能更适合NTF 的生长,特别是一些分布范围较小的物种。
3.2 澜沧江干流NTF的水陆关系
从各样区物种检出情况来看,澜沧江干流各样区对称水陆间物种组成存在较大差异:在9个样区中仅有一个样区水体底泥中检出物种数高于陆地土壤,其余样区均为陆地土壤检出物种数高于水体底泥;有2个样区的对称水陆生境间物种组成完全不同;4个样区水陆间既存在共有种,也有其水、陆特有物种;3个样区水体底泥中检出物种是陆地土壤检出物种的子集。三江并流区澜沧江干流多为深切的高山峡谷,河流在海拔的最低处,陆地土壤与水体间的环境异质性较高,奔流在高山峡谷间的澜沧江干流的水陆落差非常大,水体中微生物难以通过地下水系统横向运输扩散到河岸,再加上支流汇入带入的物种,使得干流水陆间物种组成的相似度大大降低。然而,即便水陆间的物种组成存在较大差异,仍然有7个样区对称水陆间物种组成具有一定的相似性,这表明在流域这样一个具有明显边界的生态系统内,水陆生境间高度的环境异质性会显著增加环境对微生物的选择作用,但水陆生境仍会通过地表水循环形成一定的关联性。
3.3 以流域为单元更容易发现微生物空间分布格局
NTF在全球不同生境中广泛分布(Zhang et al,2014),之前在云南省开展的一系列NTF资源调查结果(毕廷菊等,2000;章靖等,2005),均呈现出随机分布的特点,因此,要发现其分布格局可能需要充分考虑研究单元的选择。而基于云南六大流域尺度的系统抽样发现,NTF在中上和中下层面都具有流域分布特征(Yang et al,2021),同时,对三江并流区澜沧江支流的调查结果也发现,NTF在支流尺度下是非随机分布的(张欣等,2022),本研究在澜沧江干流发现了更明显的水陆差异。这一方面说明,以流域为尺度,无论是在较大尺度(流域间)还是在较小尺度(流域内),都能发现NTF的空间分布格局;同时也说明,流域内的环境异质性强度、水流联通性和阻隔都能在NTF的水陆分布模式上体现;此外,环境异质性越强的区域,NTF的异质性分布就更明显。对大尺度流域中真菌和细菌群落的多样性调查结果也都显示出流域分布格局(Liu et al,2019;Carnevali et al,2021;Crump et al,2007;Kraemer et al,2020;Wu et al,2013),由此认为,以流域为单元是开展微生物多样性格局研究的理想选择。
参考文献
毕廷菊, 张克勤, 李文鹏,2000. 云南省捕食线虫真菌资源调查[J]. 云南大学学报(自然科学版), (1):73-77.
陈矼, 曹礼昆, 陈阳,2004. 三江并流的世界自然遗产价值——景观多样性[J]. 中国园林, 20(1): 22-26.
陈求稳, 欧阳志云,2005. 流域生态学及模型系统[J]. 生态学报, (5): 242-248,297-298.
陈玉福, 董鸣,2001. 生态学系统的空间异质性[J]. 生态学报, 23(2):346-352.
邓红兵, 王庆礼, 蔡庆华,1998. 流域生态学——新学科、新思想、新途径[J]. 应用生态学报, (4): 108-114.
顾纯, 李小龙, 张胜邦, 等,2019. 澜沧江, 一条南流大江的魅力[J]. 森林与人类, (8): 24-29.
李德新,2003. 土壤, 微生物的大本营[J]. 科学大众,(4): 13.
苏鸿雁, 李明, 刘晓轩,2006. 捕食线虫真菌玻片制作方法的改进[J].大理学院学报(自然科学), (6): 25-26,30.
苏婕,2019. 珠江口中华白海豚价值评估及其空间分布[D].厦门:厦门大学.
游珍, 封志明, 姜鲁光, 等,2014. 澜沧江-湄公河流域人口分布及其与地形的关系[J]. 山地学报, 32(1):21-29.
章靖, 莫明和, 邓敬石, 等,2005. 云南西部地区的捕食线虫真菌[J]. 云南大学学报(自然科学版), (1): 71-76.
张克勤,莫明和,2006. 中国真菌志?第三十三卷?节丛孢及相关属[M]. 北京:科学出版社.
张欣, 邓巍, 朱娅佼, 等,2022. 澜沧江两条支流捕食线虫真菌水陆分布差异及关联性初探[J]. 生态学报, 42(12):5059-5066.
庄鸿飞,2018. 三江并流自然遗产地代表物种的优先保护研究[D]. 太原: 山西大学.
Carnevali P B M, Lavy A, Thomas A D, et al,2021. Meanders as a scaling motif for understanding of floodplain soil microbiome and biogeochemical potential at the watershed scale[J]. Microbiome, 9(1): 1-23.
Chase A B, Martiny J B,2018. The importance of resolving biogeographic patterns of microbial microdiversity[J]. Microbiology Australia, 38(4): 204-205.
Clark M K, Schoenbohm L M, Royden L H, et al,2004. Surface uplift, tectonics, and erosion of eastern Tibet from large-scale drainage patterns[J]. Tectonics, 23(1): TC1006, doi:10.1029/2002TC001402.
Crump B C, Adams H E, Hobbie J E, et al,2007. Biogeography of bacterioplankton in lakes and streams of an arctic tundra catchment[J]. Ecology, 88(6): 1365-1378.
Giuma A Y, Cooke R C,1972. Some endozoic parasites on soil nematodes[J]. Transactions of the British Mycological Society, 59(2): 213‐218.
Hofstetter V, Miadlikowska J, Kauff F,et al,2007. Phylogenetic comparison of protein-coding versus ribosomal RNA-coding sequence data: a case study of the Lecanoromycetes (Ascomycota) [J]. Molecular phylogenetics and evolution 44(1): 412-426.
Hu Y J, Veresoglou S D, Tedersoo L, et al,2019. Contrasting latitudinal diversity and co-occurrence patterns of soil fungi and plants in forest ecosystems[J]. Soil Biology and Biochemistry, 131:100-110.
Hu A, Wang J J, Sun H, et al,2020. Mountain biodiversity and ecosystem functions: interplay between geology and contemporary environments[J]. The ISME Journal, 14(4):1-14.
Jeewon R, Liew E C,Hyde K D,2002. Phylogenetic relationships of Pestalo-tiopsis and allied genera inferred from ribosomal DNA sequences and morphological characters[J]. Molecular phylogenetics and evolution 25(3): 378-392.
Kraemer S, Ramachandran A, Colatriano D, et al,2020. Diversity and biogeography of SAR11 bacteria from the Arctic Ocean[J]. The ISME Journal, 14(1):79-90.
Liu J, Wang J N, Gao G H, et al,2015. Distribution and diversity of fungi in freshwater sediments on a river catchment scale[J]. Frontiers in microbiology, 6:329.
Liu J, Tu T, Gao G, et al,2019. Biogeography and diversity of freshwater bacteria on a river catchment scale[J]. Microbial ecology, 78(2): 324-335.
Niu X M, Zhang K Q,2011. Arthrobotrys oligospora: a model organism for understanding the interaction between fungi and nematodes[J]. Mycology, 2(2): 59-78.
Oliveira U, Vasconcelos M F, Santos A J,2017. Biogeography of Amazon birds: Rivers limit species composition, but not areas of endemism[J]. Scientific Reports, 7(1):1-11.
Oono R,2017. A confidence interval analysis of sampling effort, sequencing depth, and taxonomic resolution of fungal community ecology in the era of high-throughput sequencing[J]. PLoS ONE, 12(12): e0189796.
Stiller J W, Hall B D,1997. The origin of red algae implications for plastid evolution[J]. Proceedings of the National Academy of Sciences,94(9):4520-4525.
Tedersoo L, Bahram M, P?lme S, et al,2014. Global diversity and geography of soil fungi[J]. Science, 346(6213): 1256688.
Wang X, Li G H, Zou C G, et al,2014. Bacteria can mobilize nematode-trapping fungi to kill nematodes[J]. Nature communications,5(1):1-9.
White T J, Bruns T, Lee S, et al,1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J]. PCR protocols a guide to methods and applications,18(1):315-322.
Wu B, Tian J Q, Bai C M, et al,2013. The biogeography of fungal communities in wetland sediments along the Changjiang River and other sites in China[J]. The ISME Journal, 7:1299-1309.
Yang X Y, Deng W, Zhang F, et al,2021. Watershed: A Key for Microbial Biogeography[J/OL]. Preprints: 2021100284. doi: 10.20944/preprints202110.0284.v1.
Zhang K Q, Hyde K D,2014. Nematode‐trapping fungi[M]. Berlin:Springer Science & Business.
(责任编辑 郑金秀)
Terrestrial and Aquatic Distribution Patterns of Nematode-trapping Fungi in the Mainstream of Lancang River of the Three Parallel Rivers Area
ZHANG Xin1,2, ZHANG Fa1,2, DENG Wei1,2, YANG Xiao‐yan1,2,3, LI Na1,2, XIAO Wen1,2,3,4
(1. Institute of Eastern-Himalaya Biodiversity Research, Dali 671003, P.R. China;
2. The “Key Laboratory of Yunnan State Education Department on Erhai Lake Basin Protection
and the Sustainable Development Research”, Dali 671003, P.R. China;
3. The provincial innovation team of biodiversity conservation and utility of the three parallel rivers region
from Dali University, Dali 671003, P.R. China;
4. Collaborative Innovation Center for Biodiversity and Conservation in the Three Parallel Rivers Region
of China, Dali 671003, P.R. China)
Abstract: In this study, we investigated the diversity of nematode-trapping fungi (NTF) in both terrestrial and aquatic environments in the mainstream of the Lancang River basin in Yunnan Province and analyzed the distribution patterns of the microorganisms between terrestrial and aquatic environments in the Lancang River watershed at different spatial scales. Nine sampling areas were systematically selected in the study area, with five terrestrial and five aquatic sampling points at each sampling area, and the five-point method was used to collect aquatic sediment and terrestrial soil samples. A total of 90 samples were collected. Pure cultures of NTF were obtained by single spore isolation, and the species were identified by morphological and molecular techniques. A total of 76 NTF strains from 13 species of 2 genera were isolated from the mainstream of Lancang River, including 49 NTF strains from 11 species of 2 genera from terrestrial soil, and 27 NTF strains from 6 species of 1 genus from aquatic sediment. There was a heterogeneous distribution pattern of NTF between terrestrial and aquatic environments, and the species detection rate and species diversity in the terrestrial environment were higher than those in the aquatic environment. Compared with a previous study on the distribution of NTF in the tributaries of Lancang River, there was a larger difference in the NTF distribution between the terrestrial and aquatic environments in the mainstream than in the tributaries. It is likely that these results reflect environmental heterogeneity due to different spatial scales in the watershed, and it is more useful to understand the spatial distribution pattern by taking the entire watershed as the research area and NTF as the subject.
Key words: nematode-trapping fungi; diversity distribution; aquatic-terrestrial link; Lancang River
watershed
收稿日期:2022-01-02 修回日期:2022-08-23
基金项目:国家自然科学基金(U1602262;31760126);云南省教育厅科学研究基金项目(2022Y890)。
作者简介:张欣,1996年生,女,硕士研究生在读,研究方向为微生物生态学。E-mail:zhangx@eastern-himalaya.cn
通信作者:杨晓燕,1977年生,女,教授,研究方向为微生物生态学。E-mail:yangxy@eastern-himalaya.cn
