线粒体lncRNA IDL影响非小细胞肺癌氧化磷酸化
2023-04-29杨维佳李佳宋雨霄赵永云
杨维佳 李佳 宋雨霄 赵永云

摘要:为了探究线粒体长链非编码RNA(mitochondrial long non-coding RNA,mtlncRNA)IDL在人非小细胞肺癌细胞(human non-small cell lung cancer,NSCLC)代谢和生长中的作用及机制,本研究首先在A549细胞中通过线粒体压力测试发现敲低IDL会导致细胞的氧化磷酸化功能受损,接着通过细胞增殖实验、划痕实验和克隆形成实验,证明了敲低IDL时人非小细胞肺癌细胞A549和H1299的生长速度变慢、迁移能力和克隆形成能力减弱. 随后通过RNA沉降实验(RNA pull-down)和RNA免疫沉淀实验(RIP)找到了在体内外均可以与IDL特异性结合的蛋白——ATP合成酶α亚基,即ATP5A1蛋白,并通过免疫共沉淀实验(Co-IP)证明了IDL下调会导致ATP5A1蛋白的O-GlcNAc修饰水平增加,在A549细胞中敲低ATP5A1也得到了与敲低IDL时一致的细胞表型. 以上结果说明敲低IDL会导致非小细胞肺癌细胞氧化磷酸化功能受损、细胞生长受抑制.
关键词:非小细胞肺癌;IDL;氧化磷酸化;ATP5A1;O-GlcNAc修饰
收稿日期: 2023-05-10
基金项目: 国家自然科学基金(32170577)
作者简介: 杨维佳(1997-),女,四川成都人,硕士研究生,研究方向为细胞生物学. E-mail:294290812@qq.com
通讯作者: 赵永云. E-mail:yongyunfly@163.com
Mitochondrial lncRNA IDL affects oxidative phosphorylation in
non-small cell lung cancer
YANG Wei-Jia,LI Jia,SONG Yu-Xiao,ZHAO Yong-Yun
(Department of Functional Genome,College of Life Sciences,Sichuan University,Chengdu 610065,China)
In order to explore the effect of the mitochondrial long non-coding RNA IDL on the metabolism and growth of human non-small cell lung cancer (NSCLC)and its mechanism,Mito Stress Test was first performed in A549 cells,showing that the knockdown of IDL resulted in the impaired oxidative phosphorylation. Then, through the cell proliferation assay, wound healing assay and colony formation assay, it was proven that the growth rate was slowed down while the migration ability and clone formation ability were weakened in A549 and H1299 cells after IDL-knockdown. Subsequently, RNA pull-down assay and RIP assay were used to find out that IDL could specifically bind with ATP5A1, the α subunit of the ATPase, both in vitro and in vivo. It was proved that the O-GlcNAc modification level of ATP5A1 was increased because of the IDL reduction through the Co-IP experiment. Meanwhile, the cell phenotypes of A549 and H1299 after ATP5A1 knockdown were consistent with those of the IDL-knockdown. These results reveal that IDL-knockdown impairs the oxidative phosphorylation function and inhibits the cell growth of non-small cell lung cancer.
NSCLC;IDL;oxidative phosphorylation;ATP5A1;O-GlcNAc modification
1 引 言
肿瘤的发生发展过程中通常伴随能量代谢的改变,长链非编码RNA(long non-coding RNA,lncRNA)与肿瘤的发生发展息息相关,在肿瘤的代谢过程中起着关键的调节作用. lncRNA通过影响葡萄糖、谷氨酰胺和脂质代谢等多种代谢途径,参与调控肿瘤代谢和能量稳态. 例如:lncRNA CRNDE在胰岛素生长因子IGF信号的调节下,促进结直肠癌的有氧糖酵解[1];lncRNA NDRG2可以抑制透明细胞肾细胞癌的谷氨酰胺分解,进而抑制肿瘤生长[2];lncRNA TUG1可与miR-145拮抗,上调sirtuin3和GDH的表达来增强肝内胆管细胞癌的谷氨酰胺代谢[3];lncRNA HULC参与促进肝癌细胞中甘油三酯和胆固醇的合成以及有氧糖酵解[4,5]. 线粒体是细胞能量代谢的重要区室,线粒体内膜上存在参与细胞氧化磷酸化的电子传递链以及ATP合成酶(ATPase),后者负责生成细胞可直接利用的能量来源即ATP. ATPase由跨膜结构域Fo亚基和基质结构域F1亚基组成,其中F1亚基上的三个α亚基和三个β亚基构成了三个合成ATP的结构域[6]. α亚基是由核基因编码的蛋白,又被称为ATP5A1,它可以被泛素化修饰[7]、O-GlcNAc修饰[8]等. 在真核生物里,动物细胞中的线粒体是除了细胞核以外,唯一含有自己的基因组即线粒体DNA(mitochondria DNA,mtDNA)的细胞器. mtDNA可以转录产生线粒体长链非编码RNA(mtlncRNA),它们有的可以作为线粒体逆行信号与核基因组协调表达来维持线粒体的稳态和功能[9],有的则参与了肿瘤细胞的能量代谢[10].
原发性肺癌是最常见的恶性肿瘤,根据世界卫生组织国际癌症研究机构IARC在2021年发布的GLOBOCAN项目最新癌症统计数据显示,肺癌在全球的发病率位居第二,死亡率位居第一[11]. 肺癌又分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)两类,其中NSCLC约占所有肺癌病例的80%~85%,晚期患者5年生存率不到20%[12,13],因此迫切需要针对NSCLC开发新疗法、寻找新的治疗靶点.
本研究团队前期通过RNA-SELEX技术筛选出一条位于线粒体D-loop区上的lncRNA[14],其基因序列与已有研究发现的一条mtlncRNA相同,该研究团队因其表达量在细胞变为“永生”状态即肿瘤细胞时有所上升,故将其命名为“Immortalization-associated D-Loop”,即IDL[15].本文通过在非小细胞肺癌细胞中运用shRNA干扰的方法敲低IDL,研究其对线粒体发挥能量代谢功能的影响和对肿瘤细胞生长的影响,深入研究线粒体基因组的表达调控机制,为常见恶性肿瘤治疗提供潜在的靶标.
2 材料和方法
2.1 材 料
人非小细胞肺癌细胞A549和NCI-H1299(简称为H1299)、人胚肾细胞293T均购于中国科学院典型培养物保藏委员会细胞库,通过短串联重复序列STR鉴定,由本实验室冻存使用. 克隆菌株E.coli DH5α由本实验室保存. 质粒psPAX2、pMD2.G、pLKO.3G、pLKO.1-puro、pLKO.1-scramble shRNA、pCI-neo由实验室保存. 细胞培养基、胎牛血清、胰酶购自Hyclone公司. 限制性内切酶、T4 DNA连接酶购自NEB公司. RNAiso plus TRIzol试剂购自TAKARA公司. DNase Ⅰ、DynabeadsProteinG、DynabeadsTMStreptavidin购自Thermo Scientific公司. RT EasyTMⅠ、Real Time PCR EasyTM-SYBR Green Ⅰ、质粒提取试剂盒购自成都福际生物技术有限公司. 抗体购自Proteintech有限公司、Santa Cruz有限公司. 引物合成及测序由上海生工完成.
2.2 方 法
2.2.1 构建shRNA载体
将合成的shRNA寡核苷酸正、反义链混合后置于95 ℃金属浴上变性4 min,缓慢退火至室温以形成双链,再与经AgeⅠ和EcoRⅠ双酶切后的pLKO.1-puro载体连接、转化E.coli DH5α感受态细胞、提取质粒送测序鉴定. 将敲低载体与对照质粒pLKO.1-scramble shRNA(简写为SCR,即没有靶向任何基因的shRNA)、pLKO.3G(用于确定病毒包装和感染是否成功)分别和包装质粒psPAX2及pMD2.G共转染293T细胞包装慢病毒,转染48 h后浓缩病毒感染目的细胞. 用于构建shRNA的寡核苷酸正义链和反义链的序列见表1.
2.2.2 总RNA提取、逆转录和RT-qPCR
将感染96 h的细胞按照一个6孔加入1 mL TRIzol的量进行裂解,再依次向其中加入氯仿、异丙醇和75%乙醇以提取总RNA,用DNase Ⅰ消化30 min后再加入1 mL TRIzol提取总RNA并测定浓度. 将1 μg RNA按逆转录试剂盒说明书以随机引物RP6或特异性引物进行逆转录合成cDNA. 20 μL实时荧光定量PCR的(简写为RT-qPCR)反应体系为:2×SYBR GreenⅠ Mix 10 μL、上下游10 μmol/L引物各0.5 μL、用ddH2O稀释10倍的cDNA 4 μL、ddH2O 5 μL. PCR扩增程序:95 ℃预变性2 min、95 ℃变性5 s、58 ℃退火5 s、72 ℃延伸15 s,40个循环,熔解曲线为60~95 ℃内每上升0.5 ℃吸收一次荧光信号.
ACTB-F:AGGTCATCACCATTGGCAATGAGC,
ACTB-R:AGCACTGTGTTGGCGTACAGGTCT,
IDL-F:ACACATCAACTGCAACTCCAAAG,
IDL-R:TGACTGTAATGTGCTATGTACGG,
ATP5A1-F:AACTGATTATTGGTGACCGACAG,
ATP5A1-R:GGCAACAGTGGATCTCTTTTGA.
2.2.3 线粒体压力测试
按照安捷伦公司Seahorse XF线粒体压力测试试剂盒说明书,将实验细胞提前铺至XFp细胞板、水化探针板过夜. 上机前用校准液清洗细胞、校准探针板;上机时向细胞中依次加入寡霉素(oligomycin)1.5 μmol/L、解偶联剂(FCCP)1.5 μmol/L、鱼藤酮和抗霉素A混合物(Rotenone/antimycin A)0.5 μmol/L,得到反映线粒体功能的关键参数. 利用WAVE软件分析结果.
2.2.4 细胞ATP水平检测
按碧云天公司S0027增强型ATP检测试剂盒说明书进行,本实验ATP标准样品的浓度为0.1 μmol/L、0.5 μmol/L、1 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L. 按照PierceTMBCA蛋白检测试剂盒说明书对细胞总蛋白进行定量,消除样品制备时由于蛋白量的差异而造成的误差.
2.2.5 ATP合成酶活性检测
使用BioAssay Systems公司的ATP酶活性检测试剂盒,磷酸盐标准品浓度为0 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L、50 μmol/L,测定OD620nm的数值. ATP合成酶的酶活性计算公式为:[Pi](μmol/L)×40 μL/(10 μL×30 min)(U/L).
2.2.6 蛋白免疫印迹(WB)
用细胞裂解液将细胞裂解,通过BCA定量确定蛋白浓度. RNA pull-down实验需将细胞裂解液与生物素标记的体外RNA转录产物孵育后与链霉素磁珠孵育,RIP实验需要将细胞裂解液与特异性抗体孵育后与ProteinG磁珠孵育. 蛋白样品经SDS-PAGE凝胶电泳后进行转膜、封闭,再分别与一抗、二抗孵育并用PBST洗膜后,经ECL显影,用凝胶成像系统曝片得到蛋白条带.
2.2.7 细胞表型实验
敲低IDL和ATP5A1基因并用嘌呤霉素筛选96 h后,利用CCK-8测量细胞增殖情况并绘制增殖曲线、用200 μL枪头沿灭菌直尺对细胞进行划痕并每隔24 h拍照记录伤口愈合情况、用0.5%结晶紫对细胞克隆进行染色固定并拍照统计单克隆数量[16].
3 结 果
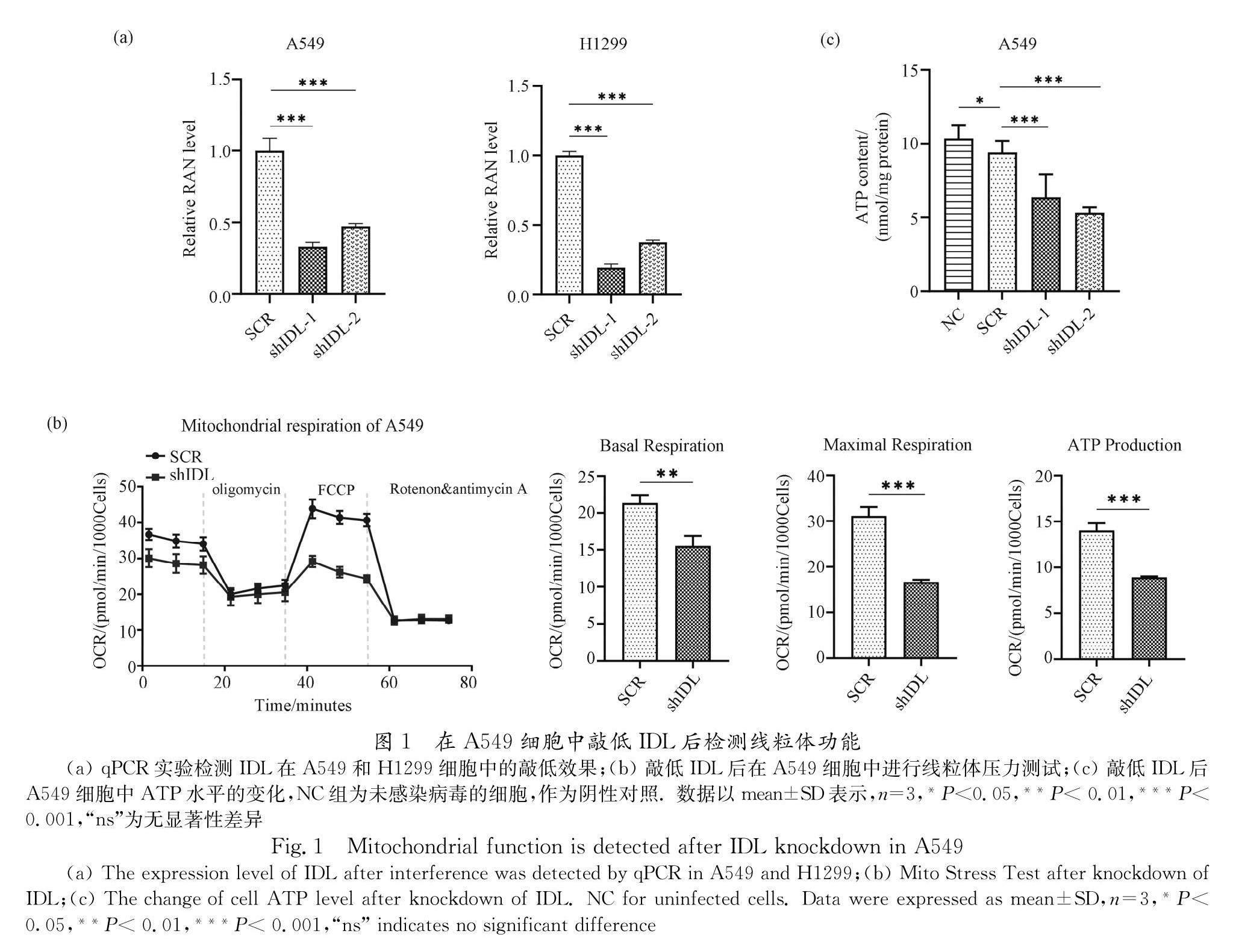
3.1 敲低IDL导致A549细胞线粒体功能损伤
为探究线粒体来源的lncRNA IDL是否能在非小细胞肺癌中发挥功能,本研究首先确定了IDL在NSCLC中的敲低条件. 线粒体基质中存在Ago2/RISC,并且其能结合进入线粒体的siRNA[17],于是我们设计了两条靶向IDL的shRNA(简写为shIDL),将其构建至慢病毒载体pLKO.1-puro上,再将慢病毒载体转染进293T细胞包装成慢病毒感染A549细胞和H1299细胞. 实时荧光定量PCR检测IDL的敲低效率,与对照组SCR相比,感染shIDL-1和shIDL-2病毒的A549细胞中IDL RNA水平分别降低至33.4%和47.3%、H1299细胞中IDL RNA水平分别降低至19.4%和37.7%(图1a). 接着,我们选择敲低效率高的一条shIDL敲低A549细胞用于Seahorse XF线粒体压力测试,细胞能量代谢分析结果表明,敲低IDL的细胞其氧气消耗速率OCR下降,基础呼吸、最大呼吸和ATP产生量显著降低(图1b),这说明IDL下调时细胞氧化磷酸化能力变弱. 细胞的代谢调控使细胞根据ATP需求的变化调整ATP的产生量来维持胞内ATP总水平,通常胞内ATP总水平的下降也表明线粒体的功能受影响. 于是,我们进一步用化学发光法检测了A549细胞的胞内ATP总水平,结果显示敲低IDL后A549细胞内ATP总水平显著下降(图1c). 以上结果说明,敲低IDL会影响非小细胞肺癌氧化磷酸化产生ATP,导致线粒体功能损伤;IDL的存在能维持A549细胞的线粒体功能.
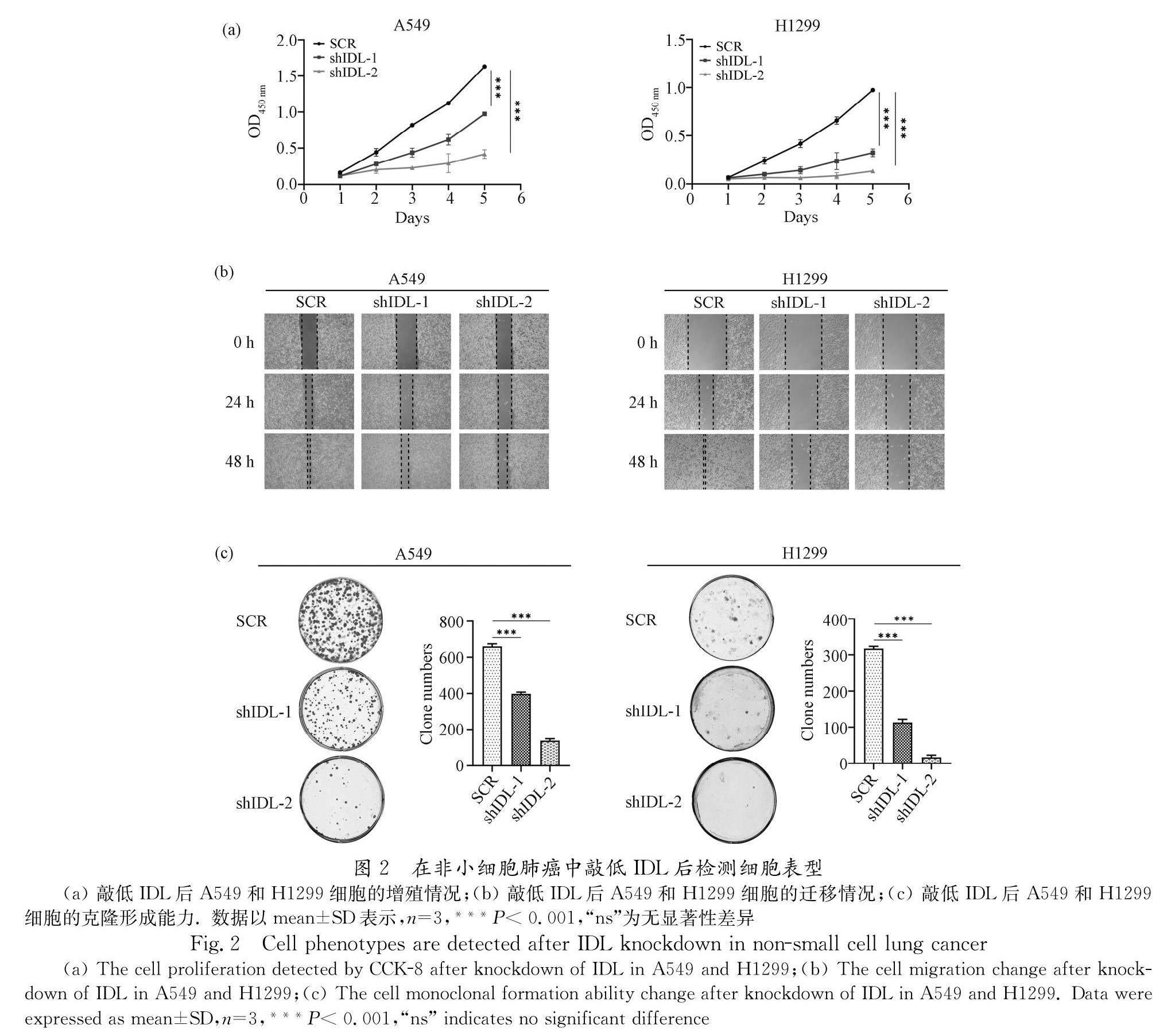
3.2 敲低IDL抑制非小细胞肺癌生长
由于细胞的生长与氧化磷酸化等代谢途径紧密相关,于是我们进一步探究了IDL下调是否会对非小细胞肺癌A549和H1299细胞的生长产生影响. 首先用CCK-8法连续5 d测定细胞增殖情况后绘制细胞生长曲线,与对照SCR组相比,两种细胞中IDL下调均导致其细胞增殖能力受到显著抑制(图2a). 接着通过划痕实验证明了敲低IDL会导致两种细胞的伤口愈合能力变弱,即细胞的迁移能力受抑制(图2b). 最后,细胞克隆形成实验的结果也证明,两种肿瘤细胞的克隆形成能力在敲低IDL后和对照SCR组相比显著下降(图2c). 以上结果证明了肺癌细胞IDL表达量下降时非小细胞肺癌不仅氧化磷酸化受损,其生长也受到了抑制.
值得思考的是,shIDL-1的RNA敲低效果优于shIDL-2,但是细胞表型结果却不如shIDL-2的明显. 我们推测这可能是由于shIDL-1的高效率敲低促使了其他与抑制肿瘤细胞生长相拮抗的信号通路上调,其具体机制可作为未来研究方向.
3.3 IDL结合ATP5A1蛋白并调控其糖基化修饰
为探索IDL影响非小细胞肺癌代谢的机制,我们首先在体外用A549细胞进行了RNA pull-down实验以筛选与IDL存在相互作用的蛋白. 对IDL RNA pull-down后细胞裂解液中的蛋白进行SDS-PAGE电泳和银染,并切下银染胶上的蛋白质送谱分析. 从质谱结果中我们可以发现,与IDL结合的蛋白中,有一个分子量大小为50 kD的蛋白正是氧化磷酸化过程中最后一步负责直接生成ATP的ATP合成酶上的α亚基,即ATP5A1(表2). 从银染结果也能看出在50 kD处有一条与IDL特异性结合的带(图3a),条带大小与ATP5A1的分子量相吻合. 接下来,我们在A549细胞中通过RIP实验进一步对RNA pull-down的结果进行了验证,RT-qPCR和WB的实验结果均表明IDL和ATP5A1二者在体内也可以结合(图3b).
为探究IDL与ATP5A1结合后怎样发挥生物学功能,我们首先通过WB实验证明了敲低IDL后,细胞ATP5A1蛋白表达水平不会因为与之结合的IDL的减少而变化(图3c). 接着我们推测,由于ATP合成酶由Fo亚基和F1亚基两部分组成,而ATP5A1正是F1亚基上的α亚基,与同在F1亚基上的β亚基共同构成ATP合成酶用于催化ADP形成ATP的功能结构域,那么IDL是否会通过结合ATP5A1来调节ATPase合成ATP的酶活性?于是我们用定磷法检测了敲低IDL后A549细胞ATPase的活性,结果显示IDL下调时ATPase活性明显减弱(图3d),这验证了之前得到的敲低IDL后ATP水平降低、线粒体功能受损的结论.
为探究IDL影响ATPase活性的机制,我们通过Co-IP实验检测了敲低IDL时A549细胞ATP5A1蛋白的修饰水平是否有变化,因为已有研究报道发现ATPase产生ATP的活性可以被ATP5A1蛋白的修饰所影响. 在确保各实验组IP到的ATP5A1蛋白水平相近的情况下,WB结果显示IDL下调后ATP5A1的O-GlcNAc修饰程度显著增加(图3e).
为了验证IDL在结合ATP5A1后可能是通过调控其O-GlcNAc修饰水平来维持非小细胞肺癌细胞氧化磷酸化功能和细胞生长,我们设计了两条靶向ATP5A1的shRNA(简写为shATP5A1),用来当做敲低IDL后进行细胞表型实验的正对照. 按照与构建shIDL敲低载体同样的方法得到shATP5A1敲低载体并包装成慢病毒感染A549细胞. 经RT-qPCR和WB检测,感染shATP5A1-1和shATP5A1-2病毒的A549细胞中ATP5A1的RNA和蛋白水平与对照SCR组相比均显著降低(图3f). 接着,我们在A549细胞中敲低ATP5A1基因后进行了细胞表型实验,结果表明ATP5A1下调时的细胞表型与敲低IDL时的表型一致,细胞的增殖能力受到抑制(图3g)、迁移能力变弱(图3h)、克隆形成能力显著下降(图3i). 这些结果表明,IDL对肿瘤细胞的生长是必需的,敲低IDL会导致ATP5A1蛋白O-GlcNAc修饰水平增加、非小细胞肺癌ATP合成酶的活性降低、细胞氧化磷酸化能力变弱且生长受抑制.
4 讨 论
线粒体是细胞进行生物能量代谢、生物合成和信号传导的重要场所,它的存在使细胞能及时地适应环境,在细胞的压力感应中不可或缺. 本研究在非小细胞肺癌中确定了IDL能结合ATP合成酶的α亚基ATP5A1蛋白. 当IDL存在时,ATP5A1的O-GlcNAc糖基化修饰维持在较低的水平以保证ATPase的活性进而维持肿瘤细胞氧化磷酸化产生ATP及细胞生长.
O-GlcNAc糖修饰是一种广泛分布于在细胞质和细胞核中的蛋白质翻译后修饰,可以作为营养感受器来感应细胞外葡萄糖和脂质等多种能量分子的变化,参与肿瘤、糖尿病、心血管疾病、神经退行性疾病的发生发展[18]. 糖基化是肿瘤的重要特征之一,它参与了肿瘤从发生到转移的各个环节,因此靶向糖基化也成为了重要的抗肿瘤药物的开发策略. 有研究通过蛋白组学分析发现,线粒体内有88个蛋白存在着不同位点上的O-GlcNAc糖基化修饰,并且这些蛋白大多存在于氧化磷酸化系统中,例如大鼠心脏线粒体中ATP5A1蛋白的O-GlcNAc糖基化位点便有十多处[19]. 已有研究表明在高糖环境下,心肌细胞会增加线粒体蛋白O-GlcNAc糖基化水平并降低细胞ATP含量[20],这也与我们的实验结果一致.
ATP5A1的O-GlcNAc修饰是通过结合O-连锁-N-乙酰氨基葡萄糖转移酶(O-GlcNAc transferase,OGT)而进行的,我们推测IDL存在时ATP5A1蛋白O-GlcNAc修饰水平低可能是由于IDL结合ATP5A1后抑制了ATP5A1与OGT的互作;而ATPase在IDL下调后酶活性降低可能是因为ATP5A1与OGT的互作不再受IDL阻碍,于是O-GlcNAc修饰水平上升,进而这种修饰封闭了ATPase的活性位点. 为进一步验证以上推断,后续首先可以通过敲低IDL后进行Co-IP实验检测ATP5A1与OGT的结合情况,来验证IDL的存在是否阻碍了二者互作;在此基础上可以敲低OGT后检测ATPase的酶活,看其活性是否因为糖基化水平的降低而恢复. 此外,还可以通过BN-PAGE实验检测敲低IDL后ATP合成酶中α亚基ATP5A1蛋白与β亚基ATP5B的结合情况,推测ATP5A1的O-GlcNAc修饰水平升高是否会导致α亚基与β亚基的结合情况改变进而封闭ATPase的活性位点. 再者,IDL是否只通过影响ATP5A1的O-GlcNAc糖基化修饰水平来维持细胞代谢和生长,还需继续深入研究.
此外,由于肿瘤细胞迅速增殖且具有很高的能量需求,而糖酵解是一种相对低效的代谢方式,故有氧糖酵解的理论自诞生之日起一直受到质疑. 尽管Warburg最初提出癌细胞的线粒体是有缺陷的,但线粒体绝非癌变过程中的“stander-by”[21],线粒体代谢仍可为肿瘤细胞提供能量,甚至在一些肿瘤细胞中线粒体氧化磷酸化功能还有所增强[22]. 因此,开发有效的肿瘤能量抑制策略,除了从抑制糖酵解着手,还应考虑到抑制肿瘤细胞的线粒体代谢,尽可能地切断肿瘤所需的线粒体氧化磷酸化来源的ATP供应,这对于肿瘤治疗具有重要的研究意义. 越来越多的证据也显示肿瘤细胞中线粒体的功能并没有丧失,例如,在宫颈癌HeLa细胞中由线粒体产生的ATP约占细胞内总ATP水平的70%以上[23];多种神经胶质瘤细胞高度依赖线粒体氧化磷酸化途径来产生ATP[24];在乳腺癌、肝细胞癌、胰腺癌中,细胞优先采用氧化磷酸化的代谢方式[22,25,26];对乳腺癌细胞使用ATP合成抑制剂或线粒体解偶联剂时可减少伪足的形成,从而降低其迁移和侵袭能力[27];迁移的黑色素瘤细胞氧化代谢增强,在产生更多ATP的同时其呼吸链上复合物Ⅱ的活性及脂肪酸β-氧化增强[28,29]. 因此,线粒体来源的lncRNA IDL表达量减少导致非小细胞肺癌细胞的ATP合成能力受损、生长受抑制这一发现,也为治疗对人类健康威胁最大的恶性肿瘤之一的肺癌提供了新思路.
参考文献:
[1]Ellis B C, Graham L D, Molloy P L, et al. CRNDE, a long non-coding RNA responsive to insulin/IGF signaling, regulates genes involved in central metabolism [J]. Biochim Biophys Acta Biomembr, 2014, 1843: 372.
[2]Shi W, Xu X, Yan F, et al. N-Myc downstream-regulated gene 2 restrains glycolysis and glutaminolysis in clear cell renal cell carcinoma [J]. Oncol Lett, 2017, 14: 6881.
[3]Zeng B, Ye H, Chen J, et al. LncRNA TUG1 sponges miR-145 to promote cancer progression and regulate glutamine metabolism via Sirt3/GDH axis [J]. Oncotarget, 2017, 8: 113650.
[4]Cui M, Xiao Z, Wang Y, et al. Long noncoding RNA HULC modulates abnormal lipid metabolism in hepatoma cells through an miR-9-mediated RXRA signaling pathway [J]. Cancer Res, 2015, 75: 846.
[5]Wang C, Li Y, Yan S, et al. Interactome analysis reveals that lncRNA HULC promotes aerobic glycolysis through LDHA and PKM2 [J]. Nat Commun, 2020, 11: 3162.
[6]Nirody J A, Budin I, Rangamani P. ATP synthase: Evolution, energetics, and membrane interactions [J]. J Gen Physiol, 2020, 152: e201912475.
[7]Wang C, Du J, Du S, et al. Endogenous H 2 S resists mitochondria-mediated apoptosis in the adrenal glands via ATP5A1 S-sulfhydration in male mice [J]. Mol Cell Endocrinol, 2018, 474: 65.
[8]Cha M Y, Cho H J, Kim C, et al. Mitochondrial ATP synthase activity is impaired by suppressed O-GlcNAcylation in Alzheimers disease [J]. Hum Mol Genet, 2015, 24: 6492.
[9]Zhao Y, Liu S, Zhou L, et al. Aberrant shuttling of long noncoding RNAs during the mitochondria-nuclear crosstalk in hepatocellular carcinoma cells [J]. Am J Cancer Res, 2019, 9: 999.
[10]Sang L, Ju H QIANG, Yang Z, et al. Mitochondrial long non-coding RNA GAS5 tunes TCA metabolism in response to nutrient stress [J]. Nat Metab, 2021, 3: 90.
[11]Sung H, Ferlay J, Siegel R L, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries [J]. CA Cancer J Clin, 2021, 71: 209.
[12]Jiang J, Huang L, Liang X, et al. Gefitinib versus docetaxel in previously treated advanced non-small-cell lung cancer: a meta-analysis of randomized controlled trials [J]. Acta Oncol, 2011, 50: 582.
[13]Gettinger S, Horn L, Jackman D, et al. Five-year follow-up of nivolumab in previously treated advanced non–small-cell lung cancer: Results from the CA209-003 study [J]. J Clin Oncol, 2018, 36: 1675.
[14]Li J, Bai R, Yang W, et al. The mitochondrial-derived lncRNA MDL1 mediates a mitochondria-to-nucleus retrograde regulation by inhibiting the nuclear translocation of p53 [J]. MedComm-Oncology, 2022, 1: e15.
[15]Duncan E L, Perrem K, Reddel R R. Identification of a Novel Human Mitochondrial D-Loop RNA Species Which Exhibits Upregulated Expression Following Cellular Immortalization [J]. Biochem Biophys Res Commun, 2000, 276: 439.
[16]徐树涛,彭锐,邹方东,等. Napabucasin对结直肠癌细胞增殖及迁移的影响 [J]. 四川大学学报: 自然科学版, 2020, 57: 1193.
[17]Zhang X, Zuo X, Yang B, et al. MicroRNA directly enhances mitochondrial translation during muscle differentiation [J]. Cell, 2014, 158: 607.
[18]Chatham J C, Zhang J, Wende A R. Role of o-linked n-acetylglucosamine proteinmodification in cellular (Patho)physiology [J]. Physiol Rev, 2021, 101: 427.
[19]Ma J, Liu T, Wei A C, et al. O-GlcNAcomic Profiling Identifies Widespread O-Linked β-N-Acetylglucosamine Modification (O-GlcNAcylation)in Oxidative Phosphorylation System Regulating Cardiac Mitochondrial Function [J]. J Biol Chem, 2015, 290: 29141.
[20]Hu Y, Suarez J, Fricovsky E, et al. Increased enzymatic O-GlcNAcylation of mitochondrial proteins impairs mitochondrial function in cardiac myocytes exposed to high glucose [J]. J Biol Chem, 2009, 284: 547.
[21]Frezza C, Gottlieb E. Mitochondria in cancer: not just innocent bystanders [J]. Semin Cancer Biol, 2009, 19: 4.
[22]Smolková K, Bellance N, Scandurra F, et al. Mitochondrial bioenergetic adaptations of breast cancer cells to aglycemia and hypoxia [J]. J Bioenerg Biomembr, 2010, 42: 55.
[23]Rodríguez-Enríquez S, Carreno-Fuentes L, Gallardo-Pérez J C, et al. Oxidative phosphorylation is impaired by prolonged hypoxia in breast and possibly in cervix carcinoma [J]. Int J Biochem Cell Biol, 2010, 42: 1744.
[24]Griguer C E, Oliva C R, Gillespie G Y. Glucose metabolism heterogeneity in human and mouse malignant glioma cell lines [J]. J Neurooncol, 2005, 74: 123.
[25]Rossignol R, Gilkerson R, Aggeler R, et al. Energy substrate modulates mitochondrial structure and oxidative capacity in cancer cells [J]. Cancer Res, 2004, 64: 985.
[26]Plecitá-Hlavatá L, Lessard M, ?antorová J, et al. Mitochondrial oxidative phosphorylation and energetic status are reflected by morphology of mitochondrial network in INS-1E and HEP-G2 cells viewed by 4Pi microscopy [J]. Biochim Biophys Acta Bioenerg, 2008, 1777: 834.
[27]Zhao J, Zhang J, Yu M, et al. Mitochondrial dynamics regulates migration and invasion of breast cancer cells [J]. Oncogene, 2013, 32: 4814.
[28]Porporato P E, Payen V L, Pérez-Escuredo J, et al. A mitochondrial switch promotes tumor metastasis [J]. Cell Rep, 2014, 8: 754.
[29]Gal K LE, Ibrahim M X, Wiel C, et al. Antioxidants can increase melanoma metastasis in mice [J]. Sci Transl Med, 2015, 7: 308.
引用本文格式:
中 文: 杨维佳,李佳,宋雨霄, 等. 线粒体lncRNA IDL影响非小细胞肺癌氧化磷酸化[J]. 四川大学学报: 自然科学版, 2023, 60: 066001.
英 文: Yang W J,Li J,Song Y X, et al. Mitochondrial lncRNA IDL affects oxidative phosphorylation in non-small cell lung cancer [J]. J Sichuan Univ: Nat Sci Ed, 2023, 60: 066001.
