镉胁迫下构树qRT-PCR内参基因筛选及验证
2023-04-29李红英陈萌笛王政博等
李红英 陈萌笛 王政博等

关键词:构树;内参基因;Cd胁迫;荧光定量PCR
中图分类号:S718.46 文献标识码:A 文章编号:1001-1498(2023)04-0129-10
构树(Broussonetia papyrifera(L.)Vent.)为桑科(Moraceae)构属(Broussonetia)落叶乔木,自然分布于我国大部分地区和东南亚,是一种典型的乡土树种和先锋植物。其表型性状和遗传多样性丰富,基因组紧凑,常作为木本植物研究的模式材料。因其易繁殖、抗逆性强、生长速度快等优点,被广泛应用于饲料、造纸和植被恢复等领域。此外,构树还具有药用价值,其类黄酮、多酚、果糖等含量远高于其它植物,构树中的黄酮衍生物对癌细胞有抑制作用,多酚类物质可以抑制冠状病毒蛋白酶。近年来,有研究证明,构树对重金属Cd有一定的富集和转运能力,因此,被认为是重金属污染区群落恢复的先锋树种,其主要通过诱导或增强相关Cd抗性基因表达,合成功能性基因来应对Cd胁迫。因此,了解关键基因的表达方式将有助于阐明构树Cd胁迫中所涉及的分子机制。
实时荧光定量PCR(qRT-PCR)因其方便快捷、强特异性和高灵敏度等优势,已成为研究基因转录水平表达量的有效手段。然而,RNA质量、cDNA质量、样品稀释倍数以及实验操作准确度等因素都会影响qRT-PCR的准确性,因此,引入适宜的内参基因,对目的基因表达量标准化分析至关重要。理想的内参基因是能够在细胞中稳定表达、表达量几乎不受外界环境干扰的基因,一般为维持细胞基本生命活动的管家基因(Housekeepergene),如肌动蛋白基因(Actin)、18S核糖体RNA(18S Ribosome RNA)、微管蛋白基因(Tublin)和泛素蛋白基因(Ubiquitin)等;但近年来大量研究证明,随着物种以及组织器官的差异,管家基因的转录水平有可能会发生变化,如在羊草(Leymus chinensis(Trin.)Tzvel.)叶片、茎部以及穗中表达稳定性较高的内参基因分别是Actin、EF-1a和18S rRNA,而根部表达较为稳定的是APRT、18S rRNA。茉莉花(Jasminumsambac(L.)Aiton.)在不同的发育时期以及不同组织中筛选出的最适内参基因也不同。此外,同一植物在不同的环境下内参基因稳定性之间也存在差异,如海州常山(Clerodendrum trichotomumThunb.)内参基因RPL、AP-2基因在盐胁迫下表达最稳定,干旱胁迫下MDH、AP-2基因表达最稳定,而热胁迫下UBCE2和ACT表达最稳定。这说明管家基因只能在特定的组织或处理方式中保持相对稳定,因此,应根据特定的试验条件来选择适合的内参基因,减少试验误差。
本研究以Cd胁迫下构树的根和叶为试验材料,根据构树转录组数据选取了10个候选内参基因,并通过qRT-PCR技术,结合基因稳定性分析软件geNorm、NormFinder、BestKeeper和RefFinder在线分析工具,对10个候选内参基因在构树Cd胁迫下根和叶片中的表达稳定性进行评估,筛选出表达相对稳定的内参基因,并利用构树逆境胁迫关键基因BpDREB进一步验证上述结果的可靠性,为后续开展构树Cd胁迫响应基因的功能研究奠定基础。
1材料与方法
1.1实验材料
构树种子购自江苏宿迁天桥区映阳苗木经营部,将种子用1600 mg·L-1的GA3溶液浸泡24 h,蒸馏水冲洗2~3次后播种于草炭土和蛭石混合基质中,置于光照培养箱中(温度30℃,湿度60%,光照12 h,黑暗12 h)培养。培养6个月后,选取长势良好、大小一致的构树幼苗,参照Xu等实验设计并稍作调整,将幼苗小心剥离营养基质后置于1/2霍格兰营养液中缓苗1周,每3d更换1次,之后加入400 pmol·L-1CdCl2进行模拟Cd胁迫处理,分别在处理后0(CK)、3、6、12、24、48、72、96、120 h取其根部与叶片,液氮速冻后放置于-80℃保存,每个取样时间点均取3个重复。
1.2实验方法
1.2.1总RNA提取和cDNA第一链合成 利用Trizol法(北京聚合美,MF034)提取RNA,用1.2%的琼脂糖凝胶电泳检测RNA的完整性,使用超微量紫外分光光度计(NanoDrop2000)检测RNA浓度和纯度。利用M5 Super qPCR RTKit(北京聚合美,MF012)完成cDNA第一链合成,置于-20℃保存备用。
1.2.2引物设计 根据构树转录组序列,对选定的10个候选内参基因BpUBE2、BpRPL8、BpActin、BpGAPDH、BpHSP、BpTUA、BpDOUB、Bpβ-TUB、BpHIS、BpNADH使用Primer3web (V4.1.0,http://primer3.ut.ee/)设计引物,并利用Blast工具检测引物特异性。引物序列、扩增产物长度和Tm值等详见表1,引物由通用生物(安徽)股份有限公司合成。
1.2.3 qRT-PCR反应条件 qRT-PCR采用SYBR Green染料法,按照2×M5 HiPer SYBRPremix EsTaq试剂盒(北京聚合美,MF787)说明书配制PCR反应体系为:cDNA棋板1μL,正反向引物(10μmol·L-1)各0.2 pL,2×M5 HiPerSYBR Premix EsTaq 5μL,用ddH2O补至10μL。每个样品均设置3个重复,利用伯乐公司的CFX96实时荧光定量PCR仪对样品进行扩增。PCR反应程序:95℃预变性30s;95℃变性5s,60℃退火30s,39个循环,熔解曲线:以65℃到95℃,每个循环增加0.5℃,持续0.05s获得解链温度,采集荧光信号。
1.2.4引物特异性及扩增效率检测 将cDNA样本等量混合后用ddH2O稀释1倍作为模板进行普通PCR扩增,用于检测引物的特异性。反应体系为:14.3 pL ddH2O,2μL 10×PCR Buffer, 1.6μLdNTP(2.5 mmol.L-1),
0.1μL rTaq(5U·μL-1),cDNA1.5μL,上下游物(10μmol·L-1)各0.25μL。反应程序为95℃2 min;98℃10s,60℃30 s,72℃30 s,30个循环,72℃5 min,反应结束后用2%的琼脂糖凝胶进行引物特异性检测。
将Cd胁迫下所有样本的cDNA取适量等量混合后稀释成6个梯度(1/3、1/9、1/27、1/81、1/243、1/729),并以此为模板进行qPCR扩增,用于标准曲线的绘制,并利用公式E=(3-1/slope-1)×100%计算引物扩增效率。反应体系和程序如1.2.3所述。
1.2.5候选内参基因稳定性分析 通过荧光定量PCR得出10个候选基因在Cd胁迫下构树不同组织中的CT值,使用Microsoft Excel 2016软件整理原始CT值,并分别采用基于Microsoft Excel 2010的3个基因稳定性评价软件(geNorm、NormFinder、BestKeeper)和在线分析工具RefFinder(https://blooge.cn/RefFinder/)对10个候选内参基因的稳定性进行综合评价,筛选出构树在Cd胁迫下的最佳内参基因。
1.2.6内参基因稳定性验证 选择构树逆境胁迫响应基因Bp DREB用于验证筛选出的内参基因的稳定性。以Cd胁迫下构树的cDNA为模板,使用荧光定量PCR技术,以最佳候选基因及其组合作为标准化因子,以不稳定的内参基因作为比较,使用2-AACT法分析Bp DREB基因在构树根部和叶片中的相对表达量,实验设置3个重复,反应体系和程序如1.2.3所述。
2结果与分析
2.1 RNA质量检测
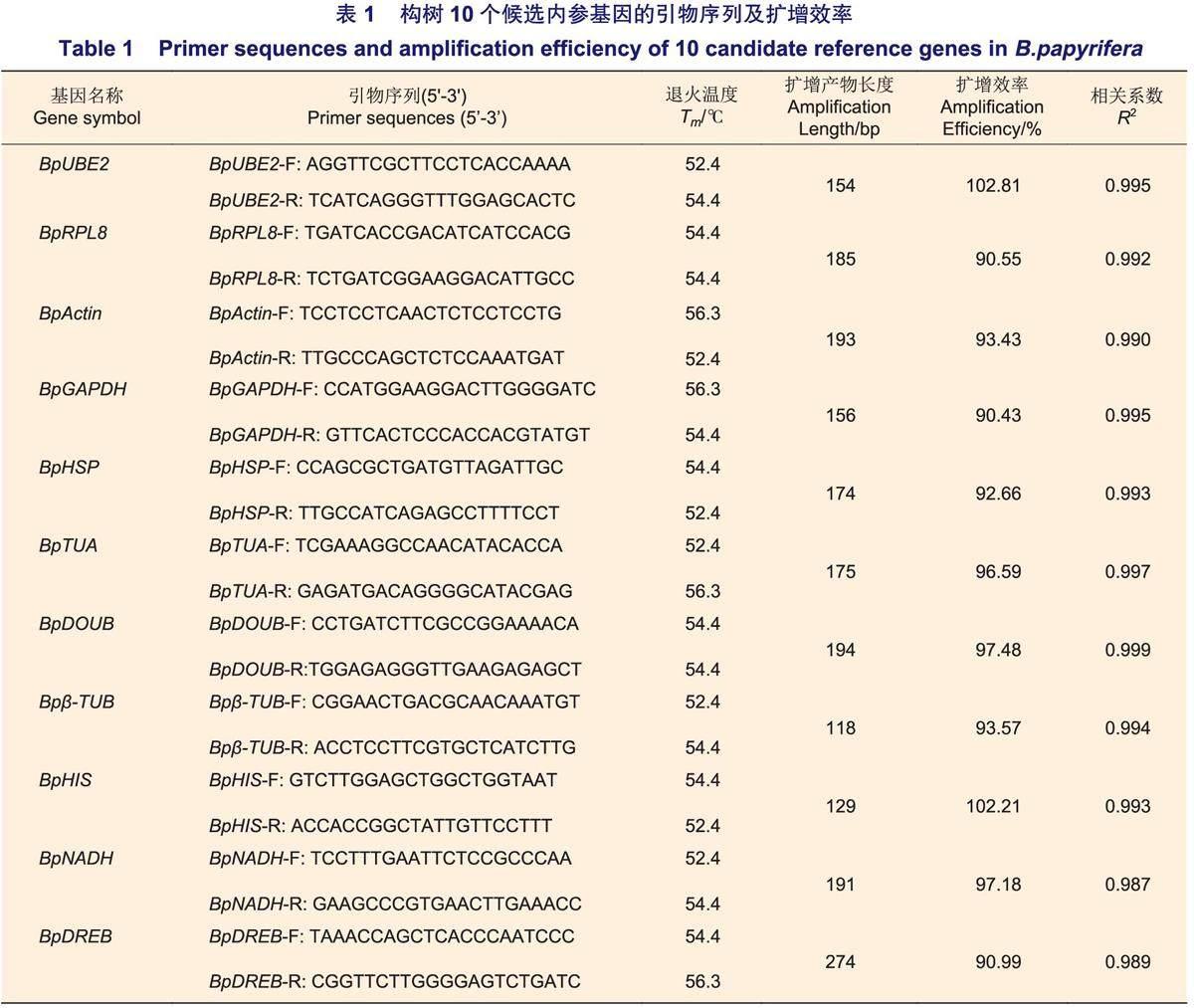
RNA样品浓度为160~287ng.μL-1,A260/280的值为2.0~2.2,这表明RNA无蛋白或酚类污染,纯度较高。琼脂糖凝胶电泳结果(图1)显示:各样本的RNA主带清晰,无弥散拖尾现象,且28S rRNA条带的亮度约为18S rRNA条带的2倍,这表明RNA无明显降解,完整性良好,可用于后续实验。
2.2引物特异性及扩增效率检测
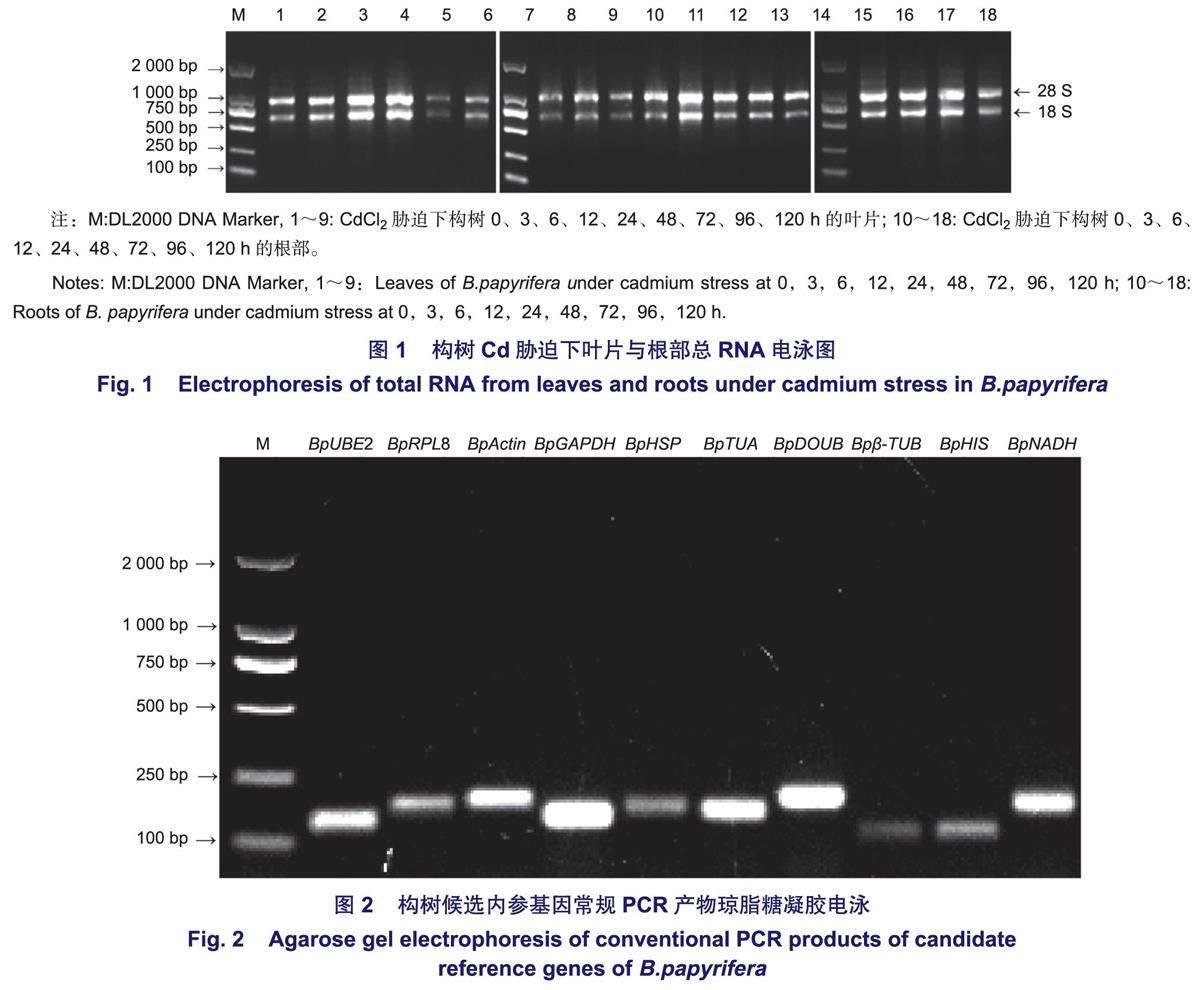
以Cd胁迫下构树根和叶等量混合的cDNA为模板进行常规PCR扩增,结果(图2)表明:所有引物目标片段单一明亮,无引物二聚体及非特异性扩增现象,且条带大小与预期相符。进一步利用qRT-PCR技术验证引物特异性,结果(图3)表明:各候选内参基因的溶解曲线均呈单一溶解峰,说明所用引物都能进行特异性扩增。经计算,各候选内参基因扩增效率(E)为90.43%~102.81%,相关系数(R2)为0.987~0.999(表1)。以上结果表明,各候选基因特异性和扩增效率良好,可用于后续实验。
2.3内参基因稳定性分析
2.3.1内参基因CT值分析 CT值与基因表达量呈反比,CT值越低基因表达水平越高。通过对箱线图(图4)进行分析可知:大部分基因CT值分布在21~28之间,表达丰度适中。此外,由箱线图跨度可初步判定BpGAPDH(21.59~32.58)的CT值跨度广,基因表达稳定性较弱,而BpNADH( 25.86~27.36))、BpDOUB(23.09~25.12)、BpUBE2(21.78~23.67)的CT值跨度小,基因表达较稳定。以上结果表明,构树中不同内参基因在Cd胁迫下具有不同的表达水平,从CT值变化跨度推测BpNADH、BpDOUB和BpUBE2表达量较稳定,是潜在的最佳候选内参基因。
2.3.2 geNorm分析 通过geNorm软件计算各候选内参基因在构树Cd胁迫下不同组织中表达稳定性的M值,该软件是以M=1.5为临界值,M值越小,则内参基因的稳定性越高。geNorm分析结果(图5A)表明:在Cd胁迫下构树各候选内参基因M值均低于1.5,即各候选内参基因表达都相对稳定,稳定性排序从高到低依次为Bp DOUB(0.35) =BpUBE2(0.35) >BpNADH(0.399)>BpHIS(0.443) >BpActin(0.501) >BpTUA(0.535) >BpHSP(0.567)>BpRPL8(0.666)>Bpβ-TUB(0.776) >BpGAPDH(1.416).
为确定内参基因的最佳数量,使用配对变异系数Vnl(n+1)对10个候选内参基因进行分析,Vnl(n+1)的临界值为0.15,当Vnl(n+1)<0.15时,说明选择r个基因作为内参基因即可保证结果稳定可靠。由图58可知:本实验所有样品的V2/3<0.15,说明在Cd胁迫下选择2个基因作为内参基因,结果稳定可靠,无需选择更多基因。
2.3.3 Normfinder分析 NormFinder软件是根据表达稳定值(S值)对基因的稳定性进行排序,S值越小基因表达越稳定。NormFinder分析结果(图6)表明:在Cd胁迫下,构树的根,叶组织中,10个候选内参基因表达稳定性排名从高到低依次为:BpDOUB(0.175) >BpNADH(0.208)>BpActin(0.214》BpHIS(0.287)>BpUBE2(0.324) >BpTUA(0.328)>BpHSP(0.740)>Bpβ-TUB(0.815)>BpRPL8(1.246)>BpGAPDH(3.947),即在Cd胁迫下构树中BpDOUB(0.175)和BpNADH(0.208)表达稳定性较高,而BpGAPDH(3.947)的稳定性最低,不适合作为内参基因使用。
2.3.4 BestKeeper分析 Bestkeeper主要是通过比较各候选内参基因CT值之间的标准偏差(SD)和变异系数(CV)来评价基因的稳定性。当SD值<1.0时,即认为该基因表达相对稳定。Bestkeeper的分析结果(表2)表明:BpGAPDH(3.40)>1.0,不适合作为内参基因,其余9个候选基因的SD值均<1.0,说明大多数候选内参基因表达较稳定,候选内参基因表达稳定性排序从高到低依次为:BpNADH(0.32)>BpHIS(0.47)>BpUBE2(0.48)>BpDOUB(0.55)>BpActin(0.61)>BpHSP(0.67)>BpTUA(0.71)>Bpβ-TUB(0.93)>BpRPL8(0.95)>BpGAPDH(3.40),其中,Bp NADH的SD和CV值最小(SD=0.32,CV=1.19),稳定性最好。
2.3.5 RefFinder分析 为避免单一内参基因评价程序引起结果误差,通过在线分析工具RefFinder对3个软件的基因表达稳定性排序进行几何平均值计算,几何平均值越小,基因的表达稳定性越高。结果(表3)所示,各基因综合稳定性排序从高到低依次为BpDOUB(1.41)>BpNADH(2.34)>BpUBE2 (2.59) >BpHIS (2.83) >BpActin(4.16)>BpTUA (6.24)>BpHSP(6.74)>Bpβ-TUB(8.24)>BpRPL8(8.74)>BpGAPDH(10.00)。说明BpDOUB(1.41)和BpNADH(2.34)表达稳定性优于其它基因,可作为Cd胁迫下构树qRT-PCR分析首选内参基因,而BpGAPDH(10.00)基因表达最不稳定,不宜作为Cd胁迫下构树的内参基因。
2.3.6内参基因稳定性验证 为验证筛选出的内参基因可靠性,采用qRT-PCR技术对Cd胁迫下BpDREB基因在构树叶片以及根部的表达模式进行研究,使用筛选出的最佳内参基因Bp DOUB、BpNADH及其组合BpDOUB+BpNADH作为标准化因子,以最不稳定的内参基因BpGAPDH为参照,对BpDREB基因表达水平进行验证。结果(图7)表明:使用不同的内参基因得到的Bp DREB表达量之间存在较大差异。分别以稳定性好的BpDOUB、BpNADH以及BpDOUB+BpNADH作为内参基因时,Bp DREB基因的表达模式一致。总体来看,在Cd处理下,构树叶片及根部的BpDREB表达量均呈上调趋势,叶片中BpDREB的表达量在96h达到最高点,根部72 h达到最高点;而用最不稳定的内参基因BpGAPDH为参照时,会导致完全不同的结果。因此,不合适的内参基因会导致目的基因表达水平偏差,影响实验的准确性,进一步验证了以BpDOUB和BpNADH作为内参基因的可靠性。
3讨论
土壤重金属污染已成为目前亟待解决的环境问题之一,Cd是最具威胁的重金属元素,对植物生长和人体健康都造成严重威胁。作为重金属区群落恢复的先锋树种,构树对重金属Cd具有极高的富集能力,研究构树抗逆机制,解析其响应Cd的基因表达调控网络,挖掘构树相关抗逆基因,有助于阐明构树Cd胁迫适应机制。实时荧光定量PCR是分析基因表达水平和调控模式的主要手段之一,选择表达稳定的内参基因是准确分析目的基因表达量的前提,以往研究结果表明,内参基因不具有绝对通用性,若不经筛选而以常见管家基因为内参基因,得到的结果精确度大幅度降低,甚至得到错误结果。以往构树基因表达研究常直接以Actin为内参,可能存在一定误差。近年来,随着构树基因组测序的完成和构树转录调控水平研究的深入,开展构树内参基因筛选能够为后续功能基因的表达分析提供重要的基础。
在非模式植物中,结合植物转录组数据库进行内参基因筛选是有效的方法之一,目前已在杉木(Cunninghamia lanceolata(Lamb.) Hook.)、麦缘锦楸(Catalpa fargesii Bur.)、福建柏(Fokieniahodginsii (Dunn) Henryet Thomas.)等多种植物中应用。有研究发现,在甘蓝型油菜(Brassica napus L.)转录组数据库挖掘到的内参基因UXS3、SAP5、ARFA IE的表达稳定性优于传统内参基因Actin 7。本研究结合构树转录组数据库,初步选择10个常见管家基因作为候选内参基因,通过qRT-PCR技术,并结合geNorm、NormFinder和BestKeeper软件对构树Cd胁迫下不同组织器官表达稳定性进行评估。由于各软件的运算逻辑及使用的统计学方法不同,各分析软件中内参基因表达稳定性排名略有差异,如geNorm与NormFinder软件分析结果均显示BpDOUB基因表达稳定性最好,而Bestkeeper软件分析结果则显示BpNADH基因表达较稳定。这种现象在杨树(Populus deltoides、)、扇脉杓兰(Cypripedium japoricum Thunb.)以及其它植物内参基因研究中也有出现。RefFinder是一种候选内参基因稳定性综合分析的程序,已被广泛用于内参基因筛选研究中。为对内参基因稳定性进行综合评价,本研究利用RefFinder对10个候选内参基因稳定性进行综合评估,基因表达稳定性从高到低依次为BpDOUB、BpNADH、BpUBE2、BpHIS、BpActin、BpTUA、BpHSP、Bpβ-TUB、BpRPL8、BpGAPDH。为避免单个内参基因造成实验误差,通常选择2个或多个基因作为内参基因调整系统偏差,得到更准确的基因表达定量结果,本研究中用geNorm软件确定了内参基因最佳数量,各候选内参基因的变异系数(V2/3)均<0.15,说明在Cd胁迫下构树仅需要2个内参基因即可得到可靠结果。最终确定BpDOUB和BpNADH为Cd胁迫条件下构树荧光定量结果标准化分析的最佳内参基因组合。
DREB是植物中特有的转录因子,植物遭受逆境胁迫后,DREB通过与逆境抗性基因启动子区的DRE/CRT(脱水反应元件)顺式元件发生特异性相互作用,调节一系列下游基因(包含DRE/CRT元件)的表达,增强植物逆境的抗性,已经在构树、甘薯(Dloscorea esculenta(Lour.)Burkill)、刚毛柽柳(Tamarix hispida Willd.)等多种植物研究中发现DREB基因可以被重金属Cd诱导上调表达,可用于验证筛选出的内参基因的可靠性。本研究分别使用筛选出的最佳内参基因BpDOUB、BpNADH及其组合为内参基因,同时以稳定性最差的基因BpGAPDH为参照,分析Cd胁迫下BpDREB基因在构树根部以及叶片中的表达模式,结果显示:使用表达稳定的基因(BpDOUB、BpNADH)进行基因表达水平归一化时,逆境胁迫响应基因BpDREB在Cd处理下构树的根部和叶部表达模式基本一致,均为上调表达,而用不稳定的BpGAPDH基因为参照时,基因表达水平明显不同,进一步验证了筛选出的内参基因的准确性。综上表明,选择适合的内参基因对于分析目的基因表达变化至关重要。
4结论
本研究通过qRT-PCR技术并结合内参基因稳定性分析软件geNorm、NormFinder、BestKeeper和RefFinder对候选内参基因的表达稳定性进行评价,确定BpDOUB和BpNADH为构树Cd胁迫条件下最适内参基因组合,并通过逆境胁迫响应基因BpDREB进一步验证筛选的内参基因的准确性。本研究结果为构树Cd胁迫下目的基因表达分析提供了可靠的内参基因,为开展构树耐Cd机理研究和重要功能基因发掘奠定基础。
