茯砖茶与羊乳复合乳体系的抗氧化、物理及消化稳定性研究
2023-04-29吕嘉枥王维波康婕伍金金
吕嘉枥 王维波 康婕 伍金金
摘 要:以陕西省特色的茯砖茶和羊乳为原料,以抗氧化稳定性、物理稳定性和消化稳定性为主要指标,研究茯砖茶与羊乳复合乳体系的稳定性.试验结果表明,25 ℃放置7 d的过程中,茯砖茶与羊乳复合乳体系抗氧化活性总体呈降低趋势,含活性金花菌的复合乳体系(样品1)的抗氧化稳定性最好,含无活性金花菌的复合乳体系(样品2)次之,不含金花菌的复合乳体系(样品3)最差.物理稳定性试验结果显示,茯砖茶与羊乳复合乳体系随着放置时间的延长,物理稳定性也不断降低,样品3的物理稳定性强于样品1、样品2;扫描电镜显微表征显示,茶汤中的金花菌与羊乳酪蛋白可形成复合物,从而降低了复合体系的物理稳定性.消化稳定性试验结果表明,随着消化时间的延长,酪蛋白体外消化率均不断增大,但與对照组相比,茯砖茶与羊乳复合乳体系抑制了乳蛋白的消化,且胃消化阶段抑制效果强于肠消化阶段,样品2的抑制效果最强,样品1次之,样品3最差.研究结果为进一步开发研制茯砖茶羊奶奶茶新产品提供了重要理论依据与技术支撑.
关键词:茯砖茶;羊乳;抗氧化稳定性;物理稳定性;消化稳定性
中图分类号:TS201.3
文献标志码: A
文章编号:2096-398X(2023)04-0048-10
Abstract:Taking the characteristic Fu Brick tea and goat milk of Shaanxi Province as raw materials,and taking the antioxidant stability,physical stability and digestive stability as the main indicators,the stability of the complex milk system of Fu Brick tea and goat milk was studied.The results showed that the antioxidant activity of the complex system of Fu Brick tea and goat milk decreased after being placed at 25 ℃ for 7 days.Among them,the antioxidant activity of the compound milk system containing activated eurotium cristatum was the best(sample 1),the second was the compound milk system containing inactive eurotium cristatum(sample 2),the last one is the compound milk system without eurotium cristatum(sample 3).The results of the physical stability test showed that the physical stability of Fu Brick tea and goat milk complex milk system decreased with the extension of time,the physical stability of sample 3 is stronger than that of sample 1 and sample 2,scanning electron microscope microscopic characterization showed that eurotium cristatum in tea soup could form a complex with casein from sheep milk,which reduced the physical stability of the complex system.Digestive stability test results show that the longer duration of digestion,casein in vitro digestibility are growing,but compared with the control group,Fu Brick tea with goat milk composite emulsion system inhibits milk protein digestion,and stomach digestion phase inhibition effect is stronger than the intestinal digestion phase,the strongest inhibitory effect of sample 2,second sample1,sample 3 is the worst.The research results provide important theoretical basis and technical support for further development of new products of Fu Brick tea and goat milk tea.
Key words:Fu Brick tea;goat′s milk;oxidation resistance stability;physical stability;digestion stability
0 引言
茶与乳复合作为奶茶饮用的历史悠久,因其营养丰富、香醇可口,深受消费者喜食.茶乳复合既能中和茶的苦涩味和奶的乳腥味,同时又能保留奶的浓郁和茶的清香,口感独特,滋味协调.茶作为天然的抗氧化剂能够抑制乳蛋白的氧化,提高乳的抗氧化能力[1].此外,乳中的钙离子和茶中富含的草酸在体外的结合降低了体内草酸摄入的浓度,减少了肾结石(草酸钙结石)在体内产生的风险[2],因此茶与乳复合的饮用方式深受不同饮用者喜爱.
但茶与乳复合时,茶、乳主要成分之间会发生相互作用,影响复合体系的稳定性.目前,有关茶与乳复合相关研究主要集中在工艺配方上,关于不同种类的茶与不同种类的乳复合制备奶茶的工艺配方研究,红茶奶茶[3,4]、乌龙茶奶茶[5]、抹茶奶茶[6]、普洱奶茶[7]、青砖茶奶茶[8]、茯砖茶奶茶[9]和绿茶羊奶茶[10]等都有研究.其中,红茶和牛奶是制备奶茶的主要原料[3-10].关于茶与乳复合之后活性成分的相互作用及其复合后各自的营养价值和稳定性的变化等研究,主要还是以红茶和牛奶为主[11-13].而茯砖茶与羊乳复合的研究较少.
茯砖茶被誉为西北各民族生命茶[14],具有降血糖、降血脂、减肥、抗氧化、抗肿瘤、抑菌、调节胃肠道等多种保健功能[15].羊乳被誉为“奶中之王”,在抗氧化、降低胆固醇、改善肠道功能、低致敏性、提高消化吸收等方面的作用都强于牛乳[16].另外,茯砖茶中含有大量独特的金花菌,金花菌具有很高的耐热性,孢子较大,悬浮于溶液中,在茯砖茶与羊乳复合过程中,金花菌对复合体系稳定性的影响亟待研究.因此,本研究以陕西省特色的茯砖茶和羊乳为原料,通过对茯砖茶与羊乳复合乳体系的抗氧化稳定性、物理稳定性和消化稳定性等方面研究,为进一步开发茯砖茶羊奶奶茶新产品提供理论依据与技术支持.
1 材料与方法
1.1 实验原料
1.1.1 原材料
茯砖茶:咸阳泾渭茯茶有限公司;羊乳:陕西金牛乳业有限公司.
1.1.2 培养基
PDA固体培养基:称取PDA培养基37.0 g,加入1 000 mL蒸馏水中,加热煮沸溶解,分装,121 ℃高压灭菌15 min,备用.
1.1.3 试剂样品及配置
磷酸氢二钠、三氯化铁、浓盐酸、磷酸二氢钾、浓硫酸、氢氧化钠、磷酸二氢钠、醋酸钾、硝酸铝,天津市科密欧试剂有限公司;硫酸亚铁、水杨酸、酒石酸钾钠、30% H2O2溶液、无水乙醇、铁氰化钾、三氯乙酸、氯化钠、冰乙酸、尿素、氯化亚锡、茶氨酸,天津市天力化学试剂有限公司;结晶乙酸钠,天津市恒兴化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),西安东升化工有限公司;芦丁标准品,国药集团化学试剂有限公司;以上试剂均为分析纯.
胃蛋白酶(猪胃黏膜)、胰蛋白酶(猪胰)、BCA蛋白检测试剂盒,福州飞净生物科技有限公司;PDA培养基,北京奥博星生物技术有限责任公司.
配制的主要试剂如下:
(1)DPPH溶液(0.2 mmol/L):准确称取7.88 mg DPPH,用无水乙醇定容至100 mL.
(2)0.3 M pH 3.6的醋酸缓冲液:称取0.364 g结晶乙酸钠,加入3.2 mL冰乙酸,蒸馏水定容至200 mL,再用1 mol/L HCL调节pH至3.6.
(3)10 mmol/L TPTZ溶液:0.078 g TPTZ用40 mM鹽酸溶液定容至25 mL.
(4)20 mmol/L FeCl3溶液:2.78 g FeCl3.6H2O用去离子水定容至50 mL.
(5)FRAP工作液:0.3 M pH 3.6的醋酸缓冲液、10 mmol/L TPTZ溶液、20 mmol/L FeCl3溶液按顺序以10∶1∶1的比例混合,现配现用.
1.2 仪器与设备
MJP型霉菌培养箱(北京中兴伟业仪器);UV-2600型紫外分光光度计(苏州莱顿仪器);HC-3018R型高速冷冻离心机(安徽中科中佳仪器);SYQ-DSX-280B型压力蒸汽灭菌锅(上海申安医疗器械厂);LECIA SMART生物显微镜(北京瑞克中义仪器);LitesizerTM500纳米粒度及zeta电位仪(奥地利安东帕);PHENOM-PRO台式扫描电镜(上海飞纳仪器)FJ200型高速分散均质机(广州越特科学仪器).
1.3 实验方法
1.3.1 茯砖茶茶汤的制备
首先,根据前期试验研究,以茶汤中茶多酚、茶黄素、茶红素、茶褐色的含量,及其与羊乳复合后的乳液的感官评分、氨基酸总量、黄酮总量、多酚总量、可溶性蛋白质总量、可溶性糖总量等的分析,选出了茯砖茶茶汤制备的最优条件为料水比1 g∶45 mL,浸提温度82 ℃,浸提时间30 min;其次,按照最优条件制备的茶汤,以离心沉淀率和感官评分为指标,得到茶汤和羊乳复合的最佳配比为2∶1;最后,在最佳浸提条件下制备了含活性金花菌的茶汤、含无活性金花菌的茶汤和无金花菌的茶汤三种茶汤.
(1)含活性金花菌的茶汤的制备:茯砖茶与水的料水比为1 g茶∶45 mL水,82 ℃浸提30 min后,100目过滤,取1 mL此茯砖茶茶汤通过PDA培养基培养5~7天检测其中金花菌活菌数为154 CFU/mL,该茶汤即为含活性金花菌的茶汤.通过光学显微镜制水浸片来观察茶汤中的金花菌,然后将茶汤通过12 000 r/min离心10 min,去掉上清液,将底部少量沉淀用扫描电镜观察茶汤中的金花菌,均发现有活性金花菌的存在.
(2)含无活性金花菌的茶汤的制备:将制备好的含活性金花菌的茶汤通过95 ℃、10 min的加热条件杀菌,再用PDA培养基检测金花菌活菌数,未检测到活的金花菌,所以将制备的含活性金花菌的茶汤通过95 ℃、10 min灭菌处理,就可以得到含无活性金花菌的茶汤.通过光学显微镜制水浸片来观察茶汤中的金花菌,然后将茶汤通过12 000 r/min离心10 min,去掉上清液,将底部少量沉淀用扫描电镜观察茶汤中的金花菌,均观察到无活性的金花菌.
(3)无金花菌的茶汤的制备:将含活性金花菌的茶汤通过12 000 r/min离心10 min,再用0.45 um的微滤膜过滤两次,用光学显微镜观察此茶汤,光学显微镜下观察到的茯砖茶茶汤已经显示无金花菌存在,则能够完全去除金花菌颗粒得到无金花菌的茯砖茶茶汤.
1.3.2 茯砖茶与羊乳复合乳液的制备
分别将含活性金花菌的茶汤、含无活性金花菌的茶汤和无金花菌的茶汤与羊乳按2∶1的体积比混合均匀,得到三种茯砖茶与羊乳的复合乳液(分别标记为样品1、样品2、样品3),将此复合乳液于25 ℃下放置7天,并于0 d、1 d、3 d、5 d、7 d时取样,分析测试其抗氧化稳定性、物理稳定性和酪蛋白消化稳定性.
1.3.3 抗氧化稳定性分析
样品的前处理:参考颜慧等[17]的研究并稍作改进,分别取0 d、1 d、3 d、5 d、7 d时的样品1、样品2和样品3 10 mL,加入5 mL 95%的乙醇、3 mL 10 g/L的三氯乙酸溶液和1 mL 10 g/L的氯化钠溶液,最后用95%的乙醇定容至25 mL,静置10 min后过滤,检测滤液中的茶多酚含量、总抗氧化活性、DPPH自由基清除率、羟自由基清除率、总还原力.
1.3.4 物理稳定性分析
分别取0 d、1 d、3 d、5 d、7 d时的样品1、样品2和样品3,拍照观察样品的沉淀分层现象,检测其离心沉淀率,用纳米粒度和zeta电位仪检测其中的平均粒径和zeta电位;用光学显微镜和扫描电镜观察茯砖茶中的金花菌与羊乳酪蛋白的复合情况.
1.3.5 消化稳定性分析
分别取0 d、1 d、3 d、5 d、7 d时的样品1、样品2和样品3,测定样其中的蛋白质的体外消化率和抗氧化活性的变化,以等量蒸馏水和等量羊乳复合做空白对照.
模拟胃消化:分别取30 mL样品溶液,用2 mol/L盐酸溶液调节pH值到3.0,按照1∶100的比例加入胃蛋白酶,37 ℃恒温水浴,震荡酶解2 h,胃消化完成后调节各组pH值到7.5终止消化.消化时,分别在0.5 h、1 h、2 h的时取样分析.
模拟肠消化:将剩余的胃消化液继续进行肠消化试验.同样按1∶100的比例加入胰蛋白酶,37 ℃恒温水浴,震荡酶解2 h,肠消化完成后,沸水浴10 min终止消化.分别在0.5 h、1 h、2 h的时取样分析.
1.3.6 数据统计与分析
每组试验数据平行测定三次,用Excel 2021软件计算平均值和标准偏差,Origin 2021软件作图,SPSS 25.0软件对数据进行显著性分析,p<0.01或者p<0.05.
1.4 检测方法
1.4.1 扫描电镜显微表征
参考文献[18]方法,取待测样品,高速离心后去掉上清液,取沉淀物用2.5%的戊二醛溶液固定3~4 h,然后5 000 r/min离心10 min去除上清液.用无菌磷酸盐缓冲液清洗三次,每次均需離心去除上清液.使用乙醇梯度(30%、50%、75%、100%)脱水10 min,然后同样离心去除上清液.将上述处理后的样品放入烘箱60 ℃干燥处理,干燥好的样品放置于真空镀膜装置镀金,喷金后的样品即可在扫描电镜下观察.
1.4.2 茶多酚含量
采用GB/T 21733-2008《茶饮料》中的酒石酸亚铁比色法测定茶多酚含量[19].
1.4.3 总抗氧化活性
参考刘宇等[20]的方法,以1~10 mmol/L不同浓度的FeSO4溶液浓度值为横坐标,吸光度为纵坐标绘制标准曲线,如图1所示.
用移液枪吸取供试样液100 μL,加入FRAP工作液3 mL,37 ℃反应10 min,于593 nm处测吸光度.将吸光度值代入标准曲线y=0.307 01x-0.007 89即可得到总抗氧化活性FRAP值(mmol/L).
1.4.4 DPPH自由基清除率
测定加样的程序如表1所示.按表1加入试液后,混合均匀,避光反应30 min,分别在517 nm波长下测定吸光值A样、A空、A对,DPPH自由基清除率(%)=[1-(A样-A空)/A对] ×100%.
1.4.5 羟自由基清除率
依次将1 mL FeSO4溶液(9 mmol/L)、1 mol水杨酸(9 mmol/L)及1 mol试样加入到10 mL离心管中,混匀后加入1 mL H2O2(8.8 mmol/L)引发反应,反应在37 ℃下进行30 min后用紫外分光光度计测定510 nm处的吸光度值.以水代替H2O2测定样品的本底吸光度值,以蒸馏水代替试样测空白对照的吸光度值.利用公式(1)计算羟自由基清除率:
式(1)中:A0为空白对照样品吸光度,Ax为试样吸光度,Ax0为水替代H2O2的本底吸光度.
1.4.6 总还原力
采用铁氰化钾还原法[20]检测总还原力,总还原力以吸光度值的大小表示.
1.4.7 离心沉淀率
称取10 mL离心管的质量记为m0,分别加入8 mL试样,称取离心管和试样的质量之和记为m1,3 000 g离心30 min,去掉清液后称取沉淀物和离心管的质量之和记为m2,离心沉底率(%)=(m2-m0)/(m1-m0)×100%.
1.4.8 平均粒径
纳米粒度和zeta电位仪相关参数:90 °散射角,颗粒吸收率0.887 2,颗粒折射率1.450,分散剂折射率1.330,分散剂为水.样品池直径为1 cm,加样体积不超过2/3,测定温度为 25±1 ℃,由仪器自带的软件计算平均粒径.
1.4.9 zeta电位
纳米粒度和zeta电位仪相关参数与平均粒径的检测设定相同.加样量(1 mL以下)不超过最大刻度线.
1.4.10 蛋白质体外消化率
取待测试液和等体积10%的三氯乙酸溶液混合,4 000 r/min离心10 min,取上清液,用BCA蛋白检测试剂盒检测蛋白质浓度,并计算含量,计算时需减去消化0 h的上清液中蛋白质含量.按公式(2)~(4)计算蛋白质胃消化率(PDG)、蛋白质肠消化率(PDI)、蛋白质总消化率(PDT):
式(2)~(4)中:P0为样品中的蛋白质含量/mg;P1、P2分别为模拟胃液、肠液消化后上清液中的蛋白质含量/mg.
2 结果与讨论
2.1 茶汤的显微表征
茯砖茶中有独特并且大量存在的金花菌,图2为含活性金花菌的茶汤中金花菌的显微特征,图3为含无活性金花菌的茶汤的显微特征.
由图2、图3可知,含活性金花菌的茶汤中金花菌的子囊果较为完整,扫描电镜下只有很少的子囊果破裂,子囊孢子的形态良好;而含无活性金花菌的茶汤中金花菌的子囊果破裂较多,光学显微镜下观察到子囊孢子较多地释放到茶汤中,且扫描电镜下部分子囊孢子有干瘪的迹象.说明温度过高能够使金花菌的子囊果破裂,子囊孢子失去活性,从而使含活性金花菌的茶汤变为含无活性金花菌的茶汤.
2.2 茯砖茶与羊乳复合乳体系的抗氧化稳定性
2.2.1 茶多酚含量的变化
由图4可知,茶汤和羊乳复合0 d时,样品1、样品2、样品3的茶多酚含量相差不显著;放置1 d 时样品1、样品2的茶多酚含量显著高于样品3的茶多酚含量;放置3 d时样品1的茶多酚含量显著高于另外两组,3 d时样品1、样品2、样品3的茶多酚含量分别为15.56 mg/g、12.15 mg/g、11.88 mg/g;放置5 d时样品1、样品2、样品3的茶多酚含量之间都有显著性差异,且样品1的茶多酚含量最高,样品2次之,样品3含量最低;放置7 d时同3 d时,样品1的茶多酚含量明显高于另外两组.
2.2.2 总抗氧化活性的变化
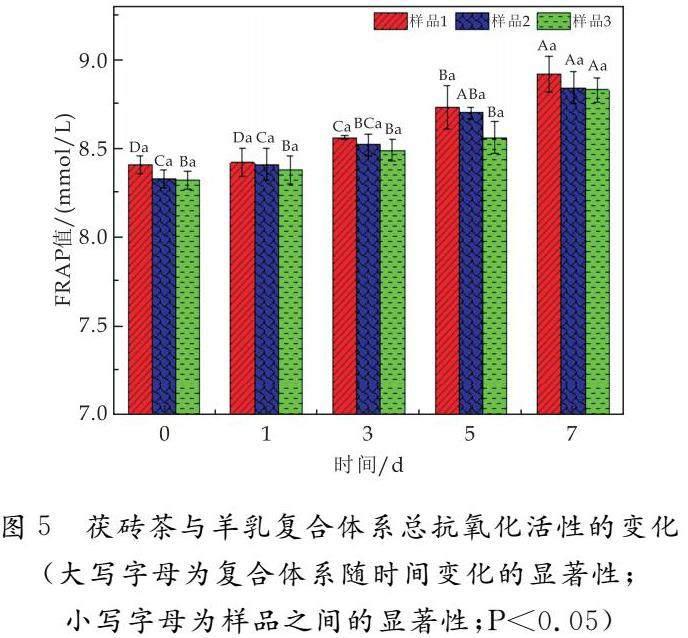
由图5可知,随着放置时间的延长,样品1、样品2、样品3的铁离子还原总抗氧化活性都不断增大,并且一直是样品1的FRAP值最大,样品2的FRAP值次之,样品3的FRAP值最小;放置3 d时,样品1、样品2、样品3的FRAP值分别为8.56 mmol/L、8.52 mmol/L、8.49 mmol/L.另外,样品1放置3 d时总抗氧化活性显著增强,样品2放置5 d时总抗氧化活性显著增强,而样品3放置7 d时总抗氧化活性才显著增强.说明金花菌有利于提高茯砖茶茶汤和羊乳复合体系的抗氧化稳定性.
2.2.3 DPPH自由基清除率的变化
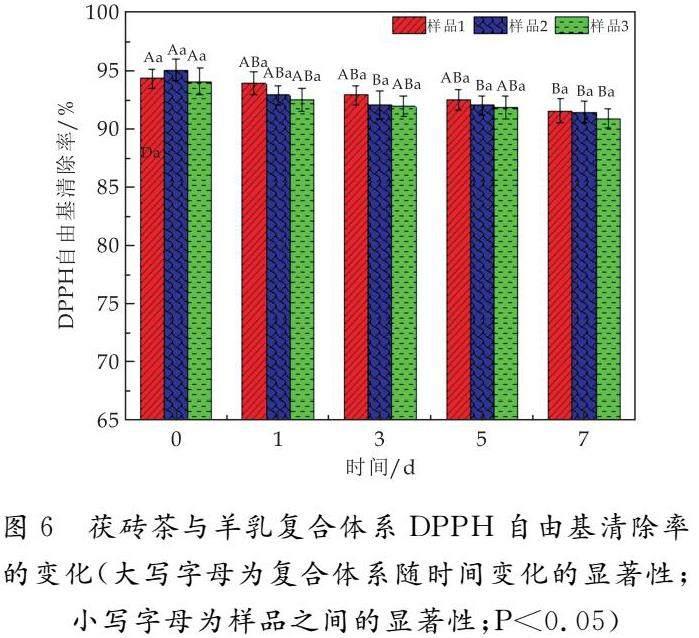
由图6可知,随着放置时间的延长,样品1、样品2、样品3的DPPH自由基清除率都在不断降低,这与总抗氧化活性的结果正好相反.其中,样品1、样品2的DPPH自由基清除率在放置7 d时显著降低,而样品3的DPPH自由基清除率在放置3 d时就显著降低,说明茶汤中的金花菌具有延缓茯砖茶茶汤和羊乳复合体系抗氧化活性降低的作用.复合0 d时,样品2的DPPH自由基清除率最高,为94.98%;但放置1 d后,三个样品的DPPH自由基清除率一直是样品1最大,样品2次之,样品3最小;放置3 d时,样品1、样品2、样品3的DPPH自由基清除率分别为92.82%、92.04%、91.87%.
2.2.4 羟自由基清除率的变化
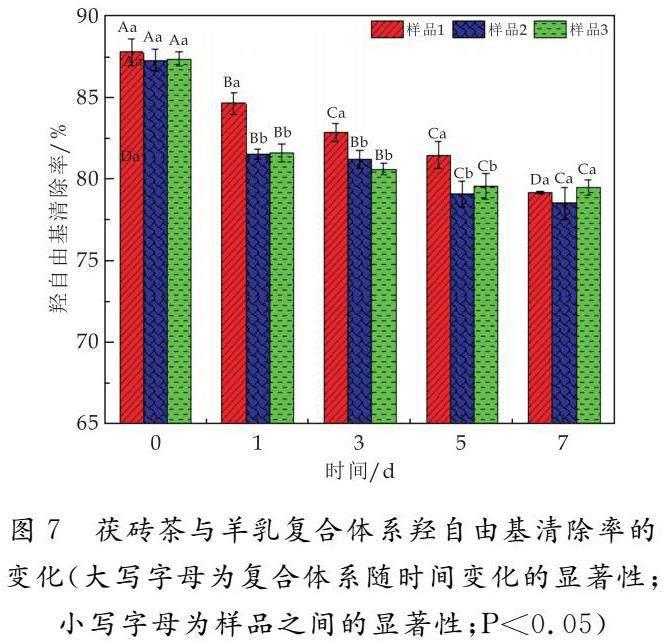
由图7可知,随着放置时间的延长,样品1、样品2、样品3的羟自由基清除率也在不断降低,这与2.2.3的结果一致.复合0 d时,三组样品的羟自由基清除率差异不显著,但是在放置1 d、3 d和5 d时,样品1的羟自由基清除率都显著高于另外两组,到放置7 d时三组样品之间的羟自由基清除率才没有显著性差异.说明茶汤中的活性金花菌在一定时间(0 d~5 d)内有利于延缓茯砖茶茶汤和羊乳复合体系抗氧化活性的降低.放置3 d时,样品1、样品2、样品3的羟自由基清除率分别为82.80%、81.16%、80.56%.
2.2.5 总还原力的变化
由图8可知,随着放置时间的延长,样品1、样品2的总还原力呈略微波动后降低的趋势,样品3的总还原力逐渐降低,放置7 d时三组样品的总还原力低于复合0 d时的总还原力.放置3 d时样品1、样品2的总还原力有增强现象可能是茶汤中金花菌包含的活性物质随着子囊果的破裂和子囊孢子的解离被释放出来从而增强体系的总还原力.另外,放置3 d、5 d时样品1、样品2的总还原力显著高于样品3的总还原力.说明茶汤中的金花菌(包括活性和无活性金花菌)在一定时间(0~5 d)内有利于延缓茯砖茶茶汤和羊乳复合体系抗氧化活性的降低.放置3 d时,样品1、样品2、样品3的总还原力分别为1.873、1.858、1.777.
2.3 茯砖茶与羊乳复合乳体系的物理稳定性
2.3.1 平均粒径的变化
由圖9可知,样品1、样品2、样品3,0 d时体系的水动力学平均粒径无显著性差异;放置1 d时,样品1、样品3的平均粒径略有减小,说明短时间内复合体系的颗粒有轻微溶解,物理稳定性仍然维持较好;放置1 d时样品2的平均粒径略有增大,显著大于另外两组,可能是样品2的金花菌子囊孢子和羊乳酪蛋白接触比表面积更大,所以放置1 d时体系的物理稳定性低于样品1和样品3;放置3 d时样品1、样品2的平均粒径开始显著增大,且显著大于样品3的平均粒径,说明样品1、样品2的稳定性在放置3 d时显著降低;样品3在放置1 d、3 d时的平均粒径无显著性变化,放置5 d时平均粒径才显著增大,说明样品3的稳定性在放置5 d时显著降低;放置3 d时,样品1、样品2、样品3的平均粒径分别为897.41 nm、1029.09 nm、475.21 nm;说明含金花菌的茶汤和羊乳复合体系的稳定性低于无金花菌的茶汤和羊乳复合体系的稳定性.
2.3.2 zeta电位的变化
由图10可知,样品1、样品2、样品3,0 d时复合体系的zeta电位绝对值无显著性差异;随着放置时间的延长,样品1、样品2、样品3的zeta电位绝对值都不断降低,说明茯砖茶茶汤和羊乳复合体系随放置时间的变化稳定性不断降低;样品1、样品2的zeta电位绝对值在第3 d显著降低,说明含金花菌的茶汤和羊乳复合体系在放置3 d时变得不稳定;而样品3的zeta电位绝对值在放置5 d时才陡然降低,说明无金花菌的茶汤和羊乳复合体系在放置5 d时变得不稳定;放置3 d时,样品1、样品2、样品3的zeta电位绝对值分别为18.07 mV、17.83 mV、20.93 mV;所以无金花菌的茶汤和羊乳复合体系的稳定性强于含金花菌的茶汤和羊乳复合体系.
2.3.3 离心沉淀率的变化
由图11可知,样品1、样品2、样品3,0 d时体系的离心沉淀率无显著性差异;随着放置时间的延长,样品1、样品2、样品3的离心沉淀率都不断增大,说明茯砖茶茶汤和羊乳复合体系随时间的变化稳定性不断降低;样品1、样品2的离心沉淀率在放置3 d时陡然增大,说明含金花菌的茯砖茶茶汤和羊乳复合体系在放置3 d时变得不稳定;样品3的离心沉淀率在放置5 d时才陡然增大,说明无金花菌的茶汤和羊乳复合体系在放置5 d时变得不稳定;放置3 d时,样品1、样品2、样品3的离心沉淀率分别为10.04%、10.29%、6.93%;所以无金花菌的茶汤和羊乳复合体系的稳定性强于含金花菌的茶汤.
2.3.4 沉淀分层的变化
由图12可知,样品1、样品2、样品3,0 d时体系保持物理稳定,无沉淀分层现象,随着放置时间的延长,样品1、样品2在3 d时发生沉淀分层现象,样品3在3 d时仍然保持物理稳定,在放置5 d时才发生沉淀分层现象,这与上文检测的平均粒径、zeta电位、离心沉淀率等数据所反应的结果一致,样品3相对于样品1和样品2与羊乳复合体系的物理稳定性更好.
总之,无金花菌的茶汤和羊乳复合体系的物理稳定性强于含金花菌的茶汤,金花菌对复合体系维持物理稳定性有显著抑制作用,金花菌可能会和羊乳体系中的酪蛋白相互作用从而导致复合体系发生沉淀分层现象.
2.3.5 茶汤与羊乳复合乳体系的显微表征
由图13、图14可知,茯砖茶与羊乳复合体系中,释放到茶汤中的金花菌子囊孢子会被羊乳酪蛋白胶束包裹.由于样品2中的金花菌子囊果绝大部分破裂,子囊孢子分散开,散落的子囊孢子与羊乳酪蛋白接触的比表面积更大,包裹更充分,因此很难被扫描电镜观察到,偶然观察到几个子囊孢子结合在酪蛋白胶束中;样品1中未破裂的金花菌子囊果内部的子囊孢子无法和羊乳酪蛋白结合,只有子囊果破裂后,散落的子囊孢子才能够和羊乳酪蛋白充分结合;总之,无论是含活性金花菌还是含无活性金花菌的茶汤,和羊乳复合后,其中的金花菌都会和羊乳酪蛋白结合形成复合物,从而可能降低复合体系的物理稳定性,这也解释了为什么含金花菌的茶汤和羊乳复合体系的物理稳定性低于无金花菌的茶汤.
2.4 茯砖茶与羊乳复合乳体系的消化稳定性
茯砖茶与羊乳复合乳体系的蛋白胃消化率、肠消化率和总消化率的变化如图15~17所示.由图15~17可知,PDG、PDI、PDT分别代表蛋白质模拟体外胃消化率、蛋白质模拟体外肠消化率和蛋白质模拟体外总消化率.
在胃消化30 min时,样品1、样品2、样品3的PDG分别从16.38%降低到14.87%、13.60%(P<0.05)和14.97%;胃消化60 min时,分别从23.95%降低到18.38%(P<0.000 1)、16.60%(P<0.000 1)和19.77%(P<0.001);胃消化120 min时,分别从28.33%降低到20.95%(P<0.000 1)、18.17%(P<0.000 1)和23.66%(P<0.001).
在腸消化30 min时,样品1、样品2、样品3的PDI分别从34.22%降低到28.21%(P<0.01)、27.23%(P<0.01)和29.29%(P<0.01);肠消化60 min时,分别从50.51%降低到40.24%(P<0.001)、38.52%(P<0.000 1)和43.18%(P<0.01);肠消化120 min时,分别从53.57%降低到43.65%(P<0.000 1)、40.08%(P<0.000 1)和46.84%(P<0.001).
其中,样品1、样品2、样品3的PDG在120 min时分别降低了26.05%、35.86%、16.48%,降低呈显著性;样品1、样品2、样品3的 PDI在120 min时分别降低了18.52%、25.18%、12.56%,降低呈显著性.说明样品1、样品2、样品3对乳蛋白在胃消化阶段的抑制作用大于肠消化阶段,这可能是因为胃消化阶段为酸性环境,而肠消化阶段为碱性环境,而蛋白质在酸性条件下难溶,在中性和碱性条件下易溶,所以在胃消化阶段,羊乳蛋白以不溶性的胶体或颗粒形式存在,茶汤此时和羊乳复合,其包含的活性成分更易包裹在蛋白质周围形成较大的粒子从而阻碍其消化.
另一方面,在胃消化阶段,样品1、样品2、样品3的蛋白质体外消化率分别从30 min的14.87%、13.6%、14.97%增长到120 min的20.95%、18.17%、23.66%,增速分别为40.89%、33.60%、58.05%;肠消化阶段则分别从28.21%、27.23%、29.29%增长到43.65%、40.08%、46.84%,增速分别为54.73%、47.20%、59.92%;进一步说明了样品1、样品2、样品3在肠消化阶段的消化作用强于胃消化阶段,即在胃消化阶段的抑制作用大于肠消化阶段.
总之,随着消化时间的延长,蛋白质体外消化率不断增大.样品1、样品2、样品3的模拟体外胃消化率、肠消化率和总消化率均显著低于对照组,说明茶汤和羊乳复合有利于降低乳体系的蛋白质的模拟体外消化率,主要原因可能是茶湯中主要是多酚等小分子活性成分,它们易于和乳中蛋白质结合从而降低蛋白质的体外消化率,这与杜淑霞等[21]的研究一致.另外,样品2的体外蛋白质胃消化率、肠消化率和总消化率最低,样品1次之,样品3最高.说明金花菌在茶汤和羊乳复合体系中也能够起到降低乳中蛋白质体外消化率的作用,且无活性的金花菌的作用强于活性金花菌的作用,这可能是因为金花菌也能够和羊乳蛋白结合从而降低蛋白质的体外消化率,而由显微表征可知,无活性金花菌因其大部分子囊果破裂,子囊孢子和活性成分释放更充分,更增大了其与羊乳蛋白质接触的比表面积,所以其降低乳蛋白体外消化率的作用更强.
3 结论
试验以陕西省特色茯砖茶和羊乳为原料,制备了三种茯砖茶茶汤,且分别与羊乳进行复合,较为全面系统地研究了复合乳体系的抗氧化稳定性、物理稳定性和消化稳定性,表明了二者复合后对三种稳定性均有不同的影响.
其中,随着放置时间的延长,抗氧化活性呈现降低趋势,茯砖茶中的金花菌有利于维持茯砖茶与羊乳复合体系的抗氧化稳定性,且活性金花菌的作用强于无活性金花菌;随着放置时间的延长,物理稳定性不断降低,茯砖茶中的金花菌不利于维持茯砖茶与羊乳复合体系的物理稳定性,通过扫描电镜发现可能是由于金花菌能够与羊乳酪蛋白结合形成复合物;而随着消化时间的延长,复合体系的消化作用不断增强,肠消化阶段的消化作用强于胃消化阶段,茯砖茶中的金花菌对复合体系的消化有抑制作用,且无活性金花菌的抑制作用强于活性金花菌,无活性金花菌的子囊孢子释放更充分,和羊乳酪蛋白结合的比表面积更大,所以对体外消化的抑制作用更强.
研究结果表明了茯砖茶与羊乳复合的可行性,揭示了茯砖茶中的金花菌是影响茯砖茶与羊乳复合体系稳定性的因素,金花菌对复合体系抗氧化稳定性的影响较小,对物理稳定性和消化稳定性的影响较大,且无活性金花菌的作用强于活性金花菌.研究结果为进一步开发茯砖茶羊奶奶茶新产品提供了重要理论依据与技术支持.
参考文献
[1] 赵钜阳,姚恒喆,石长波.多酚与蛋白质相互作用及其对蛋白质影响[J].食品与生物技术学报,2020,39(12):14-20.
[2] Noonan S C,Savage G P.Oxalate content of foods and its effect on humans[J].Asia Pacific Journal of Clinical Nutrition,2015,8(1):64-74.
[3] 杨庆莹,谢克英,王彦平,等.奶茶工艺配方的研究[J].河南农业,2015,26(8):62-64.
[4] 阮巧莉,韩俊成,代 濛,等.新疆奶茶对小鼠生理生化指标的影响[J].现代食品,2021,7(9):94-100.
[5] 傅新征,张美玲.大红袍奶茶加工工艺的研究[J].武夷学院学报,2014,33(5):28-32.
[6] 王国宇,张 维,张 铁,等.抹茶奶茶固体饮料研制[J].福建茶叶,2014,36(4):16-19.
[7] 杨薇红,韩艳丽,洪文龙,等.紫薯普洱奶茶的配方优化研究[J].农产品加工,2017,16(6):14-16.
[8] 闫 舒,王凌琴,刘红娜.不同工艺条件对青海传统蒙古奶茶品质的影响[J].中国奶牛,2019,37(6):48-54.
[9] 邵 帅,李宗军,李 珂,等.正交试验法优化茯砖茶奶茶配方[J].农产品加工(学刊),2013,12(13):37-38,42.
[10] 王 攀.核桃羊奶茶的研制[J].陕西农业科学,2014,60(9):50-53.
[11] Ryan L,Petit S.Addition of whole,semiskimmed,and skimmed bovine milk reduces the total antioxidant capacity of black tea[J].Nutrition Research,2010,30(1):14-20.
[12] 刘夫国,马翠翠,王 迪,等.蛋白质与多酚相互作用研究进展[J].食品与发酵工业,2016,42(2):282-288.
[13] Wu X L,Wang W P,Zhu T,et al.Phenylpropanoid glycoside inhibition of pepsin,trypsin and α-chymotrypsin enzyme activity in kudingcha leaves from ligustrum purpurascens[J].Food Research International,2013,54(2):1 376-1 382.
[14] 李佳莲,胡博涵,刘素纯,等.微生物与茯砖茶品质形成研究进展[J].食品工业科技,2010(9):406-408,413.
[15] 王 宇,胡文忠,管磬馨,等.茯砖茶主要化学成分及其功效研究进展[J].大连民族大学学报,2020,22(1):16-20.
[16] 李 贺,马 莺.羊乳营养及其功能性特性[J].中国乳品工业,2017,45(1):29-33,49.
[17] 颜 慧,张 鹏,邹勇平,等.奶茶饮料中茶多酚含量测定的方法改进[J].食品安全导刊,2017,11(36):154-156.
[18] 李 颖,李明春.真菌生物学实验教程[M].北京:科学出版社,2015.
[19] GB/T 21733-2008,茶饮料[S].
[20] 刘 宇,熊 亮,彭 成,等.姜黄醇提物化学成分及其抗氧化活性分析[J].食品科学,2019,40(12):226-231.
[21] 杜淑霞,欧仕益,贝惠玲,等.茶多酚与牛奶蛋白互作对蛋白质离体消化率的影响[J].食品与发酵工业,2010,36(2):76-79.
【责任编辑:陈 佳】
基金项目:陕西省科技厅重点研发计划项目(2022NY-027)
作者简介:吕嘉枥(1964—),女,陕西三原人,教授,研究方向:食品微生物
