脑脊液中miRNAs对胶质瘤诊断价值的Meta分析
2023-04-29冯强冯书彬董留建王朝林齐林李涛
冯强 冯书彬 董留建 王朝林 齐林 李涛
【摘要】 目的 系统评价脑脊液中miRNAs对胶质瘤的诊断价值。方法 检索Cochrane图书馆、PubMed、Embase、万方数据库、中国期刊全文数据库和中国维普数据库,检索时间为建库起至2021年3月,收集脑脊液中miRNAs在胶质瘤中诊断价值的文献。采用诊断准确性研究的质量评估方法2(QUADAS-2)对纳入文献进行质量评价,应用Stata 14.0和Meta-Disc 1.4软件进行数据分析。结果 共纳入9篇文献14项研究,累计胶质瘤患者427例,对照组423例。Meta分析结果显示合并灵敏度为0.80(95% CI:0.76~0.84),特异度为0.84(95% CI:0.81~0.88),阳性似然比为5.28(95% CI:3.53~7.89),阴性似然比为0.22(95% CI:0.14~0.35),诊断比值比为29.05(95% CI:15.42~54.76);综合受试者工作特征曲线下面积(AUC)为0.908 3(Q*=0.840 3)。结论 脑脊液中miRNAs在胶质瘤中具有较高的诊断性能,可以作为其潜在的诊断标志物。
【关键词】 微小RNAs;胶质瘤;诊断;Meta分析
【中图分类号】 R739.41 【文献标志码】 B 【文章编号】 1672-7770(2023)02-0195-05
Abstract: Objective To systematically evaluate the diagnostic value of miRNAs in cerebrospinal fluid for glioma. Method Cochrane Library, PubMed, Embase, WanFang Database, China National Knowledge Infrastructure and VIP Database were searched and retrieved. The literature of miRNAs in cerebrospinal fluid for the diagnosis of glioma were obtained from inception to March 2021. Quality assessment of diagnostic accuracy studies-2(QUADAS-2) was used to evaluate the quality of included literature. STATA 14.0 and Meta-Disc 1.4 were used to conduct all statistical analyses. Results A total of 9 articles and 14 studies were included, with 427 patients with glioma and 423 in the control group. Meta analysis showed that the combined sensitivity was 0.80(95% CI:0.76-0.84), the specificity was 0.84(95% CI:0.81-0.88), the positive likelihood ratio was 5.28(95% CI:3.53-7.89), the negative likelihood ratio was 0.22(95% CI:0.14-0.35), and the diagnostic odds ratio was 29.05(95% CI:15.42-54.76). The area under the working characteristic curve(AUC) of the comprehensive subject was 0.908 3(Q*=0.840 3). Conclusion MiRNAs in cerebrospinal fluid have high diagnostic performance and can be used as potential diagnostic markers for glioma.
Key words: miRNAs; glioma; diagnosis; Meta-analysis
基金项目:2018年度河南省医学科技攻关计划(联合共建项目)(2018020671)
作者单位:450000 郑州,郑州大学附属儿童医院,河南省儿童医院(郑州儿童医院)神经外科
通信作者:齐林
胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,约占恶性脑肿瘤的81%[1]。根据WHO分类分为低级别胶质瘤(low-grade glioma,LGG)即Ⅰ-Ⅱ级和高级别胶质瘤(h-gradhige glioma,HGG)即Ⅲ-Ⅳ级,级别越高、恶性程度越高、预后越差,尤其是Ⅳ级胶质母细胞瘤,1年生存率为40.8%,而5年生存率仅为6.8%[2]。因此,对于胶质瘤的早期识别尤为重要。微小RNAs(microRNAs,miRNAs)是一类小的非编码RNA,是基因表达的关键调节因子,与肿瘤的发生发展密切相关 [3]。研究表明,miRNAs在多种疾病尤其是肿瘤性疾病中异常表达,而脑脊液中miRNAs也常被作为胶质瘤潜在的诊断标志物被研究[4-12],但结果不尽相同。本研究旨在通过Meta分析系统评价脑脊液中miRNAs对胶质瘤的诊断效能。
1 资料与方法
1.1 文献检索 检索数据库包括Cochrane图书馆、PubMed、EMBASE、万方数据库、中国期刊全文数据库和中国维普数据库,文献检索时间均为建库起至2021年3月。中文数据库检索词:胶质瘤、胶质母细胞瘤、微小RNA、miRNA、microRNA、miR、診断、标志物、灵敏度和特异度、ROC曲线、脑脊液;英文数据库检索词:glioma、glioblastoma、neuroglioma、miRNA、microRNA、miR、diagnosis、biomarkers、sensitivity and specificity、ROC curve、CSF、cerebrospinal fluid。
1.2 文献筛选标准 纳入标准:(1)实验组为金标准(病理检查)确诊的胶质瘤患者;(2)报道了脑脊液中miRNAs对胶质瘤的诊断能力;(3)能获得完整的四格表数据(真阳性、假阳性、假阴性和真阴性);(4)实验组和对照组样本总量≥20例。排除标准:(1)无有效数据的研究;(2)非临床研究、综述、病案报告、会议摘要。
1.3 资料提取与质量评价 由两名研究者独立进行文献筛选、提取数据、评价文献质量,并交叉核对,出现不同意见时与第三方讨论解决。资料提取主要包括研究第一作者、发表年份、种族、胶质瘤类型、对照组情况、脑脊液来源、样本量、miRNA类别以及诊断参数(灵敏度、特异度)。质量评价主要根据诊断准确性研究的质量评价方法2(quality assessment of diagnostic accuracy studies-2,QUADAS-2)清单进行质量评估[13]。QUADAS-2从4个部分(病例选择、待评价试验、金标准、病例流程和进展情况)和2个方面(偏倚风险和临床适用性)评估研究。标志性问题的回答包括“是”“否”“不确定”, 对应偏倚风险等级为“低”“高”“不确定”。将结果为“是”的计1分,“否”或“不确定”则为0分。
1.4 统计学方法 应用Stata 14.0和Meta-Disc 1.4软件进行数据分析。通过计算灵敏度对数与(1-特异度)对数的Spearman相关系数判断是否存在阈值效应;通过Cochran's Q检验和I2 检验评价由非阈值效应引起的异质性,I2>50%表示存在明显异质性。若存在阈值效应或明显异质性,则采用随机效应模型来合并计算灵敏度、特异度、阳性似然比(positive likelihood ratio,PLR)、阴性似然比(negative likelihood ratio,NLR)和诊断比值比(Diagnostic odds ratio,DOR),绘制综合受试者工作特征曲线(summary receiver operating characteristic curve,SROC)及获得曲线下面积(area under the curve,AUC),并进一步行回归分析、亚组分析探讨异质性来源;反之,则采用固定效应模型。此外,行敏感性分析检验结果的稳定性,绘制Deek's漏斗图评价发表偏倚。
2 结 果
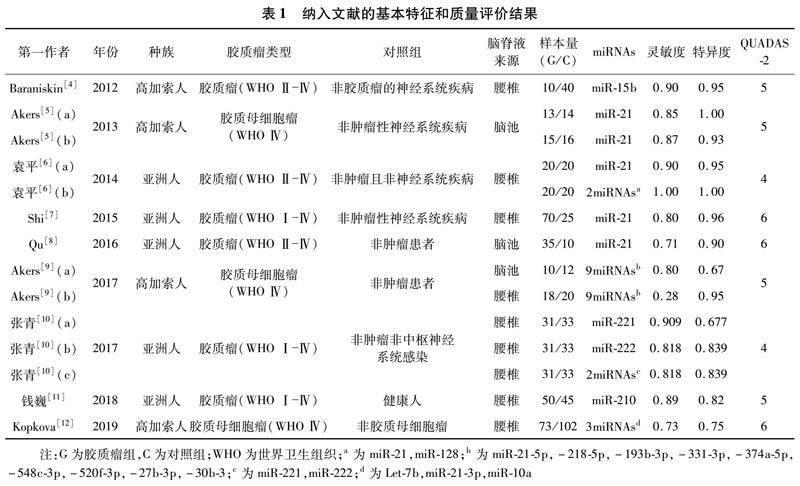
2.1 文献检索结果和质量评价 共检索出文献138篇,其中中文文献26篇,英文文献112篇。通过阅读题目、摘要及全文,根据纳入和排除标准,最终纳入9篇符合要求的文献[4-12],6篇为英文,3篇为中文。 纳入的9篇文献包含14组研究,850例研究对象,其中胶质瘤患者427例,对照组423例。见表1。
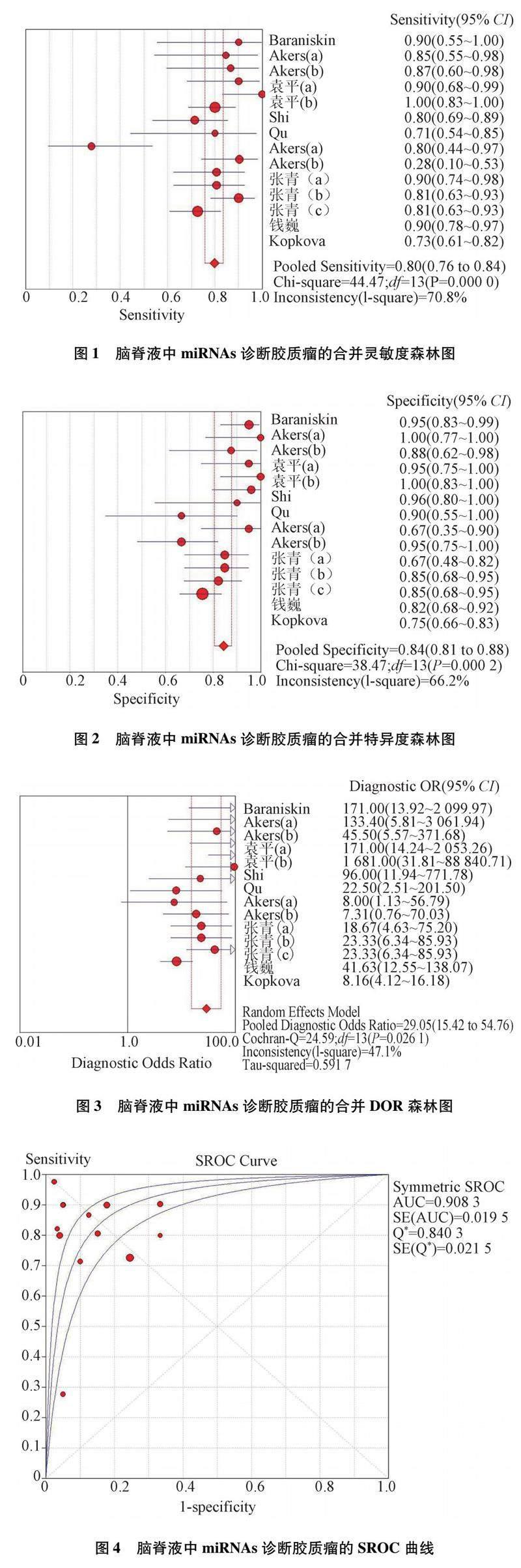
2.2 脑脊液中miRNAs诊断胶质瘤的价值 Spearman相关系数= -0.117,P=0.691,提示纳入研究不存在阈值效应。异质性检验提示研究间灵敏度(I2=70.8%)、特异度(I2=66.2%)、PLR(I2=54.4%)、NLR(I2=81.7%)均存在明显异质性,DOR(I2=47.1%)存在轻度异质性,采用随机效应模型进行Meta分析。结果显示合并灵敏度为0.80(95% CI:0.76~0.84),特异度为0.84(95% CI:0.81~0.88),PLR为5.28(95% CI:3.53~7.89),NLR为0.22(95% CI:0.14~0.35),DOR为29.05(95% CI:15.42~54.76);SROC曲线下面积(AUC)为0.908 3(Q*=0.840 3)。见图1-4。
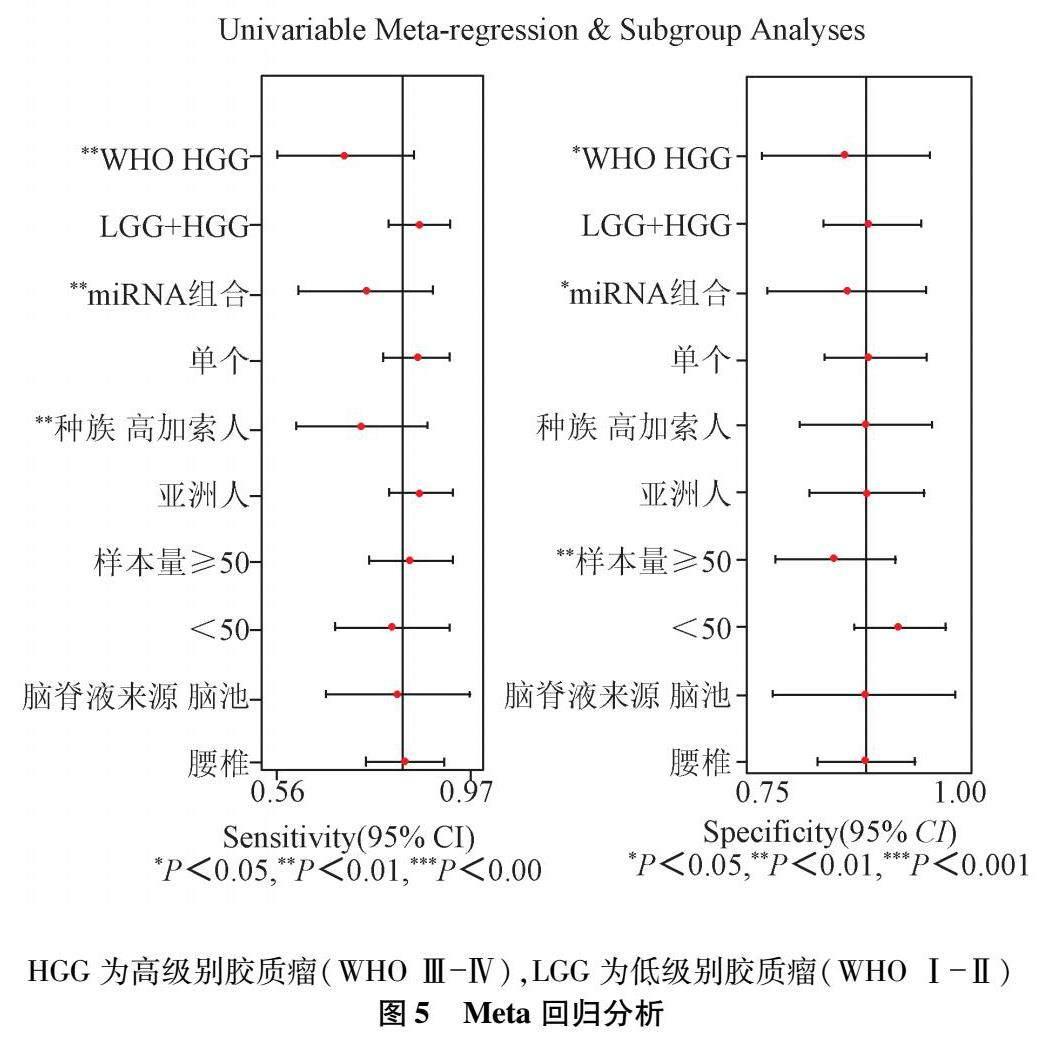
2.3 Meta回归分析和亚组分析 为进一步探索异质性来源,基于WHO分级(HGG/LGG+HGG)、miRNA类别(组合/单个)、种族(高加索人/亚洲人)、样本量(≥50/<50)和脑脊液来源(脑池/腰椎)进行Meta回归分析和亚组分析。回归分析结果显示,WHO分级、miRNA类别、种族是灵敏度异质性的潜在来源(P均<0.01),WHO分级、miRNA类别、样本量是特异度异质性的潜在来源(前两者P<0.05,后者P<0.01)。见图5。
亚组分析结果显示:(1)基于WHO分级分组,胶质瘤组WHO级别为LGG+HGG时灵敏度和特异度的I2均较整体下降,但级别为HGG时I2较整体上升;另外,级别为LGG+HGG时具有相对高的诊断性能,灵敏度和特异度分别为(0.84∶0.70)(0.87∶0.80);(2)按miRNA类别分组,单个miRNA时灵敏度和特异度的I2均较整体下降,而组合miRNA I2较整体上升;另外,单个miRNA较组合miRNA有更高的诊断性能,灵敏度和特异度分别为(0.84∶0.73)(0.87∶0.81);(3)按种族分组,亚洲人中灵敏度和特异度的I2均较整体下降,而高加索人中I2较整体上升;另外,亚洲人中较高加索人中具有更高的灵敏度(0.84∶0.71),而特异度差异较小(0.85∶0.83);(4)按样本量大小分组,样本量<50或≥50时灵敏度和特异度的I2有不同程度的上升或下降;另外,样本量<50者较≥50者特异度更高(0.92∶0.82),而灵敏度稍低(0.76∶0.81);(5)按脑脊液来源分组,脑池组中灵敏度和特异度的I2均较整体下降,而腰椎组中I2较整体上升;而诊断性能上不同脑脊液来源间差异不大。综上,亚组分析结果提示WHO分级、miRNA类别、种族、样本量和脑脊液来源均可能是异质性的來源,见表2。
2.4 敏感性分析 拟合优度和二元正态性分析,表明本研究的模型是可靠的。离群值检测提示发现1项异常值即Akers等[9](b),去除异常值后,合并灵敏度为0.82(95% CI:0.78~0.86),特异度为0.84(95% CI:0.80~0.87),结果未见明显变化,说明Meta分析结果较稳定。见图6。
2.5 发表偏倚分析 绘制Deek's 漏斗图评价发表偏倚,结果显示P=0.13>0.10,提示不存在发表偏倚。见图7。
3 讨 论
目前,组织病理学检查依然是胶质瘤诊断的金标准,影像学检查如正电子发射断层显像/计算机体层摄影术(PET/CT)和磁共振成像(MRI)是诊断和监测病情的主要常规方法[14],但侵入性操作、成本过高或对诊断的能力不足等原因使之对于胶质瘤的诊疗仍有欠缺。近年来,液体活检在肿瘤中显示出巨大的临床和研究潜力,其中,miRNAs因其可稳定地表达于血浆、尿液及其他体液中而成为疾病诊断标志物的研究热点[15-18]。对于胶质瘤而言,与其直接接触的脑脊液更是诊断性生物标志物的重要来源,已有诸多研究探讨了脑脊液中miRNAs对于胶质瘤的诊断价值[4-12],但结果差异较大。因此,本研究总结了近年来的相关研究进行系统评价。
本研究共纳入9篇文献14项研究,累计胶质瘤患者427例,对照组423例。纳入文献整体质量中等。Meta分析结果显示合并灵敏度、特异度、DOR、AUC分别为0.80、0.84、29.05、0.908 3,提示脑脊液中miRNAs对胶质瘤具有较高的诊断性能。对比近年其他关于miRNAs诊断胶质瘤的Meta分析,Zhou等[19]纳入28篇涵盖所有样本来源的研究合并灵敏度、特异度分别为0.85、0.90。He等[20]纳入18篇样本来源为血液的研究合并灵敏度、特异度分别为0.84、0.84。Zhao等[21]则纳入11篇关于miR-21的研究,合并灵敏度、特异度分别为0.83、0.92。本研究显示的脑脊液中,miRNAs对于胶质瘤的诊断性能与其他样本来源、综合样本来源或突出的单个miRNA相比,水平相当。
异质性检验提示,纳入研究间存在较大的异质性,Meta回归分析和亚组分析提示WHO分级、miRNA类别、种族、样本量、脑脊液来源可能均是导致异质性的原因。另外,亚组分析显示,胶质瘤组WHO级别为低级别和高级别混合者较单纯高级别者、单个miRNA较组合miRNA、亚洲人较高加索人、样本量<50者较≥50者相对具有更高的诊断性能,此结果与Zhou等[19]、 He等[20]、Zhao等[21]在不同样本来源或miRNA类别中的亚组分析结果不同。分析异质性较大及影响本研究Meta分析结果的可能原因:(1)不同研究间纳入对象的选择除病例组WHO分级不同外,对照组的选择也多样,如非胶质瘤的神经系统疾病(含其他肿瘤)、非肿瘤性神经系统疾病、非肿瘤疾病等,其中Kopkova等[12]病例组和对照组则分别是胶质母细胞瘤和非胶质母细胞瘤(含低级别胶质瘤、脑膜瘤、脑转移瘤),加之该研究样本量大,对整体结果则会产生一定影响,而因对照组选择过于多样及整体纳入文献偏少未进一步基于对照组的选择进行亚组分析;(2)各研究所检测的miRNAs种类不一,且仅能针对是单个或组合进行亚组分析,难以按具体指标一一分析;(3)多数纳入研究样本量小;(4)纳入研究的数量少,且均为病例对照研究,多数研究对于是否盲法描述不明,从而影响文献质量。
综上所述,脑脊液中miRNAs可以作为胶质瘤潜在的诊断标志物,但受诸多因素限制,尚需进一步开展高质量、大规模的研究,以提供更可靠的证据。
[参 考 文 献]
[1]Ostrom QT,Bauchet L,Davis FG,et al.The epidemiology of glioma in adults:a“state of the science”review[J].Neuro Oncol,2014,16(7):896-913.
[2]Ostrom QT,Cioffi G,Gittleman H,et al.CBTRUS statistical report:primary brain and other central nervous system tumors diagnosed in the United States in 2012—2016[J].Neuro Oncol,2019,21(Suppl 5):v1-v100.
[3]Romano G,Acunzo M,Nana-Sinkam P.microRNAs as novel therapeutics in cancer[J].Cancers(Basel),2021,13(7):1526.
[4]Baraniskin A,Kuhnhenn J,Schlegel U,et al.Identification of microRNAs in the cerebrospinal fluid as biomarker for the diagnosis of glioma[J].Neuro Oncol,2012,14(1):29-33.
[5]Akers JC,Ramakrishnan V,Kim R,et al.MiR-21 in the Extracellular Vesicles(EVs) of Cerebrospinal Fluid(CSF):a platform for glioblastoma biomarker development[J].PLoS One,2013,8(10):e78115.
[6]袁平,何曉英,李小刚.脑脊液中miR-21和miR-128诊断神经胶质瘤的价值[J].国际检验医学杂志,2014,35(18):2464-2465,2468.
[7]Shi R,Wang PY,Li XY,et al.Exosomal levels of miRNA-21 from cerebrospinal fluids associated with poor prognosis and tumor recurrence of glioma patients[J].Oncotarget,2015,6(29):26971-26981.
[8]Qu K,Lin T,Pang Q,et al.Extracellular miRNA-21 as a novel biomarker in glioma:evidence from meta-analysis,clinical validation and experimental investigations[J].Oncotarget,2016,7(23):33994-34010.
[9]Akers JC,Hua W,Li HY,et al.A cerebrospinal fluid microRNA signature as biomarker for glioblastoma[J].Oncotarget,2017,8(40):68769-68779.
[10]张青,仇诚,夏东彦,等.miR-221/miR-222家族在神经胶质瘤患者脑脊液中的表达及其诊断价值[J].临床神经外科杂志,2017,14(6):401-405.
[11]錢巍,潘云青.脑脊液小分子核糖核酸210对神经胶质瘤早期诊断的研究[J].中国慢性病预防与控制,2018,26(2):143-145.
[12]Kopkova A,Sana J,Machackova T,et al.Cerebrospinal fluid microRNA signatures as diagnostic biomarkers in brain tumors[J].Cancers(Basel),2019,11(10):1546.
[13]Whiting PF,Rutjes AWS,Westwood ME,et al.QUADAS-2:a revised tool for the quality assessment of diagnostic accuracy studies[J].Ann Intern Med,2011,155(8):529-536.
[14]Hu LS,Hawkins-Daarud A,Wang LJ,et al.Imaging of intratumoral heterogeneity in high-grade glioma[J].Cancer Lett,2020,477(5):97-106.
[15]Galva~o-Lima LJ,Morais AHF,Valentim RAM,et al.miRNAs as biomarkers for early cancer detection and their application in the development of new diagnostic tools[J].Biomed Eng Online,2021,20(1):21.
[16]焦婷婷,韩秋霞,张冬,等.微小RNA在糖尿病肾病中的作用机制研究进展[J].中华肾病研究电子杂志,2019,8(3):138-141.
[17]唐锦莉,严枫,王晓明,等.血浆miR-199a-5p与miR-200c-3p在胃腺癌中的临床应用[J].中华检验医学杂志,2015,38(6):402-406.
[18]王成,汪俊军.细胞外囊泡miRNA作为肿瘤新型液体活检分子指标的价值[J].中华检验医学杂志,2021,44(3):250-254.
[19]Zhou Q,Liu J,Quan J,et al.MicroRNAs as potential biomarkers for the diagnosis of glioma:a systematic review and meta-analysis[J].Cancer Sci,2018,109(9):2651-2659.
[20]He JM,Jiang Y,Liu L,et al.Circulating microRNAs as promising diagnostic biomarkers for patients with glioma:a meta-analysis[J].Front Neurol,2021,11(2):610163.
[21]Zhao XL,Xiao ZH,Li B,et al.miRNA-21 may serve as a promising noninvasive marker of glioma with a high diagnostic performance:a pooled analysis of 997 patients[J].Ther Adv Med Oncol,2021,13(1):1758835920987650.
(收稿2021-07-27 修回2021-12-03)
