基于真实问题情境下的高考化学实验复习
2023-04-25河北省衡水市故城县教育局教研室颜建河
■河北省衡水市故城县教育局教研室 颜建河
盘点近年来的高考化学实验试题,不难发现,通过题目中的真实情境呈现,考查必备知识,突出关键能力,注重学用结合。同时,强调了化学实验对能力考查的作用,要求考生能预测或描述实验现象,对观察、记录到的实验现象、实验结果和测得的数据进行分析处理,并得出正确结论的能力,真正做到“注重过程学习”这一指导方针。这就要求我们在复习中,必须打好扎实的基础学科基本功,要以真实问题情境为载体,建立科学的思维分析方法。要走进实验,从实验中感悟科学探究的方法,并不断地提出问题和解决问题,要对基础知识和基本技能进行深入的理解和归纳,直至创新,以最大程度的发展来提升能力。
一、以不同的视角审视已做过的实验,学会对知识的归纳、迁移,直至创新
高考试题以《课程标准》为依据,着眼教材,明确化学实验与探究的能力要求,这就要求我们在对化学实验的复习中,要从不同的视角审视已做过的实验,从深层次上提出问题。同时,要从大的方面去归纳整理,对一些细小的地方也要进行归纳和整理,切不可忽视。例如,在复习实验室制Cl2的实验时,要细致阅读教材中的演示实验,明确实验操作流程,理解实验原理,思考常规实验的非常规做法,同时,从操作到现象和原理都要熟练掌握。复习时做到多提问:①选择气体发生装置的条件有哪些? 中学常用的气体发生装置有几套? 分别适用于哪些气体的制备? ②除MnO2外,KMnO4、K2Cr2O7、KClO3等作氧化剂,是否可以制得Cl2? ③制得的Cl2中含有HCl、H2O,如何除去? 中学常见的干燥剂有哪些? 干燥装置有哪些? 使用干燥剂的原理及注意事项是什么? ④该实验为什么只能用浓盐酸? 收集有毒、有污染的气体时应注意些什么? 其实验装置如何设计? 等等。
例1实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色,易潮解,100 ℃左右时升华。图1 是两名学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。
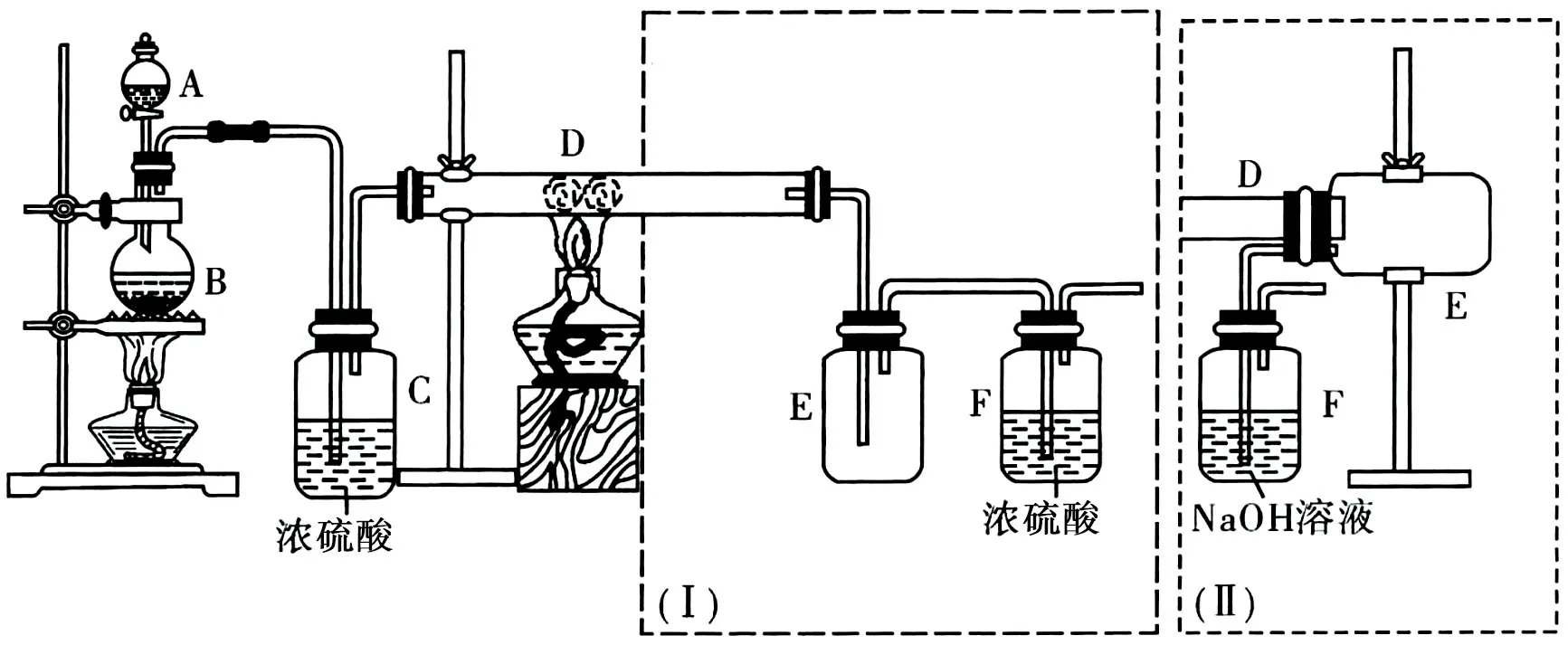
图1
试回答:
(1)B中反应的化学方程式为_____。
(2)D 中的反应开始前,需排除装置中的空气,应采取的方法是____。
(3)D 中反应的化学方程式为_____。
(4)装置(Ⅰ)的主要缺点是____。
(5)装置(Ⅱ)的主要缺点是____,如果选用此装置来完成实验,则必须采取的改进措施是_____。
解析:对于化学实验复习,要从过程开始,注重细节,善于归纳与总结。真实的实验问题的提出方式多种多样,对巩固所学知识,掌握实验基本操作技能,发展迁移、创新能力都将起到积极的促进作用。面对不同的实验装置,尽可能多提出问题,并能根据所学物理、化学原理去思考、判断、评价其装置的真正作用,最终学会对简单的实验进行设计。
(1)Cl2有何种重要物理、化学性质? 实验室采用何种装置进行制备? 采用何种方法(装置)进行干燥? 如何收集呢? 怎样证明Cl2将反应装置中的空气排净呢? 尾气能不经过处理直接排放到大气中吗? 用何种方法净化呢?
(2)何为升华现象? 易升华的物质能否采用导气管导出? 用何种方法导出最好呢?
(3)何为潮解现象? 对易潮解的物质应采用何种装置来防止其潮解呢?
针对上述问题的提出,结合所学知识,考生便可迅速解决(回答)以上问题,并能对该实验的设计、操作方法作出正确的全面的判断和评价。最终回答出两名学生所设计装置的缺陷与不足,从而在问题情境中提出问题、解决问题,实现在复习知识的过程中,正确、完整地解答出题目中的各个问题。
答案:(1)+Cl2↑+2H2O
(2)B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D
(4)导管易被产品堵塞;尾气中含没有反应完的Cl2,排入空气中易造成环境污染
(5)产品易受潮解 在瓶E 和F 之间连接装有干燥剂的装置
二、了解实验目的、步骤和原理,学会对简单的实验进行设计与评价
化学是一门以实验为基础的科学,高考试题对考生实验能力的考查,都是通过设计实验方案、描述实验操作步骤、推测实验结果等方式完成,且在高考中占有非常重要的地位。创建“问题”情境,通过恰当的“问题”设计,不仅可以突出复习重点,而且可以体现核心素养内涵,培养考生的综合能力。在复习化学实验内容时,要做到“一个了解、五个会”,即:了解实验目的、步骤和原理;会控制条件,会使用仪器,会观察分析,会解释结果得出相应结论,会设计简单的实验方案及评价。
例2实验室以含有Ca2+、Mg2+、Cl-、SO2-4、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
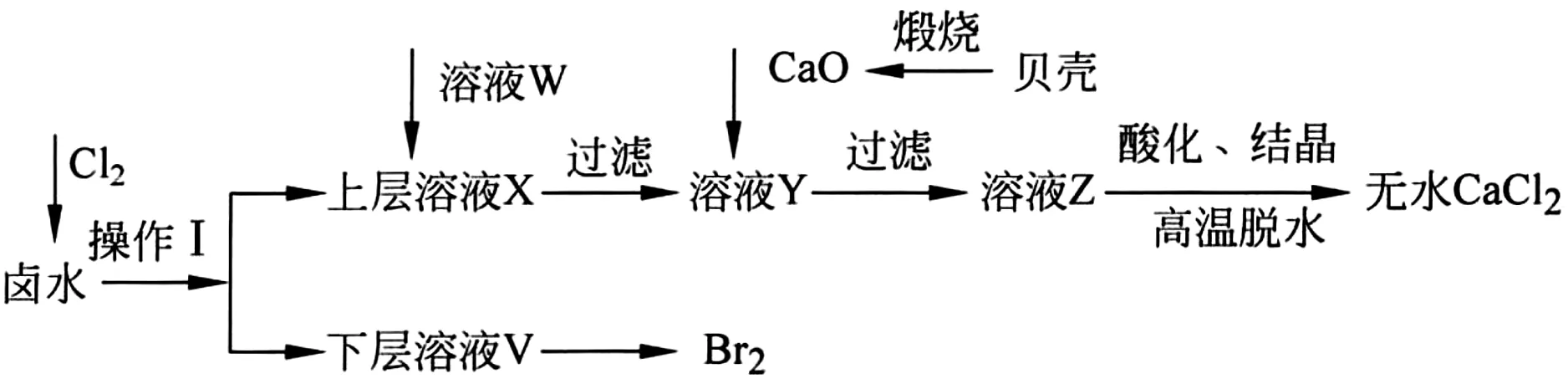
(1)操作Ⅰ使用的试剂是____,所用主要仪器的名称是_____。
(2)加入溶液W 的目的是____。用CaO调节溶液Y 的pH,可以除去Mg2+。由表1中数据可知,理论上可选择的pH 最大范围是____。酸化溶液Z时,使用的试剂为____。
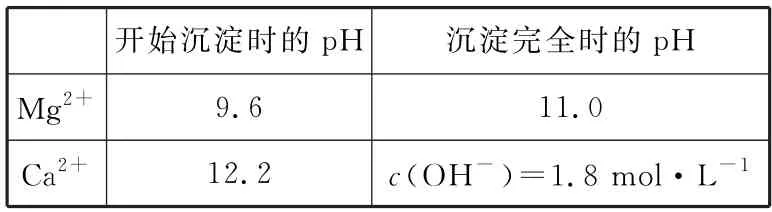
表1
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,图2所示装置中合理的是_____。

图2
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-3,H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH 小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于____。
设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论,仪器自选):___。
供选的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH 试纸。
解析:考生在面对这样的实验问题情境时,对所给框图转化及仪器都是熟悉的,但对其作用并不一定都清楚。这时考生要学会自己提出问题,并能根据所学物理、化学原理去思考、判断、评价其装置的真正作用,最终学会对简单的实验进行设计。
(2)因为加入CaO 的目的是除去Mg2+,故加入W 的目的是除去;为了不使Ca2+沉淀,pH 的理论值为11.0≤pH <12.2;酸化时,为不引入新的杂质离子,应选用盐酸。
(3)装置的选择,应从发生装置、除杂装置和收集装置三个方面分析。a中收集方法不对;c中的长颈漏斗应插在液面以下;b、d是合理的。
(4)要通过测pH 判断两种酸的酸性强弱,两种酸的浓度必须是相等的,而SO2的溶解度远大于CO2的溶解度,两饱和溶液的浓度不相等,故该实验的设计是错误的。
验证酸性强弱,最常用的原理是强酸置换弱酸,故实验步骤:将SO2通入NaHCO3溶液中,生成的气体再通过酸性高锰酸钾溶液除去过量的SO2,再用品红溶液检验SO2是否除尽,最后通入饱和石灰水中。
实验现象:品红溶液不褪色,饱和石灰水变浑浊。
实验结论:H2SO3酸性强于H2CO3。
答案:(1)四氯化碳 分液漏斗
(3)b、d
(4)用于比较pH 的两种酸的物质的量浓度不相等
三种参考方案如下:
方案一:配制相同物质的量浓度的NaHCO3和NaHSO3溶液,用酸度计(或pH试纸)测两种溶液的pH。前者的pH 小于后者,证明H2SO3酸性强于H2CO3
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水。品红溶液不褪色且澄清石灰水变浑浊,证明 H2SO3酸性强于H2CO3
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液。品红溶液不褪色,证明H2SO3酸性强于H2CO3
三、以知识和技能为载体,重新审视实验,学会对常规实验仪器的创新使用
实验是理科发展最重要的动力之一,实验是培养创新能力和实践能力的重要方式。高考化学实验题是借助实验情境来考查物质性质和反应原理,这是高考题的命题原点。要引导考生通过对“问题”的分析,形成假设,设计探究活动并进行验证,概括归纳所获得的结论。例如,在后期复习阶段,挖掘“教材”中的实验素材,创设“问题”情境来实现对知识的深层次理解,并不断强化基本实验操作,直至对常规实验的创新使用,提升科学素养。
例3绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN 溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:____、____。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)设为装置A,称重,记为m1g。将样品装入石英玻璃管中,再次将装置A 称重,记为m2g。按图3连接好装置进行实验。
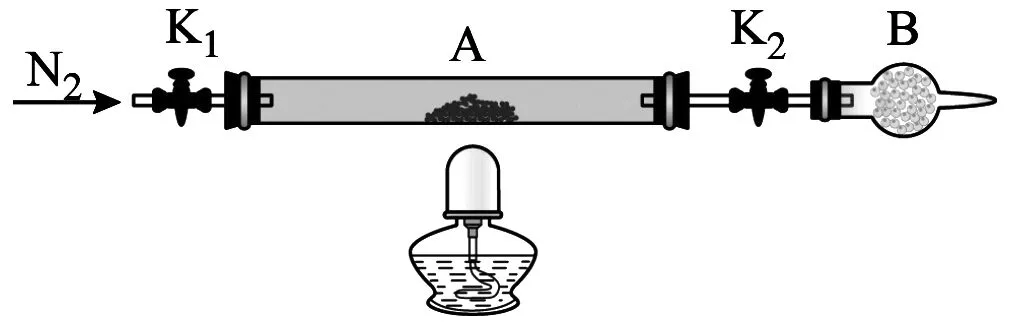
图3
①仪器B的名称是____。
②将下列实验操作步骤正确排序:_____(填标号);重复上述操作步骤,直至A 恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=____(列式表示)。若实验时按a、d次序操作,则使x_____(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A 接入图4所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
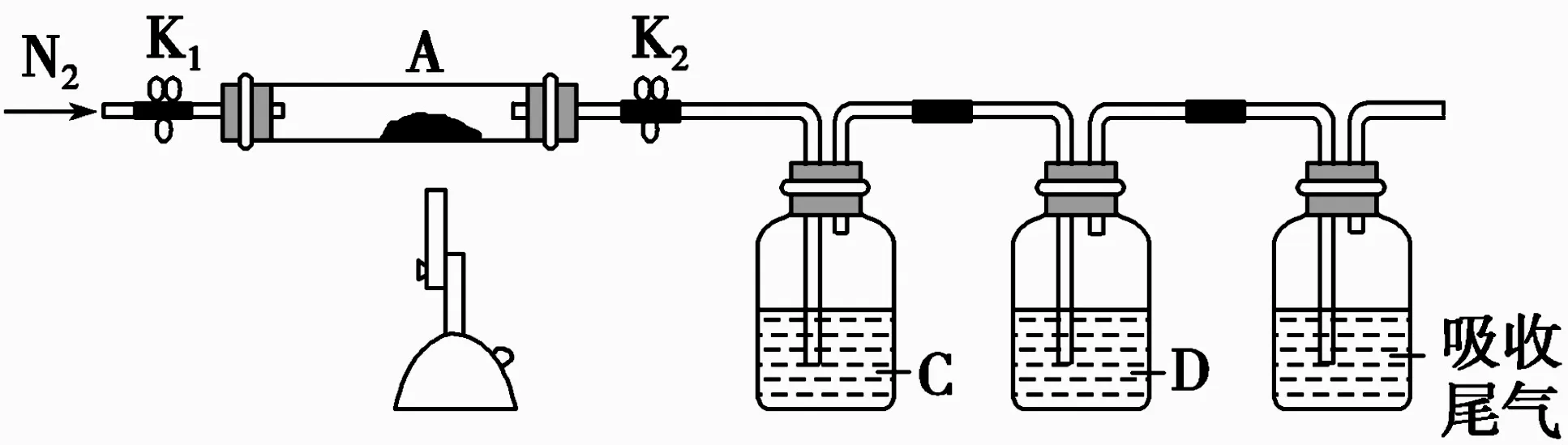
图4
①C、D 中的溶液依次为____(填标号)。C、D 中有气泡冒出,并可观察到的现象分别为_____。
a.品红 b.NaOH c.BaCl2
d.Ba(NO3)2e.浓硫酸
②写出硫酸亚铁高温分解反应的化学方程式:___。
解析:考生在面对真实情境下的实验素材,特别是涉及动手、创新能力方面的试题时,最关键的就是要联想到课本上介绍的类似相关实验,清楚影响实验效果的原因,并学会提出:有什么好的改进方法? 改进实验的关键点是什么? 等等。这样,就会明白解决问题的关键所在,就不难对试题中所设计出的方法进行评价,并能评价出各种方法的优劣,从而顺利地完成对试题的解答。
(1)从实验基本操作方法入手,取少量样品放入试管中,加适量水溶解,然后滴加KSCN 溶液,溶液颜色无明显变化,说明硫酸亚铁与KSCN 不反应;再向试管中通入空气,溶液逐渐变红,说明有Fe3+产生,即硫酸亚铁易被空气氧化为硫酸铁,Fe3+遇KSCN溶液显红色。
(2)①根据仪器装置图可知,B 是干燥管;②由于装置中含有空气,空气能氧化硫酸亚铁,则加热前需要排尽装置中的空气,可利用氮气排出空气。为了使生成的水蒸气完全排除,应先熄灭酒精灯,再冷却,然后关闭K1和K2,最后称量,即正确的排序是d、a、b、f、c、e。③依据题中条件,样品的质量是(m2-m1)g,加热后剩余固体是硫酸亚铁,由失水后的反应方程式可得出;若实验时按a、d次序操作,在加热过程中硫酸亚铁被空气氧化为硫酸铁,则导致m3偏大,使x偏小。
(3)从题给实验操作步骤可得出:①最终得到红色粉末,说明有氧化铁生成。即分解过程发生了氧化还原反应,依据化合价变化可知一定有SO2生成,说明硫酸亚铁分解生成氧化铁、二氧化硫和三氧化硫。三氧化硫溶于水生成硫酸,硫酸和Ba2+结合生成白色硫酸钡沉淀,由于硝酸钡在酸性溶液中有氧化性,能氧化SO2,则所选用试剂为BaCl2,检验SO2用品红溶液,所以C、D 的溶液依次为BaCl2溶液和品红溶液,实验现象是C 中溶液变浑浊,产生白色沉淀,D 中品红溶液褪色。②从上述分析可知,硫酸亚铁高温分解的方程式为。
答案:(1)样品中没有Fe3+硫酸亚铁(Fe2+)易被空气氧化为硫酸铁(Fe3+)
总之,考生在复习中必须有较强的问题与创新意识,在立足基础的同时,根据试题真实情境从不同的方位(角度)提出问题,并在提出问题的过程中逐一解决问题,直至进行新的发现——创新。这样,创新能力的培养才不只是停留在口头上,而是扎扎实实地得到落实,创新能力会得到较大程度的发展,在高考中才能做到战无不胜。
