高考化学模拟试题
2023-04-25广东省廉江市实验学校罗智颖
■广东省廉江市实验学校 罗智颖
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Sc 45 Fe 56
一、选择题:本题共7 个小题,每小题6分。共42分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.生活中处处有化学,下列叙述正确的是( )。
A.棉花、麻和蚕丝均为碳水化合物
B.使用食品添加剂不应降低食品本身营养价值
C.通过石油的常压分馏可获得石蜡等馏分,常压分馏过程为物理变化
D.维生素C可以氧化活性氧自由基
2.一种实现官能团异构化的反应如下,下列叙述正确的是( )。

A.化合物1分子中的所有原子共平面
B.化合物1与化合物2互为同系物
C.化合物2 分子中含有羧基、羟基和醚键
D.化合物1与化合物2可以通过氯化铁溶液进行鉴别
3.某白色粉末样品,可能含有Fe2(SO4)3、KMnO4、Al2(SO4)3、MgCl2、NH4Cl 和KHCO3。取少量样品配成无色溶液,进行如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH 溶液后白色沉淀部分溶解;②另取部分溶液,加入稀硝酸酸化的Ba(NO3)2溶液,有白色沉淀产生。该样品中确定存在的是( )。
A.Fe2(SO4)3、NH4Cl
B.NH4Cl、KHCO3
C.MgCl2、KMnO4
D.Al2(SO4)3、MgCl2
4.由实验操作和现象,可得出相应正确结论的是( )。
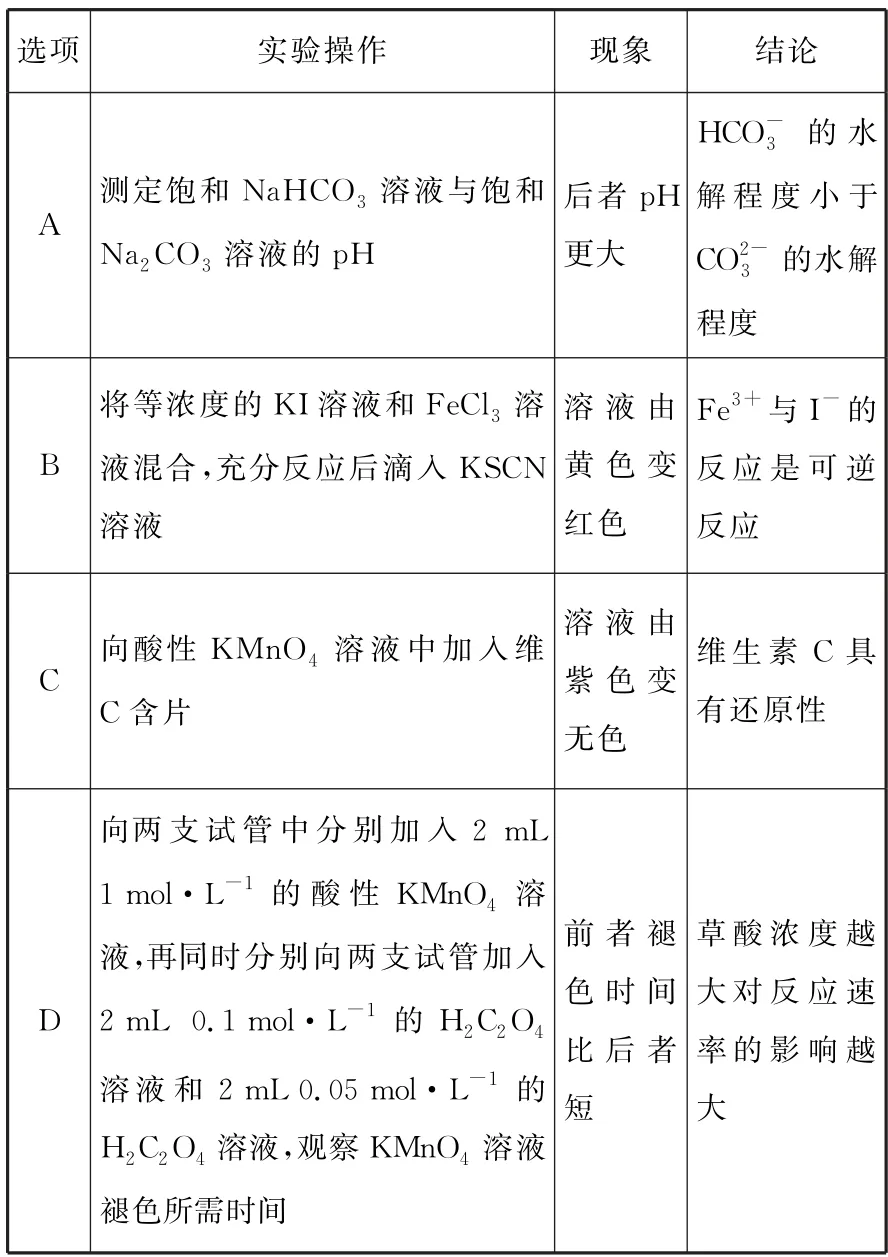
选项实验操作现象结论A测定饱和NaHCO3 溶液与饱和Na2CO3 溶液的pH后者pH更大HCO-3 的水解程度小于CO2-3 的水解程度B将等浓度的KI溶液和FeCl3 溶液混合,充分反应后滴入KSCN溶液溶液由黄色变红色Fe3+与I-的反应是可逆反应C向酸性KMnO4 溶液中加入维C含片溶液由紫色变无色维生素C 具有还原性D向两支试管中分别加入2mL 1mol·L-1 的酸性KMnO4 溶液,再同时分别向两支试管加入2mL0.1 mol·L-1 的H2C2O4溶液和2mL0.05 mol·L-1 的H2C2O4 溶液,观察KMnO4 溶液褪色所需时间前者褪色时间比后者短草酸浓度越大对反应速率的影响越大
5.钪的化合物晶体[Sc2(Y2Z4)3·6X2Z的摩尔质量为462 g·mol-1]可用作半导体镀层的蒸镀材料,X、Y、Z为三种短周期主族元素,且原子序数依次增大,且加和为15,Y6X6是一种常见有机溶剂,该钪的化合物晶体在空气中加热,随温度的变化情况如图1所示,下列叙述正确的是( )。

图1
A.X、Y、Z的单质常温下均为气体
B.Y、Z分别与X 形成的化合物的沸点:Z>Y
C.250 ℃ 时,晶体的主要成分是Sc2(Y2Z4)3·5X2Z
D.850 ℃时生成的固体化合物为Sc2O3
6.一种清洁、低成本的三步法氯碱工艺工作原理如图2所示,下列说法不正确的是( )。
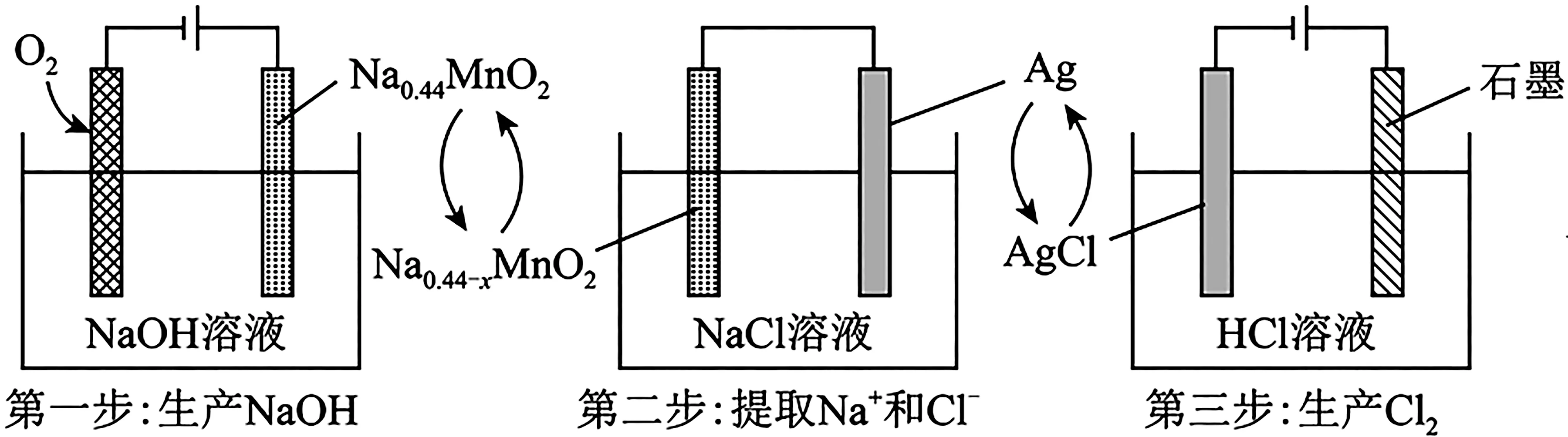
图2
A.第一步中阴极区溶液的pH 变大
C.第三步中,阴极反应式为2H++2e-
D.理论上每生产4 mol NaOH 和2 mol Cl2,可消耗1 mol O2
7.常温下,保持某含少量CaCO3浊液的水体中H2CO3与空气中CO2的平衡,调节水体pH,水体中-lg[c(X)]与pH 的关系如图3所示(其中X 为或Ca2+)。下列说法错误的是( )。
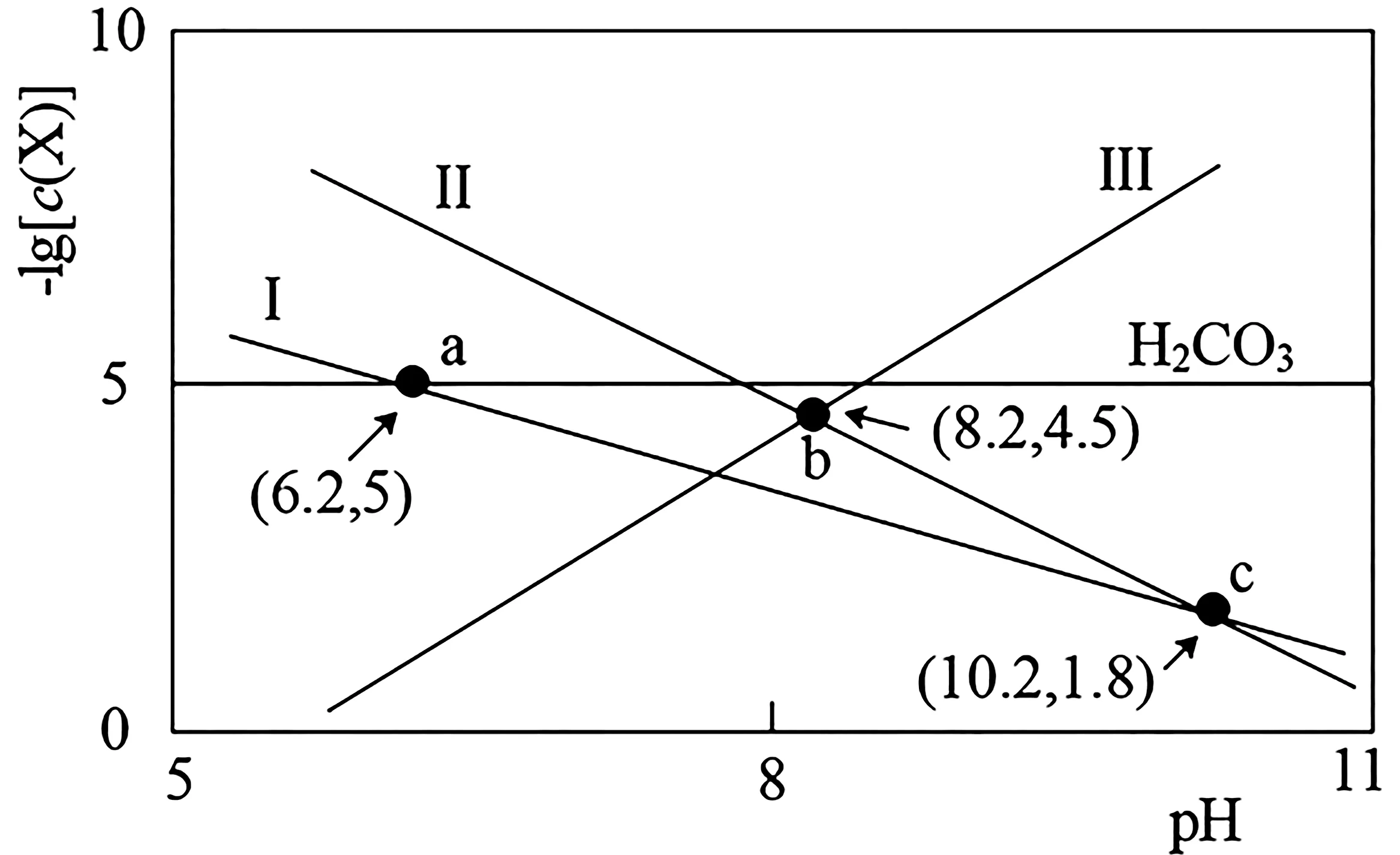
图3
B.该温度下,H2CO3的电离常数Ka2的数量级为10-11
D.向水体中加入适量Ca(OH)2固体,可使溶液由b点变到c点
二、非选择题:共58分,第8~10题为必考题,每个试题考生都必须作答。第11~12题为选考题,考生根据要求作答。
(一)必考题:共43分。
8.(14 分)我国对锆原料的需求量逐年增大,锆是一种稀有金属,具有惊人的抗腐蚀性能、极高的熔点、超高的硬度和强度等特性,被广泛用在航空航天、军工、核反应、原子能领域,工业上通过天然锆石(主要成分为ZrSiO4,同时含有Fe3O4和Al2O3等),制取锆和提取Al(OH)3的工艺流程如下。
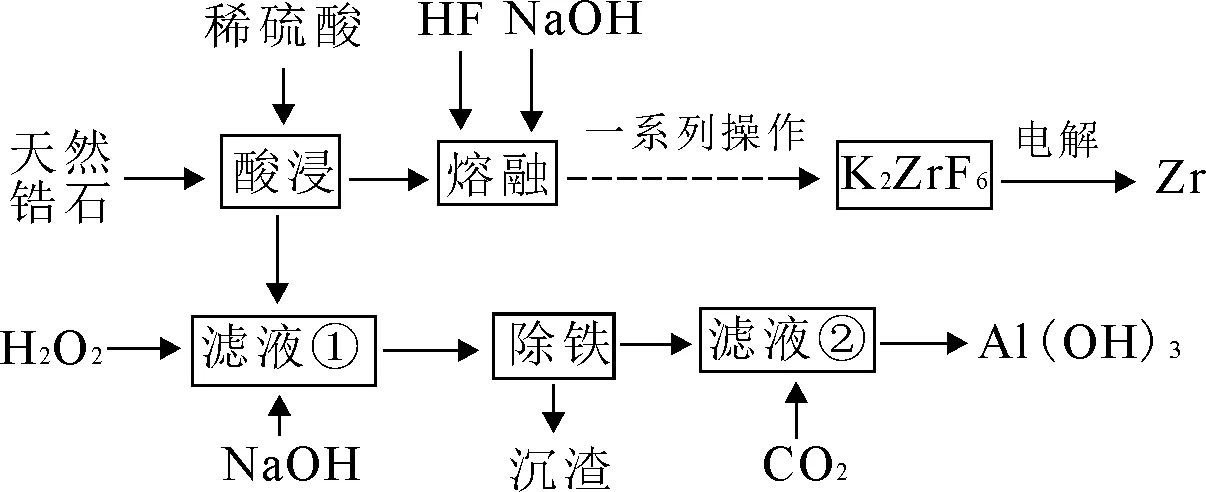
已知:①ZrSiO4与酸、碱不反应,Na2ZrF6、K2ZrF6均易溶于水,而K2ZrF6不溶于氨水。
②实验测得滤液②的pH=7.60;常温下Kw=10-14。
③pC=-lgc(C)[即pC 表示C 微粒浓度的负对数]。
回答下列问题:
(1)酸浸所得滤液①中属于盐的溶质的主要成分为____(写化学式)。
(2)在熔融态ZrSiO4、NaOH 中通入HF,可以得到Na2ZrF6,其化学反应方程式为____。
(3)“一系列操作”是指向冷却后的混合物中加入____溶液,经过抽滤、洗涤、干燥得到K2ZrF6。
A.氯化钾和氨水 B.氯化钾和硫酸
C.氯化铵和硫酸 D.KOH 和氨水
(4)1824年瑞典的J.J.Berzelius首先用钾还原K2ZrF6时制得金属锆,但不够纯,反应方程式为K2ZrF6+4K ==Zr+6KF,该反应中氧化产物与还原产物物质的量之比为____;工业上以石墨为电极,电解硫酸-K2ZrF6熔融液制得金属锆,同时伴有一种酸性气体,其阴极的电极反应式为____。
(5)检验“除铁”操作中Fe3+沉淀完全的操作方法是____,常温下向滤液②中通入二氧化碳可将铝元素恰好转化为沉淀,则溶液中=____。Al(OH)3+OH-,K=10-0.63]
9.(14 分)三草酸合铁(Ⅲ)酸钾{K3[Fe(C2O4)3]·xH2O}是一种翠绿色晶体,能溶于水,难溶于乙醇,见光易分解,是制备某些活性催化剂的主要原料。制备三草酸合铁(Ⅲ)酸钾晶体并测定其组成的实验步骤如下:
Ⅰ.将4.0 g绿矾配成溶液,加入20 mL的饱和H2C2O4溶液,加热,搅拌,静置,用倾析分离法得到黄色沉淀FeC2O4·2H2O。
Ⅱ.在沉淀中加入20 mL 含少量KOH的饱和K2C2O4溶液,再加入20 mL 6%H2O2,保持反应温度为40 ℃,只生成红褐色沉淀。然后,加热煮沸2 min 后加入16 mL的饱和H2C2O4溶液,沉淀消失,溶液变为亮绿色……抽滤得到晶体,洗涤并干燥。
回答下列问题:
(1)实验过程Ⅰ中不需要用到下列仪器中的___(从图4中选择序号)。

图4
(2)通常实验室配制绿矾溶液时需要加入_____(填试剂名称),步骤Ⅰ中生成黄色沉淀的离子方程式是_____。
(3)步骤Ⅱ中涉及反应的化学方程式依次为____、____、___。
(4)步骤Ⅱ中“……”表示向溶液中加入15 mL 95%乙醇,放置于暗处使其冷却结晶。加入乙醇的目的是_____。
(5)步骤Ⅱ中生成晶体的保存方法是____。
10.(15 分)我国科学家成功开发Pd-Fe/Fe2O3催化剂在低温条件下高选择性合成高纯度的乙烯,化学原理如下:
(1)已知:
a.几种共价键的键能如表1所示。
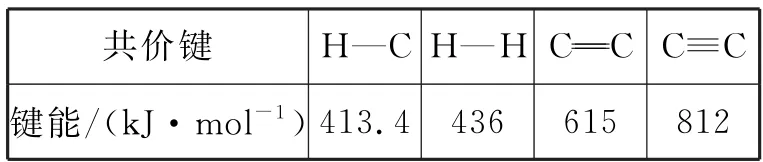
表1
b.C2H2(g)、H2(g)、C2H6(g)的燃烧热ΔH分别为-1 299.6 kJ· mol-1、-285.8 kJ·mol-1、-1 559.8 kJ·mol-1。
则ΔH1=_____kJ·mol-1;乙烯加氢生成乙烷的热化学方程式是_____。
(2)在刚性密闭容器中充入一定量的C2H2(g)和H2(g),发生反应:C2H2(g)+。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图5所示。
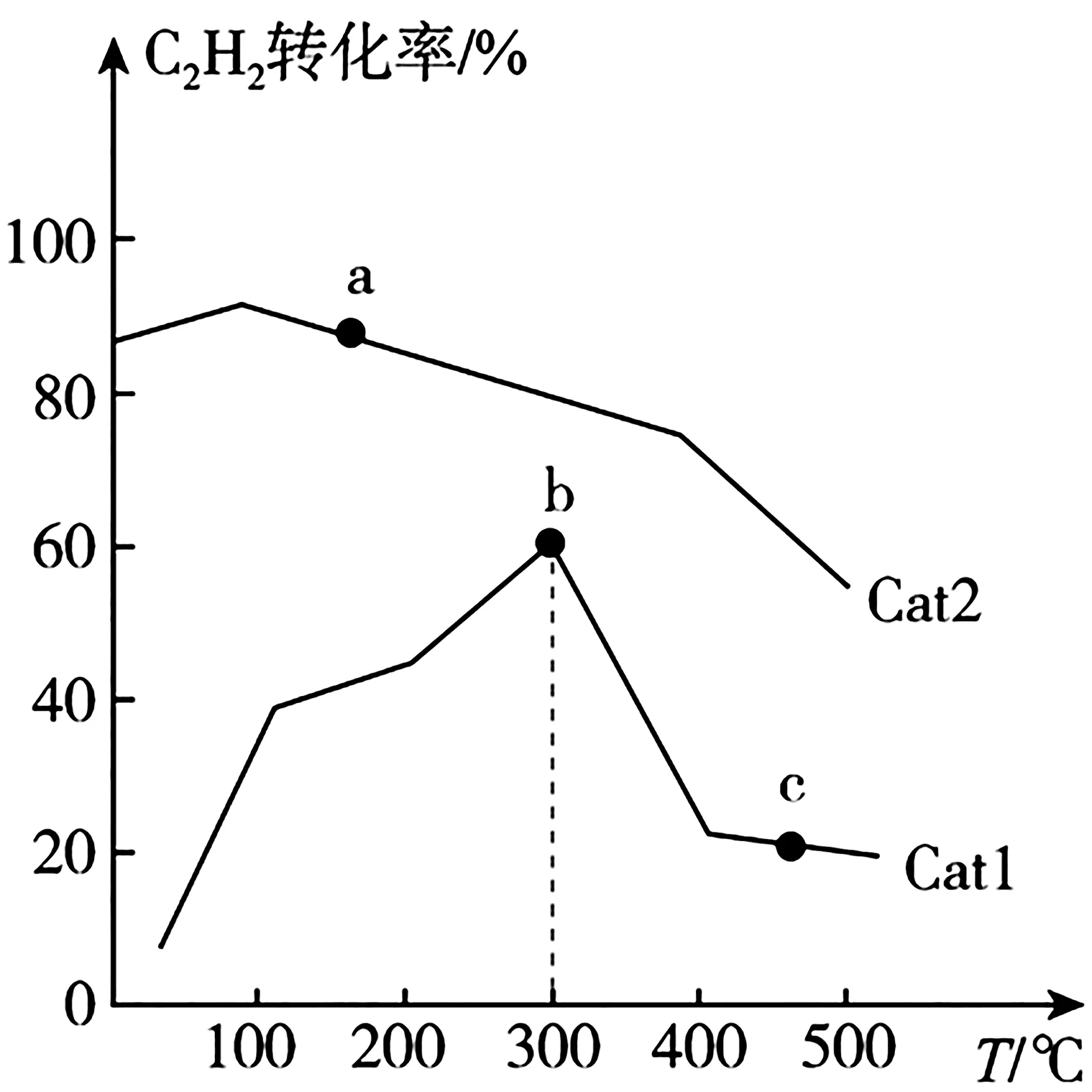
图5
①催化效率较高的是____(填“Cat1”或“Cat2”);b 点____(填“达到”或“未达到”)平衡。
②温度高于300 ℃,升高温度,b→c的原因可能是____(答1条即可)。
(3)在密闭容器中充入1 mol C2H2和2 mol H2,发生上述两个反应,测得C2H2平衡转化率与温度、压强的关系如图6所示。在T0K、20 kPa 下C2H4的选择性等于8 9[C2H4选择性 =。p0_____20 kPa(填“>”“<”或“=”)。T0K下,主反应的平衡常数Kp=____kPa-1(Kp为用气体分压计算的平衡常数,气体分压等于气体总压×物质的量分数)。
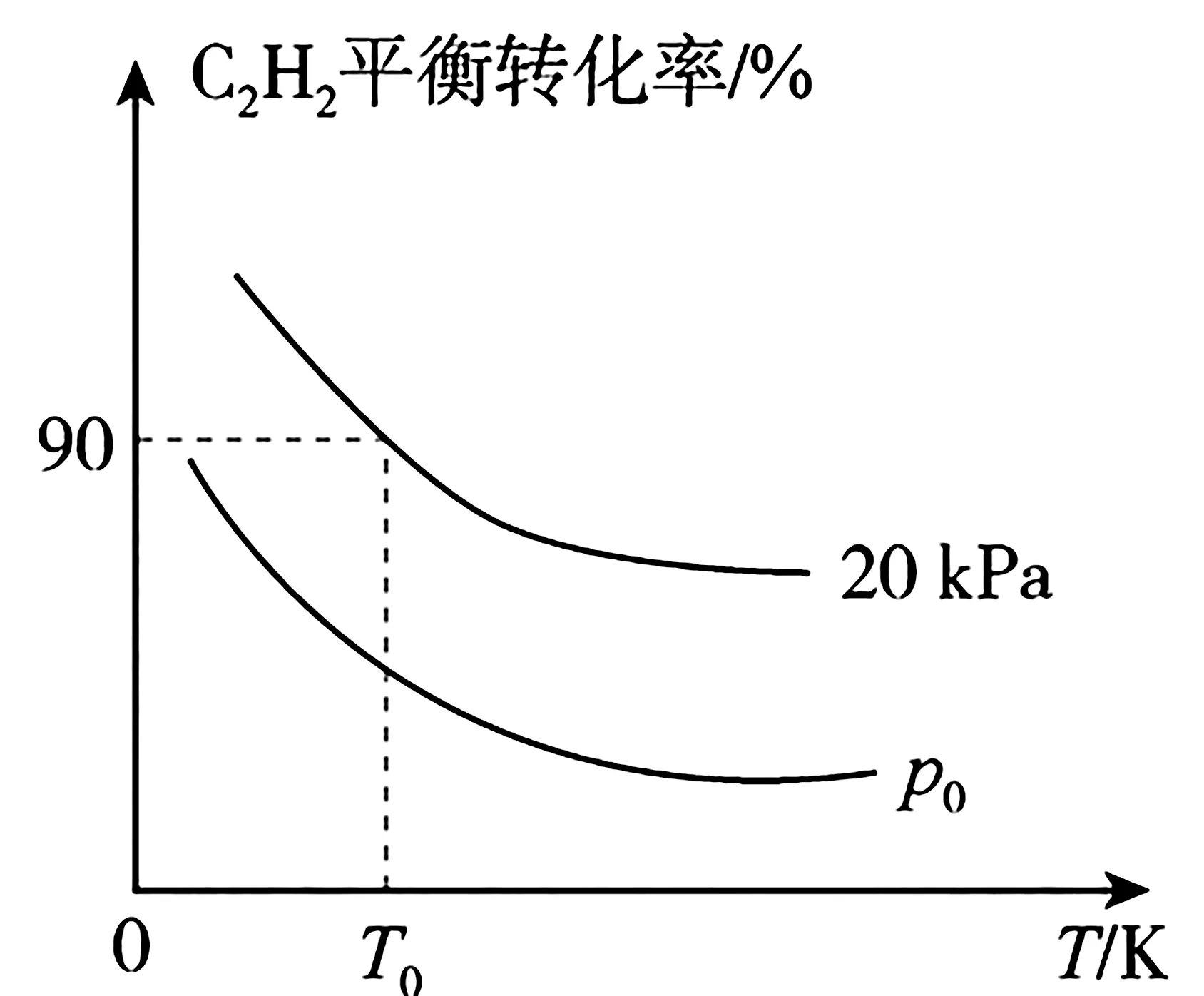
图6
(4)在恒温刚性密闭容器中通入气体分压比为p(C2H2)∶p(H2)=1∶1 的混合气体,已知某反应条件下只发生如下反应(k1、k2为速率常数):
实验测得乙烯的净生成速率方程为v(C2H4)=k1p(C2H2)·p(H2)-k2p(C2H4),可推测乙烯的浓度随时间的变化趋势为____,其理由是_____。
(二)选考题:共15分。请考生从2道化学题中任选一题作答。如果多做,则按所做的第一题计分。
11.【选修3:物质结构与性质】自修复材料、自适应材料、新型传感材料等智能材料技术大量涌现,为生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)我国科研工作者基于丁二酮肟氨酯基团的多重反应性,研制了一种强韧、自愈的超级防护材料,其中的分子机制如图7所示。
Cu+价层电子的轨道表达式(电子排布图)为_____,C、N、O 第一电离能由大到小的顺序为____。
(2)在加热和Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是____,CuO 在高温下能分解生成Cu2O,其原因是_____.
(3)萤石(CaF2)是自然界中常见的含氟矿物,CaF2与被熔物质混合,能起到快速增加受热面积,在玻璃熔化中需加入萤石(CaF2}的作用为____,其晶胞结构如图8所示,X 代表的离子是____;若该立方晶胞参数为apm,正负离子的核间距最小为____pm。
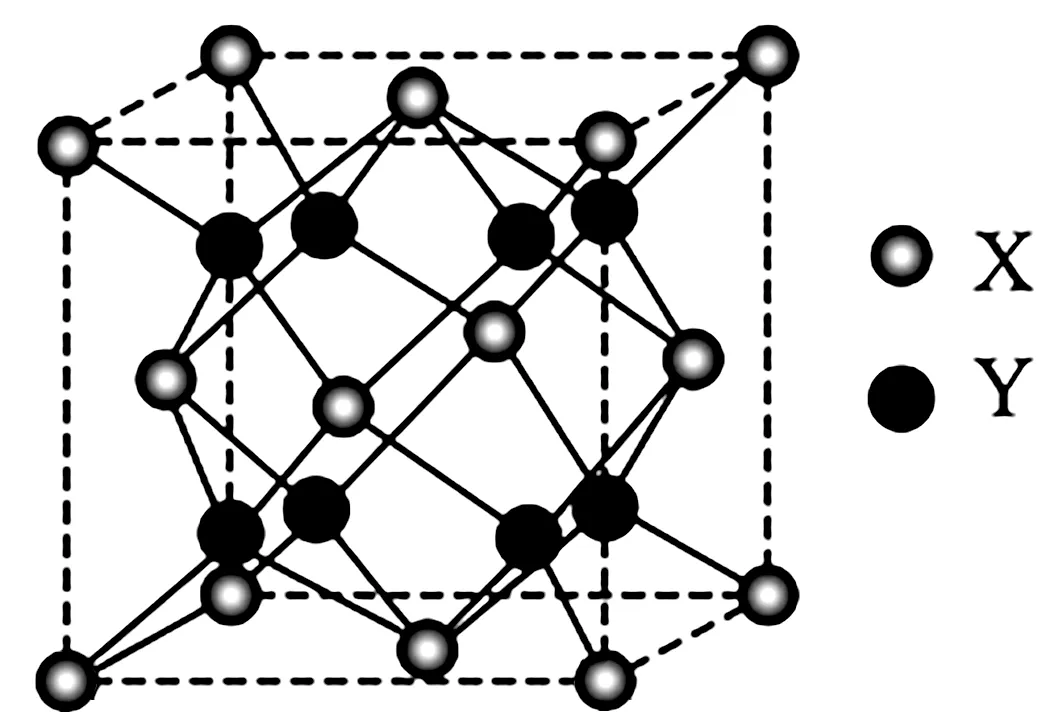
图8
12.【选修5:有机化学基础】化合物N 是合成治疗关节痛药物的重要中间体,其合成路线如下:
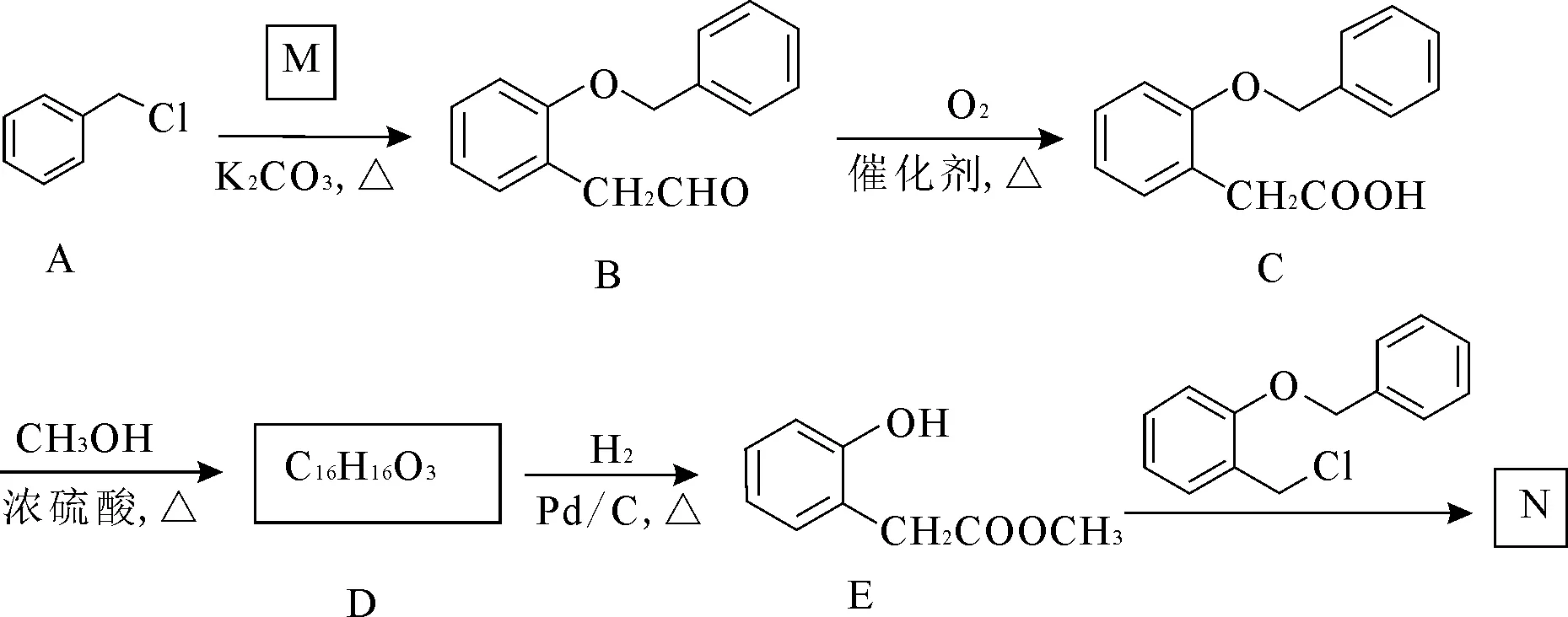
请回答下列问题:
(1)A 的化学名称为_____,B 中所含官能团的名称为_____;C→D 的反应类型为____。
(2)1 mol B在一定条件下与氢气完全反应的产物,所含手性碳原子有____mol。
(3)写出E→N 的化学方程式:___。
(4)化合物X 是M 的同分异构体,其分子中含氧官能团与M 相同,则X 的结构有____种。其中核磁共振氢谱吸收峰面积比为1∶1∶2∶2∶2的物质的结构简式为____(写出一种即可)。
