洞察命题新动向 有效复习元素及其化合物
2023-04-25河南省鄢陵县第一高级中学冯存良高小艳
■河南省鄢陵县第一高级中学 冯存良 高小艳
元素化合物知识在高考试卷中贯穿始终,题型灵活,作用之大、运用之广,很直接地反映出了其在知识体系中的重要性。而且元素化合物知识不仅是试题要直接考查的内容本身,更是用来解决其他相关问题的基础和平台。如今新旧高考模式并行,新高考命题思想渗透,研究命题动向更加重要。本文通过对高考综合改革省市试题的研究,总结出了元素化合物考查新动向。
动向一:“价—类”二维图
【动向解读】“价—类”二维图是一种以物质类别为横坐标、以化合价为纵坐标的二维图,在二维平面内绘制含有某元素的物质的转化图像,既能体现“元素观”也能体现“分类观”和“转化观”,进而实现对元素化合物知识的系统化,有助于建立系统的知识体系,明确学习要点,从而达到复习效果。
“价—类”二维认知模型以探究变价元素为载体,将散落的物质有序地排列,利用方程式进行拓展、提升,是学习元素化合物知识的重要方式之一。
例1图1 是某元素的“价—类”二维图,其中A 为正盐,X 是一种强碱,通常条件下Z是无色液体,E 的相对分子质量比D 大16。下列说法错误的是( )。

图1
A.物质A 作肥料时不适合与草木灰混合施用
B.物质B 是弱电解质,其水溶液呈弱碱性
C.物质C一般用排水法收集
D.D→E 的反应可用于检验D
解析:A 与X 反应可以生成B,A 为正盐,X 为强碱,可确定A 为铵盐,B 为NH3,Y为O2,C 为N2,D 为NO,E 为NO2,通常条件下,Z 是无色液体,可确定Z 为H2O,F 为HNO3,G 为硝酸盐。铵盐与草木灰混合会释放出NH3,不适合与草木灰混合使用,A项正确。NH3属于非电解质,其水溶液显弱碱性,B项错误。NO 难溶于水且可以与空气中的O2发生反应,生成NO2,一般采用排水法收集,C 项正确。NO 被O2氧化,生成NO2,颜色会由无色变为红棕色,有明显的颜色变化,可用于检验NO,D 项正确。
答案:B
动向二:碳达峰与碳中和
【动向解读】2020年我国首次提出:中国将提高国家自主贡献力度,采取更加有力的政策和措施,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。专家指出:气候变化是人类面临的全球性问题,随着各国二氧化碳排放,温室气体猛增,对生命系统形成威胁。在这一背景下,世界各国以全球协约的方式减排温室气体,我国由此提出“碳达峰”和“碳中和”目标。
碳达峰:就是指在某一个时点,二氧化碳的排放不再增长达到峰值,之后逐步回落。
碳中和:是指国家、企业、产品、活动或个人在一定时间内直接或间接产生的二氧化碳或温室气体排放总量,通过植树造林、节能减排等形式,以抵消自身产生的二氧化碳或温室气体排放量,实现正负抵消,达到相对“零排放”。
例2我国提出争取在2030年前实现“碳达峰”、2060年前实现“碳中和”,这对于改善环境、实现绿色发展至关重要。CO2催化加氢制CO 技术是兼顾新能源和实现“碳达峰”的重要途径之一,该反应机理如下页图2所示。下列说法错误的是( )。
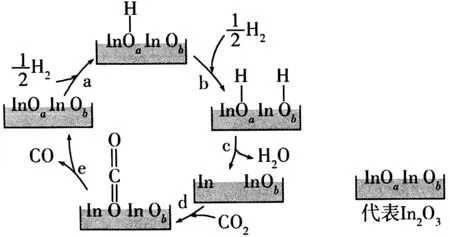
图2
B.催化剂(In2O3)表面易形成丰富的氧空位,有效促进CO2的吸附活化
C.步骤d、e中,CO2的吸附与转化均存在化学键的断裂与形成
D.催化剂(In2O3)能提高催化加氢的速率,是因为降低了反应的活化能
解析:对转化反应,升温c(H2)降低,说明平衡向正向移动,则说明正反应ΔH>0,A项正确。观察反应机理图可知,催化剂先吸附氢气、氢原子与氧成键后脱水,得到较多的氧空位,促进了CO2的吸附活化,B 项正确。步骤d中,CO2只是进入氧空位被催化剂吸附,不存在化学键的断裂与形成,C 项错误。催化剂是通过降低反应的活化能从而提高化学反应速率的,D 项正确。
答案:C
动向三:含氯消毒剂
【动向解读】含氯消毒剂是生活中常用的消毒剂。在防控新型冠状病毒期间,含氯消毒剂功不可没,这是一类高效低毒的杀菌剂,消毒效果好且抗菌谱广。常见含氯消毒剂包括“84”消毒液、漂白粉、一氧化二氯、二氧化氯、NaClO2(亚氯酸钠)等。
例3二氧化氯(ClO2)是国际上公认的绿色消毒剂,下面是ClO2的制备以及由ClO2制备一种重要的含氯消毒剂NaClO2的工艺流程:

已知:纯ClO2易分解爆炸,一般用稀有气体或空气稀释。
下列说法正确的是( )。
A.电解槽中总的离子方程式为Cl-+
解析:饱和氯化钠溶液在无隔膜电解槽pH=9 的条件下电解生成NaClO3,NaClO3和稀硫酸、SO2反应生成ClO2(用空气稀释ClO2),再将ClO2与NaOH、双氧水反应生成NaClO2溶液,经过一系列过程得到NaClO2·3H2O。 电解槽中阳极得到NaClO3,阴极得到H2,其总的离子方程式为,A 项正确。根据信息,纯ClO2易分解爆炸,一般用稀有气体或空气稀释,说明ClO2发生器中通入空气的目的是稀释ClO2,B 项错误。吸收器内发生反应生成NaClO2,则反应的离子方程式为O2↑,C项错误。从ClO2发生器进入吸收器的气体可能会含有SO2,会与H2O2反应生成,滤液中不存在,D 项错误。
答案:A
动向四:多硫含氧酸盐与多硫化物
【动向解读】形式多样的多硫含氧酸盐是高考命题的热点。以多硫含氧酸盐的性质为载体,从生活、生产实际出发发现并提出具有探究价值的问题,设计探究方案加以探究,培养实验能力及创新意识,发展化学社会意识。
例4焦亚硫酸钠(Na2S2O5)在印染、电镀、酿造等工业生产中广泛应用,其制备流程如下所示。
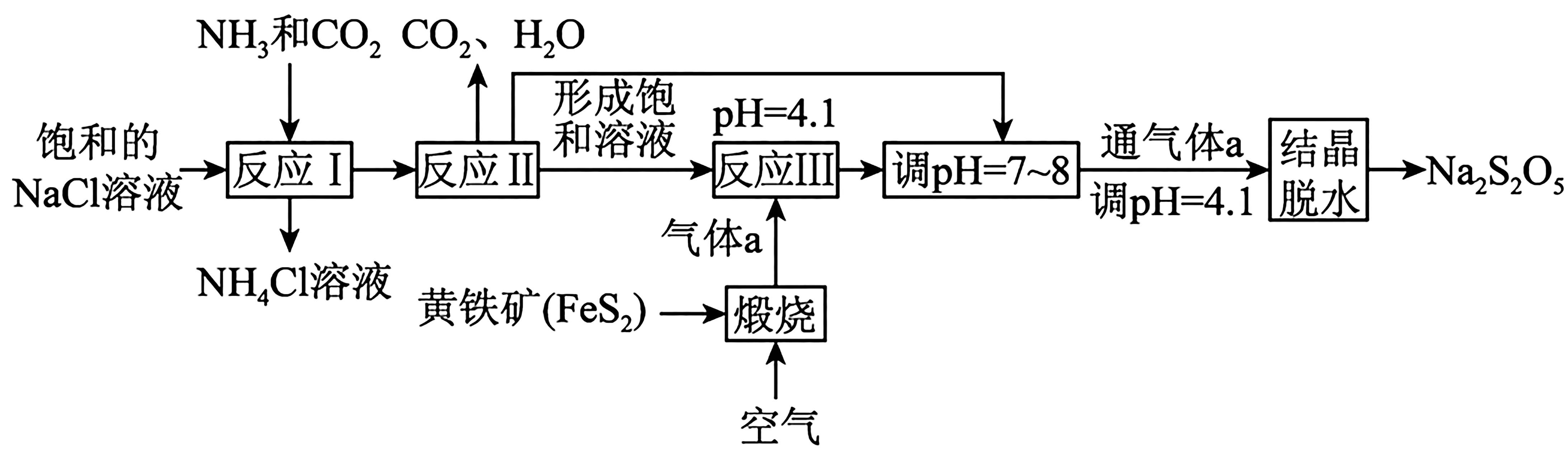
已知:NaHSO3过饱和溶液经结晶脱水得到Na2S2O5。
下列说法正确的是( )。
A.反应Ⅰ制备Na2CO3,反应时先通入氨气,再通入CO2
B.气体a为SO2,反应Ⅲ为Na2CO3+
C.调pH=7~8,并再次通入气体a的目的是得到NaHSO3过饱和溶液
D.结晶后的脱水反应为氧化还原反应
解析:饱和NaCl溶液中通入NH3和CO2,生成NaHCO3沉淀和NH4Cl溶液;过滤出沉淀,加热,溶于水得到Na2CO3饱和溶液;通入气体a(SO2),调节pH=4.1,得到NaHSO3溶液,加入Na2CO3调节pH=7~8,此时NaHSO3转化为Na2SO3,再通入SO2,并使pH=4.1,则生成NaHSO3过饱和溶液,结晶脱水得Na2S2O5。反应Ⅰ、Ⅱ是通过侯氏制碱法制备碳酸钠,反应Ⅰ制备NaHCO3的化学方程式为NaCl +CO2+,反应时先通入氨气,再通入CO2,反应Ⅱ为NaHCO3加热分解生成Na2CO3,A 项错误。根据已知信息可知,反应Ⅲ是为了制备NaHSO3,发生反应CO2,B 项错误。 由于反应Ⅲ得到的NaHSO3不是过饱和溶液,加碳酸钠固体、并再次充入SO2的目的是得到NaHSO3过饱和溶液,C项正确。由流程可知,NaHSO3失水得到Na2S2O5,过程中各元素化合价不变,为非氧化还原反应,D 项错误。
答案:C
动向五:物质之间的“类比”
【动向解读】类比是指通过两个或两类不同的对象进行比较,找出它们的相似或相同之处,以此为依据,把其中的某一对象的有关知识或结论迁移到另一对象中去。通过类比,可沟通新旧知识之间的联系,实现知识的迁移,达到化难为易、化生为熟的效果,这也是一种重要的创造性思维方法。近年来高考化学试题中的新情境题,凸出了起点高、落点低,在基础知识上开凿深的特点,考查考生运用基础知识的灵活性和应变能力,类比法已成为重要的解题途径。值得注意的是,在运用类比时,必须抓住事物的本质特征,要防止从表象出发进行机械类比,胡乱类推。
例5下列推理合理的是( )。
A.NaCl 固体与浓硫酸加热可制取HCl,则NaI固体与浓硫酸加热可制取HI
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应生成Na2SO3和O2
C.实验室可利用AlCl3与足量氨水反应来制备Al(OH)3,则也可利用CuCl2与足量氨水反应生成Cu(OH)2
D.Fe与S反应生成FeS,则Cu与S 反应生成Cu2S
解析:浓硫酸具有强氧化性,能够将NaI氧化为I2,不能用NaI固体与浓硫酸加热制HI,A 项错误。Na2O2与SO2发生氧化还原反应生成Na2SO4,B 项错误。Cu(OH)2溶于过量氨水生成[Cu(NH3)4]2+,因此不能利用CuCl2与足量氨水反应生成Cu(OH)2,C项错误。硫的氧化性较弱,只能将金属氧化到较低价态,Fe与S 反应生成FeS,Cu 与S反应生成Cu2S,D 项正确。
答案:D
动向六:新型化合物
【动向解读】以新型化合物为载体,可全面检测考生的化学学科素养。近年来高考化学科命题出现以新型化合物为载体来考量自主学习的能力。新型化合物的正确解读便成了解题的关键,试题中介绍陌生无机物的任何内容都可看做是信息,从信息呈现的方式看,可分为直接信息和潜在信息。针对试题中出现的新型化合物结构和性质的预测,关键是弄清物质的类别、结构特点,灵活运用反应的基本原理进行分析解决。
预测新型化合物性质的三个角度如下:
1.依据周期表中的位置预测物质的稳定性、最高价含氧酸的强弱。
2.依据化合物中元素的化合价预测氧化性及还原性。
3.依据物质的类别预测物质与酸、碱、水等的反应。
例6通过电氧化合成法可制得特殊高价金属化合物高铜酸钠(化学式为NaCuO2)。关于该物质的推测,下列有关说法不正确的是( )。
A.NaCuO2具有强氧化性
B.NaCuO2与浓盐酸作用会产生无色无味气体
C.强碱性条件下,通过次氯酸钠氧化氢氧化铜可制得NaCuO2
D.NaCuO2与氢气反应可能有紫红色固体生成
解析:在高铜酸钠(化学式为NaCuO2)中Cu元素化合价为+3 价,不稳定,容易获得电子,表现强氧化性,A 项正确。NaCuO2具有强氧化性,浓盐酸具有强还原性,NaCuO2与浓盐酸混合会发生氧化还原反应产生黄绿色有刺激性气味的Cl2,B 项错误。次氯酸钠具有强氧化性,H2具有强的还原性,次氯酸钠在强碱性条件下有可能将氢氧化铜氧化产生 NaCuO2,H2有可能将NaCuO2还原产生单质Cu,C、D 项正确。
答案:B
动向七:陌生物质的推断
【动向解读】无机推断题浓缩了元素及其化合物知识,具有极强的学科特色,因其题材广、可考查内容多且容易控制卷面难度的题型特点,成了高考命题中一种重要形式。近年来的考查形式已不囿于传统的无机推断,改头换面以小流程结合定量计算进行推断的形式出现。
例7化合物X由5种元素组成且不含结晶水。某兴趣小组按如下流程进行实验。
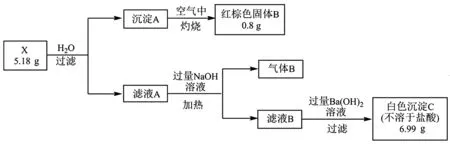
已知:
①上述流程中,除沉淀A→红棕色固体B的转化外,其余均为非氧化还原反应。
②气体B 能使湿润的红色石蕊试纸变蓝,标准状况下测得体积为2.24 L。
请回答:
(1)组成X 的元素有_____,X 的化学式是_____。
(2)红棕色固体B在KOH 高温环境下,与KNO3反应,固体B 中金属元素化合价升高。同时生成KNO2,写出该化学反应方程式:___。
(3)将气体B 通入CuSO4溶液中,先产生蓝色絮状沉淀,继续通入气体B,蓝色沉淀消失,呈深蓝色透明溶液,请写出相应的离子反应方程式:___,___。
(4)滤液A 中溶质的成分是____。
(5)设计实验方案,用化学方法确定沉淀A 中阳离子的成分:____。
解析:X 加水溶解后过滤得到的沉淀A经过灼烧发生氧化还原反应得到红棕色固体B,B为氧化铁,物质的量为0.005 mol,A 为氢氧化亚铁,根据铁元素守恒,物质的量为0.01 mol,X 中含Fe元素。滤液A 加NaOH溶液得到的气体B能使湿润的红色石蕊试纸变蓝,气体为NH3,标准状况下体积为2.24 L,物质的量为0.1 mol,说明X 中含N和H 元素。滤液B加过量的Ba(OH)2得到的白色沉淀C不溶于盐酸,C 为硫酸钡,说明X 中含硫酸根,物质的量为0.03 mol。综上,X 中含Fe(+2 价)元素0.01 mol,硫酸根0.03 mol,推测该物质的化学式可能为FeSO4·2(NH4)2SO4,根 据 质 量 守 恒:5.18
g-0.01 mol×(56+96)g·mol-1-0.02 mol×(18×2+96)g·mol-1=1.02 g,借助0.06mol推知有NH3分子以配体形式存在于化合物中,故 X 的 化 学 式 为Fe(NH3)6SO4·2(NH4)2SO4。至此,题目涉及的信息型方程式书写、溶质的判断、亚铁离子的检验可迎刃而解。
答 案:(1)Fe、H、N、O、S Fe(NH3)6SO4·2(NH4)2SO4
(4)(NH4)2SO4、NH3
(5)取少量沉淀A 于试管中,加入适量稀硫酸溶解,向其中加入少量KSCN 溶液,无明显变化,加入氯水,溶液呈红色,说明沉淀A 中含有Fe2+
动向八:热点金属及其化合物制备流程
【动向解读】化工流程题是近年高考中备受关注的一类题型,热点金属及其化合物工业制备是其主要出题方向。此类试题集综合性、真实性、开放性于一体,包含必要的操作名称、化工术语或文字说明,考查知识面广、综合性强、思维容量大。题干的呈现形式多为流程图、表格和图像;设问角度一般为操作措施、物质成分、化学反应、条件控制的原因和产率计算等,能力考查侧重于获取信息的能力、分析问题的能力、语言表达能力和计算能力;涉及的化学知识有基本理论、元素化合物和实验基础知识等。
例8我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO 等)中回收Pb 意义重大。一种回收铅的工艺流程如下。
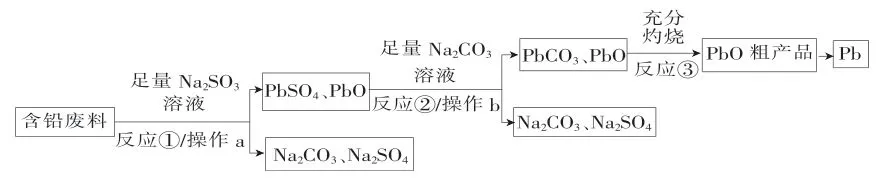
(1)铅蓄电池的总反应式为PbO2+,放电时PbO2作_____(填“正极”或“负极”),该电极附近溶液的pH____(填“增大”“减小”或“不变”)。
(2)含铅废料需要进行粉碎处理,目的是_____,反应①体现Na2SO3的____性,操作a、b的名称是____。
(3)PbCO3和PbSO4加热升温过程中固体的质量变化如图3所示。工业上用PbCO3热分解制备PbO,而不直接热分解PbSO4制备PbO,主要原因是_____。
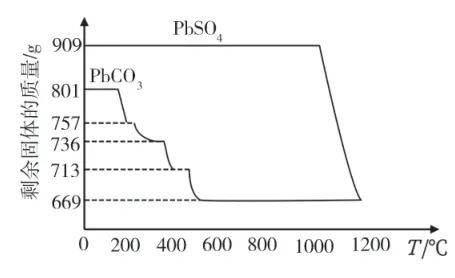
图3
(4)将反应③得到的PbO 粗产品溶解在HCl 和 NaCl 的混合溶液中,得到含Na2PbCl4的电解液。电解Na2PbCl4溶液生成Pb,装置如图4所示,则阴极的电极反应式为_____。

图4
解析:含铅废料和足量亚硫酸钠溶液反应生成硫酸铅和硫酸钠,过滤,硫酸铅和PbO与足量碳酸钠溶液反应生成碳酸铅、PbO 和硫酸钠,过滤,将滤渣灼烧得到PbO,再经过一系列反应最后得到铅。
(1)铅蓄电池的总反应式为PbO2+,放电时PbO2中Pb 化合价降低,得到电子,发生还原反应,作正极,,该反应中H+不断消耗,因此该电极附近溶液的pH 增大。
(2)含铅废料需要进行粉碎处理,目的是增大反应物接触面积,加快反应速率,反应①是亚硫酸钠和二氧化铅反应生成硫酸铅,亚硫酸钠化合价升高,因此反应①体现Na2SO3的还原性,根据操作a、b后固体和溶液分开得到操作a、b的名称是过滤。
(3)PbCO3和PbSO4加热升温过程中固体的质量变化如图3所示,PbSO4在较高温度分解为PbO 和硫的氧化物,PbCO3热分解制备PbO 和CO2,工业上用PbCO3热分解制备PbO,而不直接热分解PbSO4制备PbO,主要原因是因为PbSO4分解温度高,消耗能量多,产生硫的氧化物,污染大。
(4)电解Na2PbCl4溶液生成Pb,化合价降低,则阴极的电极反应式为。
答案:(1)正极 增大
(2)增大反应物接触面积,加快反应速率还原 过滤
(3)因为PbSO4分解温度高,消耗能量多,产生硫的氧化物,污染大
