『铁』见高考
2023-04-25河南许昌市建安区第一高级中学周晓燕
■河南许昌市建安区第一高级中学 周晓燕
铁作为变价金属元素,承担着帮助同学们初建“价类二维观”的重任。Fe2+、Fe3+的性质转化和检验是历年高考的热点,多以工艺流程题和实验题的形式呈现。下面我们就以历年高考真题为例,总结规律,构建思维模型,养成规范答题的习惯。
一、Fe2+、Fe3+的性质转化
根据铁元素的价类二维图(见图1)分析,Fe2+处于铁元素的中间价态,既有氧化性,又有还原性。在中学阶段接触Fe2+的氧化还原反应中其主要表现还原性,遇强氧化剂 H2O2、Cl2、Br2等均表现为还原性。Fe3+处于铁的高价态,遇S2-、I-、Fe等均表现为 氧化性。
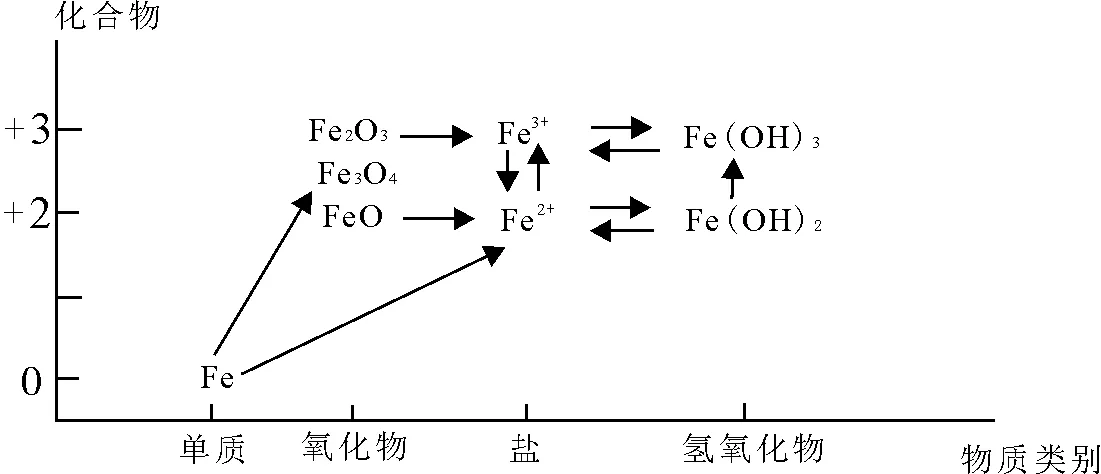
图1
基础过关练习:(1)FeCl3溶液可腐蚀铜以制作印刷线路板,则该反应的离子方程式为_____。
(2)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____。
答案:(1)2Fe3++Cu==Cu2++2Fe2+
(2)2Fe2++H2O2+2H+==2Fe3++2H2O
能力提升示例:高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺流程如下所示。

相关金属离子[c0(Mn+1)=0.1 mol·L-1]形成氢氧化物沉淀的pH 范围如表1所示。
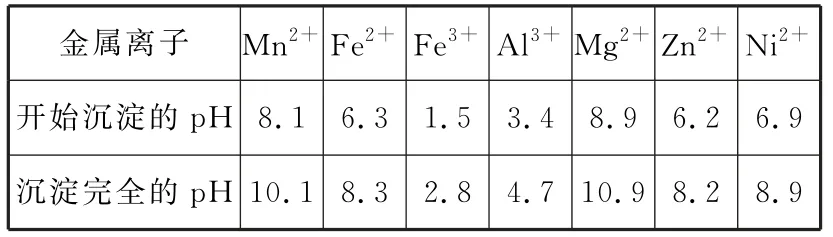
表1
回答下列问题:
(1)“氧化”中添加适量的MnO2的作用是____。
(2)“调pH”除铁和铝,溶液的pH 范围应调节为_____~6之间。
解析:①快看题干(弄清原料和目的并标记),本题的目的为制备MnSO4,则原料中Fe、Al、Mg、Zn、Ni、Si 等元素均为杂质。②粗看流程(不必把每一步都看懂)。③细看问题[结合问题(1),锁定“氧化”这一步,分析所提供元素中常见的变价元素及表格中所提供离子知Fe2+被MnO2氧化]。④规范作答,“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+。“调pH”除铁和铝,目的是除去Fe3+、Al3+,需pH≥4.7;综合考虑,溶液的pH 范围应调节为4.7~6之间。
答案:(1)将Fe2+氧化为Fe3+(2)4.7
点睛:工艺流程题涉及铁以杂质形式呈现时,可建立如下思维模型:先将Fe2+转化为Fe3+,再调节pH,将Fe3+转化为Fe(OH)3除去。
二、Fe2+、Fe3+的检验方法
1.特征反应。
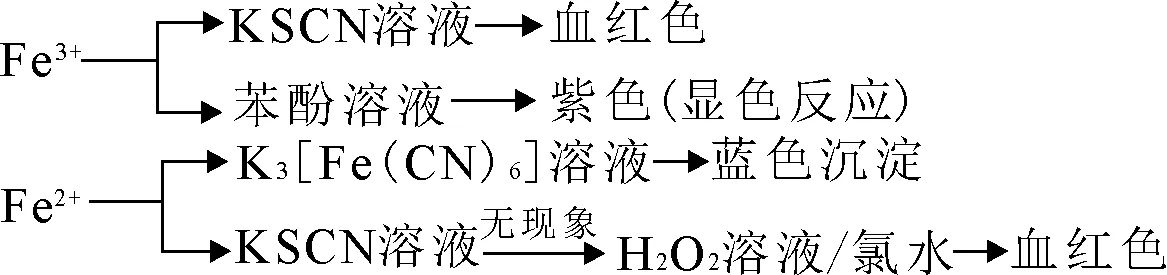
2.氧化还原反应。
Fe3+:淀粉-KI试纸(变蓝)。
Fe2+:KMnO4(H+)紫色褪去。
3.沉淀法。

基础过关练习:(1)(判断正误)向FeCl2溶液中滴加NH4SCN溶液,溶液显红色。( )
(2)向某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,则说明溶液中含_____。
答案:错误 Fe2+
能力提升示例:实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是____。
解析:铁电极表面被Fe2(SO4)3溶液活化,即发生反应活化反应完成即Fe2(SO4)3反应完全,所以只需要检验该溶液中不含Fe2(SO4)3即可。
答案:取活化后溶液少许于试管中,加入KSCN 溶液,若溶液未变血红色,则证明活化反应已完成
同学们在答题时易因试剂选择不合理、溶液颜色判断错误、答题不完整等而扣分,故同学们在熟记上述离子检验方法的同时,建构模型:取适量/少量……,加……试剂,若出现……现象,则说明……。据此养成规范答题习惯。
