μ-CnIIIC芋螺多肽二硫键异构体的合成鉴定及活性评价
2023-04-13张文杰郭凯张发进王者江董玉香姬胜利
张文杰 郭凯 张发进 王者江 董玉香 姬胜利

【摘 要】目的 對μ-CnIIIC芋螺多肽的3种二硫键异构体进行合成鉴定及生物安全性、活性评价。方法通过固相多肽合成法(SPPS)人工合成μ-CnIIIC-Ⅰ、μ-CnIIIC-Ⅱ和μ-CnIIIC-Ⅲ线性肽;采用氧化法对线性肽进行氧化折叠,获得3种折叠肽异构体(μ-CnIIIC-Ⅰ、μ-CnIIIC-Ⅱ和μ-CnIIIC-Ⅲ),并对其进行质谱表征和HPLC纯化;通过MTT法测试3种异构体的细胞毒性;采用双电极电压膜片钳技术测试3种异构体对NaV1.2的抑制作用。结果 质谱表征结果显示成功合成μ-CnIIIC-Ⅰ、μ-CnIIIC-Ⅱ和μ-CnIIIC-Ⅲ 3种芋螺多肽异构体;μ-CnIIIC 3种异构体浓度在50 μmol/L范围内时,细胞存活率均在75%以上且不发生溶血现象;μ-CnIIIC异构体浓度为20 μmol/L时,μ-CnIIIC-Ⅰ、μ-CnIIIC-Ⅱ和μ-CnIIIC-Ⅲ对对钠通道的抑制率为23.64%、52.43%、81.21%,皮肤刺激性实验每天每只动物积分均值为0.107、0.179和0.286。结论 芋螺多肽μ-CnIIIC异构体具有良好的生物安全性,二硫键连接为Ⅰ-Ⅳ、Ⅱ-Ⅴ和Ⅲ-Ⅵ的μ-CnIIIC异构体对钠通道有更好的选择性,抑制作用较强,可发挥更好的生物活性。
【关键词】μ-CnIIIC芋螺多肽;二硫键;钠通道
中图类分号:Q78 文献标志码:A 文章编号:1004-4949(2023)02-0001-05
Synthesis, Identification and Activity Evaluation of μ-CnIIIC Conopeptide Disulfide Bond Isomer
ZHANG Wen-jie1, GUO Kai2, ZHANG Fa-jin1, WANG Zhe-jiang2, DONG Yu-xiang1, JI Sheng-li1,2
[1.College of Pharmacy, Binzhou Medical University, Yantai 264003, Shandong, China; 2.ReaLi Tide Biological technology (Weihai) Co., Ltd, Weihai 264402, Shandong, China]
【Abstract】Objective To study the synthesis, identification and activity of three disulfide bond isomers of μ-CnIIIC. Methods The linear peptides of μ-CnIIIC-Ⅰ, μ-CnIIIC-Ⅱ and μ-CnIIIC-Ⅲ were synthesized by solid phase peptide synthesis(SPPS). Three-fold peptide isomers (μ-CnIIIC-Ⅰ, μ-CnIIIC-Ⅱ and μ-CnIIIC-Ⅲ) were obtained by oxidative folding of the linear peptides, which were characterized by mass spectrometry and purified by HPLC. The cytotoxicity of the three isomers was tested by MTT method. The inhibition effect of three isomers on NaV1.2 was tested by using double electrode voltage patch clamp technique. Results Mass spectrometry characterization results showed thatμ-CnIIIC-Ⅰ, μ-CnIIIC-Ⅱ andμ-CnIIIC-Ⅲ were successfully synthesized. When the concentration of three isomers of μ-CnIIIC was in the range of 50μmol/L, the cell survival rate was above 75% and no hemolysis occurred. When the concentration of μ-CnIIIC isomer was 20 μmol/L, the inhibition rates of μ-CnIIIC-Ⅰ, μ-CnIIIC-Ⅱ and μ-CnIIIC-Ⅲ on sodium channel were 23.64%, 52.43% and 81.21%, respectively. The average scores of skin irritation test were 0.107, 0.179 and 0.286 per animal per day. Conclusion The μ-CnIIIC isomers of conopeptides have good biosafety. The μ-CnIIIC isomers with disulfide bonds of Ⅰ-Ⅳ, Ⅱ-Ⅴ and Ⅲ-Ⅵhave better selectivity to sodium channels, stronger inhibitory effect and better biological activity.
【Key words】μ-CnIIIC conopeptide; Disulfide bond; Sodium channel
芋螺毒素(conotoxins,CTX)是来源于海洋芋螺毒液的一类活性多肽,又称芋螺多肽。大多数芋螺多肽富含二硫键,具有特定的分子构型,能选择性作用于细胞膜上特异的离子通道和受体等,具有激活乙酰胆碱受体等生物活性[1]。钠通道广泛分布于各种组织和器官中,参与多种生理过程,其功能异常会导致疼痛、癫痫、周期性麻痹等多种疾病发生,开发针对钠离子通道的新型化合物有助于多种疾病的治疗和新型药物的开发[2]。芋螺含有超过上百万的天然多肽类化合物,但迄今为止仅百余种多肽化合物被发现,具有很大的开发应用潜力[3]。μ-CnIIIC属于μ类芋螺毒素,其为14至26个氨基酸残基肽,共享CCXnCXnCXnCC的特定半胱氨酸框架[4]。二硫键(disulfide bond)是多肽链内或链间中的两个半胱氨酸残基侧链的巯基氧化形成的共价键,μ类芋螺毒素具有6个半胱氨酸残基的骨架,理论上可以形成15种不同的二硫键异构体。研究表明[5],并非所有的“活性”芋螺多肽折叠是最有效的生物活性肽,而具有非天然二硫键连接的芋螺毒素优于天然的“活性”对应物;同时二硫键的结构对芋螺多肽的功效具有重要意义。为了解二硫键对芋螺多肽μ-CnIIIC异构体活性的影响,本研究采用固相法合成3种μ-CnIIIC异构体线性肽,并通过氧化法合成3种μ-CnIIIC异构体,对其细胞毒性、钠通道活性进行研究,现报道如下。
1 材料与方法
1.1 实验动物 8只实验小鼠来源于滨州医学院医药研究中心,所用小鼠均为(体重30~40 g)普通级雌性昆明小白鼠,并严格按照“动物实验的护理和使用指南”饲养。8只实验家兔来源于滨州医学院医药研究中心,所用家兔均为普通级新西兰白兔,并严格按照“动物实验的护理和使用指南”饲养。
1.2 主要材料与试剂 二氯甲烷(DCM)及乙腈(旺通化工有限公司);1-羟基苯并三唑(HOBT)、二异丙基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP)及氨基酸(苏州昊帆生物股份有限公司);3,4,5-三羟基苯甲醛(麦克林生化科技有限公司);三异丙基硅烷(Tis,湖北永阔有限公司);N,N-二甲基甲酰胺(DMF,鲁西化工基团股份有限公司);Rink Amide 树脂(上海联迈生物工程有限公司);RAW 264.7细胞(南京科佰生物科技有限公司);二甲基亚砜(DMSO)購于鲁西化工基团股份有限公司;高糖DMEM培养液(山东致圣生物科技有限公司);胎牛血清(浙江天杭生物科技有限公司)。
1.3 实验仪器 智能磁力搅拌器(上海越众有限公司,型号:ZNCL-BS 230*230);高效液相色谱仪(美国Waters有限公司,型号:Waters-0150);质谱仪(美国Waters有限公司,型号:Waters-2695);旋转蒸发仪(上海爱朗有限公司,型号:N-1300);电热鼓风干燥箱(天津泰斯特仪器有限公司,型号:101-2AB);紫外分析仪(上海光豪有限公司,型号:ZF-5);Axon Axoclamp 900A膜片钳微电极放大器系统(美国Molecular Devices公司);真空冷冻干燥机(青岛永合创信电子科技有限公司,型号:CTFD-18);高压灭菌锅(厦门致微仪器有限公司,型号:San Yo MLS-3750)。
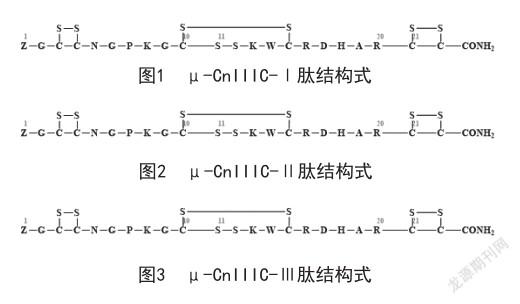
1.4 芋螺多肽合成 采用传统Fmoc保护的固相多肽合成法合成[5]。采用可酰胺化的Rink Amide树脂,并采用DCC、HOBT及DIEA为缩合体系,DMF为反应溶剂。线性肽合成后使用裂解溶液室温下切割2 h,切割后的多肽释置于甲基叔丁基醚中析出后经冷冻干燥,进行下一步氧化折叠;采用三步氧化法对线性肽进行氧化折叠,获得μ-CnIIIC-Ⅰ(见图1)、μ-CnIIIC-Ⅱ(见图2)和μ-CnIIIC-Ⅲ(见图3)3种折叠肽异构体,然后对其进行质谱表征和HPLC纯化,合成产物冻干后分装备用。

1.5 芋螺多肽表征 流动相采用乙腈-水(75∶25),流速为0.4 ml/min,柱温30 ℃;进样量为30 μl。采用电喷雾离子源,正离子模式,全扫描模式(Full Scan),扫描范围m/z 400~2600,电喷雾电压4500 V;加热毛细管温度380 ℃;毛细管电压100 V;Tube lens 150 V;氮气(N2)压力30 arb;辅助气(N2)压力10 arb;二级离子采用碰撞诱导解离(collision-induced dissociation,CID)采集数据。
1.6 生物相容性研究 生物相容性是验证化合物能否作为候选药物的重要指标,因此对3种多肽的溶血活性和细胞毒性进行研究。用荧光显微镜观察红细胞形态,分析其溶血活性。测定3种多肽对动物细胞的细胞毒性[6]。8只实验小鼠分为a、b、c、d 四组,每组2只。4组小鼠分别尾静脉注射生理盐水(NS)0.2 ml和3种芋螺多肽0.2 ml(8 mg/kg)进行溶血试验,2 h后从小鼠眼眶取血2滴,分别用生理盐水稀释,荧光显微镜下观察红细胞形态。用MTT法测定3种多肽对小鼠单核巨噬细胞白血病细胞(RAW 264.7细胞)的细胞毒性。将RAW 264.7细胞(约2000个细胞)接种于96孔板,然后置于37 ℃、5% CO2培养箱中培养,使细胞粘附。将不同浓度的芋螺多肽经多次稀释后加到细胞培养液中孵育24 h。孵育完成后,吸掉上清液,每孔加入150 μl DMSO溶解溶液,37 ℃下孵育2 h;然后通过酶标仪测量450 nm处的吸光度强度,确定3种多肽的细胞毒性。每个测试至少重复3次。
1.7 电生理活性检测 使用自动全细胞膜片钳检测μ-CnIIIC 3种异构体对钠离子通道抑制作用。首先将钠通道稳定表达的HEK293细胞系培养在10%的胎牛血清和DMEM高糖培养基(含10% FBS和1%双抗)中,置于5% CO2,37 ℃培养箱中培养;除去旧培养基用PBS洗涤1次,加入1.5 ml TrypLETM Express酶溶液孵育1 min;加入培养液轻轻吹打使细胞分离,转移至离心管中离心,离心完成后将细胞接种于6 cm细胞培养皿中,每个培养皿的细胞密度不超过80%。实验检测前24 h转移至24孔板中培养,每孔体积为500 μl。细胞外液为145 mmol NaCl,4 mmol KCl,2 mmol CaCl2,1 mmol MgCl2,10 mmol 4-羟乙基哌嗪乙磺酸和10 mmol葡萄糖,用NaOH调节pH为7.4。细胞内溶液为140 mmol CsF,1 mmol乙二醇双(2-氨基乙基醚)四乙酸,5 mmol CsOH,10 mmol 4-羟乙基哌嗪乙磺酸,10 mmol NaCl,用CsOH调节pH为7.3。用0.1%牛血清白蛋白的细胞外液稀释3种芋螺多肽。钠通道在全细胞膜片钳模式下将细胞膜电位钳制在-80 mV,从-60 mV起施加,以10 mV步幅递增、并去极化方波刺激至+60 mV,确定能够激发 HEK-293细胞最大钠电流的激活电压,再固定该刺激电压值以50 ms、间隔时间5 s进行连续去极化方波刺激,待电流稳定后开始给药,并同时记录细胞膜上通道电流变化情况。
1.8 皮肤刺激性检测 根据《化妆品安全技术规范》中的毒理学试验方法检测多肽对家兔皮肤的刺激性与腐蚀性,8只家兔分为四组,每组2只。试验前24 h剪掉家兔背部脊柱两侧毛,去毛范围为3 cm×3 cm,注意不要损傷皮肤表面;取0.5 ml 2 mmol/L的多肽溶液或纯化水涂抹在家兔皮肤上,涂抹面积为2.5 cm×2.5 cm,1次/d,连续涂抹14 d[7]。第2天开始每次涂抹前应剪毛,用水或无刺激性溶剂清除残留受试物,1 h后观察结果,各组别相同方法处理。参考表1进行评分,每天每只动物平均积分均值=Σ红斑和水肿积分/受试动物数/14。每只动物积分均值在0.5以下为无刺激性,每只动物积分均值0.5~2.0为轻刺激性,2.0~6.0为中刺激性,6.0~8.0为强刺激性。
1.9 统计学方法 采用SPSS 26.0统计学软件处理本研究数据,计量资料以(x-±s)表示,行t检验;以P<0.05为差异有统计学意义,P<0.01表示统计学意义显著。

2 结果
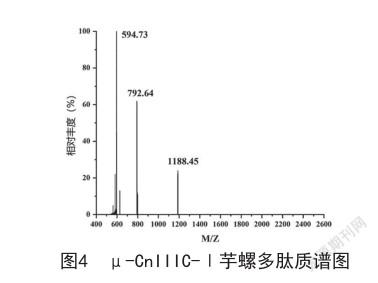
2.1 3种异构体表征 μ-CnIIIC-Ⅰ质谱图见图4,峰m/z 1188.45为[M+2H]2+离子信号,峰m/z 792.63为[M+3H]3+离子信号,峰m/z 594.73为[M+4H]4+离子信号;μ-CnIIIC-Ⅱ质谱图见图5,峰m/z 1188.45为 [M+H]+分子离子峰;μ-CnIIIC-Ⅲ质谱图见图6,峰m/z 1188.37为[M+2H]2+离子信号,峰m/z 792.74为[M+3H]3+离子信号,峰m/z 594.82为[M+4H]4+离子信号,峰m/z 475.97为[M+5H]5+离子信号。



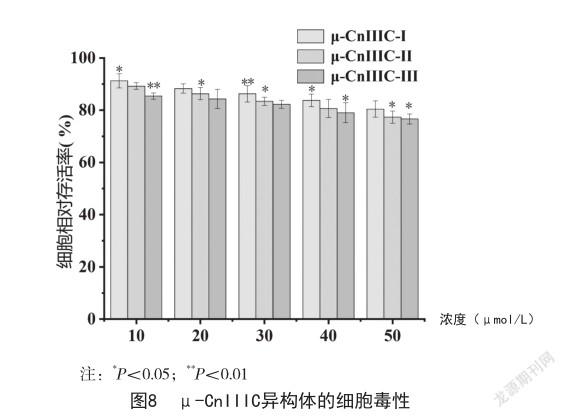
2.2 生物相容性 a组红细胞形态见图7a,b、c、d组红细胞形态见图7b、7c、7d。四组红细胞均正常,未观察到明显的红细胞溶血现象。同时,小鼠体内未发现溶血迹象。因此3种芋螺多肽均不会引起溶血现象,有良好的生物相容性。3种芋螺多肽对RAW 264.7细胞的毒性见图8,3种芋螺多肽细胞毒性均较低。当浓度低于50 μmol/L时,μ-CnIIIC-Ⅰ对RAW 264.7细胞的相对存活率大于80%,μ-CnIIIC-Ⅱ、μ-CnIIIC-Ⅲ对RAW 264.7细胞的相对存活率大于75%,表明μ-CnIIIC-Ⅰ的细胞毒性低于μ-CnIIIC-Ⅱ、μ-CnIIIC-Ⅲ,具有很好的安全性。
2.3 μ-CnIIIC异构体对钠通道的抑制作用 与异构体μ-CnIIIC-Ⅰ比较,μ-CnIIIC-Ⅱ异构体在NaV1.2上的活性提高,μ-CnIIIC-Ⅲ异构体的活性最高,见图9;μ-CnIIIC-Ⅰ、μ-CnIIIC-Ⅱ和μ-CnIIIC-Ⅲ对钠离子通道的抑制率为23.64%、52.43%、81.21%。
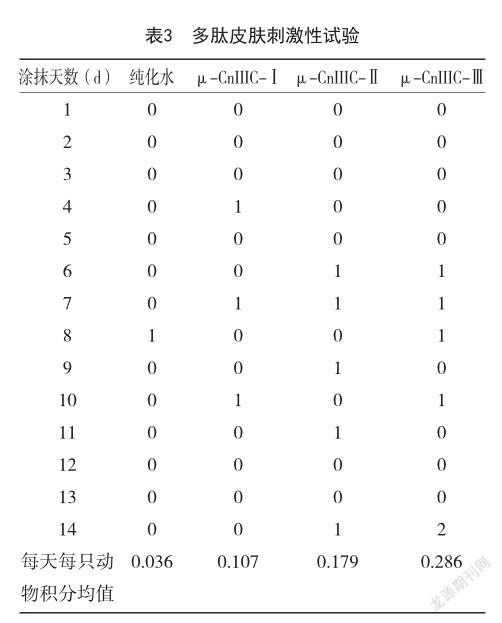
2.4 皮肤刺激性研究 试验观察期内家兔出现非常轻的红斑和水肿,纯化水组每天每只动物积分均值为0.036,μ-CnIIIC-Ⅰ、μ-CnIIIC-Ⅱ、μ-CnIIIC-Ⅲ组每天每只动物积分均值为0.107、0.179和0.286,虽略大于纯化水组,但值均<0.5,说明3种多肽异构体对皮肤多次给药刺激性较低,具有较高的安全性。


3 讨论
芋螺多肽可以作用于离子通道,其中钠通道广泛分布于各种组织和器官中,参与多种生理过程,其功能的异常会导致多种疾病的发生,如疼痛、癫痫、心脏传导病、周期性麻痹等[8]。开发针对钠离子通道的新型化合物有助于多种疾病的治疗和新型药物的开发[9]。
本研究采用固相多肽合成法合成μ-CnIIIC 3种异构体线性肽,进一步氧化合成了μ-CnIIIC-Ⅰ、μ-CnIIIC-Ⅱ和μ-CnIIIC-Ⅲ 3种异构体,并对其进行质谱表征,结果表明3种芋螺多肽异构体成功合成。μ-CnIIIC 3种异构体浓度在50 μmol/L范围内时,细胞毒性实验中细胞存活率均在75%以上,对细胞几乎无杀伤作用;细胞溶血实验中红细胞完整,无溶血现象;说明3种芋螺多肽都有良好的生物安全性和较低的细胞毒性。μ-CnIIIC异构体浓度为20 μmol/L时,μ-CnIIIC-Ⅰ、μ-CnIIIC-Ⅱ和μ-CnIIIC-Ⅲ对钠通道的抑制率为23.64%、52.43%、81.21%,说明芋螺多肽可特异性地阻断钠离子通道,使钠离子内流受阻,导致肌肉动作电位不能形成,表情肌得以放松,从而有效预防和减少皱纹,说明其可作为抗皱产品中的活性成分;另外,也表明二硫键的复杂程度对其功能活性有很大的影响,二硫键的连接次序越复杂,芋螺多肽对钠通道的抑制作用越明显。此外皮肤刺激性实验每天每只动物积分均值为0.107、0.179和0.286,表明芋螺多肽的三种异构体对皮肤具有良好的安全性,可作为外用制剂发挥疗效,通过涂抹即可达到注射肉毒杆菌毒素的作用,有望替代注射等侵入式祛皱方法,从而更安全有效地祛皱,避免侵入式产品对人体造成感染、面瘫等潜在危害。
综上所述,芋螺多肽活性受二硫键结构的影响比较确切,二硫键结构越复杂的芋螺多肽可更好的作为外用制剂阻断钠离子通道发挥抗皱等生物活性。
参考文献
[1] Margiotta F,Micheli L,Ciampi C,et al.Conus regiusDerived Conotoxins:Novel Therapeutic Opportunities from a Marine Organism[J].Mar Drugs,2022,20(12):773.
[2] Mir R,Karim S,Kamal MA,et al.Conotoxins:Structure,Ther apeutic Potential and Pharmacological Applications[J].Curr Pharm Des,2016,22(5):582-589.
[3] Fu Y,Li C,Dong S,et al.Discovery Methodology of Novel Conotoxins from Conus Species[J].Mar Drugs,2018,16(11):417.
[4] Kaas Q,Westermann JC,Craik DJ.Conopeptide characterization and classifications:an analysis using ConoServer[J].Toxicon,2010,55(8):1491-1509.
[5] Tietze AA,Tietze D,Ohlenschlager O,et al.Structurally diverse μ-conotoxin PIIIA isomers block sodium channel NaV 1.4[J].Angew Chem Int Ed Engl,2012,51(17):4058-4061.
[6] Dutton JL,Bansal PS,Hogg RC,et al.A new level of conotoxin diversity,a non-native disulfide bond connectivity in alpha-conotoxin AuIB reduces structural definition but increases biological activity[J].J Biol Chem,2002,277(50):48849-48857.
[7] Zhang Y,Vinogradov AA,Chang JS,et al.Solid-PhaseBased Synthesis of Lactazole-Like Thiopeptides[J].Org Lett,2022,24(43):7894-7899.
[8] Huo Y,Ma L,Zhang M,et al.Development of anticancer peptides with low hemolysis,high penetrating membrane activity,certain analgesic activity and the synergistic anticancer effect[J].Biomater Sci,2022,10(7):1724-1741.
[9] 吳赟,曹锟,张广献.4种α-芋螺毒素来源多肽合成及功能鉴定[J].广东医科大学学报,2021,39(3):253-258.
编辑 刘雯
