应用“三个守恒”书写新高考化工流程题中复杂化学方程式方法
2023-04-08徐兴宇
徐兴宇


摘 要:文章应用“得失电子守恒、电荷守恒、原子守恒”三个守恒,通过四道高考试题,详细介绍了化工流程题中复杂化学方程式书写方法,此方法简单、实用、易于掌握.
关键词:电子守恒;电荷守恒;原子守恒;化工流程题;化学方程式;高中化学
中图分类号:G632 文献标识码:A 文章编号:1008-0333(2023)34-0129-04
新高考化学工艺流程题涉及复杂化学方程式书写[1].本文通过2021年高考化工流程题,分两种类型详细介绍用“三个守恒”书写化学方程式的方法,并用该方法书写2022年高考化工流程题涉及的化学方程式加以佐证.1 氧化还原反应方程式书写
书写化学方程式,使用“三个守恒”顺序依次为:得失电子守恒、电荷守恒、原子守恒.
例1 [2021年河北省普通高中学业水平选择性考试化学试题15题 (5)]
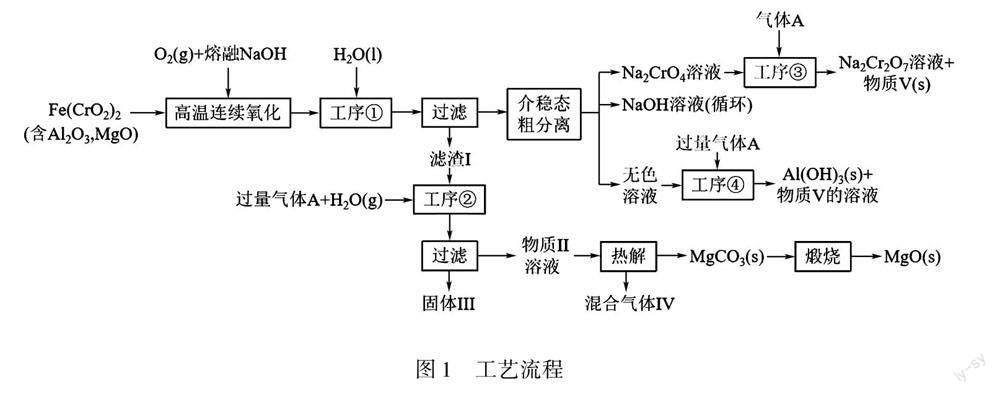
绿色化学在推动社会可持续发展中发挥着重要作用.某科研团队设计了一种熔盐液相氧化法,制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg深度利用和Na+内循环.工艺流程如图1所示.
(5)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为:_______.
分析 书写步骤如下:
第一步 :确定氧化剂、还原剂、氧化产物和还原产物.
反应物:Fe(CrO2)2、O2、NaHCO3
生成物:Na2CrO4 ,濾渣I中有Fe(CrO2)2中
+2价Fe高温连续氧化后生成的难溶于水的+3价Fe化合物,经分析为Fe2O3.
氧化剂:O2 ;还原剂: Fe(CrO2)2
氧化产物:Na2CrO4、Fe2O3;还原产物:-2价O化合物
离子方程式:
Fe(CrO2)2+O2CrO2-4+ Fe2O3
第二步:根据得失电子守恒,写出相应系数.
4Fe(CrO2)2+7O28CrO2-4+ 2Fe2O3
第三步:电荷守恒,即反应物所带电荷数=生成物所带电荷数.
反应物电荷数:0,生成物电荷数:-8×2=-16,反应物有NaHCO3参与反应,故反应物应由HCO-3提供负电荷,电荷数为:-1×16 =-16,即反应物由16HCO-3提供16个负电荷.
4Fe(CrO2)2+7O2+16HCO-38CrO2-4+2Fe2O3
第四步:原子守恒,应用原子守恒依次配平主要原子和H、O等原子.
①配平主要原子C,使C原子个数守恒.
反应物有16个C原子,生成物也应有16个C原子,但必须是呈电中性化合价为+4价的C的化合物.经分析16CO2符合.
4Fe(CrO2)2+7O2+16HCO-38CrO2-4+ 2Fe2O3+ 16CO2
②最后观察H、O原子个数,生成物补充8H2O,全部守恒.
4Fe(CrO2)2+7O2+16HCO-38CrO2-4+ 2Fe2O3+ 16CO2+8H2O
写成化学方程式:
4Fe(CrO2)2+ 7O2+16NaHCO38Na2CrO4+2 Fe2O3+ 16CO2+8H2O
2 非氧化还原反应方程式书写
书写化学方程式,使用“一个守恒”:原子守恒.
例2 [2021年湖南省普通高中学业水平选择性考试化学试题17题(5)]
Ce2(CO3)3可用于催化剂载体及功能材料的制备.天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质.以独居石为原料制备Ce2(CO3)3·nH2O的工艺流程如图2所示.
回答以下问题:
(5)“沉铈”过程中,生成Ce2(CO3)3·nH2O的离子方程式为_______.
分析 书写步骤如下:
第一步:写出题中已经确定的反应物和生成物.
离子方程式:
Ce3++HCO-3Ce2(CO3)3·nH2O
第二步:原子守恒,应用原子守恒配平主要原子.
2Ce3++3HCO-3Ce2(CO3)3·nH2O
第三步:电荷守恒,即反应物所带电荷数=生成物所带电荷数.
反应物电荷数:2×3-3×1=3,生成物电荷数:0,反应物有NH4HCO3参与反应,故反应物应由HCO-3提供负电荷,电荷数为:-1×3=-3,即反应物由3HCO-3提供3个负电荷.
2Ce3++3HCO-3+3HCO-3Ce2(CO3)3·nH2O
第四步:原子守恒,应用原子守恒依次配平主要原子和H、O原子.
①配平主要原子C,使C原子个数守恒.
反应物中有6个C原子,生成物中已有3个C原子还应再有3个C原子,但必须是呈电中性化合价为+4价的C元素的化合物,经分析3CO2符合.
2Ce3++3HCO-3+3HCO-3Ce2(CO3)3·nH2O+3CO2
②最后观察H、O原子个数,反应物补充(n-3)H2O,全部守恒.
2Ce3++6HCO-3+(n-3)H2O Ce2(CO3)3·nH2O+3CO2
例3 [2021年全国乙卷化学试题26题(1)]
磁选后的炼铁高钛炉渣中,其主要成分有TiO2、SiO2、Al2O3、MgO、CaO和少量Fe2O3,为节约并充分利用资源,通过图3所示工艺流程回收钛、铝、镁等.
回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不能发生化学反应,Al2O3、MgO、CaO、Fe2O3转化为相应硫酸盐,写出Al2O3转化为NH4Al(SO4)2的化学方程式_______.
分析 书写步骤如下:
第一步 :写出题中已经确定的反应物和生成物.
化学方程式:
Al2O3+(NH4)2SO4NH4Al(SO4)2
第二步:原子守恒,应用原子守恒依次配平主要原子和H、O原子.
①Al原子守恒
1Al2O3+(NH4)2SO42NH4Al(SO4)2
還有S原子守恒和N原子守恒两种情况.
第一种情况:
②先S原子守恒:
1Al2O3+4(NH4)2SO42NH4Al(SO4)2
③再N原子守恒:
反应物中有8个N原子,生成物中已有2个N原子还应再有6个N原子,但必须是呈电中性化合价为+3价的N元素的化合物.经分析6NH3符合.
1Al2O3+4(NH4)2SO4
2NH4Al(SO4)2+6NH3
④最后观察H、O原子个数,生成物补充3H2O,全部守恒.
1Al2O3+4(NH4)2SO42NH4Al(SO4)2+6NH3+3H2O
第二种情况:
⑤先N原子守恒:
1Al2O3+1(NH4)2SO42NH4Al(SO4)2
⑥再S原子守恒:
反应物中有1个S原子,生成物中有4个S原子,反应物中还应再有3个S原子,但必须是呈电中性化合价为+6价的S元素的化合物.经分析3SO3或3H2SO4符合.但从工艺流程分析,高炉矿渣焙烧工序,无SO3或H2SO4参与此步反应.故这种情况不能写出化学方程式.
例4 [2022年6月浙江省普通高校招生选考科目考试化学试题28题(3)]
化合物X由三种元素组成,某个实验小组按图4所示流程进行实验.
回答:
(3)①写出X到A的化学方程式_______.
②X难溶于水,但可溶于氨水中,写出该反应的离子方程式_______.
分析 第①问的书写步骤如下:
第一步 :确定氧化剂、还原剂、氧化产物和还原产物.
反应物:BaCu3O4、NH3
生成物:Cu,Cu化合价降低,得到电子,则氨中N化合价升高,NH3被氧化生成N2.
氧化剂:BaCu3O4;还原剂:NH3
氧化产物:N2;还原产物:Cu
离子方程式:NH3+Cu3O2-4Cu+N2
第二步:应用得失电子守恒,写出相应系数.
2NH3+Cu3O2-43Cu+N2
第三步:电荷守恒.
反应物电荷数:-2,生成物电荷数: 0,反应物有NH3参与反应,碱性环境,故生应物应由OH-提供负电荷,电荷数为:-1×2 =-2,即生成物由2OH-提供2个负电荷.
2NH3+Cu3O2-43Cu+N2+2OH-
第四步:原子守恒,观察H、O原子个数,生成物补充2H2O,全部守恒.
2NH3+Cu3O2-43Cu+N2+2OH-+2H2O
写成化学方程式:
2NH3+BaCu3O4Ba(OH)2+3Cu+N2+2H2O
第②问的书写步骤如下;
第一步:写出题中已经确定的反应物和生成物.
离子方程式:
Cu3O2-4+NH3·H2OCu(NH3)2+4
第二步:应用原子守恒配平主要原子.
Cu3O2-4+12NH3·H2O3Cu(NH3)2+4
第三步:电荷守恒.
反应物电荷数:-2,生成物电荷数:3×2=+6,反应物有NH3·H2O参与反应,碱性环境.故生成物应由OH-提供负电荷,电荷数为:-1×8=-8,即生成物由8OH-提供8个负电荷.
Cu3O2-4+12NH3·H2O3Cu(NH3)2+4+8OH-
第四步:原子守恒,观察H、O原子个数,生成物补充8H2O,全部守恒.
Cu3O2-4+12NH3·H2O
3Cu(NH3)2+4+8OH-+8H2O
BaCu3O4难溶于水,离子方程式中BaCu3O4不能写成Cu3O2-4,
故离子方程式为:
BaCu3O4+12NH3·H2O3Cu(NH3)2+4+Ba2++8OH-+8H2O
参考文献:
[1] 中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[M].北京:人民教育出版社,2020.
[责任编辑:季春阳]
