miR-106a对胶质瘤增殖和凋亡的影响及机制研究
2023-03-31林亦海吴漳益郭亮
林亦海 吴漳益 郭亮
胶质瘤是最常见的原发性脑肿瘤,具有生长快速、耐药性和侵袭性强的特性,因此患者预后很差[1]。胶质瘤患者的中位生存期仅有15 个月,5年生存率不到10%[2]。寻找和探索胶质瘤发生、发展的分子机制十分重要。微小RNA(microRNA,miRNA)是一类长度为17~22 个核苷酸的非编码RNA,在转录后基因调控中具有关键功能[3]。研究认为miRNA 有望成为胶质瘤新的治疗选择[4]。miR-106a 位于X 染色体上,在多种肿瘤中异常表达,促进肺腺癌、肝细胞癌、前列腺癌、宫颈癌等癌症进展[5-8],并可促进胶质瘤的发生、发展[9-11]。Wnt/β-连环蛋白(β-catenin)信号通路是一个保守的信号轴,参与多种生理过程。异常的Wnt/βcatenin 信号通路可促进癌细胞增殖和分化,在肿瘤发生和治疗反应中发挥关键作用[12]。本研究利用miR-106a 抑制物干扰胶质瘤细胞系中miR-106a 的表达,利用克隆形成实验检测细胞增殖能力,采用流式细胞术检测细胞凋亡水平,综合生物信息学预测和双荧光素酶报告基因实验的结果,明确miR-106a 在胶质瘤中的靶基因是否为腺瘤样息肉(adenomatous polyposis coli,APC)基因,以期揭示miR-106a 促进胶质瘤增殖并抑制凋亡的分子机制。
1 材料和方法
1.1 材料
1.1.1 组织样本收集 收集2020年1月至2021年12月浙江省立同德医院收治的10 例胶质瘤患者手术切除的胶质瘤组织。纳入标准:CT、MRI 检查及病理活检确诊为脑胶质瘤;未经手术、化疗等治疗;颅内单发肿瘤;临床资料完整。排除标准:合并其他类型肿瘤;合并其他颅内病变;有严重心脏、肝脏、肾脏功能障碍;术前发生瘤卒中。以同期颅脑损伤内减压术中切取的10 例脑组织为对照。标本收集后立即放入预冷无菌的组织保存液中,液氮冷冻保存。使用时,复苏冻存组织,并用组织处理模具将组织切成1 mm 的薄片。本研究严格遵循医学伦理委员会的审查批准,所有参与本研究的患者及其家属对本研究知情同意。
1.1.2 试验细胞及培养 人胶质瘤细胞系LN229、U251、U87 和人星形胶质细胞HA1800 均来源于中科院上海生科院细胞库。所有细胞均在10%FBS 和1%青霉素和链霉素的RPMI1640 培养基中培养,37 ℃,5%二氧化碳(CO2),正常换代。
1.1.3 药物及试剂 miR-106a 抑制物(化学修饰的RNA单链,5'-CUACCUGCACUGUAAGCACUUUU-3')及阴性对照(miR-106a抑制物的乱码序列,5'-ACUUCUACUGGCUAAGCUCACUU-3')、沉默APC(sh-APC)(正向:5'-CCGGAGTACAAGGATGCCAATATTACTCGAGTAATATTGGCATCCTTGTACTTTTTTG- 3',反 向:5'-AATTCAAAAAAGTACAAGGATGCCAATATTACTCGA -GTAATATTGGCATCCTTGTACT-3')的pGPU6/Hygro 质粒均购于上海吉玛制药技术有限公司;RPMI1640 培养基(批号:PM150110)以及FBS(批号:164210-50)均购于武汉普诺赛生命科技有限公司;Trizol(批号:SY4016)和SYBR Green PCR 试剂盒(批号:YT8466)购于北京伊塔生物科技有限公司;Annexin V-FITC/PI 试剂盒(批号:A211-01/02)购于南京诺唯赞生物科技股份有限公司;TOP-FLASH(批号:PVT1301)和FOPFLASH(批号:PVT1302)质粒均购于武汉维克赛思科技有限公司;APC(批号:ab40778)、细胞-髓细胞瘤病病毒癌(cellular-myelocytomatosis viral oncogene,c-Myc)(批号:ab17355)、B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)(批号:ab32124)、β-catenin(批号:ab68183)Lamin B1(批号:ab16048)以及β-肌动蛋白(β-actin)(批号:ab8226)抗体均购于艾博抗(上海)贸易有限公司;pmirGLO 载体(批号:MY1439)购于上海酶研生物科技有限公司;双荧光素酶报告基因检测试剂盒(批号:MD-21001-100)购于上海乐赛生物科技有限公司;QuickMutation™基因定点突变试剂盒(批号:D0206M)购于上海碧云天生物技术有限公司;lipofectamine 3000转染试剂盒(批号:L3000-015)购于北京索莱宝科技有限公司;High Capacity cDNA 逆转录试剂盒(批号:4368813)购于美国赛默飞世尔科技(中国)有限公司。
1.2 方法
1.2.1 miR-106a 表达检测 采用实时荧光定量PCR(qRT-PCR)法。使用Trizol 试剂从组织样本(胶质瘤组织及对照组织)、细胞样本(LN229、U251、U87 和HA1800)中分别分离总RNA,根据High Capacity cDNA逆转录试剂盒方法将总RNA逆转录成cRNA,按照SYBR Green PCR 试剂盒方法,以U6 为内参进行荧光定量检测。采用2-ΔΔCt法计算各样本中miR-106a表达水平。选择表达水平较高的2株细胞系用于后续细胞实验。
1.2.2 细胞转染及分组 根据lipofectamine 3000 转染试剂盒方法将sh-APC 质粒、miR-106a 抑制物及其阴性对照转染到miR-106a 高表达的2 个细胞系中。各细胞系分为3 组:阴性对照组仅转染miR-106a 抑制物的阴性对照;miR-106a 抑制物组仅转染miR-106a 抑制物;miR-106a 抑制物+sh-APC 组共转染miR-106a抑制物和sh-APC 质粒。正常培养备用。
1.2.3 细胞增殖能力检测 采用克隆形成实验。取1.2.2 中的阴性对照组和miR-106a 抑制物组细胞,以1 000/孔的细胞密度在6 孔板中铺板,37 ℃,5% CO2培养箱中正常培养2 周后,PBS 洗涤1 次,4%多聚甲醛固定细胞40 min,PBS 再次洗涤,室温下用0.5%结晶紫溶液染色15 min;PBS 洗涤细胞数次,晾干。用倒置显微镜对含有超过50 个细胞的细胞群(克隆)进行计数,分析被染成紫色的克隆的数量,以此检测各组细胞增殖能力。
1.2.4 细胞凋亡检测 采用流式细胞术。取1.2.2 中的阴性对照组和miR-106a 抑制物组细胞,室温下培养48 h,收集细胞并用PBS 洗涤。各管加入用PBS 稀释的1×缓冲液,使细胞充分重悬后,避光加入Annexin V和PI,轻轻混匀。室温避光孵育15 min,加入1×结合缓冲液混匀。取细胞悬液避光转移到流式管中,1 h 内用流式细胞仪上机检测,使用荧光激活细胞分选法分析细胞凋亡的结果。处于左上象限(Q1)的为死细胞,处于右上象限(Q2)的为凋亡中晚期细胞,处于右下象限(Q3)的为早期凋亡细胞,处于左下象限(Q1)的为活细胞。细胞凋亡比例(%)=Q1 细胞数占总细胞数的比例(%)+Q2 细胞数占总细胞数的比例(%)。
1.2.5 Wnt/β-catenin 通路活性检测 采用TOP/FOP荧光素酶实验。用0.15 μg TOP-FLASH 和FOP-FLASH质粒分别转染1.2.2 中的阴性对照组和miR-106a 抑制物组细胞,室温下于96 孔板中孵育72 h。使用Dual-Luciferase Reporter Assay 系统测量各组细胞的萤火虫荧光素酶活性,以海肾荧光素酶活性作为内部对照。
1.2.6 蛋白表达水平检测 采用Western blot 法。取1.2.2 中的阴性对照组和miR-106a 抑制物组细胞,用预冷的RIPA 缓冲液处理,提取总蛋白。使用SDS-PAGE系统电泳分离各蛋白质样品,转移到硝酸纤维素膜上,在5%脱脂牛奶中封闭2 h,分别加入β-catenin、c-Myc、Bcl-2、Lamin B1、β-actin 蛋白的一抗抗体,4 ℃孵育过夜;加入IgG 二抗,室温孵育1 h。使用ECL 检测系统使蛋白条带可视化,并使用Image J 软件对蛋白条带的灰度值进行分析。
1.2.7 APC 表达检测 采用qRT-PCR 法。用TRIzol试剂分离1.2.2 中阴性对照组和miR-106a 抑制物组细胞总RNA,用High Capacity cDNA 逆转录试剂盒将总RNA 逆转录成cRNA,按照SYBR Green PCR 试剂盒方法,计算APC 的mRNA 相对表达量。
1.2.8 miR-106a 与APC 结合验证 使用双荧光素酶报告基因检测实验。根据试剂盒说明书方法合成包含miR-106a 结合位点的野生型APC 3'非编码区(UTR)片段,按照QuickMutationTM基因定点突变试剂盒方法制备该片段的突变型,将野生型和突变型片段插入pmirGLO 载体中。将构建的报告质粒与miR-106a 抑制物或阴性对照共转染miR-106a 表达量较高的2 株细胞,孵育48 h。根据双荧光素酶报告基因检测试剂盒方法评估荧光素酶活性,并将萤火虫荧光素酶活性标准化为海肾荧光素酶活性。分别采用qRTPCR 法和Western blot 法检测两个细胞系中APC 的mRNA 表达水平和蛋白表达水平。
1.3 统计学处理 采用SPSS 21.0 统计软件。计量资料以表示,组间比较采用两独立样本t 检验或方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 miR-106a 在不同组织和不同细胞系中的表达相比于对照组织,miR-106a 在胶质瘤组织中显著高表达,表达水平提高2.9 倍(P<0.01),见图1A。相比于HA1800,miR-106a 在LN229、U251、U87 中显著高表达,其中LN229 和U251 的高表达最为显著,约为HA1800 的4.4 倍(均P<0.05),见图1B。因此将LN229和U251 用于后续细胞实验。

图1 miR-106a 在不同组织和不同细胞系中表达的比较(A:miR-106a 在胶质瘤组织和正常组织中表达的比较;B:miR-106a 在不同胶质瘤细胞系和人星型胶质细胞中表达的比较)
2.2 miR-106a 对LN229 和U251 细胞增殖和凋亡的影响 克隆形成实验发现,miR-106a 抑制物组LN229 和U251 细胞增殖能力均降低,分别是阴性对照组的44%和39%(均P<0.01),见图2A。流式细胞术结果发现,miR-106a 抑制物组细胞凋亡率显著提高,分别是阴性对照组的2.62 和2.90 倍(均P<0.01),见图2B。

图2 miR-106a对LN229和U251增殖和凋亡的影响(A:miR-106a对胶质瘤细胞增殖的影响;B:miR-106a对胶质瘤细胞凋亡的影响)
2.3 miR-106a 对LN229 和U251 中Wnt/β-catenin 信号通路蛋白表达的影响 TOP/FOP 荧光素酶实验结果表明,miR-106a 抑制物组LN229 和U251 细胞中TOP/FOP 荧光素酶活性均降低,分别是阴性对照组的47%和54%(均P<0.01),见图3A。Western blot结果显示,与阴性对照组相比,miR-106a 抑制物组c-Myc 和Bcl-2蛋白表达水平降低,核内β-catenin 蛋白表达水平减少,但总的β-catenin 蛋白水平无影响,见图3B。提示抑制miR-106a 的表达阻止了胶质瘤细胞核内Wnt/βcatenin 信号通路的激活。
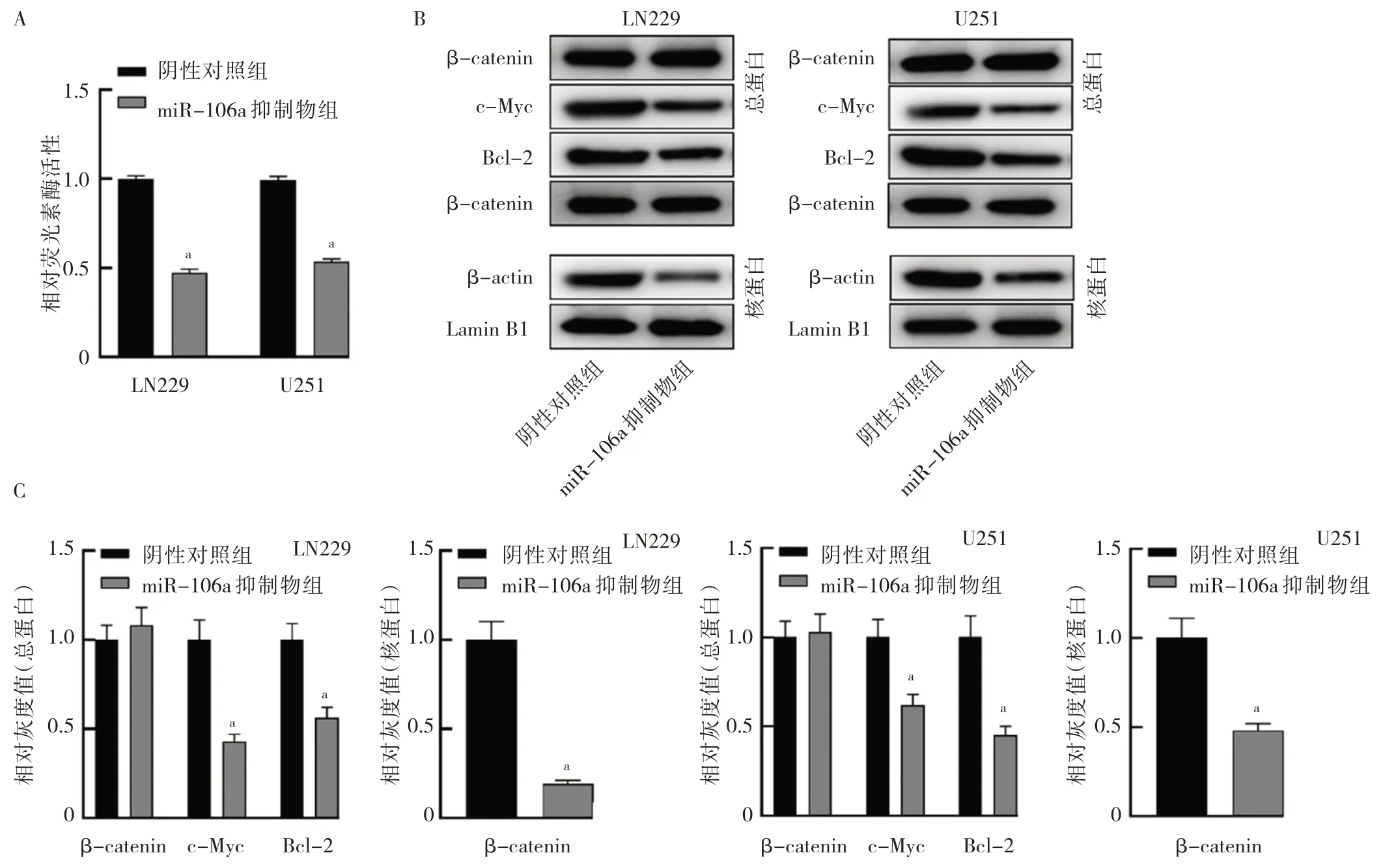
图3 miR-106a 表达对细胞内Wnt/β-catenin 信号通路活性的影响(A:miR-106a 对胶质瘤细胞荧光素酶活性的影响;B:Wnt/βcatenin 信号通路蛋白电泳图;C:信号通路蛋白表达水平)
2.4 miR-106a对LN229和U251中APC mRNA表达的影响 Starbase数据库显示miR-106a 与APC 3'UTR 存在结合位点,见图4A。双荧光素酶报告基因实验表明,相比阴性对照组,miR-106a 抑制物组野生型APC 3'UTR 荧光素酶活性表达显著增强(P<0.01),但突变型APC 3'UTR 荧光素酶活性变化不大(P>0.05),见图4B。qRT-PCR 和Western blot 的结果显示,相比阴性对照组,miR-106a 抑制物组细胞中APC 的mRNA 和蛋白表达水平均显著提高,差异均有统计学意义(均P<0.01),见图4C-D。APC 是Wnt/β-catenin 信号通路的抑制基因,提示miR-106a 在胶质瘤细胞中通过靶向并抑制APC 的表达,激活Wnt/β-catenin 信号通路。

图4 APCmiR-106a 对细胞APC mRNA 和蛋白表达的影响(A:miR-106a 和APC 的结合位点;B:miR-106a 对APC 野生型和突变型细胞荧光素酶活性的影响;C:胶质瘤细胞中APC mRNA 表达的比较;D:APC 蛋白电泳图和表达水平)
2.5 APC 在miR-106a 介导的胶质瘤细胞增殖和凋亡中的作用 克隆形成实验结果表明:与阴性对照组相比,miR-106a 抑制物组细胞增殖能力显著减弱(P<0.01),与miR-106a 抑制物组相比,miR-106a 抑制物+sh-APC 组细胞的增殖能力显著增强(P<0.05),见图5A。流式细胞术结果表明,与阴性对照组相比,miR-106a 抑制物组细胞凋亡率显著升高(P<0.01),与miR-106a 抑制物组相比,miR-106a 抑制物+sh-APC组细胞凋亡率显著降低(P<0.01),见图5B。

图5 APC 在miR-106a 介导的胶质瘤细胞增殖和凋亡中的作用(A:3 组细胞增殖比较;B:3 组细胞凋亡比较)
3 讨论
胶质瘤的恶性等级从Ⅰ级到Ⅳ级逐渐增加,组织学亚型包括星形细胞瘤、多形性胶质母细胞瘤、少突胶质细胞瘤和混合肿瘤;其特点是细胞快速增殖和血管生成,对常规治疗易产生抵抗性,容易复发,恶性程度高,预后差[13]。因此,探索胶质瘤发生的分子机制和研究可靠治疗靶点是目前关注的热点。
miRNA 在肿瘤细胞中具有某些致癌基因mRNA的结合位点,因此与癌症密切相关[14]。许多研究表明,一些miRNA 与胶质瘤的诊断和预后相关[15]。Nan 等[16]发现miRNA-451 可以通过靶向IκB 激酶beta 亚基来调节NF-κB 信号通路,从而在体外和体内抑制胶质瘤细胞的生长。Yu 等[17]发现miRNA-338-3p 过表达抑制胶质瘤细胞系增殖、迁移、侵袭,并促进胶质瘤细胞凋亡,证明了miRNA-338-3p/髓磷脂转录因子1 样轴在胶质瘤的进展中起关键作用。此外,miR-139-5p 也被证明通过靶向γ1 氨基丁酸A 型受体α1 抑制胶质瘤细胞增殖[18]。本研究发现,miR-106a 在胶质瘤组织中高表达,在LN229 和U251 胶质瘤细胞系中显著高表达,抑制miR-106a 表达可减少胶质瘤细胞增殖,增加胶质瘤细胞凋亡,这与Xu 等[9]的研究一致。
miR-106a 通过直接靶向甲基CpG 结合蛋白2(Methyl CpG binding protein 2,MeCP2)来抑制Wnt/βcatenin 信号通路,从而抑制口腔鳞状细胞癌进展[19]。本研究发现,miR-106a 可以促进胶质瘤细胞中的βcatenin 核移位,从而激活核内Wnt/β-catenin 信号通路。生物信息学分析结果表明APC 是miR-106a 的直接靶基因,进一步的实验结果表明,抑制miR-106a 的表达可以提高胶质瘤细胞中APC 的mRNA 和蛋白表达水平。APC 是Wnt/β-catenin 信号通路的抑制剂[20],如miR-106a 可通过靶向APC 在胃癌中发挥作用[21]。研究表明APC 通过Wnt/β-catenin 信号通路在胶质瘤中发挥着促癌作用,促进胶质瘤细胞系增殖,侵袭,转移并抑制细胞凋亡[22-25]。除了直接靶向APC,miR-106a 还可直接靶向Kruppel 样因子4[26],后者可直接与β-catenin 的c 端反式激活结构域相互作用,从而抑制β-catenin 对E1A 结合蛋白p300/CREB 结合蛋白的招募[27]。miR-106a 与forkhead box Q1(FOXQ1)的3'UTR区结合,抑制FOXQ1 表达[28]。miR-106a 表达可增强Wnt 靶基因如血管内皮生长因子和基质金属肽酶的表达,这些Wnt 靶基因受FOXQ1 调控[29]。本研究结果显示,抑制miR-106a 在LN229 和U251 胶质瘤细胞系中的表达可降低细胞增殖,促进细胞凋亡。与miR-106a抑制物组相比,miR-106a 抑制物+sh-APC 组细胞增殖变强,凋亡变弱,揭示了APC 在miR-106a 介导的胶质瘤细胞增殖和凋亡中的重要作用。
综上所述,miR-106a 在胶质瘤患者组织和细胞系中高表达。miR-106a 可能通过靶向APC 3'UTR 区,调控APC 蛋白表达水平,并抑制Wnt/β-catenin 信号通路的激活,从而影响胶质瘤细胞的增殖和凋亡等生物学行为。研究结果为完善胶质瘤的发病机制提供了重要的实验依据,也为胶质瘤的靶向治疗提供新的线索。此外,胶质瘤患者血液中miR-106a 的表达水平也是今后值得关注的一个研究内容。
