金丝桃苷对高糖诱导海马HT22细胞氧化应激介导的神经元凋亡的保护作用研究
2023-03-23吴琼崔利张大伟马斌斌
吴琼 崔利 张大伟 马斌斌
(1.大连医科大学附属大连市中心医院神经内科,辽宁 大连 116000;2.大连医科大学附属第二医院神经外科, 辽宁 大连 116000)
糖尿病性脑病(Diabetic encephalopathy,DE)现在被认为是糖尿病的并发症,由于全球糖尿病的发病率增加,并且在越来越年轻的患者中发生,糖尿病脑病可能会增加。现有纵向研究表明,随着时间的推移,糖尿病患者的认知功能会加速下降[1-2]。主要受影响的认知领域包括注意力、记忆力以及处理速度[3]。糖尿病与认知功能障碍之间的关系早在1922年的中就已提出[4],发病原因与胰岛素缺乏,对神经营养因子、神经递质、氧化和凋亡应激源的表达产生有关,对其下游的影响进而导致神经元的完整性、连通性缺陷和丢失,这也通常发生在仍在发育的大脑中[5]。金丝桃苷(hyperoside,Hyp)是一种植物来源的类黄酮,主要存在于水果、果汁(主要是黄烷醇、黄酮和花青素)和中药中,具有抗氧化、抗肿瘤、抗炎、保护心脑血管等作用[6-8],临床上已广泛应用于减轻炎症、改善心血管功能等方面。然而,金丝桃苷能否通过激活Akt/GSK-3β通路保护高糖损伤下所致的HT22海马神经元氧化应激及凋亡未见报道,因此本研究拟采用高糖诱导海马HT22细胞损伤,探索金丝桃苷是否通过调控Akt/GSK-3β通路发挥抗氧化、抗细胞凋亡作用,为其临床保护神经细胞,防治脑尿病脑病相关疾病提供基础理论依据。
1 材料与方法
1.1试验药物 金丝桃苷为成都曼思特生物科技有限公司产品,纯度≥98%。采用二甲基亚砜(DMSO)溶解后配成10 mmol/L金丝桃苷母液,在超净台内采用0.22 μmol/L微孔滤器过滤除菌,实验用药时取少量母液稀释成相应浓度使用,其它放置-20℃冻存备用。
1.2细胞 HT22细胞复苏后接种于含有1%双抗(青霉素-链霉素)、10%FBS、90%低糖DMEM培养基中,培养基葡萄糖浓度正常(17 mmol/L),置于37℃,体积分数5% CO2培养箱中培养。当细胞融合率至70%~80%时,传代培养,选取对数生长期的细胞进行实验。
1.3试剂 金丝桃苷购于成都曼思特生物科技有限公司;TCBN(triciribine,Akt inhibition)、p-Akt、p-Gsk3β、Caspase-3购于abcam公司;GAPDH抗体、二抗购于proteintect公司;低糖DMEM培养基购于Sigma公司;CCK8试剂购于Beyotime试剂公司;双抗、胎牛血清购于hyclone公司;活性氧检测试剂盒、BCA法蛋白检测试剂盒、ECL显影剂、Hoechst染色试剂盒、线粒体膜电位检测试剂盒、凋亡检测试剂盒购于上海碧云天生物技术有限公司。
1.4仪器 细胞微孔板成像系统cytation5(美国Biotek公司);倒置相差显微镜(日本奥林巴斯公司);电泳仪、垂直电泳槽、化学发光凝胶成像系统(美国伯乐公司);二氧化碳培养箱(Thermo公司);低温高速离心机(德国sigma公司)。
1.5方法
1.5.1分组与给药 HT22细胞分为对照组、高糖处理组、金丝桃苷组和TCBN组。对照组:正常培养HT22细胞;高糖处理组:培养基中加入50 mmol/L高糖培养作用48 h;金丝桃苷组:培养基中分别加入100 μmol/L金丝桃苷预处理2 h后加入50 mmol/L高糖培养48 h;TCBN抑制剂组:培养基中加入金丝桃苷100 μmol/L+1 μmol/L TCBN预处理2 h,然后加入50 mmol/L高糖培养48 h。
1.5.2增强型CCK-8检测HT22细胞活力 取对数生长期的HT22细胞,经胰蛋白酶消化后,分别以每孔1×105个接种于96孔板中,每孔100 μL,细胞培养24 h后加入药物。使金丝桃苷终浓度为(0、25、50、100、200 μmol/L)的培养基培养或按照1.5.1的分组及给药方式培养48 h,每个浓度设置3个复孔。每孔加入10 μL增强型CCK-8试剂,放入培养箱孵育1~4 h,于490 nm处测定OD值。
1.5.3DCFH-DA荧光探针检测ROS水平 用无血清培养液按1∶1 000稀释DCFH-DA,使终浓度为10 mmol/L。按照1.5.1分组及给药方式培养后,吸去培养液,加入适量的DCFH-DA,充分盖住细胞,37℃培养箱孵育20 min,用无血清培养基洗涤3次,于488 nm激发波长和525 nm发射波长,采用Cytation5观察细胞内ROS表达,放大倍数4倍。同一实验平行重复3次。最后采用Image-Pro Plus 6.0软件对结果进行荧光定量分析。
1.5.4免疫荧光染色测定JC-1 按照1.5.1分组及给药方式培养48 h后,弃去培养基,PBS冲洗3次,加入1 mL JC-1染色工作液,于5% CO2培养箱中避光染色20 min,取出后用JC-1染色缓冲液冲洗2遍,置于Cytation5观察JC-1表达。
1.5.5Hoechst 33342染色 按照1.5.1分组及给药方式培养48 h后,室温条件下,将HT22细胞在4%多聚甲醛中固定15 min,Triton-X 100透化20 min,将细胞用Hoechst 33342染色液在37°C下染色10 min,用PBS洗涤两次。置于Cytation5下观察Hoechst 33342染色。
1.5.6流式细胞仪测定各组HT22细胞凋亡率 按照1.5.1分组及给药方式培养48 h后,分别收集各组细胞,取1×105个细胞,按说明处理细胞PBS洗涤细胞2次;加入500 μL Binding Buffer重悬细胞;分别加入5 μL Annexin V-FITC和PI室温避光染色10 min,进行流式细胞仪检测,分析细胞凋亡率,同一实验平行重复3次。
1.5.7Western Blot测定蛋白表达 各组HT22细胞经药物处理作用48 h后,进行p-Akt、p-GSK-3β、Caspase-3蛋白测定。经BCA法测定蛋白质含量,进行SDS-聚丙烯酰胺凝胶电泳,PAGE凝胶中蛋白质电转移至硝酸纤维素膜上,封闭。放入一抗中(1∶1 000)4℃杂交过夜。将PVDF膜经TBST冲洗3次后放入二抗(1∶5000)孵育1~2 h。取出PVDF膜,TBST冲洗后,吸去多余液体,铺于玻璃板上。将ECL试剂盒内的detection reagent 1与detection reagent 2等体积混合后,均匀滴在PVDF膜上,反应1~2 min。放置到化学发光凝胶系统分析仪中进行Ecl化学发光,成像,分析。
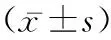
2 结 果
2.1金丝桃苷对高糖诱导HT22细胞活力的影响 为了证明金丝桃苷对HT22细胞的生物安全性,将不同剂量金丝桃苷加入到DME/F12培养基中以17 mmol/L葡萄糖作为正常葡萄糖条件作用48 h以确定金丝桃苷对HT22细胞活力的影响。CCK8检测结果表明,金丝桃苷25、50、100 μmol/L浓度范围内对细胞活力没有不利影响(P>0.05),而200 μmol/L金丝桃苷降低细胞活力(P<0.01)见图1A。与对照组相比,50 mmol/L高糖组HT22细胞活力明显降低(P<0.01),25 μmol/L金丝桃苷组对细胞活力没有影响;50、100 μmol/L金丝桃苷组HT22细胞活力显著上升,差异具有统计学意义(P<0.01),见图1B。以上结果提示100 μmol/L金丝桃苷对细胞活力没有任何损伤,且对高糖损伤后细胞活力有明显升高作用,表明100 μmol/L金丝桃苷可能是保护HT22免受损伤的最佳浓度,所以我们选择100 μmol/L金丝桃苷用于后续实验研究。
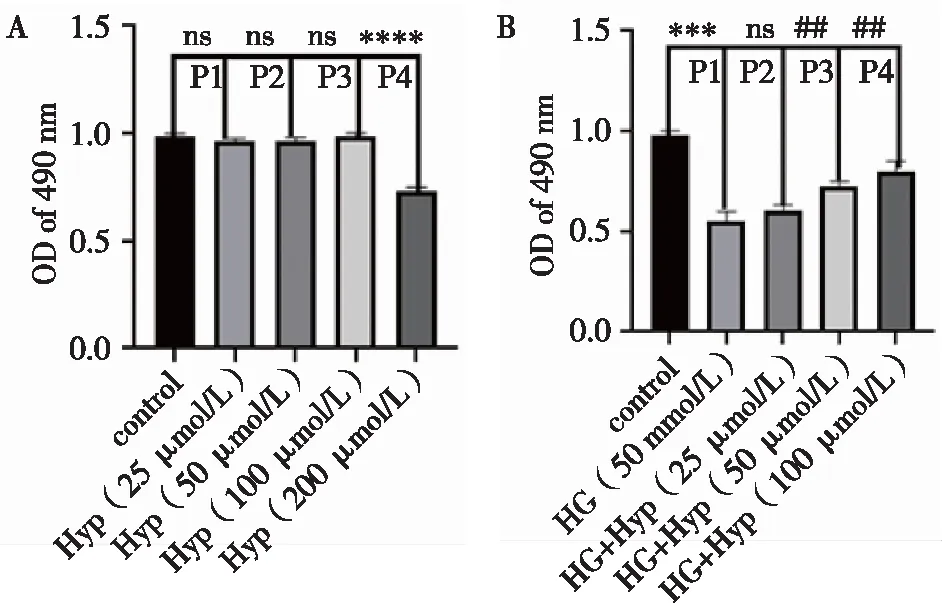
图1 不同浓度金丝桃苷处理HT22细胞增殖活力的影响
2.2金丝桃苷对高糖诱导HT22细胞活性氧水平的影响 Cytation5结果显示,与正常对照组相比,高糖损伤后细胞内产生大量ROS,表现为强绿色荧光;金丝桃苷组ROS明显被抑制,表现荧光强度降低;TCBN组细胞内ROS增多,提示金丝桃苷保护作用被TCBN阻断,以上结果提示金丝桃苷能够减少或抑制高糖损伤后HT22细胞产生ROS,但这种保护作用能够被TCBN阻断,见图2。
2.3金丝桃苷对高糖诱导HT22细胞JC-1水平的影响 Cytation5结果显示,正常组细胞JC-1呈高红低绿表达;与正常对照组相比,高糖损伤组JC-1呈高绿低红表达;与高糖损伤组比较,金丝桃苷组能增加HT22细胞JC-1表达,红色荧光增多,荧光增强,绿色荧光减少,荧光强度降低;与金丝桃苷组相比较,TCBN组JC-1表达红色荧光减少,荧光强度降低,绿色荧光增多,荧光强度增加,总体呈高绿低红荧光,见图3。以上结果提示金丝桃苷能保护高糖损伤后HT22细胞线粒体损伤,保护HT22细胞发生早期凋亡,但这种保护作用能够被TCBN所阻断。
2.4金丝桃苷对高糖诱导HT22细胞Hoechst 33342染色的影响 Cytation5结果显示,与对照组相比,高糖组明显可见凋亡细胞增多;与高糖组相比,金丝桃苷组凋亡细胞数减少;与金丝桃苷组相比较,TCBN组凋亡细胞增多,以上结果提示金丝桃苷对高糖损伤HT22细胞凋亡具有保护作用,而这种作用能够被TCBN所阻断。见图4。
2.5金丝桃苷对高糖诱导HT22细胞凋亡的影响 流式细胞仪检测结果显示,与正常对照组相比,高糖组HT22细胞凋亡比例为38.21%,差异具有统计学意义(P<0.01);与高糖组相比,金丝桃苷组作用HT22细胞48 h后,细胞凋亡比例数减少,下降至15.74%,差异具有统计学意义(P<0.01);与金丝桃苷组相比,TCBN组HT22细胞凋亡明显增多,从金丝桃苷组15.74增至25.71%,两组相比差异有统计学意义(P<0.05)。以上结果表明金丝桃苷能保护高糖损伤HT22所导致的细胞凋亡,但这种保护作用被TCBN所阻断。见图5。
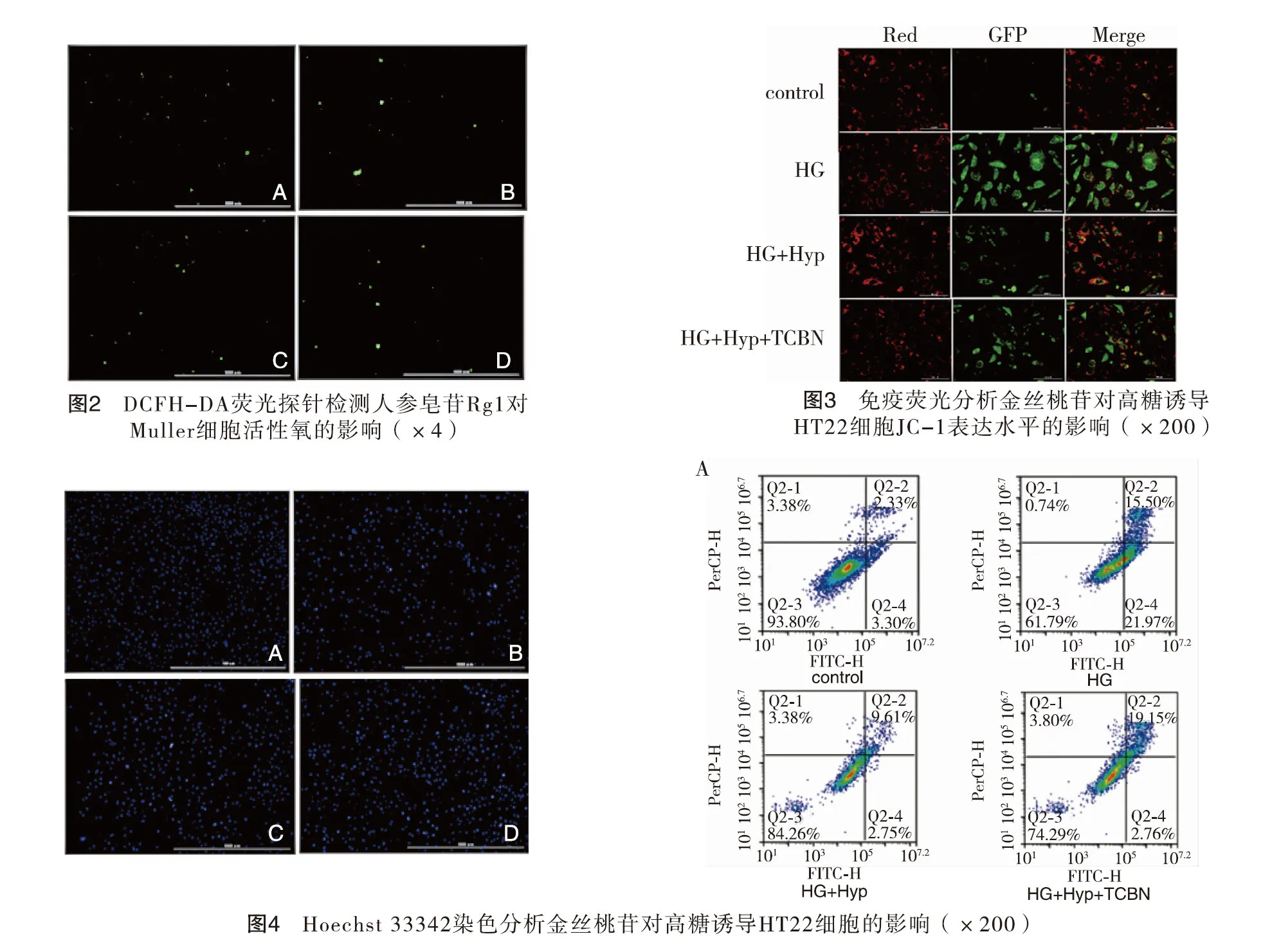
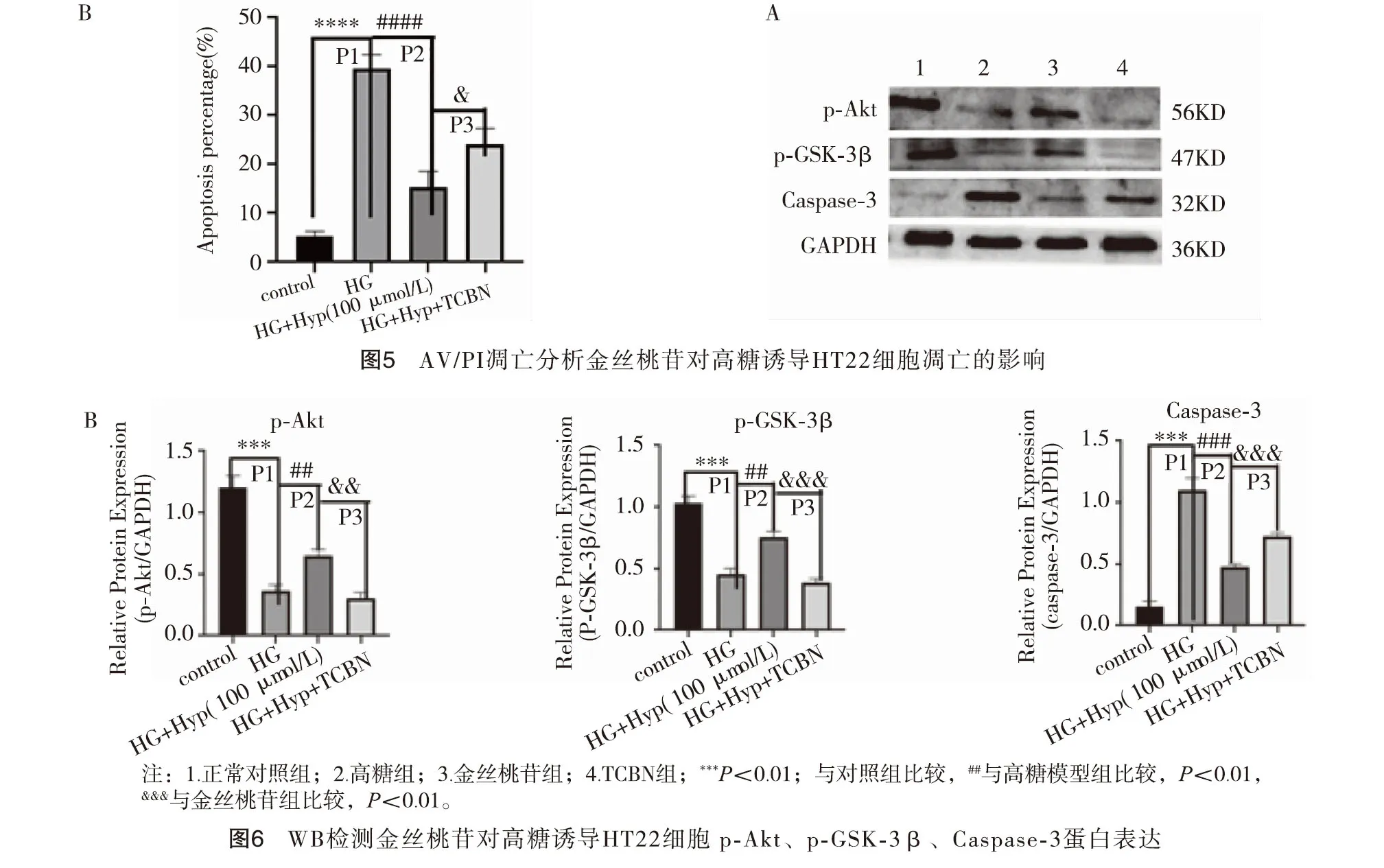
2.6金丝桃苷对高糖诱导HT22细胞p-Akt、p-GSK3β、Caspase-3水平的影响 Western blot分析显示,与正常对照组相比,高糖组p-Akt、p-GSK3β蛋白表达明显减少(P<0.01),Caspase-3蛋白表达增加(P<0.01);与高糖组相比,金丝桃苷组p-Akt、p-GSK3β蛋白表达水平升增加(P<0.01),Caspase-3蛋白表达下降(P<0.01);而TCBN组p-Akt、p-GSK3β、Caspase-3蛋白表达与高糖组相似,和金丝桃苷组结果相反。以上结果提示金丝桃苷可能通过激活Akt/GSK3β信号通路增加高糖损伤后HT22细胞p-Akt、p-GSK3β蛋白表达、降低Caspase-3蛋白表达,而TCBN能阻断金丝桃苷这种作用。见图6。
3 讨 论
DE主要表现在认知功能、学习能力、智力发展和记忆恢复等方面,导致学业和专业表现受损,其机制主要与葡萄糖代谢紊乱、血管变化引发的脑内多种结构变化有关[9-10]。HT22海马神经元是参与认知、学习记忆的重要神经元细胞,在不同因素(例如谷氨酸、高糖)刺激的情况下可发生神经元凋亡[11-12]。高糖刺激后糖基化终产物、自由基等物质堆积产生大量ROS,ROS促进细胞色素C(Cyt C)的释放,进而导致体内细胞损伤,线粒体膜下位下降,发生氧化应激反应。有研究表明细胞受损后首先表现在线粒体膜电位的改变,早于形态学的变化,是细胞凋亡的早期表现[13]。ROS、JC-1、细胞凋亡率检测是反应细胞氧化应激和凋亡的主要指标。本次研究结果表明,HG作用后明显增加ROS表达,JC-1表达下降,HT22细胞凋亡数明显增加,而Hyp作用后能明显抑制ROS产生,抑制JC-1下降,增加JC-1表达,减少HT22细胞凋亡,表明Hyp具有明显的抗氧化应激、抗凋亡作用,而Akt抑制剂TCBN能明显阻断Hyp的这种作用,但其体机制有待于进一步探讨。
AKT(蛋白激酶B)/GSK-3β(糖原合成酶激酶-3)通路已被证明在神经保护中发挥关键作用,通过刺激细胞增殖和抑制细胞凋亡来增强细胞生存。据文献报道,莱菔硫烷通过激活Akt/GSK-3β信号通路改善糖尿病大鼠认知功能[14]。牛膝多肽可能通过调节PI3K/Akt/GSK-3β通路发挥对神经元凋亡的保护作用[15]。Akt是细胞存活和凋亡的重要调控因子,文献报道[16]阿尔茨海默症(Alzheimer’sDisease AD)患者大脑中的PI3K/Akt信号减弱。一般来说,在Akt激活的过程中,完全激活需要Ser473,因此Ser473磷酸化水平代表了Akt磷酸化的程度。激活的Akt磷酸化参与细胞生存、细胞周期、血管生成和代谢的靶蛋白,从而起到神经保护作用[17]。选择性下调Akt同时上调GSK-3β活性可能与脑功能失调的发病机制有关[18]。已有研究[19]表明,Akt活化可能在神经退行性疾病中发挥治疗作用。GSK-3β广泛活跃,是PI3K/Akt细胞信号转导的关键效应因子。因此,GSK-3β依赖于细胞代谢、细胞死亡和存活等细胞过程[20]。本研究结果显示,HG能减少p-Akt、p-GSK-3β蛋白表达,增加Caspase-3蛋白表达,与文献报道一致[14-15]。而Hyp能明显增加p-Akt、p-GSK-3β蛋白表达,降低Caspase-3蛋白表达,但加入Akt阻断剂TCBN组结果与HG组相似,与Hyp组结果相反,以上结果提示,Hyp可能通过激活Akt/GSK-3β信号通路保护HT22细胞氧化应激及凋亡。
综上所述,本研究只是初步探讨了体外实验中Hyp的抗氧化应激及抗凋亡作用与抑制ROS表达,保护线粒体膜电位,减少细胞凋亡有关,可能是通过激活Akt/GSK-3β信号通路来实现的,但其更深入的机制还需要在体内动物模型中进一步验证。
