红景天甙调控BDNF/TrkB通路对听觉剥夺模型大鼠听皮层可塑性的影响
2023-03-22贾歆刘强刘经尧
贾歆 刘强 刘经尧
(1邢台市人民医院药剂科,河北 邢台 054001;2河北省眼科医院医学影像科;3河北医科大学)
耳聋是临床常见的耳鼻喉科疾病,药物、噪音、外伤等是引起耳蜗组织细胞损伤,导致听觉丧失的主要因素,听力丧失可极大影响日常交流,给患者正常学习工作造成障碍〔1,2〕。听觉中枢在听力受损或恢复时,其神经细胞病理形态会发生改变,被称作可塑性,药物、噪音等外界刺激可诱导活性氧(ROS)的大量产生,引发严重的过氧化及炎症反应,造成耳蜗组织结构受损,毛细胞凋亡缺失,进而引起听皮层可塑性改变,是导致听觉丧失的主要病理基础〔2~4〕。脑源性神经生长因子(BDNF)可与受体酪氨酸激酶(Trk)B结合,促进神经元的生长、发育、分化及再生修复,维持突触的传递及可塑性,是保证神经系统正常生理结构及功能的关键信号,上调其信号分子表达,可抑制ROS的过量产生,减轻β-淀粉样蛋白25-35诱导的神经细胞损伤与认知功能障碍,还可延缓耳聋患者听神经的退化,促使其听力恢复〔5,6〕,因而BDNF/TrkB信号是改善听觉丧失患者听皮层可塑性的潜在作用靶点。红景天苷是一种酚苷类化合物,大多提取自红景天属植物的根、茎,具有抗氧化、抗衰老、抗疲劳、抗菌、抗炎的功能,能通过清除ROS抑制高糖诱导的应激及炎症反应,减轻视网膜Müller细胞凋亡,还能显著减轻噪声引发的耳蜗外毛细胞损伤,缓解豚鼠听力损伤症状〔7,8〕,但红景天甙是否可通过调控BDNF/TrkB通路而改善耳聋患者听皮层可塑性,目前还未可知,本文探讨红景天甙调控BDNF/TrkB通路对听觉剥夺模型大鼠听层可塑性的影响。
1 材料与方法
1.1动物 SPF级SD大鼠63只,体重(200±20)g,生产许可证号SCXK(粤)2018-0043,购自广州相观生物科技有限公司。大鼠在本院动物中心进行适应饲养,动物饲养房中温度(25±2)℃,相对湿度(55±5)%,以12 h/12 h明暗循环进行照明,大鼠自由饮水进食。
1.2主要试剂及仪器 庆大霉素注射液(批号1808183)购自河南润弘制药公司;红景天苷(HPLC≥98%,货号D0558)购自上海宝曼生物科技有限公司;K252a(货号HY-N6732)购自美国MedChemExpress公司;活体组织ROS测定试剂盒(货号HL10016.4)购自上海哈灵生物科技有限公司;OCT包埋剂(货号4583)购自上海睿铂赛生物科技有限公司;苏木素-伊红(HE)染色试剂盒、二喹啉甲酸(BCA)蛋白检测试剂盒、大鼠白细胞介素(IL)-18酶联免疫吸附试验(ELISA)试剂盒、大鼠肿瘤坏死因子(TNF)-α ELISA试剂盒、大鼠干扰素(IFN)-γ ELISA试剂盒、兔源磷酸甘油醛脱氢酶(GAPDH)一抗、兔源脑源性神经营养因子(BDNF)一抗、兔源TrkB一抗、兔源p-TrkB一抗、羊抗兔二抗(货号分别为ab245880、ab102536、ab213909、ab236712、ab239425、ab181602、ab226843、ab248704、ab197072、ab150077)购自美国Abcam公司;RIPA裂解液(货号P0013K)购自上海碧云天公司等。
ABR电位仪(型号ICS-CHARTR-EP),购自北京麦德森医疗器械销售中心;隔声屏蔽室购自广州声左声学科技有限公司;扫描电子显微镜(型号S-4800)购自日本日立公司;全波长酶标仪(型号HBS-ScanX)购自南京德铁实验设备有限公司;冰冻切片机(型号KH-LQ3500)购自湖北孝感阔海医疗科技有限公司;光学显微镜(型号E100)购自日本Nikon公司;小型蛋白垂直电泳转印系统(型号1658033)购自美国Bio-Rad公司;凝胶成像系统(型号GelDoc-It 310)购自上海巴玖实业有限公司等。
1.3听觉剥夺模型大鼠制备及分组给药 取SD大鼠63只,检测大鼠听觉脑干诱发电位(ABR)阈值,然后以100 mg/kg的剂量肌内注射庆大霉素注射液〔9〕,每天1次,连续注射2 w,再次测定ABR阈值,当其上升20 dB以上时,表示造模成功,共造模51只大鼠,将造模成功48只随机分为模型组、K252a(BDNF/TrkB通路抑制剂)组、红景天苷组、红景天苷+K252a组,每组12只,另取12只大鼠肌内注射等剂量生理盐水,设为对照组。将红景天苷、K252a以生理盐水溶解,配制为10 mg/ml的红景天苷〔10〕药液、20 μg/ml的K252a〔11〕药液、10 mg/ml的红景天苷及20 μg/ml的K252a混合药液,给药组大鼠以5 ml/kg的剂量腹腔注射,对照组与模型组腹腔注射同剂量生理盐水,每天注射一次,持续21 d。
1.4ABR阈值检测 以乙醚气体麻醉大鼠,于其颅顶正中插入记录电极,于给声耳、对侧耳后皮下分别插入参考电极及接地电极,将大鼠放在隔声屏蔽室内,以滤波短声刺激,耳机输出,距离给声耳道口0.5 cm,每秒重复10次,频率100~3 000 Hz,叠加512次,扫描时程10 ms,以Ⅲ波为基准确定记录反应阈值。
1.5大鼠耳蜗组织病理形态检测及标本采集 ABR阈值检测结束后,以注射器自颈动脉处采集血液1.5 ml,离心(4℃,1 000 r/min),收集上清置于干净的Ep管中,保存在-80℃冰箱中;通过颈椎脱位处死大鼠,各组随机选出6只解剖,取出大脑及双侧听泡,分离出听皮层及耳蜗组织,各剪下0.5 g保存在液氮中;各组剩余的6只大鼠解剖后取出大脑及双侧听泡,也分离出听皮层及耳蜗组织,将大脑听皮层组织浸入OCT包埋剂中,以液氮快速冰冻后置于冰冻切片机中,做连续病理切片备用,耳蜗组织进行充分灌注固定后,于解剖显微镜下仔细解剖、暴露耳蜗各转螺旋器,以单宁酸导电染色后脱水,经叔丁醇置换后将样品粘贴在导电胶上,进行离子溅射镀膜后,以扫描电子显微镜观察耳蜗组织病理形态。
1.6大鼠听皮层神经元病理形态检测 取出1.5中的大脑听皮层切片,浸入冰丙酮中固定后,采用试剂盒进行HE染色,以蒸馏水漂洗后,置于光学显微镜下观察并拍照。
1.7大鼠听皮层及耳蜗组织ROS水平检测 取出1.5中保存在液氮中的听皮层及耳蜗组织,加入RIPA裂解液进行匀浆、离心,采集上清液,以BCA检测试剂盒测定其中蛋白总浓度,取出0.15 ml,采用ROS测定试剂盒测定其中ROS水平,剩余蛋白样品液保存在-80℃冰箱中。
1.8大鼠血清致炎因子IL-18、TNF-α、IFN-γ水平检测 取出1.5中的血清,以冰水浴解冻,采用试剂盒测定其中致炎因子IL-18、TNF-α、IFN-γ水平。
1.9大鼠听皮层及耳蜗组织BDNF/TrkB通路蛋白表达检测 取出1.7中剩余的蛋白样品液,以冰水浴解冻,加入适量上样缓冲液后煮沸变性,每组各取20 μg进行电泳(110 V,90 min),分离蛋白后湿转(110 V,90 min),以5%脱脂奶粉封闭所得聚偏氟乙烯(PVDF)膜上蛋白,根据蛋白分子量截取目的蛋白p-TrkB、TrkB、BDNF、GAPDH条带,以兔源一抗孵育、洗膜,加入羊抗兔二抗孵育、洗膜,显色后拍照,通过Image J软件分析图片灰度值,进行定量后统计分析出各蛋白相对表达量。
1.10统计学分析 采用SPSS24.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1各组听力情况比较 与对照组相比,模型组ABR阈值显著升高(P<0.05);与模型组、红景天苷+K252a组分别相比,红景天苷组ABR阈值均显著降低(P<0.05),K252a组ABR阈值均显著升高(P<0.05)。见表1。
2.2各组听皮层及耳蜗组织ROS水平比较 与对照组相比,模型组听皮层及耳蜗组织ROS水平显著升高(P<0.05);与模型组、红景天苷+K252a组分别相比,红景天苷组听皮层及耳蜗组织ROS水平均显著降低(P<0.05),K252a组听皮层及耳蜗组织ROS水平均显著升高(P<0.05)。见表1。
2.3各组血清致炎因子IL-18、TNF-α、IFN-γ水平比较 与对照组相比,模型组血清致炎因子IL-18、TNF-α、IFN-γ水平显著升高(P<0.05);与模型组、红景天苷+K252a组分别相比,红景天苷组血清致炎因子IL-18、TNF-α、IFN-γ水平均显著降低(P<0.05),K252a组血清致炎因子IL-18、TNF-α、IFN-γ水平均显著升高(P<0.05)。见表1。
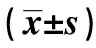
表1 各组ABR阈值、听皮层及耳蜗组织ROS、血清致炎因子IL-18、TNF-α、IFN-γ水平、p-TrkB/TrkB、BDNF蛋白表达
2.4各组耳蜗组织病理改变 对照组耳蜗组织毛细胞形态正常,排列整齐;模型组毛细胞结构改变,大小不一,且排列紊乱,数目缺失,与螺旋神经节细胞周围突结合发生裂隙,耳蜗组织出现明显病理损伤;红景天苷组耳蜗组织病理损伤相比模型组减轻;K252a组耳蜗组织病理损伤相比模型组进一步加重;红景天苷+K252a组耳蜗组织病理损伤相比模型组无明显变化。见图1。
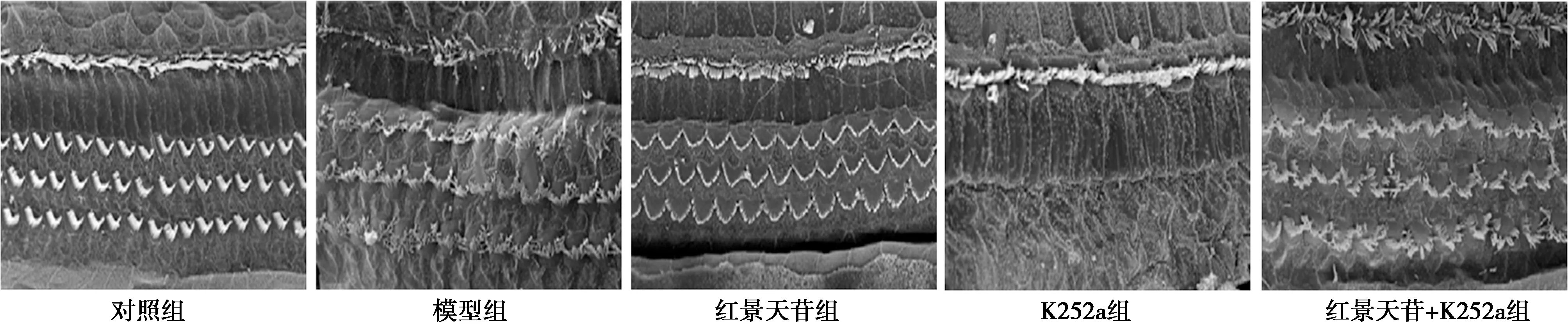
图1 扫描电镜观察各组耳蜗组织病理形态(×3 000)
2.5各组听皮层神经元改变 对照组听皮层神经元体积较大,结构形态完好,分布均匀;模型组听皮层神经元萎缩变小,胞质减少,细胞核出现固缩碎裂,且分布杂乱,数目明显减少,呈明显病理损伤;红景天苷组听皮层神经元病理损伤相比模型组减轻;K252a组听皮层神经元病理损伤相比模型组进一步加重;红景天苷+K252a组听皮层神经元病理损伤相比模型组无明显变化。见图2。
图2 各组听皮层神经元病理形态(HE染色,×200)
2.6各组听皮层及耳蜗组织BDNF/TrkB通路蛋白表达比较 与对照组相比,模型组听皮层及耳蜗组织p-TrkB/TrkB、BDNF蛋白表达水平显著降低(P<0.05);与模型组、红景天苷+K252a组分别相比,红景天苷组听皮层及耳蜗组织p-TrkB/TrkB、BDNF蛋白表达水平均显著升高(P<0.05),K252a组听皮层及耳蜗组织p-TrkB/TrkB、BDNF蛋白表达水平均显著降低(P<0.05)。见表1和图3。

1~5:对照组、模型组、红景天苷组、K252a组、红景天苷+K252a组图3 各组听皮层及耳蜗组织BDNF/TrkB 通路蛋白的免疫印迹检测
3 讨 论
听力损失是由各种外界有害刺激引发的耳蜗组织及听皮层神经可塑性损伤,其中氨基糖苷类抗生素暴露是造成耳聋的主要原因〔12,13〕,本文以肌内注射庆大霉素的方法建立听觉剥夺大鼠模型,结果显示模型构建成功。氨基糖苷类抗生素可诱导ROS自由基过量产生,引发炎症反应发生,增强氧化应激,导致耳蜗及听觉神经损伤,造成听力丧失,清除ROS,进而降低过氧化反应,抑制炎症,可防治听力损失症状〔14,15〕。红景天苷是我国传统中药材红景天的主要有效成分,具有显著的抗氧化及消炎作用,可抑制永久性大脑中动脉闭塞大鼠神经元凋亡,保护神经功能,还可明显降低庆大霉素诱导的过氧化反应,减轻耳蜗毛细胞损伤〔16,17〕。本文结果表明红景天苷可清除庆大霉素暴露诱导产生的ROS,降低致炎细胞因子水平,抑制炎症,减轻氧化应激,缓解听皮层神经元与耳蜗组织损伤,改善听皮层可塑性,提高大鼠听觉能力,证实了红景天苷对耳聋的治疗作用。
BDNF在突触可塑性、神经元的发育、再生、修复等方面起到重要的调控作用,可促使下游TrkB蛋白磷酸化,减少ROS、炎性细胞因子合成产生,抑制炎症进展,降低氧化应激水平,保护神经细胞免于凋亡损伤,维持连接毛细胞的螺旋神经节神经元存活、突起生长及分支,促进其与毛细胞之间的突触形成,减轻兴奋毒素诱导的突触病变、缺失,促使听力恢复〔18~20〕,因此,激活BDNF/TrkB信号是防治耳聋的有效手段。本文结果显示,BDNF/TrkB信号参与听力丧失过程,红景天苷可通过激活该信号抑制氧化应激及炎症反应,
综上,红景天苷可上调BDNF蛋白表达,提高TrkB蛋白的磷酸化水平,显著减少ROS及炎性因子产生,抑制炎症发生及进展,降低氧化应激水平,减轻听觉剥夺模型大鼠耳蜗组织损伤,减弱听皮层神经元变性凋亡,改善听皮层可塑性,缓解大鼠听觉丧失症状,激活BDNF/TrkB通路是其发挥药理作用的分子机制之一,本文为红景天苷在防治耳聋方面的临床应用及推广提供了有力证据。
