铽(Ⅲ)金属有机骨架材料对模拟尿液中二硫化碳生物标志物2-硫代噻唑烷-4-羧酸的荧光识别
2023-03-21何文涛秦红燕尚可霞
何文涛,秦红燕,尚可霞,2*
(1.河西学院 医学院,张掖 734000; 2.甘肃省河西走廊特色资源利用重点实验室,张掖 734000)
二硫化碳(CS2)可用作黏胶纤维、玻璃纸、土壤消毒剂和电子真空管的原料[1],也可在食品保藏中用来防昆虫和防细菌[2]。CS2具有周围神经毒性[3-6],长时间接触可能引发中枢神经系统方面的疾病;CS2具有挥发性,低浓度水平CS2即可加速动脉、冠状动脉粥样硬化[7]。CS2进入人体后,其中0.7%~2.3%的CS2会与谷胱甘肽反应生成2-硫代噻唑烷-4-羧酸(TTCA)[8],常通过尿液排泄掉,美国工业卫生专家会议建议将TTCA 作为尿液中转移性CS2的生物监测指标[9]。目前,尿液中TTCA 的常用检测方法有毛细管气相色谱法、高效液相色谱法、气相色谱-质谱法,但是这些方法存在维修成本高、选择性低、灵敏度低等缺点[10]。与其他检测方法相比,荧光分光光度法具有可移植性、检出限低、选择性高、灵敏度高、操作简单、响应快速等显著优势[11]。
金属有机骨架材料(MOF)是由无机金属离子与含氮、氧的多齿有机配体通过配位作用自动组装形成的具有无限网络结构的多孔材料,具有高结晶度、多孔性和强金属-配体作用等特点,在气体吸附与分离、有机催化、传感器与驱动器、药物缓释、光学材料等领域的应用前景良好[12]。发光MOF 是新兴的有机杂化材料,可用于制备荧光传感器[13-14],主要通过荧光猝灭[15]或增强[16]的方式检测分析物。3-(3′,5′-二羧基苯氧基)邻苯二甲酸(H4L)中羧基上的氧原子与发光稀土金属离子Tb3+具有很强的亲和能力,二者形成的[Tb(HL)(H2O)3]·H2O(Tb-MOF)具有高发光稳定性、强荧光寿命,可以通过荧光猝灭机理检测CS2生物标记物TTCA,检出限低、抗干扰能力强[10-11]。
鉴于此,本工作通过水热法合成了荧光传感材料Tb-MOF,并成功应用于模拟尿液中TTCA 的识别。
1 试验部分
1.1 仪器与试剂
Thermo Scientific Nicolet-is 50型傅里叶红外光谱仪;F98型荧光分光光度计;FTS 3000型X 射线粉末衍射(PXRD)仪;Perkin-Elmer TG-7型热重分析仪;DHG-9036A 型电热恒温干燥箱;N-117M型体视显微镜;UV-2600型紫外-可见分光光度计;OLYMPUS IX71型倒置荧光显微镜。
模拟尿液:根据正常人体尿液中化学成分的组成配制模拟尿液,其中氯化钾、氯化钠、氯化铵、硫酸钠、肌酸、肌酐、葡萄糖、尿素、尿酸的浓度均为0.01 mol·L-1,用磷酸盐缓冲溶液调节其酸度至pH 7.40左右。
H4L、六水合硝酸铽以及氯化钾、氯化钠、氯化铵、硫酸钠、肌酸、肌酐、葡萄糖、尿素、TTCA、尿酸等为分析纯,均为市售试剂,使用前不需要进一步纯化;试验用水为一次纯化水。
1.2 仪器工作条件
1.2.1 荧光分光光度计
激发波 长(λex)335 nm,发射波 长(λem)546 nm;扫描速率1 000 nm·min-1;激发狭缝宽度10 nm;扫描范围450~650 nm。
1.2.2 表征仪器
热重分析仪:升温速率20 ℃·min-1;工作气和保护气均为氮气;温度范围25~800 ℃。PXRD仪:铜钯;管电压40 k V;管电流40 m A;扫描速率12.5°·min-1;扫描范围5°~90°。红外光谱仪:溴化钾压片;扫描范围400~4 000 cm-1;分辨率4.0。荧光显微镜:目镜×10;物镜×10;工作距离4 mm;数值孔径(NA)0.25。
1.3 试验方法
1.3.1 Tb-MOF的制备
总而言之,新课改下的初中英语课堂应该是学生主动学习、主动探究的课堂,教是为了做到不教,教师要从课前预习过程中正确引导做起,在课前预习、课堂引导以及教学评价过程中教会学生学习,锻炼初中生的能力,鼓励他们积极进取,让学生在有限的英语学习时间内获得最佳学习效果,获得更多收获。
参考文献[17]制备Tb-MOF。将90.6 mg六水合硝酸铽,69.3 mg H4L和8 mL水混合均匀,密封后置于25 mL 内衬为聚四氟乙烯的耐高压不锈钢反应釜中,于120℃加热72 h。冷却至室温,所得产物用水洗涤,室温下自然风干。计算产物产率,结果为37%。
1.3.2 TTCA 的检测
取24 mg制备好的Tb-MOF分散到24 mL水中,形成1 g·L-1的Tb-MOF分散悬浮液,超声约10 min,放置12 h后再超声3 min,按照1.2.1节仪器工作条件测试。在200μL 模拟尿液中加入适量TTCA,和上述处理好的Tb-MOF 分散悬浮液2 mL混合,超声约10 min,放置12 h 后再超声3 min,按照1.2.1节仪器工作条件测量体系的荧光强度I。同时测量不加TTCA 时空白样品溶液的荧光强度I0。
2 结果与讨论
2.1 表征结果
H4L、Tb-MOF 以 及Tb-MOF 与TTCA 作用后干燥所得的Tb-MOF+TTCA 固体的红外光谱图、热重曲线、PXRD 图如图1所示。
由图1(a)可知:Tb-MOF的红外光谱特征峰主要出现 在3 641 cm-1(w)、3 340 cm-1(m)、1 663 cm-1(s)、1 580 cm-1(s)、1 472 cm-1(w)、1 394 cm-1(s)、1 294 cm-1(m)、1 220 cm-1(m)、996 cm-1(m)、861 cm-1(m)、766 cm-1(m)、687 cm-1(s)、636 cm-1(m)、530 cm-1(w)处(其中s,m,w 分别代表红外光谱吸收强度为强、中等、弱),与文献报道的结果一致[17],表明该反应合成了Tb-MOF;H4L红外光谱图中1 568~1 720 cm-1处和Tb-MOF红外光谱图中1 663 cm-1处存在特征吸收峰,归因于H4L 未配位羧基的不对称伸缩振动;Tb-MOF红外光谱图中1 394~1 580 cm-1处存在强特征吸收峰,归因于为羧基中氧原子与Tb3+配位键的伸缩振动。由图1(b)可知:100~390 ℃的质量损失率为11.60%,和理论值12.54%基本一致,源于Tb-MOF失去3个配位水分子和1个客体水分子;Tb-MOF 在400 ℃以内保持稳定,继续升温Tb-MOF骨架才会坍塌和分解,说明Tb-MOF热稳定性良好。由图1(c)可知:Tb-MOF 在2θ为5°~20°处的衍射峰和模拟Tb-MOF 单晶的基本一致,衍射峰峰形尖锐,说明制备的Tb-MOF 晶体结构良好,但是由于制备的Tb-MOF 的产率只有37%,材料的纯度不高,未观察到2θ在26°~28°处的特征衍射峰;Tb-MOF+TTCA 的衍射峰和Tb-MOF的一致,说明Tb-MOF与TTCA 并不是通过Tb-MOF骨架坍塌来进行荧光传感识别的。

图1 红外光谱图、热重曲线和PXRD图Fig.1 Infrared spectrograms,thermogravimetric curve and PXRD patterns
2.2 荧光性能结果
2.2.1 Tb-MOF固态荧光
对Tb-MOF 的固态荧光性能进行测试,546 nm发射波长下Tb-MOF 的激发光谱、335 nm激发波长下TB-MOF的发射光谱以及Tb-MOF的荧光显微镜图如图2所示。
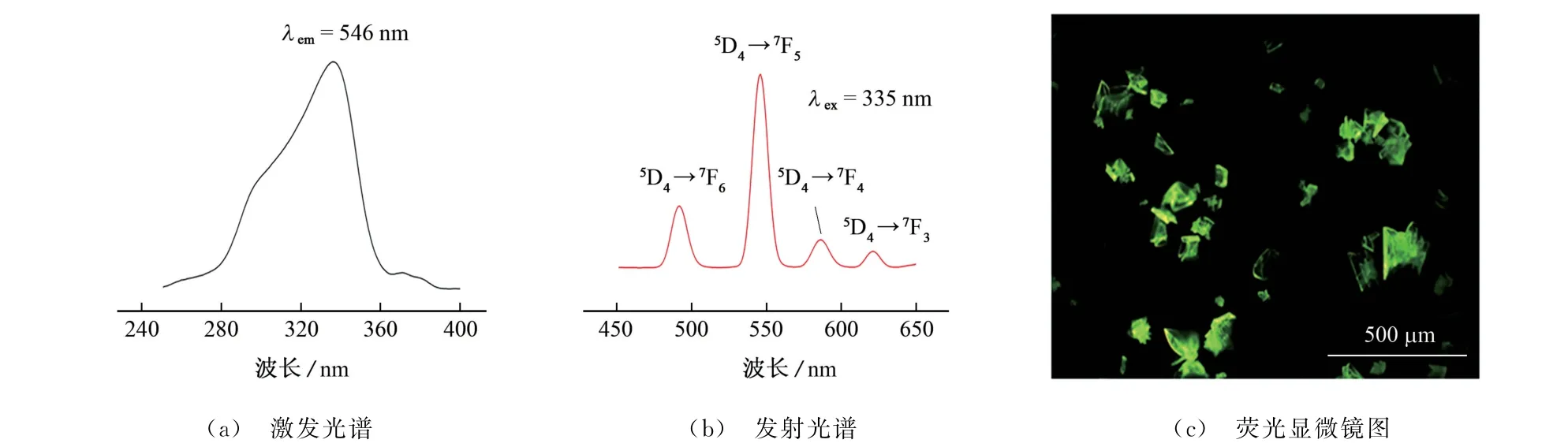
图2 Tb-MOF的荧光激发光谱、发射光谱和荧光显微镜图Fig.2 Fluorescence excitation spectrum,emission spectrum and fluorescence microscope image of Tb-MOF
由图2可知:Tb-MOF 的激发波长为335 nm,在该激 发波长 下,Tb-MOF 在491,546,586,621 nm 处有特 征发射 峰,分别对 应 Tb3+的5D4→7F6、5D4→7F5、5D4→7F4和5D4→7F3跃迁,其中546 nm 处对应的5D4→7F5跃迁荧光强度最大,发出特征强绿色荧光,这与文献[17]的报道结果一致;Tb-MOF粒子呈块状,在荧光显微镜下发绿色荧光,粒径约220μm,颗粒较为细小。因此,试验选择在发射波长546 nm 处检测。
在2 mL 1 g·L-1的Tb-MOF分散悬浮液(空白)中加入等体积0.01 mol·L-1氯化铵、氯化钾、肌酸、肌酐、氯化钠、硫酸钠、葡萄糖、尿素、尿酸溶液,所得发射光谱如图3(a)所示。在上述各模拟尿液组分添加前后再分别加入适量TTCA,使其浓度达到3.125 mmol·L-1,加入前后体系的相对荧光强度(相对于空白)如图3(b)所示。
由图3可知:1 g·L-1的Tb-MOF分散悬浮液特征发射峰分别位于491,546,586,621 nm 处,和固态荧光发射光谱的基本一致,说明Tb-MOF的水稳定性较好;不添加TTCA 时,氯化铵、氯化钾、肌酸、肌酐、氯化钠、硫酸钠、葡萄糖、尿素、尿酸体系的相对荧光 强度分别为98.19%,96.97%,95.15%,94.88%,93.93%,93.43%,93.03%,89.27%,57.43%,其中尿酸对Tb-MOF 有一定的荧光猝灭效果,加入其他尿液组分时体系的荧光强度和空白的相差不大,荧光猝灭效果不明显,这和365 nm 紫外灯下肉眼观察到的荧光猝灭效果基本一致;添加了TTCA 后,前8种组分的相对荧光强度和空白的相对误差绝对值在5.0%以内,说明氯化铵、氯化钾、肌酸、肌酐、氯化钠、硫酸钠、葡萄糖、尿素对TTCA 的检测干扰不大,加了尿酸的体系的相对误差绝对值大于5.0%,说明尿酸对TTCA 的检测干扰较大,故在检测尿液中TTCA 时,需注意尿酸的干扰,并通过适合的方法消除。另外,尿液中可能含有蛋白质,其干扰试验还待进一步开展。
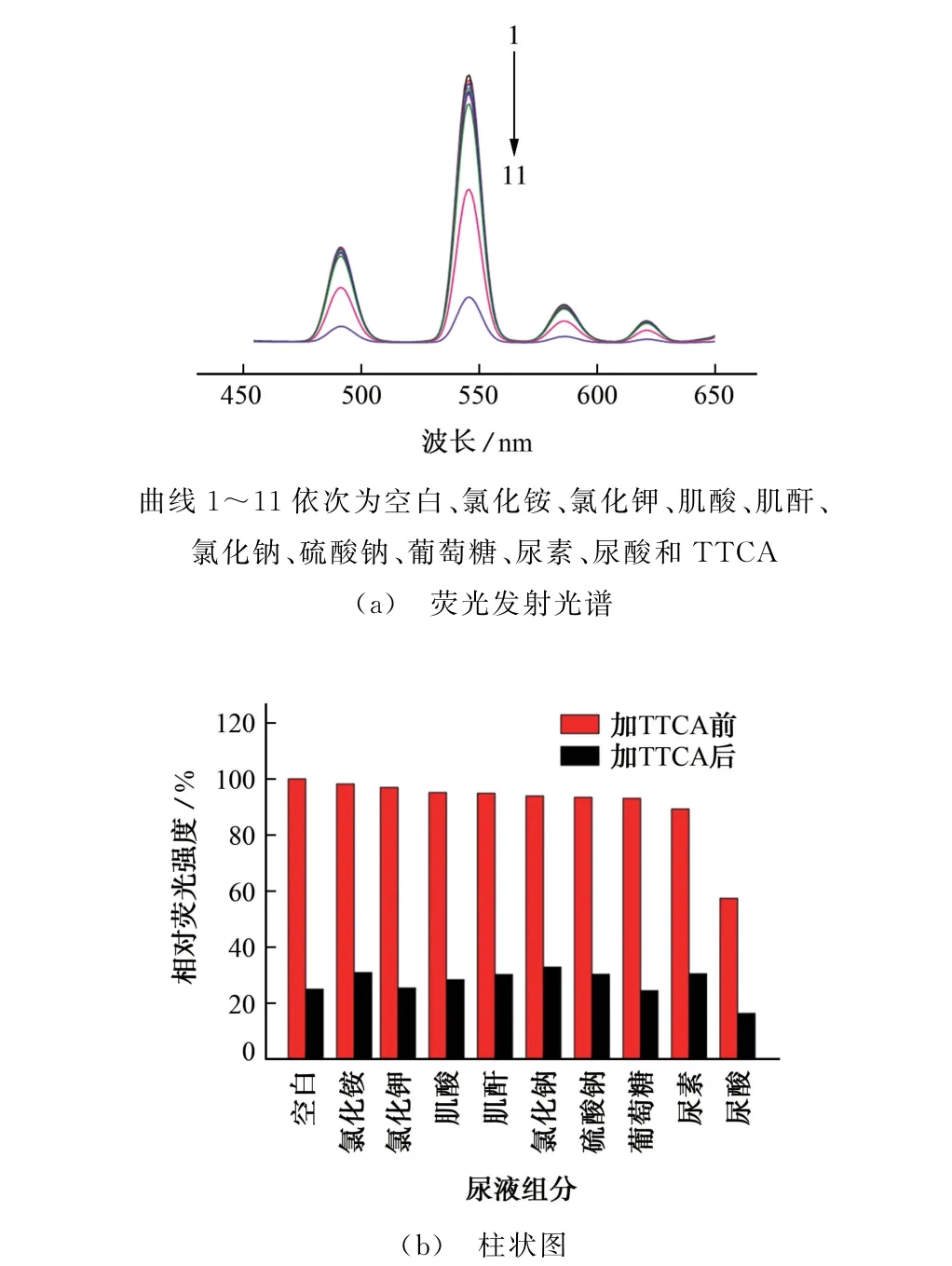
图3 各尿液组分中TTCA 加入前后Tb-MOF分散悬浮液的荧光发射光谱和相对荧光强度Fig.3 Fluorescence emission spectra and relative fluorescence intensity of Tb-MOF disperse suspension before and after adding various urine components and TTCA
2.3 线性关系和检出限
方法学考察是量化传感器材料性能的关键过程,通过在1 g·L-1的Tb-MOF分散悬浮液中逐步添加0.01 mol·L-1TTCA 标准溶液的方法确定线性参数,所得I0/I随TTCA 浓度变化的曲线如图4所示。
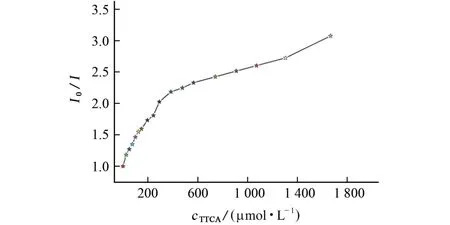
图4 I0/I 随TTCA 标准溶液浓度变化的曲线Fig.4 Curve showing changes of I0/I with the concentration of TTCA standard solution
结果显示,I0/I随着TTCA 浓度的增加而增加。在低浓度水平范围内(25~196μmol·L-1),以I0/I为纵坐标,TTCA 浓度为横坐标进行线性拟合,所得线性回归方程为y=4 687x+1,相关系数为0.986 9,符合斯顿-伏尔莫(Stern-Volmer)方程(I0/I=1+Ksv×[M],式中Ksv为猝灭速率常数,本方法 中[M]为TTCA 的浓度),即Ksv为4 687 L·mol-1。
按照仪器工作条件重复测定1 g·L-1Tb-MOF分散悬浮液的荧光强度11次,计算I0/I的标准偏差(s),以3s与低浓度水平的Ksv的比值计算检出限,所得结果为3.84×10-2μmol·L-1。
2.4 稳定性试验
制备5份1 g·L-1的Tb-MOF 分散悬浮液,测量其荧光强度,放置12 h后再次测量,荧光强度较初始值下降了9%,相对荧光强度的RSD 为3.7%,说明Tb-MOF分散悬浮液在12 h内稳定性良好。
2.5 荧光猝灭机理
Tb-MOF 的发光性能主要依赖于具有刚性骨架结构的多元羧酸配体H4L,为进一步了解TTCA对Tb-MOF 的荧光猝灭机理,研究了TTCA 和配体H4L 室温固态荧光特性,所得图谱如图5所示。
由图5可知,TTCA 在278,322 nm 处的吸收峰和配体H4L 激发带(280~335 nm)有重叠。根据文献[18-20]报道,如果荧光供体的激发光谱与分析物的吸收带有重叠,则配体与分析物间可能产生竞争性能量吸收。
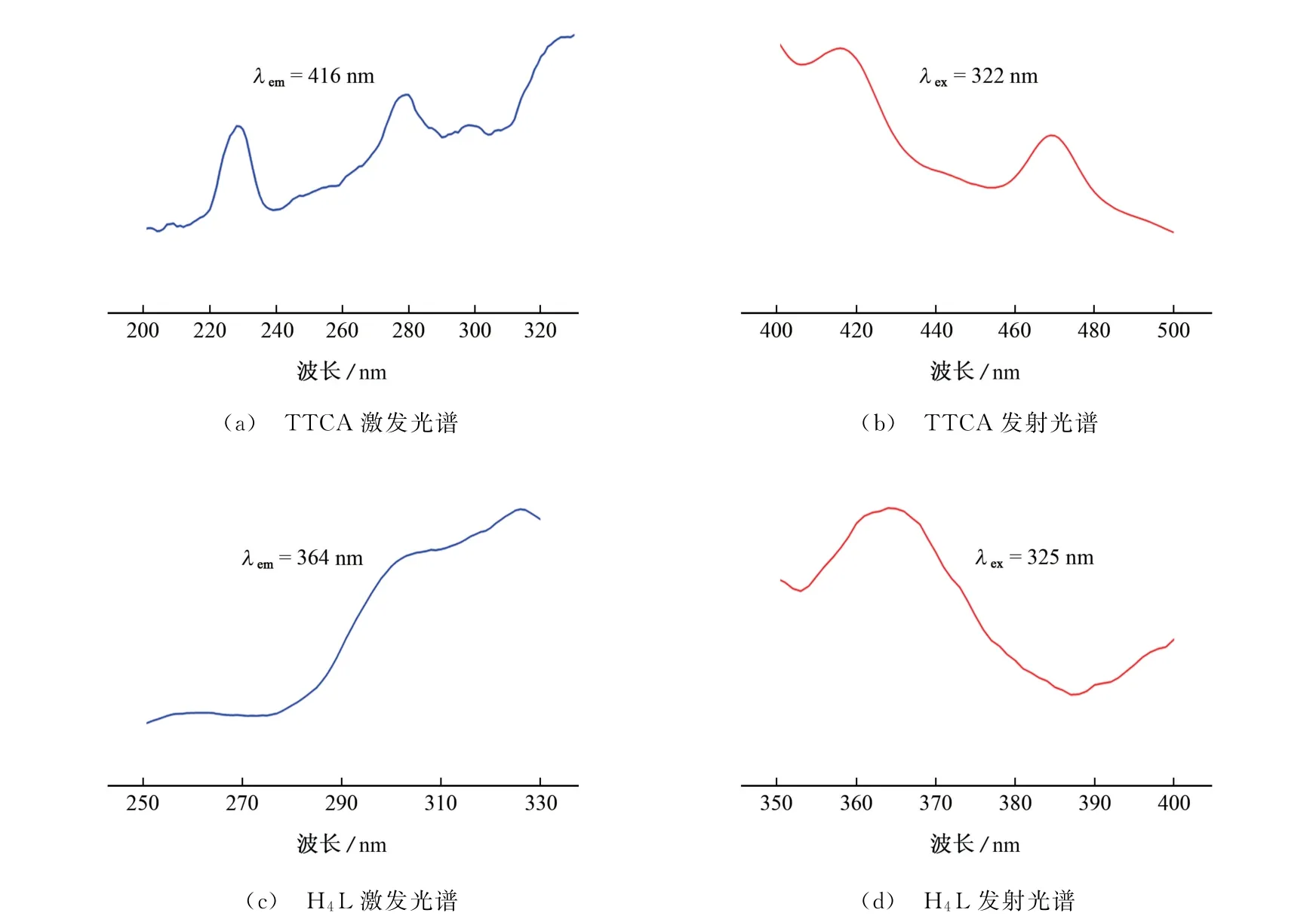
图5 TTCA 与H4 L室温固态荧光光谱Fig.5 Room temperature solid state fluorescence spectra of TTCA and H4 L
为进一步验证这一猜想,比较了TTCA 的紫外吸收光谱和Tb-MOF 的激发光谱,结果如图6所示。
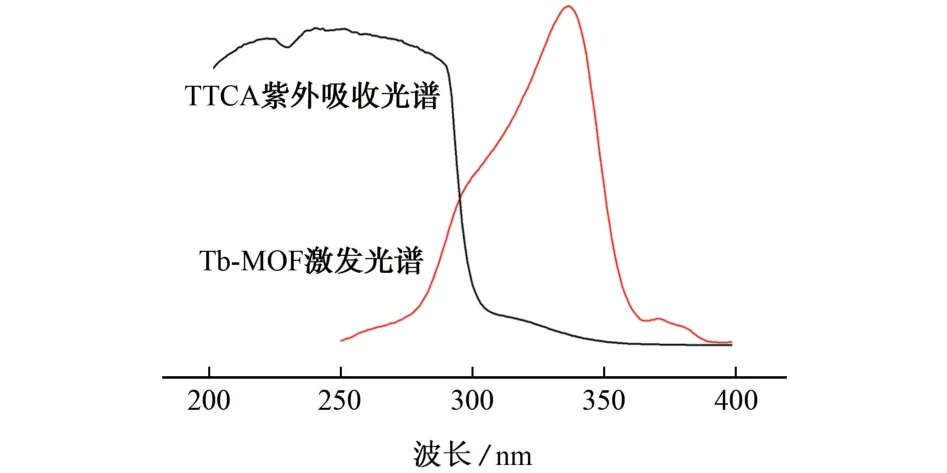
图6 Tb-MOF分散悬浮液的激发光谱(λem=546 nm)和TTCA 标准溶液的紫外吸收光谱Fig.6 Excitation spectrum of Tb-MOF dispersed suspension(λem=546 nm)and ultraviolet absorption spectrum of TTCA standard solution
结果表明,TTCA 标准溶液的紫外吸收峰和Tb-MOF 分散悬浮液的激发光谱有部分重叠(250~365 nm),使得从配体转移到Tb3+的能量减少,进而导致荧光猝灭,说明荧光猝灭可能来源于配体和分析物的竞争吸收[20-21]。
本工作采用水热法制备Tb-MOF,通过傅里叶红外光谱仪、PXRD 仪以及热重分析仪确定其组成和结构,并成功用于模拟尿液中TTCA 的检测。本方法具有较好的抗干扰性、选择性和检出限,在实际应用中具有重要意义。
