探究性化学实验中控制变量的考查
2023-03-18张应飞
张应飞
(江苏省无锡外国语学校)
新课程指出,学生应该学习质疑、预测、设计、反思、验证以及科学概括、推理、类比、归纳和演绎等科学方法.通过以学生为主体的各种学习活动,可以提高学生的基础学习能力,形成健全的人格,促进学生全面发展.对探究性实验的考查,正符合这一理念,能够开发学生的思维,提高学生的学习兴趣.中学化学实验要研究多个因素之间的关系时,往往先控制其他因素不变,研究某一个因素的变化所产生的影响,这种方法叫控制变量法.控制变量法是化学中常用的探究问题和分析问题的科学方法之一,通过控制变量可以对影响实验结果的多个因素逐一进行探究,然后再总结出结论,这种方法在高考化学试题中经常出现.
1 探究酸性强弱
酸性强弱的比较是高考化学试题中经常考的知识点,可以通过强酸制弱酸实验或测定对应盐溶液的pH 大小来确定酸的相对强弱.
例1下列现象和实验结论正确的是( ).

分析向NaAlO2溶液中通入足量的CO2,反应生成氢氧化铝沉淀,说明H2CO3酸性大于Al(OH)3的酸性,选项A 错误.NaClO 溶液和NaF溶液均水解显碱性,等浓度时,溶液的pH 越大,对应酸的酸性越弱,则NaClO 溶液的pH 大于NaF 溶液的pH,可知Ka(HF)>Ka(HClO),选项B正确.选项C没有说明NaHCO3与CH3COONa的浓度是否相同,不能判断两者的酸性强弱,错误.NaClO 溶液中存在水解生成的HClO,具有漂白性,能使pH 试纸褪色,故无法用pH 试纸测定其pH,选项D 错误.答案为B.
2 探究难溶物质的溶度积大小
难溶物质的溶度积大小可以通过比较溶度积常数大小或比较沉淀的转化或相同条件下产生沉淀的量的多少来决断.
例2下列实验目的对应的方案设计、现象和结论都正确的是( ).

分析向饱和Na2CO3溶液中加入BaSO4固体,由于Qc(BaCO3)>Ksp(BaCO3),生成BaCO3沉淀,不能说明BaCO3溶解度大于BaSO4,选项A 错误.NaCl、NaI 的混合溶液的浓度未知,不能比较Ksp(AgCl)与Ksp(AgI)的大小,选项B 错误.向等体积的饱和AgCl和AgI溶液中分别滴加等量的浓AgNO3溶液,得到沉淀n(AgCl)>n(AgI),说明饱和氯化银溶液中氯离子浓度更大,故Ksp(AgCl)>Ksp(AgI),选项C正确.由操作和现象可知,Ag2CrO4转化为更难溶的 Ag2S,则Ksp(Ag2CrO4)>Ksp(Ag2S),选项D 正确.答案为C、D.
点评选项B中如果控制NaCl、NaI的混合溶液中两物质的物质的量浓度相同,滴入少量稀AgNO3溶液,有黄色沉淀生成,就可以判断Ksp(AgCl)>Ksp(AgI).
3 探究影响化学反应速率的因素
影响化学反应速率的外界因素有:浓度、压强、温度、催化剂、反应物的颗粒大小等.因此在研究某一因素对化学反应速率的影响时可注意控制其他变量相同,只改变一个因素.
例3乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验.
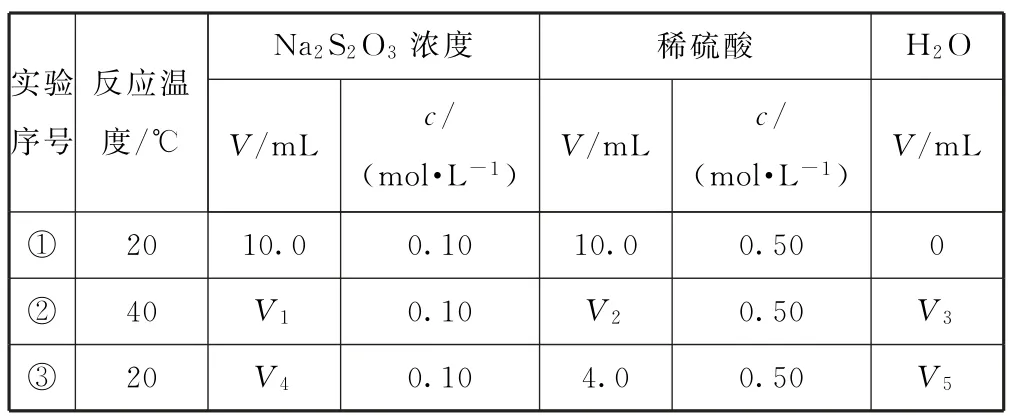
表1
该实验①、②可探究_________对反应速率的影响.实验①、③可探究硫酸浓度对反应速率的影响,因此V5=_________.
分析实验①温度20 ℃,实验②温度40 ℃,实验①和实验②探究反应温度对化学反应速率的影响,因此要控制其余实验的条件相同,V1=10.0 mL;从表中可见实验①和③温度相同,硫酸所取的体积不同,可探究硫酸浓度对反应速率的影响,其余实验条件相同,V4=10.0mL,液体体积相同,因此
点评比较不同因素对化学反应速率的影响时要注意实验①是标准,其他实验都要与实验①作比较,找出相同的条件,只能有一个条件改变,从而确定Na2S2O3、稀硫酸、水的体积.实验②中V1=V2=10.0mL,V3=0 mL;实验③中V4=10.0 mL,V5=10.0mL-4.0mL=6.0mL.
4 探究物质的化学性质
探究物质的化学性质是研究化学最主要的目的,在研究物质的化学性质时,要从多方面、多角度进行对比,排除干扰因素,得出正确结论.
例4某兴趣小组探究SO2使品红溶液褪色的原因,实验结论错误的是( ).
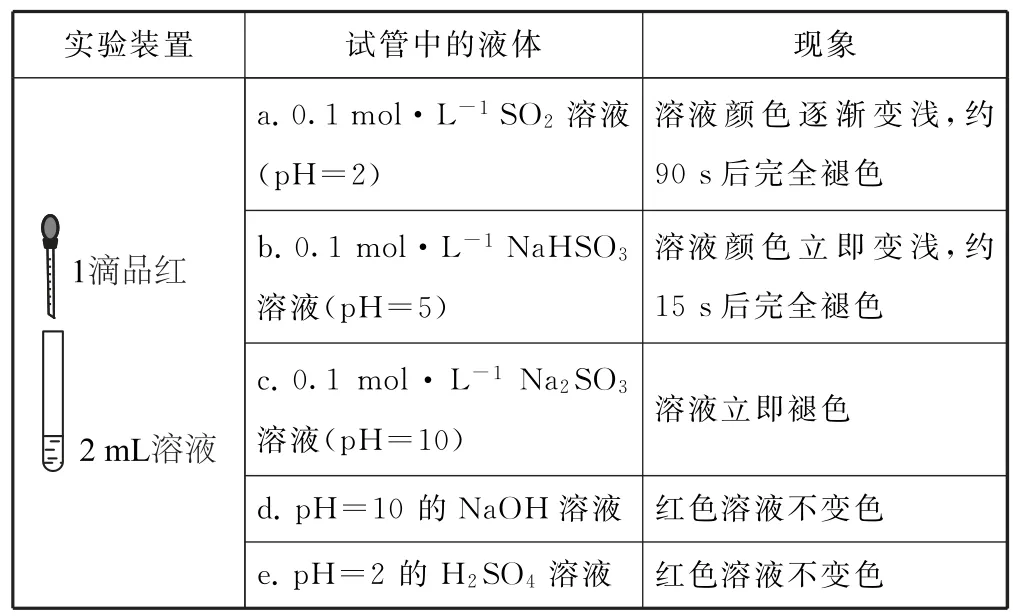
表2
A.在探究实验中控制变量思想可以把复杂问题简化为单一问题
B.b中HSO3-电离程度大于其水解程度,使溶液显酸性
C.实验a、b、c说明SO2使品红溶液褪色时,起主要作用的微粒是HSO3-
D.实验c、d证明OH-对品红溶液褪色不产生干扰
分析在探究实验中控制变量思想可以通过对某一变量的研究,把复杂问题简化为单一问题,选项A 正确.b中HSO3-电离程度大于其水解程度,溶液中H+浓度大于OH-浓度,使溶液显酸性,选项B 正确.实验a、b、c碱性增强,溶液中SO23-浓度变大,说明SO2使品红溶液褪色时起主要作用的微粒是SO23-,选项C 错误.实验c、d中OH-浓度相等,实验现象证明OH-对品红溶液褪色不产生干扰,选项D正确.答案为C.
点评探究SO2使品红溶液褪色的原理,要考虑等因素以及酸碱性的影响,因为SO2与水部分反应生成了H2SO3,H2SO3电离生成了HSO3-和H+,HSO3-继续电离生成了和H+,因此要用浓度相同的SO2溶液、NaHSO3溶液、Na2SO3溶液,这3种溶液的酸碱性不同,还要用pH 对应相等的NaOH 溶液、H2SO4溶液作比较,从而确定品红溶液褪色的真正原因.
总之,探究性化学实验要注意控制变量,如果只有一组实验,则要和标准组实验比较找出变化的因素.
(完)
