过氧化氢诱导人自然杀伤细胞损伤的特点和主要机制①
2023-03-17齐婧姝平大冰胡旭东刘成海
齐婧姝 平大冰 孙 鑫 胡旭东 彭 渊 刘成海④⑤
(上海中医药大学附属曙光医院肝病研究所,上海 201203)
自然杀伤(natural killer, NK)细胞由造血干细胞发育分化而来,是淋巴细胞的一个亚群,同时也是一种细胞毒性淋巴细胞,可直接识别和杀伤病毒感染的和癌变的细胞,在机体天然免疫防御体系中占有重要地位。然而,在多种慢性疾病如过敏性紫癜、肝纤维化、自身免疫性溶血性贫血、肝癌中,NK细胞尽管处于不同的疾病微环境,但活性和功能均受到明显抑制,而这些疾病均具有氧化损伤这一共同的病理特征[1-4]。导致氧化损伤的一个主要因素是过氧化氢(hydrogen peroxide, H2O2),已有研究发现,H2O2及其产物可诱导NK 细胞损伤,然而作用机制尚不清楚[5]。本研究采用H2O2诱导人NK 细胞的氧化损伤模型,观察其诱导NK 细胞氧化损伤的特点并探讨其主要机制,为NK 细胞氧化损伤及其体外实验研究建立细胞模型基础。
1 材料与方法
1.1 材料
1.1.1 细胞与试剂 人NK92MI 细胞株,货号:ATCC®CRL-2408TM,购自美国ATCC 公司;人慢性髓系白血病细胞K562(3131C0001000700029)购自中国科学院上海生命科学研究院细胞资源中心;30%H2O2(10011218)购自国药集团化学试剂有限公司;TANK 细胞无血清培养基(CT001-1)购自宜明昂科生物医药技术(上海)有限公司;Cytotoxicity LDH Assay Kit-WST(CK12)、AnnexinⅤ/PI 细胞凋亡检测试剂盒(AD10)均购自东仁化学科技(上海)有限公司;UNIQ-10 柱 式Trizol 总RNA 抽 提 试 剂 盒(B511321)购自上海生工生物工程股份有限公司;逆转录试剂盒 PrimescriptTMRT reagent Kit with gDNA Eraser(RR047A)、TB GreenTMPremix EX TaqTM扩增试剂盒(RR420A)均购自日本TaKaRa 公司;CellTiter-Glo®Luminescent Cell Viability Assay(G7573)购自Promega;PMSF(32610823)、Complete Mini EDTAfree Protease Inhibitor Cocktail Tablets(05892791001)、PhosSTOP Phosphatase Inhibitor Cocktail Tablets(04906837001)均购自Roche公司;RIPA Lysis Buffer Ⅱ(C510006)购自生工生物工程(上海)股份有限公司;PierceTMBCA Protein Assay Kit(WA322434)购自Thermo Scientific;Omni-EasyTM速溶型蛋白上样缓冲液(LT101)购自上海雅酶生物医药科技有限公司;彩虹180广谱蛋白Marker(PR1910)购自北京索莱宝科技有限公司;40%Acr-Bis(A7168)、SDS(L3771)、TEMED(T9281)、过硫酸铵(A3678)均购自Sigma 公司;Tris(77-86-1)购自Amresco;浓盐酸(10011018)购自国药集团化学试剂有限公司;SuperBlockTMT20(TBS) Blocking Buffer(37536)购自Thermo Scientific;anti-p-JNK1(ab215208)、anti-JNK1(ab199380)均 购自Abcam公司;GAPDH Monoclonal Antibody(60004-1-Ig)购自Proteintech 公司;Anti-rabbit IgG、HRP-linked Antibody(7074P2)、Anti-mouse IgG、HRP-linked Antibody(7076P2)均购自CST公司。
1.1.2 仪器 ChemiScope mini 系列化学发光成像系统购自上海勤翔科学仪器有限公司;DxFLEX 流式细胞仪购自Beckman Coulter 公司;MyCyclerTMThermal Cycler 逆转录仪购自美国Bio-Rad 公司; TECAN F200 PRO 多功能酶标仪购自TECAN 公司;ABI Vii A7型荧光定量PCR 仪购自Thermo Scientific公司;Olympus-IX70 显微图像分析仪购自日本奥林巴斯公司;Bio-Tek Power Wave XS 微孔板分光光度计购自美国Bio-Tek公司。
1.2 方法
1.2.1 细胞培养 将细胞以适宜的密度接种于T75 培养瓶或CulturPlateTM-96 板,NK92MI 细胞培养于TANK 细胞无血清培养基,K562 细胞培养于含10%FBS 的IMDM 培养基。所有细胞置于37 ℃、5%CO2、95%湿度的培养箱中培养。
1.2.2 药物配制 将30%H2O2溶解于灭菌后的细胞用水,配制成1 mol/L 的储存液;以TANK 细胞无血清培养基稀释,分别配制1、5、25 mmol/L 的H2O2工作液。
1.2.3 H2O2诱导NK 细胞损伤模型 取对数生长期的NK92MI 细胞,以1×104个/孔和2.5×105个/孔的密度分别接种于96 孔板和24 孔板,分别给予0、1、5、25 mmol/L 的H2O2工作液连续刺激1 h 或5 h 诱导损伤模型。
1.2.4 细胞存活率检测 将NK92MI 细胞接种于96 孔板,1×104个/孔,给予1、5、25 mmol/L 的H2O2工作液连续刺激5 h,每个浓度设5 个复孔。设正常对照组,置于TANK 细胞无血清培养基培养。连续刺激5 h后,试剂盒检测细胞LDH 释放率,LDH 释放率(%)=(样品的吸光度-低对照的吸光度)/(高对照的吸光度-低对照的吸光度)×100%(注:样品吸光度=样品孔吸光度-样品Blank 孔吸光度;高对照的吸光度=高对照孔吸光度-高对照Blank 孔吸光度;低对照的吸光度=低对照孔吸光度-背景Blank孔吸光度);NK细胞存活率(%)=(1-LDH释放率)×100%。
1.2.5 Annexin V/PI 细胞凋亡检测 将NK92MI 细胞接种于24孔板,2.5×105个/孔,给予1、5、25 mmol/L的H2O2工作液连续刺激1 h 或5 h,每个浓度设5 个复孔。设正常对照组,置于TANK 细胞无血清培养基培养。连续刺激1 h 或5 h 后收集细胞,按Annexin V/PI 凋亡检测试剂盒说明书操作,流式细胞仪检测细胞凋亡,FlowJo 10.7.2 软件分析早期凋亡(Annexin V+PI-)、晚期凋亡(Annexin V+PI+)细胞占比,计算细胞凋亡率(%),细胞凋亡率(%)=早期凋亡率(%)+晚期凋亡率(%)。
1.2.6 NK 细胞杀伤实验 将NK92MI 细胞接种于T25 培养瓶,1×106个/瓶,给予1、5 mmol/L 的H2O2工作液连续刺激1 h 预处理,每个浓度1 瓶。预处理1 h后收集NK92MI细胞,与处于对数生长期的K562细胞共培养于CulturPlateTM-96 板,将效(effector∶ NK92MI 细胞)/靶(target∶K562 细胞)比分别设为1∶1、2∶1、4∶1,共培养4 h 后按CellTiter-Glo®Luminescent Cell Viability Assay 试剂盒说明书操作,检测NK92MI 细胞对K562 细胞的杀伤能力,并计算靶细胞杀伤率,靶细胞杀伤率(%)=1-[Mean 共培养- Mean(NK)]/[Mean(K562)]×100%[6]。 Mean(共 培养):NK92MI 细胞和K562 细胞共培养的平均荧光强度;Mean(NK):NK92MI 细胞的平均荧光强度;Mean(K562):K562细胞的平均荧光强度。
1.2.7 RT-PCR 检测 将NK92MI 细胞接种于T25培养瓶,2×106个/瓶,给予1、5、25 mmol/L 的H2O2工作液连续刺激5 h,每个浓度设5 个复孔。设正常对照组,置于TANK 细胞无血清培养基培养。连续刺激5 h后收集细胞,提取细胞总RNA,检测RNA纯度及浓度,逆转录合成cDNA,扩增定量检测mRNA 表达。引物序列见表1。
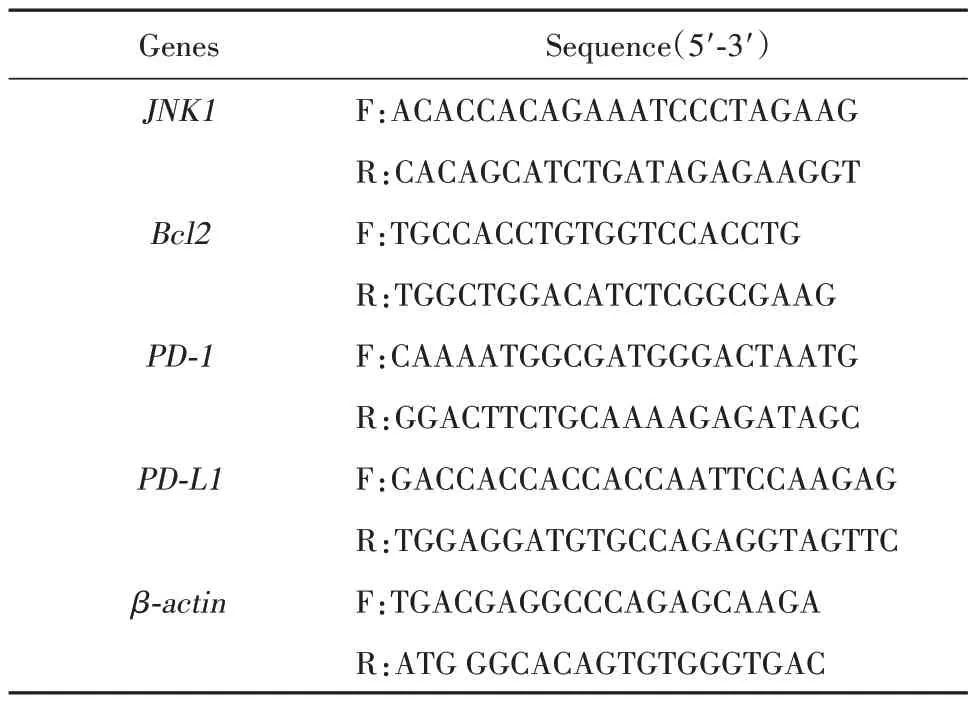
表1 引物列表Tab.1 List of primers
1.2.8 蛋白印迹检测 将NK92MI细胞接种于T25培养瓶,2×106个/瓶,给予5、25 mmol/L 的H2O2工作液连续刺激5 h,每个浓度设5 个复孔。设正常对照组,置于TANK 细胞无血清培养基培养。连续刺激5 h 后收集细胞,提取细胞总蛋白;BCA 试剂盒检测蛋白浓度;制备分离胶和堆积胶,进行电泳、转膜、封闭、一抗孵育、二抗孵育、ECL 显影。各条带吸光度值使用ChemiScope mini 系列化学发光成像系统测量,分别计算蛋白表达强度。
1.3 统计学处理 采用SPSS21.0软件统计系统进行统计学处理,GraphPad Prism 9.0软件作图。计量资料以±s表示,组间比较采用单因素方差分析,LSD进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 H2O2对NK92MI 细胞生长状态的影响 0 mmol/L 组NK92MI 细胞呈聚团悬浮生长;经不同浓度H2O2作用后,NK92MI细胞自1 h开始,细胞聚团减少,细胞体积缩小,形态呈现萎缩变形,且该现象随H2O2浓度增加而愈加显著。培养5 h后,1 mmol/L组较0 mmol/L 组细胞聚团显著减少,5 mmol/L和 25 mmol/L组无细胞聚团,细胞皱缩明显。见图1。
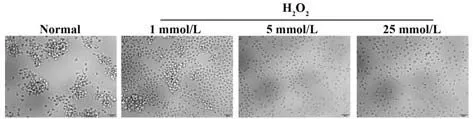
图1 H2O2 作用5 h 后对NK92MI 细胞生长状态的影响(×200)Fig.1 Effect of 5 h-exposure with H2O2 on growth status of NK92MI cell (×200)
2.2 H2O2对NK92MI 细胞存活率的影响 与 0 mmol/L 组相比,H2O2作用5 h 后NK92MI 细胞培养上清中LDH 含量随H2O2浓度增加而显著增多,IC50为5 mmol/L,以25 mmol/L 组最为显著(P<0.01);细胞存活率随H2O2浓度增加而显著降低,且呈剂量依赖性。见图2。
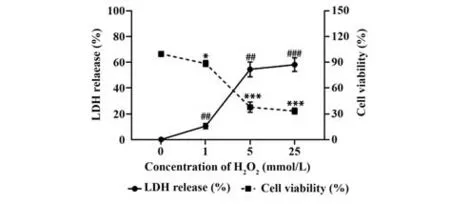
图2 H2O2作用5 h后对NK92MI细胞存活率的影响Fig.2 Effect of 5 h-exposure with H2O2 on viability of NK92MI cells
2.3 H2O2对NK92MI 细胞上清GSH、SOD 含量的影响 H2O2作用NK92MI 细胞5 h 后,细胞中GSH、SOD 含量随H2O2作用浓度的增加而减少(P<0.05),见图3。
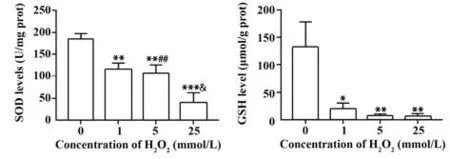
图3 H2O2 作用5 h 后对NK92MI 细胞培养上清中GSH、SOD含量的影响Fig.3 Effect of 5 h-exposure with H2O2 on levels of GSH and SOD in supernatant of NK92MI cells
2.4 H2O2对NK92MI细胞凋亡的影响 与0 mmol/L组相比,H2O2作用1 h 后,NK92MI 细胞细胞凋亡率随H2O2作用浓度增大而增加,其中1 mmol/L 组和 25 mmol/L 组差异有统计学意义(P<0.05);晚期凋亡(Annexin V+PI+)细胞比例与上述趋势相同。与 0 mmol/L组相比,H2O2作用5 h后,NK92MI细胞细胞凋亡率随H2O2作用浓度增大而显著升高(P<0.01),其中晚期凋亡(Annexin V+PI+)细胞比例明显高于死亡(Annexin V-PI+)细胞比例,晚期凋亡率随H2O2工作浓度增加而增加(P<0.05),呈剂量依赖性。见 表2、表3,图4。
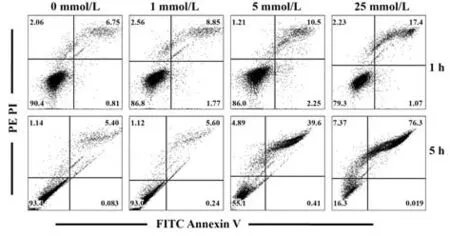
图4 H2O2对NK92MI细胞Annexin V/PI表达的影响Fig.4 Effects of H2O2 on expression of Annexin V/PI on NK92MI cells
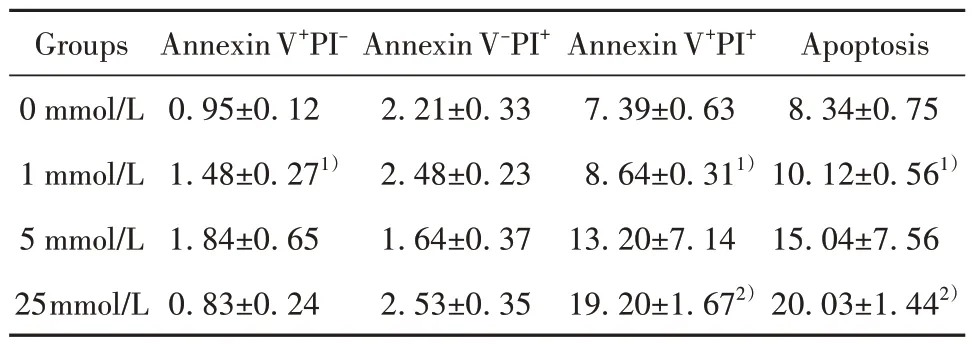
表2 H2O2诱导1 h的NK92MI细胞凋亡率(xˉ±s,n=5,%)Tab.2 Apoptosis rate of NK92MI cells after induction with H2O2 for 1 h (xˉ±s,n=5,%)
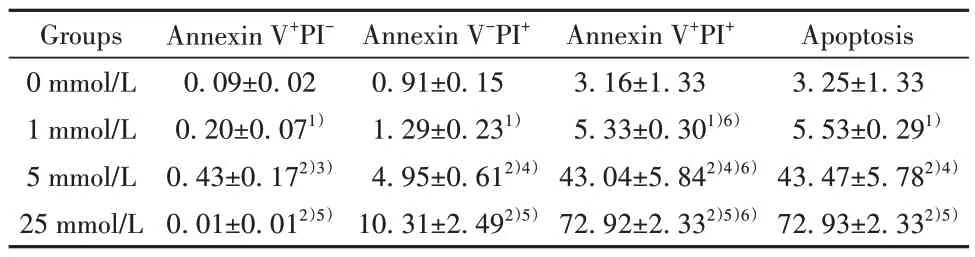
表3 H2O2诱导5 h后NK92MI细胞凋亡率(xˉ±s,n=5,%)Tab.3 Apoptosis rate of NK92MI cells after induction with H2O2 for 5 h (xˉ±s,n=5,%)
2.5 H2O2对NK92MI 细胞杀伤能力的影响 经H2O2预孵育后的NK 细胞与K562 细胞共培养,随着H2O2浓度的增加,K562 细胞活性显著降低(P<0.05),NK 细胞对K562 的杀伤能力显著降低(P<0.05),其中,经5 mmol/L H2O2刺激后,NK92MI 对K562的杀伤能力降至零。见图5。
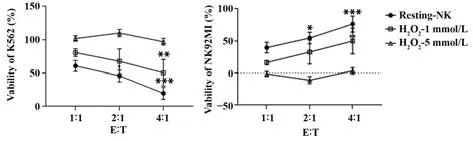
图5 H2O2对NK92MI细胞杀伤能力的影响Fig.5 Effect of H2O2 on killing capacity of NK92MI cells
2.6 H2O2对NK92MI 细胞凋亡相关基因表达的影响 经H2O2刺激5 h 后,与0 mmol/L 组NK 细胞相比,5 mmol/L 组和25 mmol/L 组促凋亡的PD-1基因表达显著升高(P<0.05),25 mmol/L组促凋亡JNK1、PD-L1基因表达水平显著升高(P<0.05);抗凋亡的Bcl-2基因水平低于0 mmol/L 组(P<0.05)。其中,JNK1、PD-1和PD-L1水平随H2O2作用浓度增大而升高,呈剂量依赖趋势。见图6。
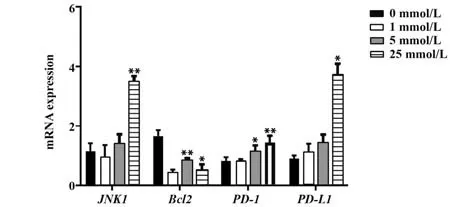
图6 H2O2对NK92MI细胞凋亡相关基因表达的影响Fig.6 Effect of H2O2 on expressions of apoptosis-related genes in NK92MI cells
2.7 H2O2对NK92MI 细胞凋亡相关蛋白的影响 经H2O2刺激5 h 后,与0 mmol/L 组NK 细胞相比,JNK1 蛋白表达随H2O2作用浓度增大无明显变化(P>0.05),p-JNK1蛋白表达随H2O2作用浓度增大而增加(P<0.01),呈剂量依赖性。见图7。
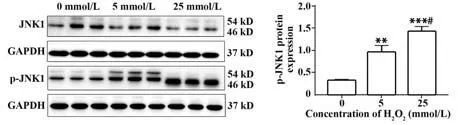
图7 H2O2对NK92MI细胞JNK1/p-JNK1蛋白表达的影响Fig.7 Effect of H2O2 on protein expression of JNK1/ p-JNK1 in NK92MI cells
3 讨论
H2O2是活性氧簇(reactive oxygen species,ROS)的主要成员之一,正常条件下细胞产生的H2O2,有90%以上来自于线粒体内氧化呼吸链的“电子漏”,是氧正常代谢的天然副产物,可由抗氧化系统如SOD、GSH 等清除,形成氧化和抗氧化平衡[7-8]。但当H2O2的产生超过机体抗氧化能力,H2O2会对机体细胞产生氧化应激损伤,其可破坏蛋白质与脂质,尤其是破坏基因组与线粒体中的DNA。有研究表明,H2O2可诱导多种细胞因氧化而损伤甚至凋亡,已被广泛用于诱导细胞氧化应激损伤模型[9]。
氧化应激损伤贯穿多种慢性疾病发生和发展的病理过程,固有免疫细胞作为人体天然免疫防御的主力军,不可避免地会受到氧化损伤因子(如H2O2)的影响,研究表明:体外低剂量H2O2诱导可提高小鼠腹腔巨噬细胞的趋化和吞噬能力[10],但若超过一定剂量,则会导致巨噬细胞存活率及细胞抗氧化酶如GSH、SOD 水平降低,常用于体外巨噬细胞氧化损伤模型的建立,H2O2还可诱导巨噬细胞释放TGF-β、IL-1、IL-6 和MCP-1、MIP-2 等炎症因子和趋化因子[11-13];对于中性粒细胞,H2O2孵育可延迟其吞噬能力,抑制其杀菌活性及颗粒酶释放[14];此外,H2O2可降低单核细胞线粒体的储备能力[15];关于H2O2对树突状细胞(dendritic cells,DC)的作用则主要聚焦在DC 的表型和功能上,研究表明H2O2可诱导与T细胞相互作用的一些DC表面标志物的上调,包括MHC Ⅱ类分子(DQ 和DR)和共刺激分子CD40与CD86,且H2O2处理的DC比正常DC更能促进T细胞增殖[16]。相较于其他固有免疫细胞,H2O2对NK细胞的作用及相关机制研究较少,故采用NK 细胞株建立体外氧化应激损伤模型及探寻相应机制具有一定的研究价值。
传统NK 细胞相关体外实验中NK 细胞多来源于人外周血,常因个体差异导致细胞状态差异大,弊端明显[17]。NK 细胞系的建立则很好地解决了这一问题,目前国内外建立的NK 细胞系包括NK92、YT、NKL、HANK-1、NK-YS、KHYG-1、SNK-6、SNT-8、MOTN-1、IMC-1、PLT-2 细胞系等,其中,NK92 因其具有高强度,广谱的细胞毒效应,已成为临床前研究中最常使用且最受关注的NK 细胞系[18-20],NK92MI 细胞是NK92 细胞转染IL-2 cDNA 后的非IL-2 依赖型细胞株,较NK92 细胞细胞毒性作用更强[21-22]。本文旨在以H2O2诱导NK92MI 细胞株(人NK 细胞株),建立NK 细胞氧化损伤模型,并探究其作用机制。
本研究发现,正常的NK92MI 细胞聚集成团且悬浮生长,经H2O2刺激后,NK92MI 细胞聚团减少,细胞体积缩小,形态呈现萎缩变形,细胞培养上清中GSH、SOD 含量随H2O2浓度增大而明显减少,提示NK92MI细胞抗氧化能力逐渐下降。LDH 检测发现经H2O2刺激后,NK92MI细胞释放LDH 增多,细胞存活率降低,提示H2O2可能引起了NK92MI 细胞膜的损伤。经H2O2刺激后的NK92MI 细胞与K562 细胞共培养,随着H2O2作用浓度增大,其对K562 细胞的杀伤能力逐渐减弱。进一步采用流式细胞术分析细胞凋亡/死亡情况(Annexin V/PI 染色),发现经H2O2刺激1 h 和5 h 后NK92MI 细胞的凋亡率随H2O2作用浓度增大和作用时间的延长均显著升高,呈时间-剂量依赖性,且以晚期凋亡(Annexin V+PI+)细胞为主。由此,提示H2O2可通过诱导NK 细胞晚期凋亡而引起细胞凋亡和死亡。
c-Jun氨基末端激酶1(c-Jun N-terminal kinase 1,JNK1)是MAPKs 家族的重要成员之一,其可以在多种应激信号,包括肿瘤坏死因子和高渗状态下被激活并诱导细胞凋亡[23]。鉴于JNK1 的激活与细胞凋亡的诱导有关,本研究检测JNK1 和p-JNK1 蛋白表达,发现经H2O2刺激后,NK92MI细胞JNK1和p-JNK1蛋白表达水平随H2O2浓度增大而显著升高,呈明显的剂量依赖性;RT-PCR 结果验证H2O2可显著提高NK 细胞促凋亡基因JNK1表达,同时降低抗凋亡基因Bcl2的表达。进一步观察与促凋亡密切相关的程序性细胞死亡相关基因PD-1和PD-L1表达,发现经H2O2刺激后,NK92MI细胞PD-1和PD-L1基因表达水平也呈明显的剂量依赖性[15]。进一步佐证H2O2可诱导NK92MI 细胞晚期凋亡,最终使得细胞发生程序性死亡。
由此,认为H2O2诱导NK 细胞氧化损伤的模型特点主要以细胞晚期凋亡为主,其作用机制与激活JNK1信号通路引起细胞凋亡,进而发生细胞程序性死亡相关。体外采用H2O2诱导NK92MI细胞氧化损伤模型操作简单、重复性好,可较好模拟NK 细胞在体内的氧化损伤状态。应用H2O2建立NK 细胞氧化应激损伤模型并用于药物研究,对研究药物作用于NK细胞途径发挥治疗作用具有重要意义。
