一种新的镰刀菌Q7—31木聚糖酶Xyn9的分离纯化鉴定及酶学特性
2015-10-20赵联正谢占玲赵朋
赵联正 谢占玲 赵朋
摘要:为对植物病原菌镰刀菌(Fusarium sp.)Q7-31所产木聚糖酶进行鉴定及酶学特性分析,在发酵产酶培养基上对Q7—31进行发酵培养,获得能够高效降解植物细胞壁的粗酶液。然后,采用Sephacry S-100凝胶柱层析和DEAE弱阴离子交换柱层析对粗酶液进行分离纯化后得到木聚糖酶Xyn9,并对其开展蛋白质组学研究和酶学特性分析。结果表明:粗酶液中木聚糖酶比活为16.58U/mg,纤维素酶比活为0.428U/mg,细胞壁降解酶比活为0.0198U/mg,蛋白含量为2.17mg/mL。Xyn9的蛋白质组学研究结果显示,其分子量为21 ku、等电点为6.86,接近GHl0家族。纯化后Xyn9的酶学特性表明,最适反应温度为47℃,最适pH值为5.6,该酶在33℃以下和在pH值5~6的范围内较稳定;金属离子K+对该酶有激活作用,Na+、Ca2+、Mg2+、Zn2+抑制该酶活性,Cu2+、Hg+使该酶完全失活。综合Xyn9的分子量、蛋白质组学结果以及酶学特性,最终将其鉴定为一种新的介于GHl0家族与GHll家族之间的内切木聚糖酶。
关键词:镰刀菌;木聚糖酶;分离纯化;串联质谱鉴定;酶学特性
中图分类号:Q55;Q814.1 文献标志码:A 文章编号:1002-1302(2015)05-0042-04
植物细胞壁主要由纤维素、半纤维素和木质素等物质组成。半纤维素的主要成分是木聚糖,约占植物细胞干质量的30%-35%,是继纤维素之后含量第二丰富的可再生物质资源。其中,木聚糖酶(1,4-β-D—xylanase,EC 3.2.1.8)是一种重要的工业用酶,在造纸工业、能源、饲料及环境等领域中具有很好的应用前景,特别是在纸浆的生物漂白方面的应用。生物降解木质素,就是利用微生物产生的胞外酶使木质素逐步分解转化,从而实现其资源转化。所以,木质素酶作为废弃秸秆回收利用过程中的关键角色,已引起人们的高度重视。我国是农业生产大国,每年秸秆产量大约5.7亿t,占世界秸秆总产量的20%~30%。其中绝大部分因为难以利用,仅作为农家燃料或肥料。如果能够将这些秸秆通过转化成为低聚糖,就可以用作基本碳源,生产各种发酵产品,包括各种氨基酸、有机酸、单细胞蛋白、糖醇类、工业酶类、溶剂或燃剂等。因此,对木聚糖酶的研究具有十分可观的经济效益和社会效益。
根据疏水性聚类分析方法,将木聚糖酶分为GHl0和GHl 1等2个家族。GHl0家族木聚糖酶多为高分子量,通常大于30ku,等电点较低,不仅有催化结构域,还常有碳水化合物结合结构域;GHl1家族木聚糖酶多为单结构域蛋白,相对分子量一般小于30ku,等电点较高。而且2个家族的木聚糖酶在空间结构上的折叠类型不同,即GHl0家族木聚糖酶主要由重复出现的α-螺旋和β-折叠片构成,整体结构像碗状,上面略大下面较小;而GHll家族木聚糖酶具有的典型折叠结构是由β-折叠片为主所构成的单个结构域,这个结构域由2个β-折叠片层扭曲成将近90°角,构成1个深且狭长的沟缝状结构。
近10年来,基因重组、基因定位突变、细胞融合等技术在纤维素酶菌株的构建上取得了巨大的成果。对于木聚糖酶而言,酶活力偏低是研究开发中遇到的普遍问题,低酶含量造成发酵成本过高,限制了该酶制剂的工业化生产和应用。一般来说,真菌木聚糖酶比细菌的木聚糖酶产量大,例如木霉、曲霉等真菌所产木聚糖酶的酶活力较高,对木聚糖酶的研究也主要集中在这些方面。镰刀菌是一种世界性的土生丝状真菌,其中有一些可以产生多种酶,其能够降解细胞壁中的果胶与纤维素。由于镰刀菌属于病原菌,对镰刀菌的研究多集中在对致病性镰刀菌的检测鉴定、多样性与致病基因等方面,对利用其产酶的研究鲜有报道。本研究对镰刀菌(Fusarium sp.)Q7-31产细胞壁降解酶进行分离纯化,并对纯化后的木聚糖酶进行蛋白鉴定与酶学特性分析,鉴定出介于GHl0家族与GHll家族的内切木聚糖酶Xyn9,为后续研究细胞壁降解酶降解细胞壁的协同反应机制、反应条件及酶系的结构组成奠定基础。
1.材料与方法
1.1材料
1.1.1菌株镰刀菌Q7-31菌株,由青海大学生态环境工程学院微生物实验室于2007年从青海省大通县宝库乡所采土壤中自行分离纯化获得,并保存。
1.1.2培养基
固体活化培养基:PDA培养基粉末39g,1 000mL水,121 qC灭菌20min;液体种子培养基:葡萄糖2%,蛋白胨0.3%,Mendels营养盐,121℃高压灭菌20min;发酵产酶培养基:燕麦秸秆粉0.3%,蛋白胨0.3%,Mendels营养盐,121℃高压灭菌20min;Mendels营养盐:(NH4):SO4 1.4g/L、KH2PQ 2.0g/L、尿素0.3g/L、CaCl20.3g/L、MgSO4 0.3g/L、FeSO4 5.0 mg/L、MnSO4 1.6mg/L、ZnSO4 1.4mg/L、COCl2 2.0mg/L。
1.2方法
1.2.1菌种活化与发酵将保存在4℃下液体石蜡封存的斜面菌种Q7-31转接至固体活化培养基上,于25℃恒温培养箱中培养,传代2~3次,使菌种充分活化。液体种子制备:在1000mL三角瓶中装入200mL液体种子培养基,从固体活化培养基上接种直径为1.0cm的菌块至液体种子培养基中,于25℃恒温培养箱中静止培养2d后制成液体种子备用。液体发酵培养:在1000mL三角瓶中装入350mL发酵产酶培养基,将制备好的液体种子按10%接入发酵产酶培养基中,25℃ 120r/min条件下摇床培养。1.2.2酶活力的测定采用3',5'二硝基水杨酸(DNS)测定还原糖的方法,测定分别以1%木聚糖、0.5%羧甲基纤维素(cMC)及5mg/mL燕麦秸秆粉为底物时酶液中木聚糖酶、纤维素酶和植物细胞壁降解酶的活力。将1min产生1ug还原糖所需的酶液量定义为1个酶活力单位(u)。
1.2.3蛋白含量的测定
蛋白含量的测定采用Bradford法,以牛血清白蛋白(BsA)为标准绘制标准曲线。在2mL离心管中加入稀释3倍的酶液样品200uL,加入1mL考马斯亮蓝G-250染液,充分振荡混匀反应5min,60min内在595nm下测定吸光度。将测得的吸光度代入蛋白标准曲线方程,计算样品中的蛋白含量。
1.2.4酶的分离纯化用50%~80%饱和度的硫酸铵对蛋白含量较高的酶液进行分级沉淀,后将6mL沉淀后的样品上样到Sephacry s-100葡聚糖凝胶层析柱(26mm×700mm),层析柱预先用pH值为7.5的Tris-HCl缓冲液平衡,并以相同缓冲液进行洗脱,速度为1.3mL/min,用核酸蛋白检测仪在280nm波长下检测蛋白分布,对每个收集管进行标号;将初步分离的蛋白样品上样到DEAE弱阴离子交换柱(5×5mL),柱子预先用20mmol/L Tris—HCl缓冲液(pH值为7.5)平衡,以O~1mol/L的NaCl进行梯度洗脱,速度为0.5mL/min,每4min收集1管,用核酸蛋白检测仪在280nm波长下检测蛋白分布。
1.2.5SDS一聚丙烯酰胺凝胶电泳(SDS-PAGE)将制好的分离胶和浓缩胶灌入电泳槽后,把蛋白Loading Buffer与待测收集管中的样品混合,于100℃沸水浴中加热5min,取出后冷却至室温。每个点样孔上样10uL,并使用标准蛋白分子量作为参照。当溴酚蓝前沿到达距凝胶下沿约0.5cm时,停止电泳。使用小刀将凝胶轻轻撬离玻璃板,然后将凝胶剥离到装有染色液(考马斯亮蓝R-250染色液1%,甲醇40%,冰醋酸10%,混匀并过滤)的培养皿中,染色3~4 h。染色完毕后,倒出染色液,加入脱色液(甲醇10%,冰醋酸10%,混匀),脱色3~10h,定时更换脱色液,直至凝胶背景变得清晰可见。
1.2.6酶的质谱鉴定酶的质谱鉴定由华大基因(北京)完成。切下的目的蛋白凝皎位点,加入50mmol/L NH4HCO,振荡至无色;加入乙睛100uL约放置30min',通过1ug/mL胰蛋白酶酶解37℃水浴16h,加入100uL提取液(50%乙睛,5%TFA),40℃水浴1h,真空干燥除去乙睛,加入5uLO.1%三氟乙酸。取2ug的样品用Angilent 1100液相系统Finnigan线性离子阱(LTQ)质谱仪系统进行检测,质谱结果经MASCOT软件检索,结合NCBI数据库信息以及酶学特性确定酶的种类。
1.2.7酶的最适温度、pH值及稳定性测定最适温度的测定:将底物处于pH值6.8的缓冲液中,在4~90℃范围中进行酶促反应,确定酶的最适反应温度;在上述不同温度下温浴处理1h测定酶的稳定性。最适pH值的测定:将底物处于不同pH值的缓冲液中,pH值范围为3~8,在45℃条件下反应并测定酶活力,确定最适反应pH值。稳定性测定:将样品分别在pH值为3.0~11.0的条件下处理1h,测定酶的pH值稳定性。
1.2.8金属离子对酶活力的影响分别在酶液中加入金属离子化合物Na+、K+、zn+、Cu2+、Fe2+、Mg2+、Mn2+、Ca2+、Hg2+,各种金属离子在反应体系中的终浓度分别达到4、8mmol/L。40℃处理30min后测定残余木聚糖酶活力,未加金属离子的酶活力为100%。
2.结果与分析
2.1Q7-31发酵液的酶活力和蛋白含量
2.1.1酶活力Q7-31发酵液的酶的木聚糖酶活力最强,在酶液稀释100倍情况下其木聚糖酶活力高达35.96U/mL;其次具有一定的纤维素酶活力,在酶液稀释10倍的情况下,纤维素酶活力为0.929U/mL;而酶液在没有稀释的情况下,细胞壁降解酶活力只有0.043U/mL(表1)。以上结果表明,Q7-31发酵液的酶主要具有木聚糖酶活力。
2.1.2蛋白含量过滤后的酶液总体积为1 400 mL,595 nnl下的吸光度为0.840,代入标准曲线公式(y=0.8609x,r2=0.9994),得到酶液总蛋白含量为3037.26mg。
2.2酶的分离纯化及SDS-PAGE
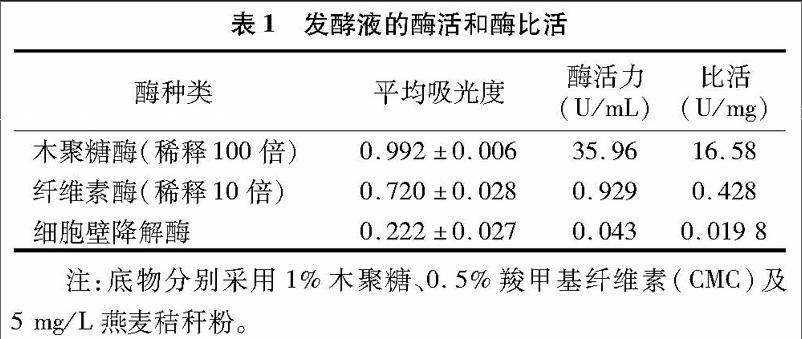
1400mL粗酶液经过50%~80%硫酸铵分级沉淀后,得到12 mL酶液,蛋白含量为1248.99mg,蛋白回收率为41.12%。将酶液上样到Sephacry s-100葡聚糖凝胶层析柱中进行初步分离纯化,得到只具有木聚糖酶活性的蛋白,将其命名为Xyn9,其酶活力为47.26U/mL,蛋白含量为5.824mg,比活为24.34U/mg,SDS-PAGE检测结果证明其为单一蛋白,分子量为21ku(图1)。再将初步分离纯化的Xyn9上样到EzFast DEAE弱阴离子交换柱中进一步分离纯化,柱子预先用pH值为8.5的Tris-HCl缓冲液平衡,以0~1mol/L NaCl进行梯度洗脱,速度为0.5mL/min,得到纯化过的Xyn9。
2.3Xyn9的质谱鉴定
选取双向电泳为1个点的Xyn9蛋白进行串联质谱鉴定,
2.4xyn9的酶学特性
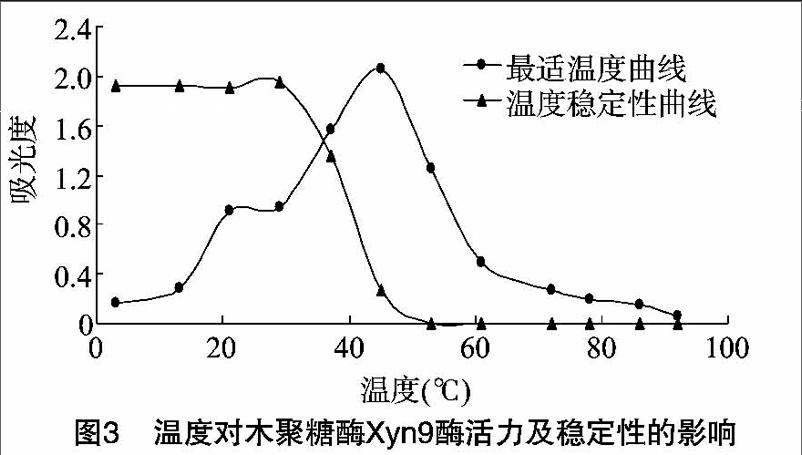
2.4.1Xyn9的最适温度及温度稳定性Xyn9的最适反应温度为47℃,在37~52℃范围内都有较高的酶活力,温度过低或过高都不利于酶促反应;Xyn9在33℃以下稳定性高,当温度高于33℃酶活力迅速降低直至为O(图3)。
2.4.2Xyn9的最适pH值及pH值稳定性纯化的低分子量木聚糖酶Xyn9的最适反应pH值为5.6;Xyn9在pH值为5~6的范围内具很好的稳定性(图4)。
2.4.3金属离子对Xyn9酶活力的影响
金属离子对木聚糖酶Xyn9酶活力具有明显的影响。K+在4、8 mmol/L离子强度条件下对该木聚糖酶活力都有一定的激活作用,且离子浓度越大,激活效果越好;Na+、Ca2+、Mg2+、Zn2+对该酶有不同程度的抑制作用;Hg2+、cu2+则完全抑制该木聚糖酶的活力(图5)。
2.5Xyn9的鉴定
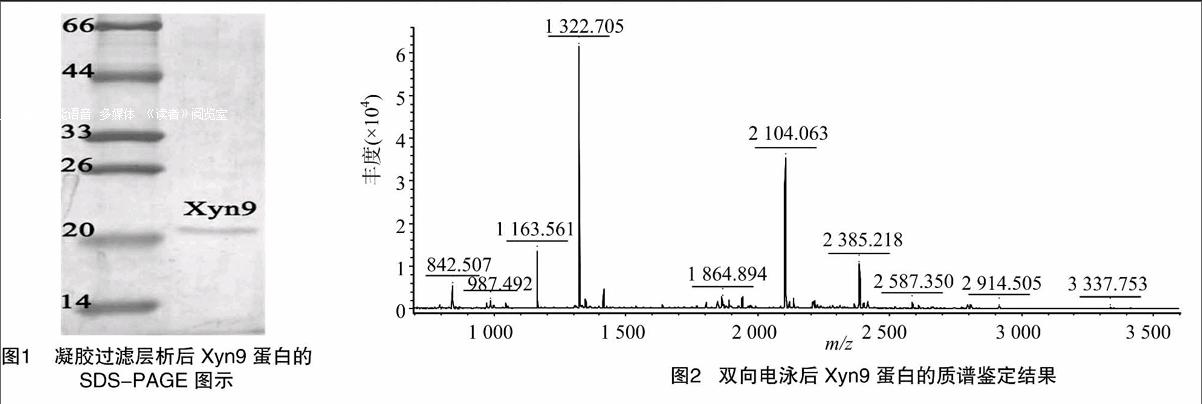
由于Xyn9的质谱鉴定结果表明其接近但不属于GH10结果表明:由于Mascot Score为37分,不足证明其为GHl0家族内切木聚糖酶的47分(P<0.05),因此Xyn9接近但并不属于GHl0家族内切木聚糖酶(NCBI注册号:gi1170139)。理论等电点(PI)为6.86,质谱鉴定结果如图2所示,匹配的肽段序列为VLGEDFVGIAFR,覆盖范围为3%。家族内切木聚糖酶,而低分子量以及酶学特性表明其接近GHll家族内切木聚糖酶。因此,最终将其鉴定为一种新的介于GHl0与GHll家族之间的内切木聚糖酶。
3.结论与讨论
对镰刀菌Q7-31发酵液进行酶活力测定,结果表明,发酵液具有木聚糖酶、纤维素酶与植物细胞壁降解酶活力,并且植物细胞壁降解酶活力较强,这种多种酶的组合在真菌中并不常见。这可能是其生活方式与环境相适应而长期进化的结果,作为植物病原菌,多种酶的协同作用可能有助于其高效感染植物,完成其生活过程。此外,病原菌木聚糖酶可能作为激发子,诱发植物的抗病防御反应,在植物与病原菌互作机制研究和植物抗病防病领域中备受关注,病原菌木聚糖酶由于能分解植物细胞壁而可能促进病原菌的侵染,且病原菌木聚糖酶还可能同时诱发植物的抗病防御系统,病原菌木聚糖酶的这种双重作用已成为近年来植物一病原菌互作关系研究中的一个热点,因此侵染过程需要一系列酶的协同作用。植物半纤维素的完全水解需要一系列酶协同完成,并且这些酶共同作用致使粗酶液具有较高的比活力。其中的小分子木聚糖酶更容易穿透植物纤维壁结构,发挥高效的降解作用。而一些木聚糖酶具有一些特殊结构区域,有利于和底物结合,热稳定区域和糖基化结构使其稳定性在不同环境中更好。
笔者在之前的研究中,已经克隆出编码Xyn8蛋白(同样从Q7-31中分离出)的Xyn8基因,并且实现了其在大肠杆菌中的原核表达,发现其为25.7ku的GHll家族内切木聚糖酶,其最适温度、pH值分别为40℃、6.0。将本研究所得到的Xyn9与Xyn8对比后发现,Xyn9的分子量以及酶学特性与Xyn8类似,即接近GHll家族内切木聚糖酶,但两者基因序列的对比结果(57%)证明其不属于GHll家族。此外,双向电泳后的串联质谱鉴定结果表明其接近但不属于GHl0家族内切木聚糖酶。因此,根据Xyn9的分子量、质谱鉴定结果以及其酶学特性,将其最终鉴定为一种新的介于GHl0与GHl 1家族之间的内切木聚糖酶。但由于其作为病原菌所产酶的特殊性,后续着重解决其归属问题。
Xyn9的酶学特性研究表明其最适反应pH值为5.6,低于33~C时酶活力较稳定,最适反应温度为47℃。多数真菌木聚糖酶的最适反应pH值在5左右,pH值稳定范围为5~6,最适反应温度为40~70℃,低于50℃较稳定。但也有一些报道认为最适pH值在更酸或偏中性环境中,如lefuji等从酵母菌Cryptococcus sp.S-2中分离得到一种小分子量内切木聚糖酶,其最适反应pH值为2.0,且当pH值为1.0时仍能保持75%的酶活力。另外一些木聚糖酶在极端pH值和温度条件下酶活力不但高而且稳定,在工业应用方面有很好的前景。如木聚糖酶应用于造纸业中需要其能够受耐高温(55~70℃)和碱性环境,在生物转化方面甚至需要一些嗜热嗜碱和嗜热嗜酸性的木聚糖酶。这就需要通过菌株筛选、诱变、基因工程或者蛋白工程等方法来提高木聚糖酶的水解效率和稳定性,这也是目前木聚糖酶研究的一个主要方向。金属离子K对木聚糖酶Xyn9具有很强的激活作用,在一定范围内,其浓度越大作用越强,而Na+、ca2+、Mg2+、zn2+对该酶有不同程度的抑制作用很少有报道。重金属离子Hg2+、cu2+对木聚糖酶具有完全的抑制作用,这与许多报道结果一致,可能由于Hg2+、Cu2+能够改变酶的构象从而使酶失活。
