X蛋白(pX)在血清4型禽腺病毒感染LMH细胞后对Toll样受体的影响
2023-03-13李小凤罗思思谢志勤阮志华张民秀黄娇玲万丽军任红玉谢丽基谢芝勋
李小凤,韦 悠,罗思思,谢志勤,阮志华,张民秀,黄娇玲,李 丹,万丽军,李 孟,任红玉,谢丽基,谢芝勋
(广西兽医生物技术重点实验室/广西兽医研究所/农业农村部中国(广西)—东盟跨境动物疫病防控重点实验室,南宁 530001)
【研究意义】禽腺病毒血清4型(Fowl adenovirus serotype 4,FAdV-4)通常感染5周龄以下的肉鸡[1],被感染肉鸡呈现心包积水综合征(Hydropericardium syndrome,HHS),其病理特征是心包内有透明或草莓色积液,肺水肿,肝脏肿胀变色,肾脏膨胀,伴有局灶性坏死和点状出血。近年来,FAdV-4疫情在中国鸡群中多次暴发,致死率高达80%[1-2],对家禽养殖业造成严重威胁。病毒在感染宿主后,宿主会启动抗病毒的免疫应答系统来抑制病毒复制。了解FAdV-4编码蛋白与宿主感染之间的相互作用有利于阐释致病机制和开发新颖、有效的治疗方案。【前人研究进展】禽腺病毒为无囊膜双链DNA病毒,病毒粒子直径70~90 nm,呈正二十面体结构,每个病毒粒子由252个衣壳粒组成[3]。其中,Hexon、Peton和Fiber是衣壳的主要结构蛋白,核衣壳蛋白还包括pX、pⅥ、pⅦ和pVⅢ。Hexon蛋白因其抗原决定簇和中和血清的特性,常被用作研究分子流行病学的靶标[4]。Penton蛋白在感染过程中附着于宿主细胞,依赖宿主细胞表面整合素介导细胞内吞[5];Shah等[6]研究表明,Penton蛋白作为亚单位疫苗免疫2周龄无特定病原(Specific pathogen free,SPF)鸡,对攻毒试验鸡有90%的保护率,说明其有作为亚单位疫苗的潜力。纤突蛋白Fiber分为3个结构域(头部、颈部、尾部),不同血清型的Fiber蛋白差异较大,FAdV-1、FAdV-4和FAdV-10有2个纤突蛋白,分别为Fiber-1和Fiber-2。Pan等[7]研究表明,在病毒感染过程中,Fiber-1蛋白头部与宿主受体CAR结合促进病毒侵入宿主,Fiber-2促进病毒复制;韦悠等[8]研究发现Fiber-2截短重组蛋白及单克隆抗体具有良好的反应原性和特异性,可用于FAdV-4病毒检测试剂盒研发。Ⅲα蛋白调节病毒侵入宿主细胞,协助病毒粒子的组装成熟[9]。pX是由腺病毒晚期编码的一种富含精氨酸残基的高碱性蛋白[10],包含核和核仁定位信号序列[11]。此外,pX含有2个腺病毒蛋白酶切割位点[12],且其前体非共价结合病毒[13],并与病毒其他核心蛋白一起参与浓缩病毒基因组[14];人腺病毒pX能调节E2蛋白的积累[12];pX在病毒复制过程中参与将线性双链DNA基因组带到衣壳的过程[15-16];Zhao等[17]研究证实,FAdV-4 pX是诱导鸡肝癌细胞(LMH)坏死的主要因子。以上研究证实,pX和其他编码蛋白在病毒复制过程中发挥重要作用,但pX与宿主的天然免疫关系尚不清楚。病毒感染宿主后,宿主细胞启动天然免疫系统利用一系列模式识别受体(Patterns recognition receptors,PPRs)识别病毒。PRRs包括Toll样受体、MDA5和cGAS受体[18-19]。PRRs识别病毒核酸后,激活下游信号通路,诱导Ⅰ型干扰素(IFN-α/β)及炎性细胞因子(如IL-1β、IL-6、IL-8和IL-15)产生,抑制病毒复制。虽然FAdV-4能引起宿主的天然免疫应答,但是也能逃避宿主强大的先天免疫反应,甚至进化出各种防御机制来保证自身的生存和复制。为研究FAdV-4编码蛋白与宿主天然免疫信号通路的关系,广西兽医生物技术重点实验室先后进行FAdV-4全病毒感染LMH细胞试验及病毒Fiber-1、Peton、22k、52k等重组质粒转染LMH细胞后病毒感染试验,检测天然免疫相关基因mRNA转录水平[20]。综上所述,FAdV-4编码蛋白在逃逸宿主天然免疫系统的识别和影响病毒感染进程等方面发挥着重要作用。【本研究切入点】在广西兽医研究所兽医生物技术室课题组的前期研究中发现FAdV-4强毒株感染LMH细胞和SPF鸡后,Toll样受体及效应因子mRNA转录水平发生显著变化[21-22],说明FAdV-4感染与宿主的天然免疫模式识别受体及其效应因子产生密切相关。已有研究表明pX具有结合病毒的功能[13],并参与浓缩病毒基因组[14],但在这些过程中,宿主天然免疫系统的作用尚不明确。【拟解决的关键问题】以FAdV-4 pX蛋白为研究对象,构建pEF1α-HA-X重组表达质粒,转染LMH细胞,利用实时荧光定量PCR检测10种Toll样受体及6种效应因子mRNA转录水平,探讨FAdV-4 pX蛋白在病毒复制过程中和宿主天然免疫之间的相互作用,为进一步阐释FAdV-4感染致病机制和免疫应答机理提供数据参考。
1 材料与方法
1.1 试验材料
1.1.1 病毒与细胞 FAdV-4(FAdV-4-GX2019-010株)、LMH细胞和PEF1α-HA载体均由广西兽医生物技术重点实验室保存。
1.1.2 主要试剂 PrimeSTAR®GXL PremiX Fast、Prime Script RT Master MiX、PMD18-T载体、TaKaRa DNA Ligation Kit Long、EcoR Ⅰ和KpnⅠ限制性内切酶均购自宝生物工程(大连)有限公司;DMEM/F12细胞培养基、胎牛血清(FBS)、转染试剂盒(Lipofectamine 3000)、HA标记小鼠源单克隆抗体、HRP标记山羊抗鼠IgG(H+L)购自美国赛默飞世尔科技公司;Universal Genomic DNA Kit购自康为世纪生物科技股份有限公司;Gene JET RNA Purification Kit、2×SYBR Green Master MiX购自美国英杰生命技术有限公司。
1.1.3 主要仪器 凝胶成像分析仪(型号为Gel DocTMXR+)购自美国Bio-Rad公司;超微量分光光度计(型号NanoDrop2000)、实时荧光定量PCR仪(型号Quant Studio 5)购自美国赛默飞世尔科技公司;倒置荧光显微镜(型号ECLIPSETi2-U)购自日本Nikon公司。
1.2 方法
1.2.1 引物的设计与合成 参考广西兽医生物技术室分离FAdV-4-GX2019-010株(登录号MW439 040)已测得的X基因编码区序列,使用Oligo 7.37设计PCR扩增引物。上游引物:5′-ccggaattcggATGCCCGCCGTGCTTTTGAC-3′(下划线为EcoRⅠ酶切位点),下游引物:5′-cccggtaccTCACTTGTTGCCATACAACTTATTG-3′(下划线为KpnⅠ酶切位点),引物委托深圳华大基因科技有限公司合成。
1.2.2 病毒DNA抽提与X基因编码区序列扩增 参照病毒Universal Genomic DNA Kit试剂盒说明书对FAdV-4病毒液进行DNA提取。以提取的DNA为模板,用PCR扩增X基因编码区序列。反应体系为50 μL:2×TransTaq-T PCR Super Mix 25 μL,上下游引物各1 μL(引物浓度10 μmol/L),DNA模板3 μL,无核酸酶水补足至50 μL。反应程序:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火1 min,72 ℃延伸1 min,进行34个循环;72 ℃终延伸5 min。PCR扩增产物经1.5%琼脂糖凝胶电泳进行分离得到目的条带。
1.2.3 pEF1α-HA-X表达载体构建 目的条带经胶回收后,与pMD18-T载体于16 ℃连接过夜,将连接产物转化DH5α感受态细胞,37 ℃培养过夜,筛选阳性克隆,摇菌扩大培养提取质粒,进行双酶切鉴定,将鉴定正确的样品送至深圳华大基因科技有限公司测序,正确的重组质粒命名为T-X。
在37 ℃恒温下,用EcoR Ⅰ和KpnⅠ限制性内切酶酶切pEF1α-HA载体和T-X重组质粒4 h,切胶回收目的片段,并将二者于16 ℃连接过夜,转化DH5α感受态细胞,37 ℃培养过夜,筛选阳性克隆,经双酶切及测序验证,筛选插入完全正确的表达质粒,并命名为pEF1α-HA-X。
1.2.4 pEF1α-HA-X重组表达质粒转染LMH细胞 LMH细胞按约1×106个/mL的数量接种于6孔细胞培养板,待LMH细胞铺满80%~90%,弃掉培养基,PBS洗2遍。分别将质粒pEF1α-HA-X(试验组)和pEF1α-HA(对照组)与转染试剂混匀(2 μg/孔),孵育30 min后转染LMH细胞,作用4 h,补加2 mL 培养基,继续培养24 h,LMH细胞状态良好,以MOI=0.01的FAdV-4进行刺激1~2 h,弃去病毒液,加入病毒维持液,继续培养24 h。以下试验是在FAdV-4感染24 h后收集LMH细胞进行,同时设立pEF1α-HA-X与pEF1α-HA不添加病毒刺激组。添加病毒刺激组分别标记为pEF1α-HA-X+和pEF1α-HA+,不加病毒刺激分别标记为pEF1α-HA-X-和pEF1α-HA-。
1.2.5 pX重组蛋白Western-blotting和间接免疫荧光验证 Western-blotting方法:收集细胞后用RIPA裂解液裂解,获得蛋白混合液样品,重组蛋白样品经SDS-PAGE分离后转印至PVDF膜,用4%脱脂乳室温封闭4 h,弃除封闭液,加入HA标记小鼠源单克隆抗体(1∶2000),于4 ℃孵育过夜,次日用PBST洗膜4次,再加入按HRP标记山羊抗鼠二抗(1∶2000),室温孵育1 h,用PBST洗膜4次,用DAB试剂显色拍照。
间接免疫荧光方法:重组质粒转染LMH细胞48 h后,弃除培养基,依次使用4%多聚甲醛固定15 min,通透液(Triton X-100)孵育15 min,封闭液封闭1 h。弃除封闭液,按500 μL/孔加入HA标记小鼠源单克隆抗体(1∶500),4 ℃孵育过夜。弃除一抗,PBS洗3遍。按500 μL/孔加入FITC标记的兔抗鼠二抗(1∶1000),室温孵育1 h。弃除二抗,PBS洗3遍,用倒置荧光显微镜观察结果。
1.2.6 LMH细胞RNA抽提及反转录 收集细胞,参照Gene JET RNA Purification Kit抽提试剂盒说明书进行RNA抽提,超微量分光光度计测定浓度,进行一步法反转录,反转录反应体系为20 μL:5×PrimeScript RT Master Mix 4 μL,RNA 1 μg,无核酸酶水补至20 μL。反转录程序:37 ℃ 15 min,85 ℃ 5 s。
1.2.7 实时荧光定量PCR测定 得到的cDNA稀释10倍后作为模板进行实时荧光定量PCR,反应体系为20 μL:2×SYBR Green Mix 10 μL,10 μmol/L上、下游引物各1 μL,cDNA模板2 μL,RNase-free水6 μL。反应程序:50 ℃激活2 min,95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火1 min,60 ℃延伸1 min,共40 个循环。每个样品重复3次。以β-肌动蛋白基因(β-actin)为内参基因,检测chTLR1a、chTLR1b、chTLR2a、chTLR2b、chTLR3、chTLR4、chTLR5、chTLR7、chTLR15、chTLR21、IFN-α、INF-β、IL-1β、IL-6、IL-8和IL-15的mRNA转录水平,引物信息见表1。

表1 引物序列信息
1.2.8 数据统计与分析 将获得的试验组与对照组目的基因及β-actin的Ct值,代入2-ΔΔCt公式计算相对表达量,计算公示为:
△Ct(试验组)=Ct(试验组目的基因)-Ct(试验组内参基因);
△Ct(对照组)=Ct(对照组目的基因)-Ct(对照组内参基因);
△△Ct=△Ct(试验组)-△Ct(对照组)。
添加病毒刺激组与未加病毒刺激组分别计算结果,表达量的差异倍数使用2-ΔΔCt。最后利用IBM SPSS statistics 2.0对数据进行Studentt差异性分析,P<0.05判断为差异显著,用*标注,P<0.01判断为差异极显著,用**标注。采用Prism 8制图。
2 结果与分析
2.1 X基因编码区序列PCR扩增及产物鉴定
以病毒基因组DNA为模板,PCR扩增产物经琼脂糖凝胶分离可获得大小约为540 bp的条带(图1),与预期结果相符。测序分析显示,FAdV-4的X基因开放阅读框(ORF)长540 bp,共编码179个氨基酸残基,与本实验室上传到GenBank的血清4型禽腺病毒X基因(登录号MN577984.1)核苷酸序列相似性为100%。
2.2 pEF1α-HA-X重组表达质粒双酶切鉴定结果
pEF1α-HA-X重组表达质粒经双酶切鉴定后得到540 bp片段,说明X基因目的片段已经正确插入pEF1α-HA载体(图2)。经深圳华大基因科技有限公司测序,结果显示插入的X基因大小、位置、ORF均正确,表明pEF1α-HA-X重组表达质粒构建成功。
2.3 pX重组蛋白Western-blotting和间接免疫荧光验证结果
pEF1α-HA-X重组表达质粒(试验组)和pEF1α-HA空质粒(对照组)转染LMH细胞48 h后,Western-blotting结果显示,试验组裂解出来的蛋白与HA标记小鼠源单克隆抗体特异性反应,在27 kD处有一特异条带,而对照组在此处没有出现相应条带(图3)。间接免疫荧光结果显示,试验组的细胞可见大量绿色荧光,而对照组没有绿色荧光(图4)。说明pX重组蛋白在LMH细胞中正确表达。

M: Trans 2K DNA标记;1~4: X基因扩增产物。M:Trans 2K DNA Marker; 1-4: X gene PCR amplification products.
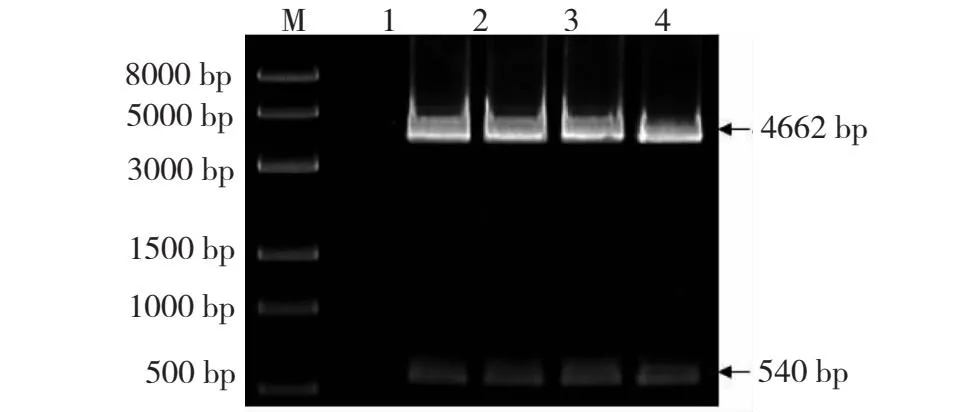
M:Trans 8K DNA标记;1~4:pEF1α-HA-X双酶切产物。M: Trans 8K DNA Marker; 1-4:Double enzyme digestion of pEF1α-HA-X products.
2.4 FAdV-4 pX对LMH细胞Toll样受体mRNA转录水平的影响
pEF1α-HA-X重组表达质粒转染LMH细胞48 h后,所检测的10 种chTLRs表达量与相应的对照组相比出现不同程度上调(图5)。与pEF1α-HA-组相比,pEF1α-HA-X-组chTLR1a和chTLR1b的mRNA转录水平极显著上调(P<0.01,下同),分别为pEF1α-HA-组的9.76和12.34倍;chTLR2a、chTLR2b、chTLR5、chTLR7、chTLR15和chTLR21的mRNA转录水平显著上调(P<0.05,下同),chTLR3和chTLR4的mRNA转录水平上调表达,但差异不显著(P>0.05,下同)。与pEF1α-HA+组相比,pEF1α-HA-X+组chTLR1a、chTLR1b、chTLR2a和chTLR2b的mRNA转录水平极显著上调,分别为pEF1α-HA+组的3.78、4.10、6.70和5.57倍;chTLR3的mRNA转录水平显著上调,为pEF1α-HA+组的3.09倍;而chTLR4、chTLR5、chTLR7、chTLR15和chTLR21的mRNA转录水平与pEF1α-HA+组差异不显著。与pEF1α-HA-X-组相比,pEF1α-HA-X+组chTLR1a和chTLR1b的mRNA转录水平极显著下调,分别下调60.0%和66.7%;chTLR2a、chTLR2b和chTLR3转录水平显著上调2.91、2.01和1.47倍,其他chTLRs的mRNA转录水平下调,但差异不显著。FAdV-4感染pX过表达LMH细胞24 h后,pX能促进chTLR2a、chTLR2b和chTLR3的mRNA转录水平表达,并抑制其他chTLRs的mRNA转录水平。
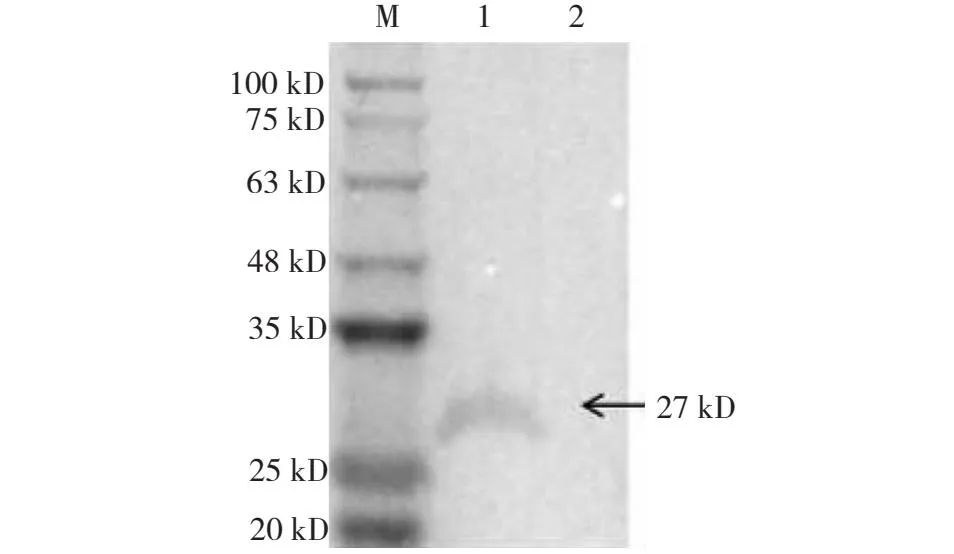
M:蛋白标记(11~180 kD);1:pEF1α-HA-X质粒; 2:pEF1α-HA空质粒。M: Protein Marker(11-180 kD);1: pEF1α-HA-X plamid;2:PEF1α-HA empty plamid.

图4 pX重组蛋白的间接免疫荧光验证结果(100×)Fig.4 Indirects immunoflurescence identification result of pX recombinant protein (100×)
2.5 FAdV-4 pX对LMH细胞效应因子mRNA 转录水平的影响
细胞效应因子检测结果(图6)显示,未添加FAdV-4感染时,与pEF1α-HA-组相比较,pEF1α-HA-X-组IFN-β、IL-1β、IL-6、IL-15的mRNA转录水平显著提高;IL-8的mRNA转录水平极显著提高,为pEF1α-HA-组的11.6倍;IFN-α的mRNA转录水平上调,但差异不显著。添加FAdV-4感染24 h后,与pEF1α-HA+组相比,pEF1α-HA-X+组干扰素(IFN-α和IFN-β)和白介素(IL-1β和IL-8)的mRNA转录水平极显著提高,分别为pEF1α-HA+组的2.90、2.77、3.10和3.3倍;IL-6的mRNA转录水平显著提高,为对照组的2.54倍(P<0.05);IL-15的mRNA转录水平与pEF1α-HA+组差异不显著。与pEF1α-HA-X-组相比,pEF1α-HA-X+组IFN-α、IFN-β和IL-1β的mRNA转录水平显著提高,分别提高2.03、1.05和1.55倍;而IL-6、IL-8和IL-15表达量下调,其中IL-8极显著下调71.29%。上述结果说明,pX在LMH细胞过表达后,受到病毒感染时,能促进或抑制细胞效应因子表达,说明pX对宿主细胞的天然免疫有激活作用,也有自己逃逸天然免疫的策略。
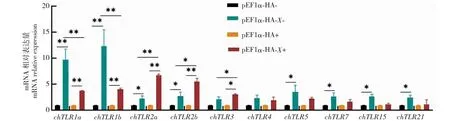
*表示差异显著(P<0.05),**表示差异极显著(P<0.01),下同。 * indicates significant differences(P<0.05), and ** indicate extremely significant differences(P<0.01).The same as below.
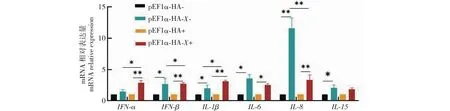
图6 FAdV-4 pX对效应因子mRNA表达量的影响Fig.6 Effect of FAdV-4 pX on the mRNA expressions of the cytokines
3 讨 论
本研究中,pEF1α-HA-X重组表达质粒转染LMH细胞后,无论是否被病毒感染,所检测的10 种chTLRs受体与相应对照组相比都有不同程度地上调表达。其中,chTLR1a和chTLR1b转录水平在2种情况下均极显著上调,与广西兽医研究所兽医生物技术室课题组前期研究FAdV-4感染LMH细胞 24 h后,chTLR1a和chTLR1b的mRNA转录水平升高一致。病毒刺激后,chTLR1a和chTLR1b的mRNA转录水平反而下降,推测是因为pX在LMH细胞过表达后,pX具有一定毒性,宿主细胞的免疫系统被激活,而在病毒感染后,病毒编码的蛋白抑制chTLR1a和chTLR1b转录表达,帮助病毒逃逸宿主天然免疫系统的攻击。pX重组蛋白在LMH细胞过表达后,pEF1α-HA-X-组的chTLR2a、chTLR2b、chTLR5、chTLR7、chTLR15和chTLR21的mRNA转录水平比pEF1α-HA-组显著上调,说明pX蛋白过表达后能促进上述受体的表达,激活宿主天然免疫系统。值得注意的是,chTLR4、chTLR5、chTLR7、chTLR15、chTLR21的mRNA转录水平在FAdV-4刺激后反而下降,原因可能是病毒与宿主相互作用过程中,宿主启动的天然免疫系统对受体的选择有偏好性,同时病毒也有可能通过其他途径抑制上述受体表达来逃逸宿主天然免疫的攻击,顺利完成复制和生存。pX蛋白在LMH细胞过表达并添加FAdV-4感染后,与pEF1α-HA-X-组相比,pEF1α-HA-X+组chTLR2a和chTLR2b的转录水平极显著上调,chTLR3的转录水平显著上调,说明chTLR2a、chTLR2b和chTLR3参与调控宿主天然免疫应答过程,可作为研究宿主识别FAdV-4感染的模式识别受体。chTLR1a和chTLR1b,chTLR2a和chTLR2b分别由TLR1、TLR2分化而来,当TLR1和TLR2结合后能识别细菌脂多糖[23]。本研究发现,在同等情况下,chTLR1a和chTLR1b,chTLR2a和chTLR2b的mRNA转录水平比其他受体转录水平上调更明显,可能在LMH细胞抗FAdV-4感染过程中,TLR1和TLR2联合发挥作用。病毒感染后,chTLR1a和chTLR1b的mRNA转录水平下调,chTLR2a和chTLR2b的mRNA转录水平上调,推测是由于两者在抑制病毒复制的分工不同。TLR3是核内保守性较强的功能蛋白,在抗病毒感染中发挥关键作用,可以识别病毒和双链RNA[24]。TLR3是唯一完全依赖于β干扰素TIR结构域衔接蛋白(TRIF)的核糖核酸传感器,介导I型干扰素、促炎细胞因子和趋化因子的转录诱导,从而共同建立宿主的抗病毒反应[25]。本研究结果显示,与pEF1α-HA-X-组相比较,pEF1α-HA-X+组chTLR3的mRNA转录水平显著提高,推测chTLR3除了可以识别病毒RNA外,也可以识别FAdV-4基因组DNA在复制过程中产生的RNA中间体,从而抑制病毒复制。
此外,病毒攻击宿主后,宿主天然免疫系统被激活,PRRs识别病毒后,宿主主要依赖Ⅰ型干扰素和促炎性因子抵御病毒。结果发现,pX在LMH细胞中过表达后,无论是否被病毒感染,所检测干扰素(IFN-α和IFN-β)和白介素(IL-1β、IL-6、IL-8、IL-15)mRNA转录水平与相应对照组相比均有所提高。pX在LMH细胞中过表达并被病毒感染后,pEF1α-HA-X+与pEF1α-HA-X-组相比,IFN-α、IFN-β和IL-1β转录水平显著提高。IFN-α和IFN-β的功能主要是抑制病毒复制,IFN-β转录水平升高与chTLR3转录水平上调这一结果相呼应,说明本研究结果可靠,同时也说明pX通过激活宿主的天然系统,提高干扰素转录表达水平来抑制病毒表达。IL-1β、IL-6和IL-8属于炎症因子,炎症因子积累有抑制病毒的作用,过多积累可能导致宿主炎症损伤和急性死亡,这与Zhao等[17]研究发现pX是诱导LMH坏死的主要因子对应,同时与Li等[26]通过FAdV-4感染SPF鸡检测到IL-8表达水平升高结果相似,同时与广西兽医研究所兽医生物技术室课题组前期FAdV-4感染CEF细胞后,SPF鸡的IL-1β、IL-6、IL-8和IL-18表达上调结果[22]相似。炎症因子的积累导致宿主细胞的死亡,可能是由于宿主在抑制病毒复制,也可能是病毒利用宿主细胞的凋亡来逃逸天然免疫的攻击使病毒得于继续复制。这些结果表明pX在FAdV-4感染过程激活宿主天然免疫信号通路起到积极作用。
4 结 论
在LMH细胞过表达pX并添加FAdV-4感染后,pX能激活宿主免疫应答系统,Toll样受体(chTLR2a、chTLR2b和chTLR3)和其效应因子(IFN-α、IFN-β和IL-1β)的mRNA转录水平显著上调以抑制病毒复制,说明pX具备激活宿主细胞天然免疫系统的功能。
