鸡TIFA和TRAF6蛋白的分子特征及其基因在免疫器官中的表达特性
2023-03-13张前勇赵采芹石海英邢静如段志强
张前勇,赵采芹,石海英,邢静如,段志强
(1. 贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵阳 550025;2. 贵州省动物遗传育种与繁殖重点实验室,贵阳 550025;3. 贵州大学动物科学学院,贵阳 550025)
【研究意义】肿瘤坏死因子受体相关因子相互作用的具有叉形头相关结构域蛋白[Tumor necrosis factor receptor associated factor (TRAF)-interacting protein with a Forked-associated (FHA) domain,TIFA]是一种与肿瘤坏死因子受体相关因子6(Tumor necrosis factor receptor-associated factor 6,TRAF6)具有相互作用的细胞免疫相关蛋白,其在白细胞介素1(Interleukin 1,IL-1)刺激下可介导IL-1 受体相关激酶1(IL-1 receptor-associated kinase 1,IRAK1)与TRAF6发生相互作用[1],在细胞信号转导、先天性免疫应答、抗病毒感染等方面发挥重要作用[2-3]。因此,开展鸡TIFA和TRAF6的分子特征及其基因在免疫器官中的表达特性研究,对了解两者参与的免疫应答在相关病毒复制的作用机制研究方面具有重要意义。【前人研究进展】TIFA和TRAF6相互作用调控核因子-κB(Nuclear factor-kappa B,NF-κB)信号通路介导的炎性免疫应答受到了越来越多研究人员的关注。如,TIFA通过促进TRAF6的寡聚化和泛素化来激活NF-κB信号通路上的κB抑制因子激酶(Inhibitor of κB kinase,IKK)与锌指结构蛋白11(Zinc finger CCHC-type containing 11,ZCCHC11),并调节Toll样受体(Toll-like receptor,TLR)信号通路的传导,进而对NF-κB信号通路起到反馈作用[2,4]。有研究证实,α-蛋白激酶1(alpha-protein kinase 1,ALPK1)的N-端结构域可以特异性识别脂多糖合成的前体糖分子二磷酸腺苷庚糖(ADP-heptose),通过蛋白构象变化诱导ALPK1 C-端激酶结构域活化,进而磷酸化TIFA;磷酸化后的TIFA发生寡聚化,并进一步与TRAF6相互作用激活下游NF-κB通路,进而诱发炎症反应[5-6]。另外,Maubach等[7]研究发现,TRAF6和TRAF2是TIFA的结合蛋白,有助于在幽门螺旋杆菌感染时形成TIFAsomes;同时,TIFA/TRAF6的相互作用还能结合转化生长因子β激活激酶-1(Transforming growth factorβactivated kinase-1,TAK1),导致NF-κB信号通路的激活,而TIFA/TRAF2相互作用导致细胞凋亡抑制剂1(Cellular inhibitor of apoptosis 1,cIAP1)从TRAF2中瞬时迁移以及cIAP1的蛋白酶体降解,促进NF-κB替代通路的激活。最近,Duan等[8]利用定量蛋白质组学研究新城疫病毒(Newcastle disease virus,NDV)感染幼仓鼠肾细胞后的差异表达蛋白发现,病毒M蛋白在细胞质中以剂量依赖的方式降低TIFA表达,并通过降低TIFA/TRAF6/NF-κB信号通路产生的细胞因子来促进NDV的复制和致病性。以上研究对深入认识TIFA和TRAF6相互作用调控的先天性免疫应答提供了重要参考。目前,有关TIFA在机体组织中的表达特征研究相对较少,仅门万夫[9]研究报道,TIFA基因在人肺癌组织中呈高表达,降低其表达可抑制肺癌细胞的增殖和迁移;同时,TIFA基因在鸡胚不同发育阶段的多种组织中均有表达,其可能参与鸡肺脏和肝脏的发育[10]。但是关于TRAF6基因的组织表达特征研究则相对较多,如TRAF6基因在人和不同动物的组织中广泛表达,特别是在肺脏、肝脏、心脏和脾脏中高表达[9,11-12];TRAF6基因在家蝇的蛹和成蝇阶段表达量高,其在家蝇发育中发挥了重要的免疫防御作用[13]。另外,骆磊[14]研究发现,在正常鸡的脾脏、肺脏和胸腺中TRAF6基因的表达显著高于其他组织,且在NDV感染鸡后的免疫器官中的表达均显著上调。【本研究切入点】由于TIFA和TRAF6蛋白相互作用共同参与机体免疫应答,二者在正常鸡的免疫器官及NDV感染鸡后的免疫器官中的共同表达特征尚不清楚。【拟解决的关键问题】首先采用生物信息学结合实时荧光定量PCR(RT-qPCR)方法,通过分析鸡TIFA和TRAF6蛋白的分子特征,1~6月龄白来航鸡及NDV感染和未感染的4周龄SPF鸡免疫器官(脾脏、胸腺、法氏囊)中TIFA和TRAF6基因的表达水平,探明二者在鸡免疫器官中的表达特征,以期为后期深入研究鸡TIFA和TRAF6相互作用调控NDV复制的作用机制提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 白来航鸡(White Lehang chicken),购自贵州大学种鸡场,1~6月龄。SPF鸡,购自北京勃林格殷格翰维通生物技术有限公司,4周龄。
1.1.2 试剂 Total RNA Kit Ⅱ提取试剂盒购自美国OMEGA公司;2×RealStar Green Fast Mixture和StarScript II反转录试剂盒购自江苏康润生物科技有限公司;胶回收试剂盒购自AxyGen公司;DNA Marker、TAE缓冲液、无水乙醇和琼脂糖等均购自北京索莱宝生物科技有限公司。
1.1.3 主要仪器设备 NANODROP 2000超微量紫外分光光度计和MaxQ 4000恒温摇床均购自美国Thermo Fisher公司;C1000 TouchTM PCR扩增仪、Gel Doc XR凝胶成像系统和CFX 96荧光定量PCR 仪均购自美国BIO-RAD公司;DYY-2C型电泳仪和WD-2105B微量瞬时离心机均购自北京六一生物科技有限公司。
1.2 方法
1.2.1 材料预处理 1~6月龄白来航鸡每个月龄挑选3只生长状况相似的试验用鸡,屠宰后分别取其脾脏、胸腺和法氏囊备用。4周龄SPF鸡采用滴鼻点眼的方式以106.0EID50/mL剂量接种NDV强毒株rSS1GFP[15],以接种PBS的SPF鸡作为对照,在感染NDV后的第3 、4和5天分别采集鸡脾脏、胸腺和法氏囊,保存于-80 ℃冰箱备用。
1.2.2 鸡TIFA和TRAF6蛋白的生物信息学分析 对前期克隆的鸡TIFA和TRAF6基因CDS区编码的蛋白进行生物信息学分析[10],利用DNAStar软件的EditSeq和MegAlign分别对鸡TIFA和TRAF6蛋白的理化性质、氨基酸同源性和结构域保守性进行分析;利用SOPMA(http://npsapbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和AlphaFold(http://swissmodel.expasy.org/)分别进行鸡TIFA和TRAF6蛋白的二级和三级结构预测,并利用PyMOL 2.5.4软件对鸡TIFA和TRAF6蛋白的表面电荷进行分析。
1.2.3 引物设计与合成 在NCBI官网上查询鸡TIFA和TRAF6基因的核苷酸序列,根据GenBank中鸡TIFA基因的登录号(XM_015276339.2)和TRAF6基因的登录号(XM_015287208.2),利用Primer Premier 5.0分别设计扩增鸡TIFA和TRAF6基因的实时荧光定量PCR特异性引物(表1)。以GAPDH作为内参基因,所有引物合成均由成都擎科生物技术有限公司完成。
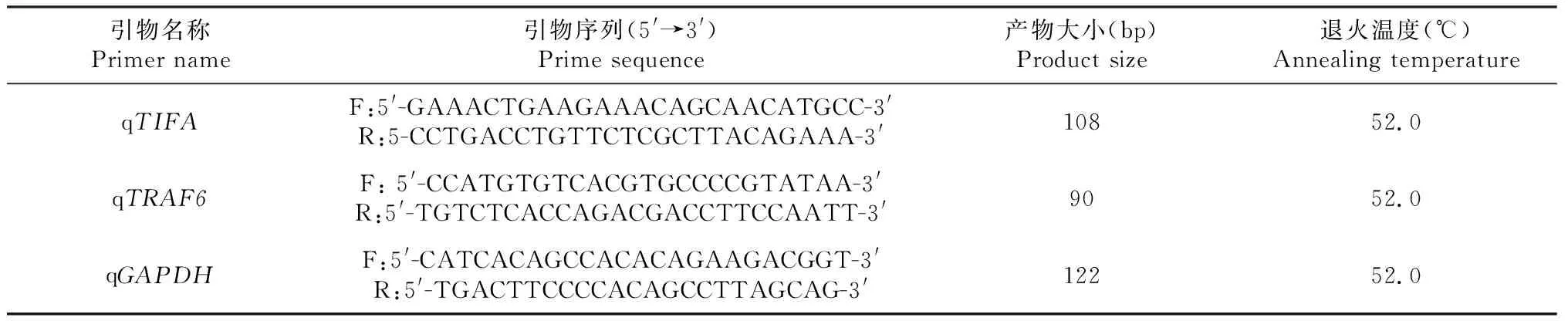
表1 荧光定量PCR引物序列信息
1.2.4 鸡免疫器官总RNA提取及cDNA第一链合成 根据Total RNA Kit Ⅱ提取试剂盒说明书,分别提取鸡的不同免疫器官(脾脏、胸腺和法氏囊)的总RNA,进行总RNA浓度和OD值测定后,按照Star-Script Ⅱ逆转录试剂盒说明书合成cDNA第一链。
1.2.5 实时荧光定量PCR检测鸡TIFA和TRAF6基因表达 利用实时荧光定量PCR法,以提取的1月龄鸡脾脏总RNA反转录产物为模板,首先研究鸡TIFA和TRAF6基因及内参基因GAPDH在脾脏中的扩增效率。以上述合成的cDNA产物为模板,分别检测鸡TIFA和TRAF6基因在脾脏、胸腺和法氏囊中的表达。反应体系总体积为20.0 μL:2×Realstar Green Fast Mixture 10.0 μL,上游引物和下游引物(10 μmol/L)各0.5 μL,cDNA模板1.0 μL,ddH2O 8.0 μL。将反应体系加入到八连管中,每个免疫器官3次重复,震荡混匀离心后使用2步法进行熔解曲线扩增,扩增反应程序设置:95 ℃预变性2 min;95 ℃变性15 s,52 ℃退火30 s,72 ℃延伸30 s,40次循环,熔解曲线由仪器自动分析。
1.3 数据统计与分析
采用Excel 2021对试验数据进行整理分析后,采用2-ΔΔCt法计算鸡TIFA和TRAF6基因的相对表达量,并通过SPSS 26.0进行单因素统计分析,结合Duncan(D)进行比较;采用GraphPad Prism 9.0软件绘制鸡TIFA和TRAF6基因在免疫器官中的表达量。
2 结果与分析
2.1 鸡TIFA和TRAF6蛋白的生物信息学特征
2.1.1 鸡TIFA和TRAF6蛋白的理化性质 通过EditSeq软件分析发现,组成鸡TIFA蛋白的187个氨基酸残基分别是强碱性氨基酸(K和R)21个,强酸性氨基酸(D和E)29个,疏水性氨基酸(A、I、L、F、W和V)53个,极性氨基酸(N、C、Q、S、T和Y)57个;蛋白相对分子量约为21.8 kDa,理论等电点(pI)为5.15,pH 7.0条件下所带电荷为-7.53。组成鸡TRAF6蛋白的545个氨基酸残基分别是强碱性氨基酸55个,强酸性氨基酸69个,疏水性氨基酸150个,极性氨基酸165个;蛋白相对分子量约为61.9 kDa,理论等电点(pI)为6.13,pH 7.0条件下所带电荷为-11.28。
2.1.2 鸡TIFA和TRAF6蛋白的二级和三级结构 鸡TIFA和TRAF6蛋白二级结构的预测结果表明,鸡TIFA蛋白包含的无规则卷曲、α-螺旋、延伸链和β-转角分别占51.87%、27.81%、16.58%和3.74%;鸡TRAF6蛋白包含的无规则卷曲、α-螺旋、延伸链和β-转角分别占47.08%、38.14%、11.86%和2.92%。由此可见,鸡TIFA和TRAF6蛋白的二级结构均以无规则卷曲和α-螺旋为主。AlphaFold在线网站预测的鸡TIFA和TRAF6蛋白三级结构与二级结构基本相符(图1)。另外,PyMOL 2.5.4软件对鸡TIFA和TRAF6蛋白表面电荷进行分析结果表明,鸡TIFA和TRAF6蛋白表面含有丰富的正电荷(蓝色)和负电荷(红色),但均以负电荷居多(图2),与鸡TIFA和TRAF6蛋白的理化性质预测结果一致,表明二者在细胞内主要带负电。
2.1.3 TIFA和TRAF6蛋白的氨基酸同源性 利用MegAlign软件对人和不同动物的TIFA和TRAF6蛋白氨基酸同源性进行分析结果表明,鸡与其他禽类TIFA和TRAF6蛋白的氨基酸同源性分别为83.3%~97.3%和94.0%~98.2%,而鸡与人和哺乳动物TIFA和TRAF6蛋白的氨基酸同源性分别为51.1%~54.9%和74.7%~77.1%。其中,鸡与火鸡TIFA和TRAF6蛋白的氨基酸同源性均最高,分别为97.3%和98.2%,而与猪TIFA及小鼠TRAF6蛋白的氨基酸同源性最低,分别为51.1%和74.7%(图3)。
2.1.4 TIFA和TRAF6蛋白的结构域保守性 根据已有报道[2-3],鸡TIFA蛋白中仅存在1个FHA结构域(47~104 aa),而鸡TRAF6蛋白中存在3个结构域,分别为RING结构(67~124 aa)、Zinc finger结构域(204~261 aa)和MATH结构域(373~522aa)。利用MegAlign软件对鸡与其他禽类、人和哺乳动物TIFA和TRAF6蛋白的功能结构域进行比对分析发现,鸡与火鸡TIFA蛋白的FHA结构域完全保守,而与其他禽类、人和哺乳动物TIFA蛋白的FHA结构域存在多处位点差异。其中,与人TIFA蛋白的FHA结构域相比,鸡的FHA结构域在47~48(MA/VV)、60~62(NLV/TFQ)、75~77(FYR/LFK)、83~85(EFC/VLS)和98~102(TVDQT/IVDSR)等区域存在明显的氨基酸差异(图4-A)。此外,鸡与火鸡、绿头鸭、鹅和鸽子TRAF6蛋白的RING和Zinc finger结构域完全保守,而与人和哺乳动物TRAF6蛋白的RING和Zinc finger结构域存在多处特异性氨基酸位点变异,如92(G/A)、95(V/I)、214(F/I)、233(N/L)、243(F/T)、250(P/H)(图4-B)。此外,除绿头鸭和鹅TRAF6蛋白MATH结构域中有1个位点变异外(506 K/E),其他禽类与鸡TRAF6 的MATH结构域氨基酸位点完全一致,并且与人和哺乳动物存在几处特异性的氨基酸差异,如385~387(GLQ/MHL)、463~465(GPE/A(P/L)(V/I)、488(H/P)等氨基酸区域或位点(图4-B)。上述结果说明,鸡与其他禽类TIFA和TRAF6蛋白的功能结构域保守性高,与蛋白的氨基酸同源性分析结果一致。
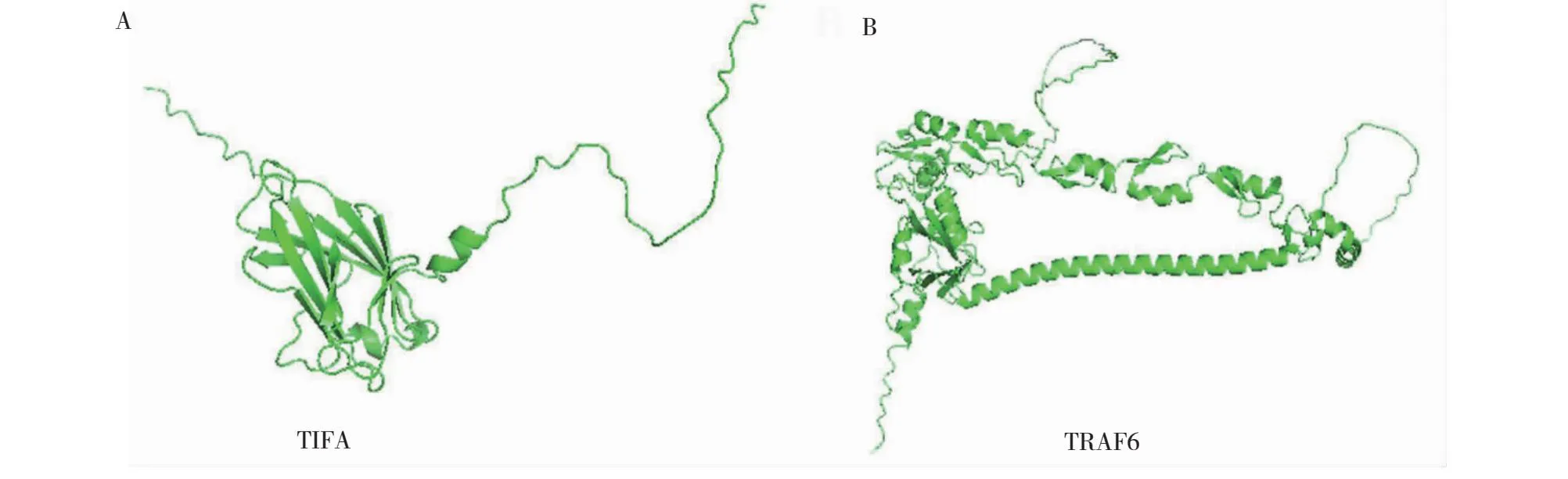
图1 鸡TIFA和TRAF6蛋白的三级结构预测Fig.1 The tertiary structure prediction of chicken TIFA and TRAF6 proteins

蓝色代表正电荷,红色代表负电荷。Blue indicates positive charge, and red indicates negative charge.
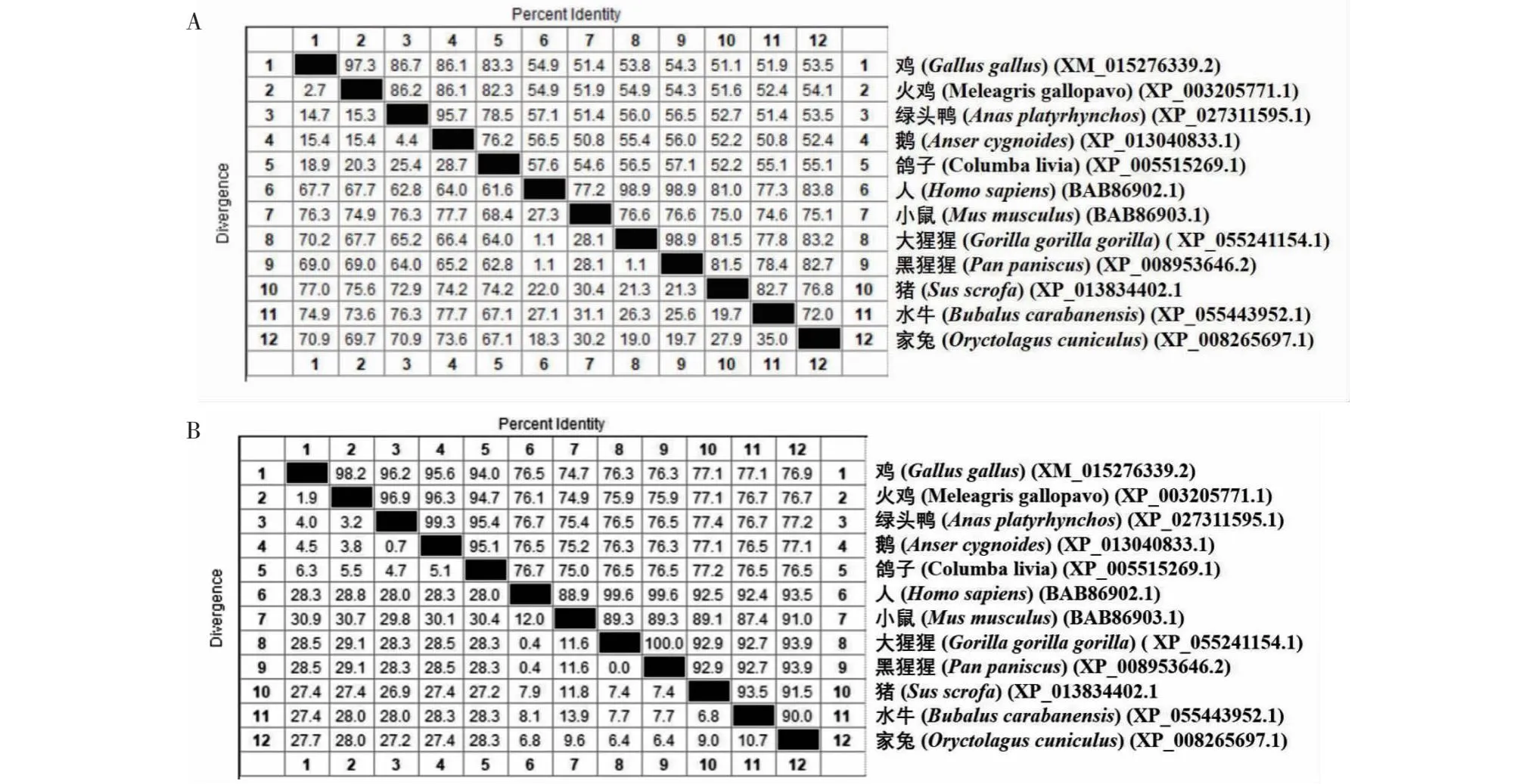
表格右上角数据为氨基酸序列相似性,左下角数据为变异度。Data in the upper right corner of the table are amino acid similarity, and data in the bottom left corner are divergence.
2.1.5 TIFA蛋白与TRAF6蛋白相互作用区域的氨基酸保守性 前期有研究报道,人TIFA蛋白第174~181位氨基酸残基是与TRAF6蛋白MATH结构域发生相互作用的区域,并且S174Q/M179D双突变能显著增强二者的相互作用[16]。从图5看出,鸡与其他禽类,以及人与小鼠、大猩猩、黑猩猩和家兔TIFA蛋白的该区域保守性高。虽然禽类TIFA蛋白未出现S174Q和M179D的突变位点,但是研究证实,鸡TIFA蛋白与TRAF6蛋白同样存在相互作用[17]。

图4 不同物种TIFA (A) 和TRAF6 (B) 蛋白功能结构域的保守性分析Fig.4 The domain conservation analysis of TIFA (A) and TRAF6 (B) proteins from different species

图5 TIFA蛋白与TRAF6蛋白相互作用区域的氨基酸保守性分析Fig.5 The amino acid conservation analysis of TRAF6 interaction region with TIFA protein
2.2 鸡TIFA和TRAF6基因的实时荧光定量PCR扩增效率
从图6看出,鸡TIFA与TRAF6基因及内参基因GAPDH的PCR扩增曲线平滑且整体呈明显的S型;熔解曲线是明显的单峰,且无二聚体和杂峰,说明设计合成的荧光定量PCR引物特异性较好,可以用于后续试验研究。
2.3 TIFA和TRAF6基因在不同月龄鸡免疫器官中的表达水平
2.3.1TIFA基因 从图7看出,鸡TIFA基因在1~6月龄白来航鸡的脾脏、胸腺和法氏囊中均存在表达,以6月龄鸡脾脏的表达量作为对照,鸡TIFA基因在不同月龄鸡脾脏、胸腺和法氏囊中的表达存在明显差异。其中,在脾脏中,鸡TIFA基因在6月龄的相对表达量最低(为1.01),1月龄最高(为14.70),分别是2~6月龄的2.8、1.4、1.2、3.2和14.6倍;在胸腺中,鸡TIFA基因在6月龄的相对表达量最低(为0.08),1月龄最高(为4.55),分别是2~6月龄的4.1、2.7、2.1、11.3和64.3倍;在法氏囊中,鸡TIFA基因在6月龄的表达量最低(为0.02),5月龄最高(为2.90),分别是1、2、3、4和6月龄的1.1、2.9、1.3、1.5和145倍。对鸡TIFA基因在不同月龄鸡免疫器官中的表达变化趋势分析发现,TIFA基因在鸡脾脏中的变化较大,而在胸腺和法氏囊中的变化相对较小,但均呈先降后升再降趋势,至6月龄时降至最低,基因的整体表达变化趋势均呈倒“N”型模式。
2.3.2 鸡TRAF6基因 从图8看出,鸡TRAF6基因在1~6月龄白来航鸡的脾脏、胸腺和法氏囊中均存在表达,以6月龄脾脏中的基因表达量作为对照,鸡TRAF6基因在脾脏中的表达量最高(为10.84),而在胸腺和法氏囊中的表达量相对较低(分别为2.60和2.01)。在脾脏中,鸡TRAF6基因在2月龄的相对表达量最低(为0.72),4月龄最高(为4.41),分别是1、2、3、5和6月龄的2.2、6.3、2.4、4.9和4.4倍;在胸腺中,鸡TRAF6基因在5月龄的相对表达量最低(为0.08),4月龄最高(为1.46),分别是1、2、3、5和6月龄的3.0、15.0、5.0、18.8和7.5倍;在法氏囊中,鸡TRAF6基因在5月龄的表达量最低(为0.06),4月龄最高(为1.26),分别是1、2、3、5和6月龄的2.6、13.0、2.6、21.7和13.0倍。对其表达变化趋势进行分析发现,TRAF6基因在鸡脾脏、胸腺和法氏囊中的变化趋势相同,均呈先降后升再降再升趋势,在4月龄时表达量达最大,基因的表达变化趋势均呈“W”型模式(图8)。
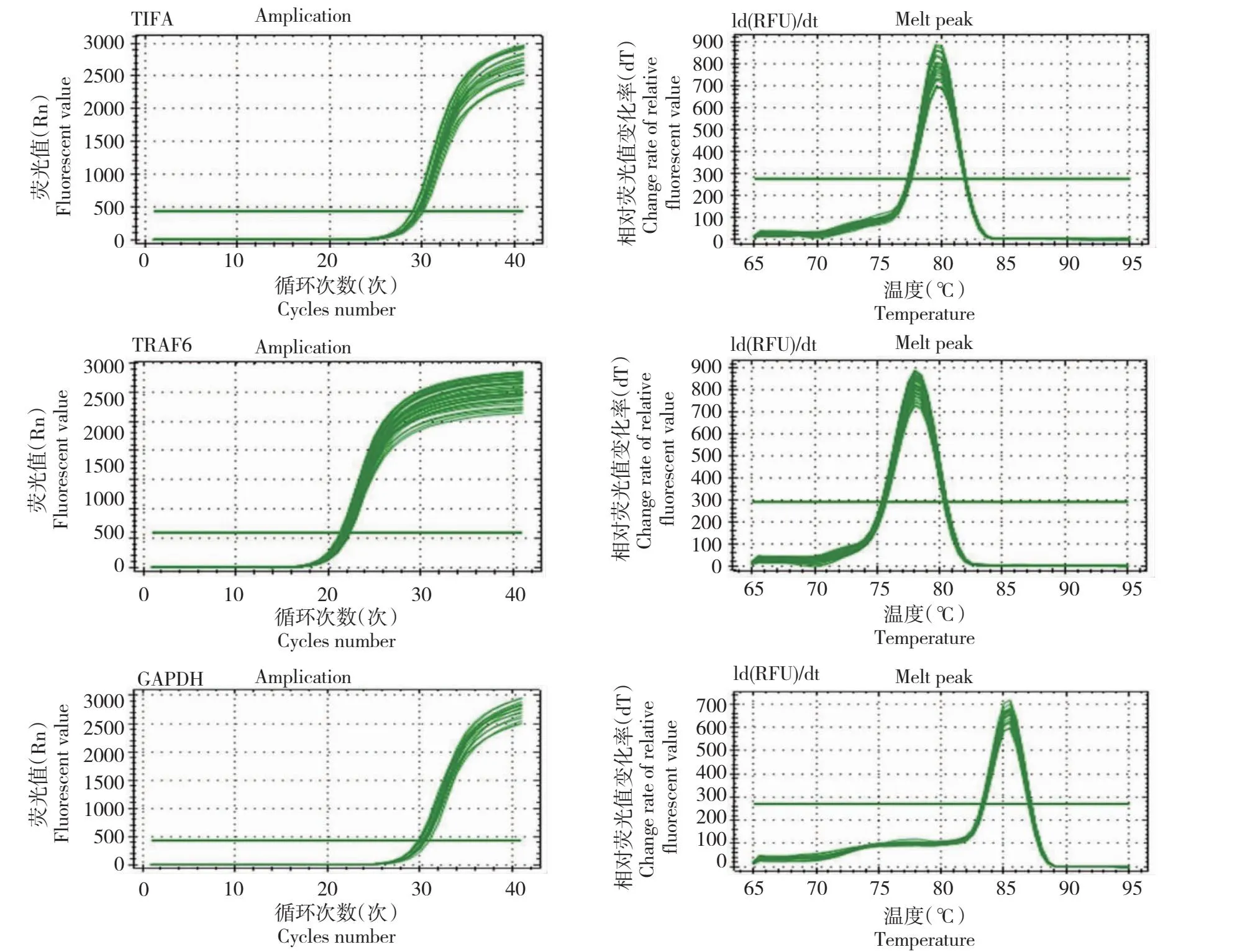
图6 鸡TIFA、TRAF6和GAPDH基因的qRT-PCR扩增曲线和熔解曲线Fig.6 qRT-PCR amplification curve and dissolution curve of chicken TIFA, TRAF6 and GAPDH genes

**表示与6月龄鸡脾脏相比差异极显著(P<0.01);ns表示与6月龄鸡脾脏相比差异不显著。下同。** indicates that the difference is extremely significant in comparison to spleen of 6-month-old chickens (P<0.01); ns indicates that the difference is not significant. The same as below.

图8 TRAF6基因在不同月龄鸡免疫器官中的表达水平 (A) 和表达趋势 (B)Fig.8 The expression level (A) and expression trend (B) of TRAF6 gene in chicken immune organs with different months of age
2.4 鸡TIFA和TRAF6基因在NDV感染SPF鸡后免疫器官中的表达水平
2.4.1 鸡TIFA基因 从图9看出,鸡TIFA基因在NDV感染后第3~5天的脾脏、胸腺和法氏囊中的表达量均明显高于同期对照。脾脏,感染组在第3天和第4天TIFA基因的表达量极显著高于对照,第5天的表达量显著高于对照,分别是对照的4.6、3.3
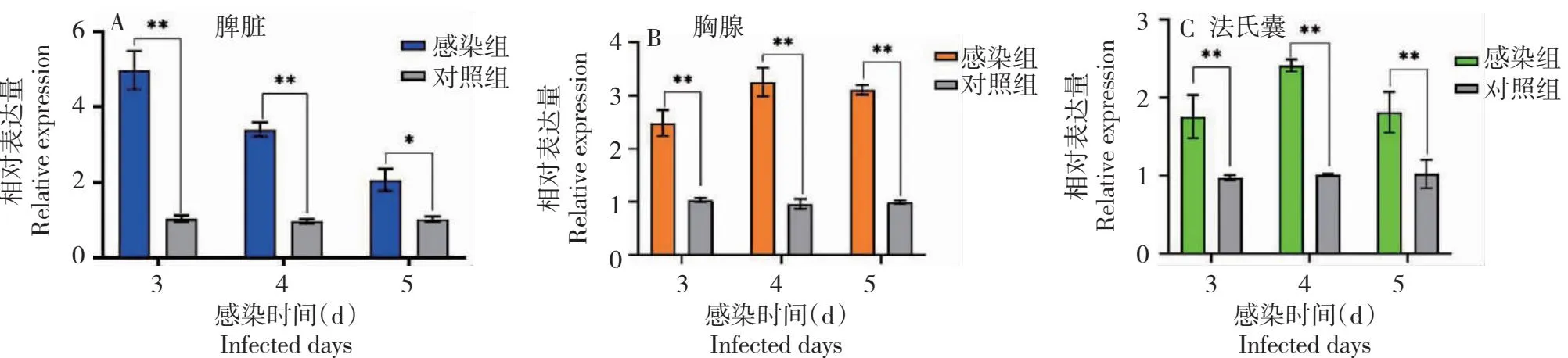
*和** 分别表示感染组与对照组间的差异显著(P<0.05)和极显著(P<0.01) 。下同。* and ** indicate that the differences between the infected group and the control group are significant (P<0.05) and extremely significant(P<0.01). The same as as below.
和1.7倍;胸腺,感染组在第3~5天的表达量均极显著高于对照,分别是对照的2.2、3.2和3.1倍;法氏囊,感染组在第3~5天的表达量也均极显著高于对照,分别是对照的1.8、2.4和4.3倍。同时,从TIFA基因表达的变化趋势看, 其在鸡脾脏中的表达量呈逐渐降低趋势,而在鸡胸腺和法氏囊中均呈先增后减趋势。
2.4.2 鸡TRAF6基因 从图10看出,NDV感染组与对照的TRAF6基因在第3~5天的脾脏、胸腺和法氏囊中的表达存在明显差异。脾脏中感染组第3~5天的表达量极显著高于对照,分别是对照的3.1、2.3和2.3倍;胸腺中感染组第3天的表达量显著高于对照,但在第4天和第5天则极显著高于对照,分别是对照的1.9、3.6和3.7倍;法氏囊中感染组第3~5天的表达量均极显著高于对照,分别是对照的2.2、2.7和4.3倍。同时,从TRAF6基因的表达变化趋势看,其在鸡脾脏中的表达量呈先减后稳定趋势,而在鸡胸腺和法氏囊中则呈逐渐增加趋势。
3 讨 论
近年来,TIFA和TRAF6蛋白的相互作用在小鼠[1]、鸡[17]、人[18]和非洲爪蟾[18]中已经得到证实。Inoue等[18]研究发现,人的TIFA蛋白C端具有与TRAF6相互作用的结合位点,二者共同参与NF-κB的激活,并且TIFA/TRAF6/NF-κB信号通路的活化是细胞产生炎性细胞因子的关键通路。Huang等[16]进一步研究证实,人的TIFA蛋白第171~184位氨基酸残基与TRAF6蛋白的第350~501位氨基酸残基是相互作用的区域,且TIFA蛋白的第174位氨基酸Q和第179位氨基酸D能显著增强与TRAF6蛋白之间的相互作用。Weng等[19]发现,在肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)的刺激下,TIFA的Thr9位点发生磷酸化,通过pThr9-FHA结构域触发TIFA寡聚化并激活NF-κB。同时,TIFA形成的六聚体以及TIFA低聚化是介导其与TRAF6相互作用的基础,六聚体磷酸化后促使TIFA-TRAF6低聚复合物形成[20]。此外,研究还发现,TIFA与TRAF6相互作用共同参与的信号通路,如TIFA/TRAF6/NF-κB、TIFA/TRAF6/IKK和ALPK1/TIFA/TRAF6等[1-2,21],在机体先天性免疫应答过程中发挥重要作用。因此,TIFA和TRAF6相互作用调控机体免疫应答的研究得到广泛关注。
本研究对鸡TIFA和TRAF6蛋白的分子特征进行分析发现,二者在二级结构和三级结构组成上均主要以无规则卷曲和α-螺旋为主,且蛋白表面均以负电荷为主。由于蛋白质中的无规则卷曲结构可作为配体和受体结合的部位,其侧链的改变能影响其空间结构组成[22],因此,此结构可能对TIFA和TRAF6蛋白的结合并发生相互作用具有重要意义。对不同物种TIFA和TRAF6蛋白的氨基酸同源性进行分析发现,鸡与其他禽类TIFA和TRAF6蛋白的氨基酸同源性高于人和哺乳动物,且TIFA和TRAF6蛋白的功能结构域在禽类中保守性也较高,与物种之间的亲缘关系研究结果一致[23]。一般而言,蛋白结构域通常决定该蛋白的活性和功能[24],序列比对发现,家禽TIFA和TRAF6蛋白功能结构域保守性高,而与人和哺乳动物保守性低且存在多处明显的氨基酸位点差异,提示家禽与人和哺乳动物TIFA和TRAF6蛋白之间可能存在不同的功能。因此,鸡TIFA和TRAF6蛋白的生物学功能注释以及在抗家禽病毒感染方面的作用机制需要进一步探究。值得注意的是,虽然TIFA蛋白与TRAF6蛋白发生相互作用的区域并不在其功能结构域中,且鸡和其他家禽与人TIFA蛋白第174~181位氨基酸残基差异较大,但是鸡TIFA蛋白仍能与TRAF6蛋白发生相互作用[17],说明发生相互作用的关键氨基酸位点应该是不同物种TIFA蛋白中的保守氨基酸位点,如S177、P178、E180、D182和E183。因此,TIFA蛋白中与TRAF6蛋白相互作用的关键氨基酸位点还有待进一步验证。
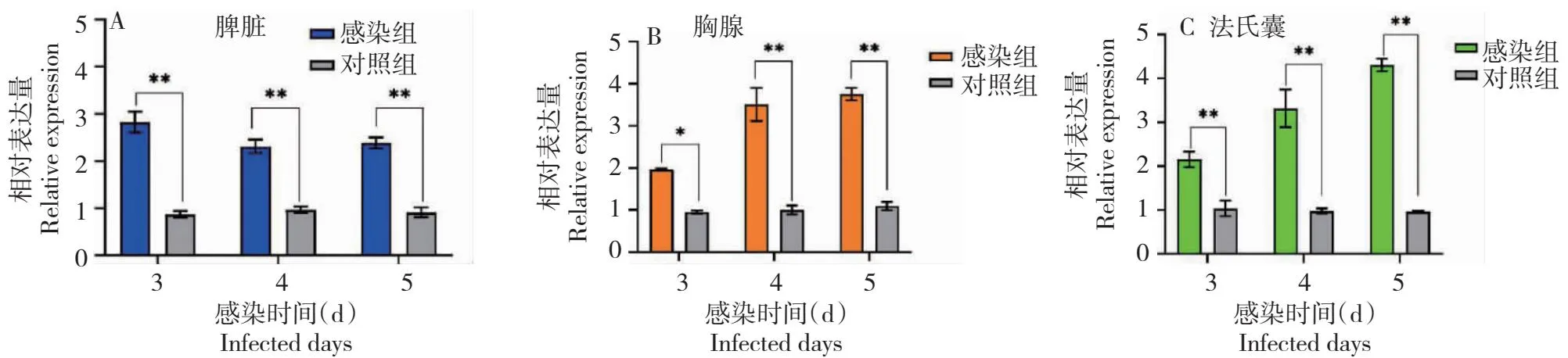
图10 鸡TRAF6基因在NDV感染组不同免疫器官中的表达水平Fig.10 The expression level of chicken TRAF6 gene in different immune organs of NDV infection group
目前,有研究报道TRAF6基因在人[25]、小鼠[26]和鸭[27]的免疫细胞中高表达,而关于TIFA和TRAF6基因在人或动物免疫器官中的表达特征报道较少,仅发现TIFA基因在小鼠脾脏中高表达,而在其他组织呈中度表达[1]。有研究表明,TIFA基因在人造血干细胞(HSC)和髓系祖细胞中的表达较多,在B淋巴细胞中表达量高[28],而脾脏是B淋巴细胞正常发育至关重要的场所[29],因此,结果暗示TIFA基因在人脾脏中同样表达丰富。在家禽研究方面,赵采芹等[10]发现,TRAF6和TIFA基因在贵州黄鸡不同发育阶段的多个组织中均有不同程度表达,其中以内脏组织的相对表达量高,但是缺少相关免疫器官的表达结果。本研究发现,鸡TIFA和TRAF6基因在1~6月龄的白来航鸡3个免疫器官中均有表达,其在脾脏中表达量最高,其次是胸腺和法氏囊,与骆磊等[14,27]的研究结果一致。对鸡TIFA和TRAF6基因在免疫器官中的表达趋势进行分析发现,二者的表达变化趋势略有不同,其中,在1~5月龄时的表达趋势相同,均在2月龄时表达水平下降,但在4月龄时表达水平又上升。然而,从1~6月龄整体表达变化看,鸡TIFA基因表达的变化趋势呈倒“N”型,而鸡TRAF6基因表达的变化趋势呈“W”型。有研究证实,在免疫系统中,TRAF6对B细胞、T细胞和骨髓细胞(包括巨噬细胞、树突状细胞和破骨细胞)的活化,以及胸腺和继发性淋巴组织等免疫细胞或器官的发育十分重要[30]。TIFA是一种在造血系统中普遍表达的细胞质蛋白,且主要于淋巴细胞中表达[31],而脾脏和胸腺作为造血器官之一,TIFA的高表达是否对其造血功能有影响还未见报道。因此,TIFA和TRAF6基因在鸡免疫器官中的表达变化差异与免疫器官发育及功能之间的关系还有待探究。
本研究结果表明,鸡感染NDV后3~5 d感染组鸡免疫器官中TIFA和TRAF6基因的表达水平均显著高于对照。有研究报道,通过人工感染鸡白痢、肠炎沙门氏菌及Poly (I:C)等病原刺激狼山鸡后,核苷酸结合寡聚化结构域样受体5(NLR family CARD domain containing 5,NLRC5)相关通路中基因在狼山鸡免疫器官中均显著上调表达,且TRAF6和NF-κB基因在感染组胸腺中的表达显著高于对照[32]。另外,骆磊[14]研究证实,NDV感染10日龄SPF鸡后,TRAF6基因及其下游细胞因子基因在胸腺、脾脏和法氏囊中均显著上调。Jin等[33]发现,在鸡感染NDV后,在体外和体内均能检测到TRAF6基因的表达水平增加。此外,Guo等[34]研究发现,TRAF6基因在扬州大白鹅脾脏中广泛表达,且在感染沙门氏菌后TRAF6基因和下游炎性细胞因子表达上调。本研究结果与上述发现一致,表明,TIFA和TRAF6共同介导的细胞因子产生对抵抗细菌或病毒感染具有重要作用。但是值得注意的是,如果机体天然免疫应答反应过于强烈会诱发“细胞因子风暴”,造成更严重的免疫器官损伤,进而促进病毒的复制效率,这是某些病毒致病性增强的原因[35-36]。TIFA通过触发NF-κB介导的胞质监视途径感知细菌中间代谢副产物[37],将免疫细胞募集到细菌感染部位,因而TIFA的高表达也反映出机体免疫应答情况。本研究发现,在鸡感染NDV后第3~5天,TIFA和TRAF6基因在鸡免疫器官中持续保持高表达水平,在此情况下可能会造成NF-κB信号通路持续激活,从而产生更多的炎性细胞因子,可能是当前NDV强毒株造成鸡免疫器官严重损伤的一个重要原因[38-39]。另外,在NDV感染后,TLR2和TLR4的表达量会增加,从而激活MyD88/TRAF6/NF-κB 信号转导通路协同调节宿主防御病毒[40]。同时,NDV具有病毒免疫逃避的特性,如NDV M蛋白以未知的方式降低TIFA和IRAK4的表达,导致促炎性细胞因子的产生减少,从而抵消细胞炎症反应[41],促进NDV在体内的快速增殖并增强其致病性。由于TIFA蛋白是TRAF6/NF-κB通路的上游接头分子,但是目前关于鸡TIFA的生物学功能研究仍相对薄弱,并且其在家禽相关病毒复制和致病性中的作用研究也相对较少。因此,本研究后续将开展与鸡TIFA蛋白相互作用细胞蛋白的筛选和功能分析,并深入解析TIFA和TRFA6相互作用调控NDV复制的作用机制。
4 结 论
鸡TIFA和TRAF6蛋白在禽类中的氨基酸同源性和结构域保守性高于人和哺乳动物,二者在不同月龄鸡免疫器官中均有表达,且以脾脏中的表达量最高;在NDV感染鸡的免疫器官中表达水平显著高于对照,二者参与的先天性免疫应答可能在NDV复制中具有重要作用。
