微晶纤维素含量对板栗浆悬浊液稳定性的影响
2023-03-12周小悦姚丽娜陶文初贲东旭赵芳芳薛玉清李言郡舒志成
周小悦,姚丽娜,陶文初,贲东旭,赵芳芳,薛玉清,李言郡,舒志成
(杭州娃哈哈集团有限公司食品科学研究院,浙江杭州 310018)
板栗,俗称栗子,以其独特的风味、品质和营养而享誉全球[1]。板栗的主要产区及消费区域分布在亚洲、美国和欧洲,其中,中国是最大的产地之一[2−3]。板栗果仁中碳水化合物含量为62%~70.1%、蛋白质7.2%~10.7%、脂类5%~7.4%。此外,板栗中还含有八种氨基酸及丰富的胡萝卜素、硫胺素、核黄素、烟酸、泛酸、生物素、生育酚等多种维生素,富含Ca、Fe、P、K、Mg、Zn等矿质元素[4]。板栗不仅食用价值高,还有健脾补肾之功能,并可预防和治疗高血压、骨质疏松,提高免疫力,因此有“干果之王”的美称[5−6]。
以板栗制作饮料产品有助于拓展板栗资源的应用范围,对延伸板栗产业链具有极其重要的促进意义[7]。但其高淀粉含量,且天然板栗淀粉存在的水溶性差、粘度高、易凝结等诸多缺陷,直接影响了板栗饮料的稳定性[8]。吴超平[9]研究了4种乳化剂(蔗糖酯、单甘酯、聚甘油酯、PGA)和4种亲水性胶体(黄原胶、CMC-Na、卡拉胶、瓜尔豆胶)对板栗浊汁类饮料的稳定性作用,以持水力、风味和静置1个月的状态作为考察指标,确定了CMC-Na、卡拉胶、聚甘油酯和PGA的较优复配方案。万景瑞等[10]研究了黄原胶、羧甲基纤维素钠、单硬脂肪酸甘油酯、脂肪酸蔗糖酯、海藻酸丙二醇酯等稳定剂和乳化剂对新型板栗饮料稳定性的影响,但仅凭离心沉淀率大小作为稳定性评定的唯一标准略显片面,缺乏对稳定体系的全面评估。由于板栗浆浓度的差异及加工过程中的不定因素,稳定性问题得不到根本的解决,需要进一步研究和开发不同的稳定体系来提高板栗饮料的稳定性。本文以MCC复配琼脂构建悬浮体系,通过粒径、粘度、流变、Turbiscan稳定性分析,探讨该体系中MCC含量对板栗浆悬浊液的稳定性影响。
1 材料与方法
1.1 材料与仪器
微晶纤维素GP 3282 杜邦(上海)实业有限公司;琼脂Q50 上海琼泽生物科技有限公司;板栗酱烟台加宝食品有限公司;椰子油 中粮集团有限公司;单硬脂酸甘油酯、双乙酰酒石酸单双甘油酯(DATEM) 丹尼斯克(中国)有限公司;小苏打 桐柏博源新型化工有限公司;乳酸链球菌素(Nissin)洛阳奇泓生物科技有限公司;中温α-淀粉酶BAN 480L(标准活性为480 KNU/g) 诺维信(中国)生物技术有限公司。
高剪切混合乳化分散机L5M Silverson公司;水浴锅DK-S24 上海三发科学仪器有限公司;均质机NS2002H 德国GEA公司;高压灭菌锅Sanyo 3020 日本三洋集团;MCR302流变仪 奥地利安东帕公司;Zen 2600 Zeta电位仪、Mastersizer 2000激光粒度分析仪 英国马尔文仪器公司;Turbiscan Lab分散稳定性分析仪 法国Formulaction公司。
1.2 实验方法
1.2.1 酶解板栗浓浆的制备 按3 L、10 g/L板栗悬浊液目标样品准备,称取30 g板栗酱,加入120 g热水(70 ℃左右即可)中,5000 r/min剪切10 min,经25/5 MPa均质后,加入0.01 g的α-淀粉酶搅拌均匀,置于70 ℃的水浴锅中酶解20 min,酶解后的板栗浆液经过沸水浴5 min完成灭酶,留存备用。酶解参照万景瑞等[10]的方法。
1.2.2 乳化液制备 按3 L目标样品准备:称取2.7 g单甘酯、4.2 g DATEM和0.9 g小苏打,加入500 mL 70 ℃的热水,3500 r/min剪切5 min,加入45 g椰子油,继续剪切15 min,经25/5 MPa均质后,留存备用。
1.2.3 板栗乳液制备 将酶解板栗浆液和乳化液混合,加入1.5 g Nissin,3500 r/min剪切5 min后,均分成6份备用。
1.2.4 胶体分散液制备 按琼脂含量0.4 g/L,MCC含量分别为2.0、2.2、2.4、2.8、3.0 g/L的目标样品各500 mL制备胶体分散液。为排除溶胶过程产生的差异,分别配制MCC分散液和琼脂分散液,并按用量比例称取、混合。
称取15 g MCC,加入735 g 80 ℃热水,5000 r/min剪切分散20 min,配制为2%浓度MCC分散液,根据不同方案用量分别称取50、55、60、70、75 g各1份备用。
称取1.2 g琼脂,加入200 g 80 ℃热水中,5000r/min剪切分散20 min后均匀分成6份备用。
1.2.5 板栗浆悬浊液的制备及保温实验 分别取1份板栗乳液、1份MCC分散液、1份琼脂分散液,混合并定容到500 mL,3500 r/min剪切5 min后,灌入血清瓶中,高压灭菌锅125 ℃杀菌5 min,得到目标样品5份,其中板栗酱含量均为10 g/L,琼脂含量均为0.4 g/L,MCC含量分别为2.0、2.2、2.4、2.8、3.0 g/L,其余配料含量均一致。样品用于检测及37 ℃保温和检测。其中,初始样品进行粒径、Zeta电位、粘度、流变和Turbiscan稳定性检测,37 ℃保温1周后样品进行粒径和粘度检测,37 ℃保温2周后进行粒径检测。
1.2.6 指标测定
1.2.6.1 粒径检测 采用激光粒度分析仪对样品的粒径进行检测,检测条件为:温度25 ℃,泵速2200 r/min,颗粒折射率为1.52,颗粒吸收率为0.1,分散剂为水,分散剂折射率为2.3。
1.2.6.2 Zeta电位检测 采用Zeta电位仪进行电位分析。吸取样品加于样品池中,设置测试温度为25 ℃,读取Zeta电位值。
1.2.6.3 粘度及流变检测 采用流变仪测定乳液的粘度及储能模量G'和损耗模量G''。取适量样品放置于样品池,使其均匀分布,以防产生气泡,在温度为25 ℃条件下,设置剪切速率从0.1到100 rad/min,测定乳液的粘度;然后取适量样品放置在样品池中,在25 ℃条件下扫描样品在0.05~10 Hz频率范围的储能模量G'和损耗模量G''。
1.2.6.4 Turbiscan稳定性检测 采用分散稳定性分析仪,测量各样品在不同时间的透射光和背散射光强度,分析体系中粒子的运动以及得到各样品体系稳定性指数(TurbiScan stability index,TSI)的变化。仪器参数设置:温度为25±0.5 ℃,连续性扫描程序为每1 h扫描一次,连续扫描24 h。
1.3 数据处理
所有检测数据为重复三次取平均值所得结果,采用Origin 8.5进行数据处理、方差分析和制图,P<0.05为显著性差异。
2 结果与分析
2.1 板栗浆悬浊液的粒径分析
由图1可知,初始悬浊液平均粒径随着MCC含量的增加而减小,当MCC含量从2.0 g/L增加到3.0 g/L时,体系粒径(d(0.9))从37.35 μm降低到20.17 μm;加速保温实验(37 ℃)1周及2周后,不同MCC用量的悬浊液粒径均有所增大,说明体系内蛋白质、淀粉分子间发生了不同程度的聚集,使粒径增大[11]。但粒径随着MCC含量的增加先增大再减小,是因为MCC在溶液中能够通过氢键与水形成三维网络结构,可有效防止体系中颗粒物的聚集。MCC含量较低时,网络结构无法形成,随着MCC含量升高,体系形成的网络结构逐渐增强,体系内分子间保持相对稳定而不易聚集[12]。
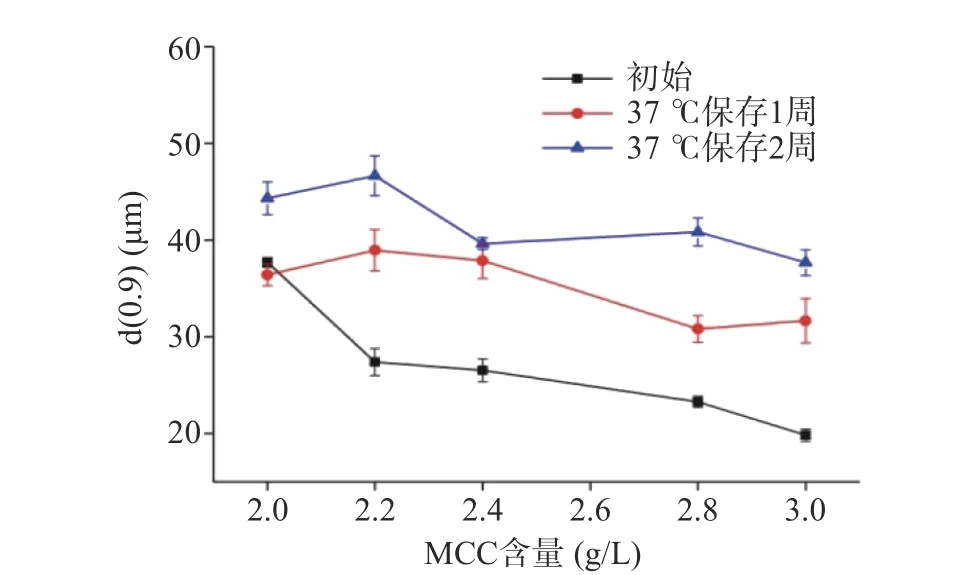
图1 板栗浆悬浊液平均粒径(d(0.9))Fig.1 Particle size distribution (d(0.9)) of chestnut suspension
在37 ℃保温1周后,MCC用量为2.0 g/L时,粒径无显著变化(P>0.05),MCC用量在2.2~2.8 g/L范围内时,粒径均增大约40%,当MCC用量达到3.0 g/L时,粒径增大达60%以上,此时MCC用量为2.8 g/L时体系粒径最小,为32.18 μm。在37 ℃环境下继续保温至2周后,MCC用量为2.0 g/L时,体系粒径也有较明显的增大(约20%),在MCC用量为2.2~3.0 g/L时体系粒径也有不同程度的增大,此时MCC用量为2.4 g/L时体系粒径最小,为40.13 μm。相比于37 ℃保温1周后的体系粒径,结果表明,MCC用量为2.8 g/L时粒径增大最明显(约26%),而MCC用量为2.4 g/L时体系粒径则基本保持不变。
上述结果表明,在短时间内MCC用量小,体系粒径变化较小,但随着时间的增加,MCC用量在2.4 g/L时体系粒径更加稳定。综合体系粒径大小以及粒径在加速保温过程中的稳定性,从斯托克斯方程来看,当MCC用量为2.4 g/L时,MCC-琼脂复合胶体对板栗浆体系的悬浮稳定性最好。
2.2 板栗浆悬浊液的ζ电位分析
Zeta电位常用作讨论体系稳定性的依据,当Zeta电位的绝对值较小时,体系内颗粒之间的排斥力较少,颗粒间容易絮凝并形成沉淀[13]。一般认为,当ζ电位的绝对值超过30 mV时,系统是稳定的[14]。从图2检测结果来看MCC用量在2.0~3.0 g/L范围内时,板栗浆悬浊液ζ电位先增大后减小,但其绝对值均小于30 mV,体系存在不稳定风险。当MCC用量为2.4 g/L时,ζ电位达到最大值(−25.6 mV),悬浮颗粒间的静电斥力最强,可阻止颗粒聚集,体系稳定性相对最强[15−16]。
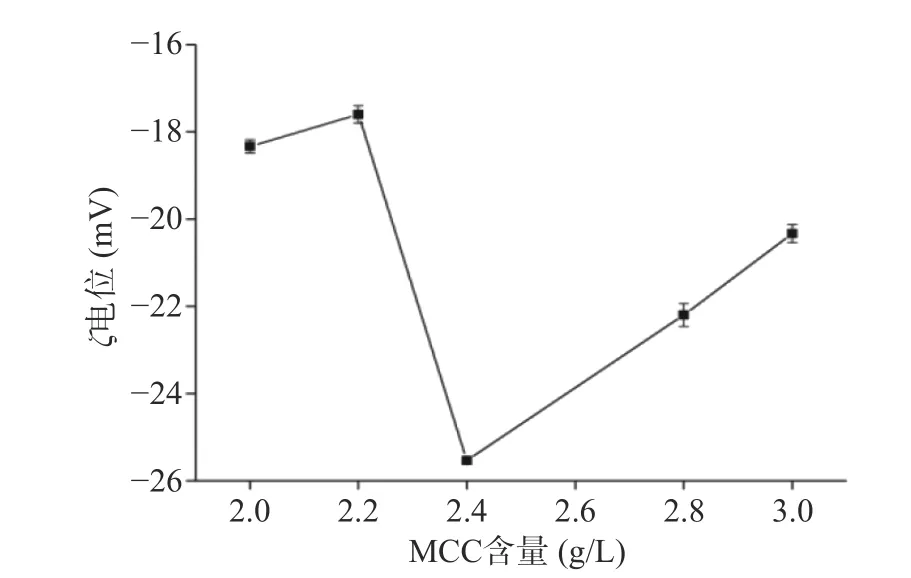
图2 板栗浆悬浊液的ζ电位Fig.2 ζ potential of chestnut suspension
2.3 板栗浆悬浊液的流变学特性
流变学特征是表征体系形态和稳定特性的重要参数,体系粘度高可降低微粒的沉降速率,提高产品的稳定性[17]。从图3a可以看出,不同MCC用量条件下,板栗浆悬浊液杀菌前表观粘度随剪切速率的增大而减小,呈现剪切变稀的现象,说明各悬浊液都属于假塑性非牛顿流体[18]。当剪切速率大于10 min–1,体系粘度不随剪切速率的变化而变化。体系粘度随着MCC用量的增加先增大后减小,MCC含量为2.0 g/L时粘度最小,2.8 g/L时粘度最大。造成该结果的原因,一方面是MCC的增加所产生的位阻效应阻碍了体系中琼脂分子以及板栗淀粉链等的流动,使体系粘度增大[19]。另一方面是MCC分子间以及MCC与板栗淀粉、琼脂分子间通过氢键相互作用形成网络结构,体系结构性增强、流动性减弱,表现为表观粘度增大[20−21]。而当MCC含量增加至3.0 g/L粘度下降的原因可能是过量的MCC包裹板栗淀粉颗粒,使直链淀粉溶出减少[22]。
板栗浆悬浊液杀菌后及经37 ℃保温1周后,粘度随剪切速率及MCC用量变化的规律与最初基本相同,但不同MCC用量下的体系粘度均有不同程度的降低或增加(见图3b~图3d)。
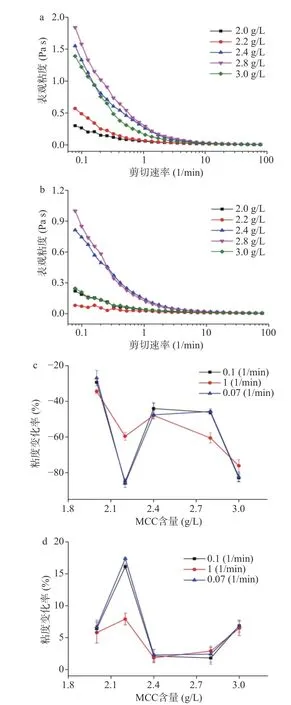
图3 不同剪切速率下板栗浆悬浊液粘度的变化Fig.3 Variation of the viscosity of chestnut suspension under different shear rates
从图3b可以看出,MCC含量为2.2 g/L时体系粘度最小,MCC含量在2.8 g/L时体系粘度最大。但随着剪切速率增大,MCC含量为2.8 g/L时的体系粘度下降速率高于MCC含量为3.0 g/L,其抗剪切能力略低于MCC含量为3.0 g/L的体系。对比杀菌前后粘度,MCC含量为2.0 g/L,体系粘度变化率在0.07、0.1以及1 min–1剪切速率时都最小,其次是MCC含量为2.4 g/L的体系(图3c),表明体系结构性相对较强,耐高温环境破坏能力更强。而MCC含量在2.2及3.0 g/L时,体系粘度在杀菌后显著降低(P<0.05),表明这两种MCC含量下体系不耐高温,在通常的乳品饮料杀菌过程中体系结构被破坏程度较高。
加速破坏试验可以在较短的时间了解食品饮料的物理、化学和生物学方面的变化,从而预估体系在长时间内的稳定性。板栗浆悬浊液经37 ℃保温1周后体系粘度变化如图3d所示。MCC含量为2.2 g/L时,体系粘度显著增大(P<0.05),体系中大分子如板栗淀粉等可能与胶体以及胶体与胶体之间发生聚集,导致体系出现弱凝胶的现象。MCC含量为2.4和2.8 g/L时,体系粘度变化率最低,表现出相对较好的稳定性。
从粘度试验结果可以看出,当MCC含量为2.4和2.8 g/L时,板栗浆悬浊液体系具有较高的粘度,对于体系内的悬浮颗粒等可以起到良好的悬浮稳定作用,且体系内胶体网络结构性较强,耐破坏性较好。
动态流变学特性用于描述板栗悬浊液的粘弹性。储能模量G'代表样品弹性性能的大小,而损耗模量G''代表粘性性能的大小[23]。从图4中可以看出,G''随着频率的增大都逐渐增大,而G'随着频率的变化则根据MCC用量不同出现不同的趋势。
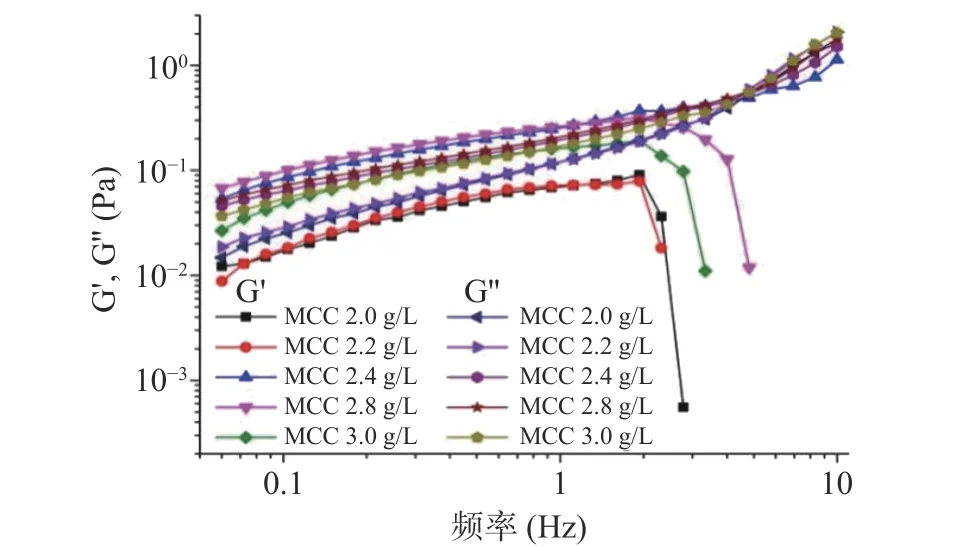
图4 板栗浆悬浊液储能模量(G')和损耗模量(G")曲线Fig.4 Curve of energy storage modulus (G') and loss modulus(G") of chestnut suspension
MCC含量为2.0和2.2 g/L时,G''始终大于G',体系主要表现出粘性行为[24]。MCC含量为2.4和2.8 g/L时,G'在中低频段大于G'',在高频段则小于G'',两者出现交叉点,表明体系发生了从弹性行为到粘性行为的流变转变[25]。MCC含量为3.0 g/L时,在 中 低 频 段(0.05~1 Hz)G''与G'无 显 著 性 差 异(P>0.05),而在高频段G''则显著大于G'(P<0.05)。
G'与G''大小随MCC含量的变化而有所不同。在中低频段(0.05~2 Hz),G'与G''随MCC浓度的增加先增大后减小,当体系中MCC含量高于2.2 g/L时,体系G'显著增大(P<0.05),而后随着MCC继续增大,G'先增大后减小,可能MCC的加入抑制了板栗淀粉与琼脂分子所形成悬浊液的弹性性能。研究表明[26]直链淀粉之间的相互作用是淀粉凝胶弹性性能的基础,而当MCC浓度足够高时,MCC可将板栗淀粉颗粒包裹,抑制板栗淀粉中直链淀粉释放在溶液中。另一方面,MCC与板栗淀粉链之间形成氢键,一定程度上减少了板栗淀粉链间的相互作用,从而抑制了淀粉与琼脂形成弹性溶胶,体系整体弹性性能下降。
研究表明,溶液具有弹性是因为体系内部形成了由大量的分子间或颗粒间键合力组成的网络结构,从而限制了体积元位置的变化,使得溶液具有固体的弹性特征[27]。因此,图4中G'随着MCC添加量的增多而增大,表明体系内MCC、板栗淀粉分子以及琼脂分子链间缠结点增多,网络结构性增强。在较低频率的应变作用下,分子链间缠结点破坏基本可以重建,其网络结构可以保持不变,G'有所增大。而在较高频率的应变作用下,分子链缠结点或网络结构被破坏的速度大于其重建的速度,导致体系弹性急剧减小(G'出现拐点)直至失去弹性,或体系出现从弹性行为到粘性行为的流变转变(G'与G''出现交点)。当MCC含量为2.0、2.2、2.8和3.0 g/L时,G'均出现拐点,最终失去弹性,体系网络结构崩塌。当MCC含量为2.4 g/L时,G'未出现拐点,但在4.01 Hz处体系出现从弹性行为到粘性行为的转变,体系部分网络结构被破坏。
对比MCC含量为2.4~3.0 g/L范围内体系G'与G''交点处的频率大小(表1),发现随着MCC用量增加,交点频率向低频偏移,表明体系结构性逐渐减弱,抗破坏能力下降,颗粒悬浮稳定性下降。从饮料体系的货架期稳定性方面考虑,MCC用量为2.4 g/L可以使体系具有良好的悬浮稳定性。
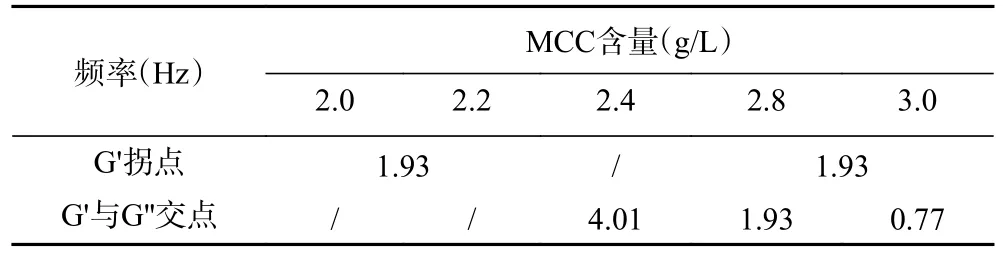
表1 体系G'出现拐点以及与G"出现交点时对应的频率Table 1 Frequency of the inflection point of G' and the intersection point of G' and G"
2.4 板栗浆悬浊液的背散射光光谱分析
图5a~图5e为不同MCC含量的样品经扫描24 h后背散射光光强变化(ΔBS)沿测试室高度的曲线。对比不同时间的ΔBS曲线,各样品中体系整体颗粒粒径都有所增大,出现较低程度的颗粒聚集,其中MCC含量为2.4 g/L的体系颗粒发生聚集的趋势最小,而MCC含量为2.8及3.0 g/L的体系颗粒发生聚集的趋势则较大,该结果与粒径检测结果一致。MCC含量为2.0 g/L时,样品顶部ΔBS随时间逐渐减小(绝对值逐渐增大),而底部ΔBS变化较小,表明体系颗粒虽然出现了聚集,并有下沉的趋势,但沉降速率较低。而当MCC含量开始增加到2.4 g/L时,样品底部ΔBS随时间先增大后减小,体系开始出现上浮及沉淀现象。当MCC继续增加至3.0 g/L后,样品底部ΔBS变化较小,但顶部ΔBS随时间逐渐变化较明显,体系出现较为明显的上浮现象[28]。
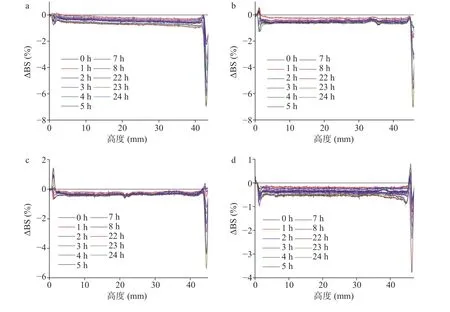
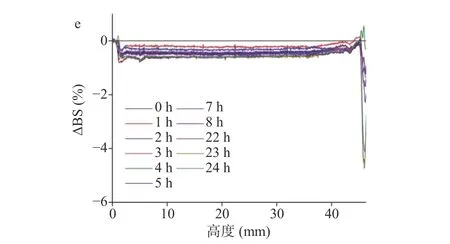
图5 MCC含量对板栗浆悬浊液背散射光强的影响Fig.5 Influence of MCC concentrations on the backscattering of chestnut suspension
TSI为体系稳定性指数,可量化衡量分散体系的不稳定性。一般而言,TSI值越大,体系稳定性越差,反之TSI值越小,体系稳定性则相对越好[29]。在TSI-时间曲线中,斜率越低,则样品的稳定性越好,反之则越差[30]。从图6a中结果可知,MCC含量为2.0 g/L时,体系TSI值最小,在检测时间内TSI值随着时间增加不断增大。MCC含量为2.2和3.0 g/L的体系在前期TSI值相当且较大,在10 h后两者TSI值都趋于稳定,但MCC含量为2.2 g/L的体系更快达到平稳,此时TSI值也相对更小。MCC含量为2.8 g/L的体系在前期的TSI值和2.4 g/L的体系相当,随后则很快趋于稳定,而MCC含量为2.4 g/L的体系TSI增大速率虽然有所降低,但仍然保持持续增大的趋势,在检测时间内未达到平稳值。如图6b,样品经37 ℃保温1周后的TSI值都有所增大,且曲线趋势也有所变化。在所检测时间范围内,只有MCC含量为3.0 g/L的体系TSI值在一定时间后会趋于稳定,而其他样品TSI值都随时间的增加而增大。其中MCC含量为2.4 g/L的体系TSI曲线斜率最小,其次是2.0及2.2 g/L的体系,3.0 g/L的体系TSI曲线斜率最大。
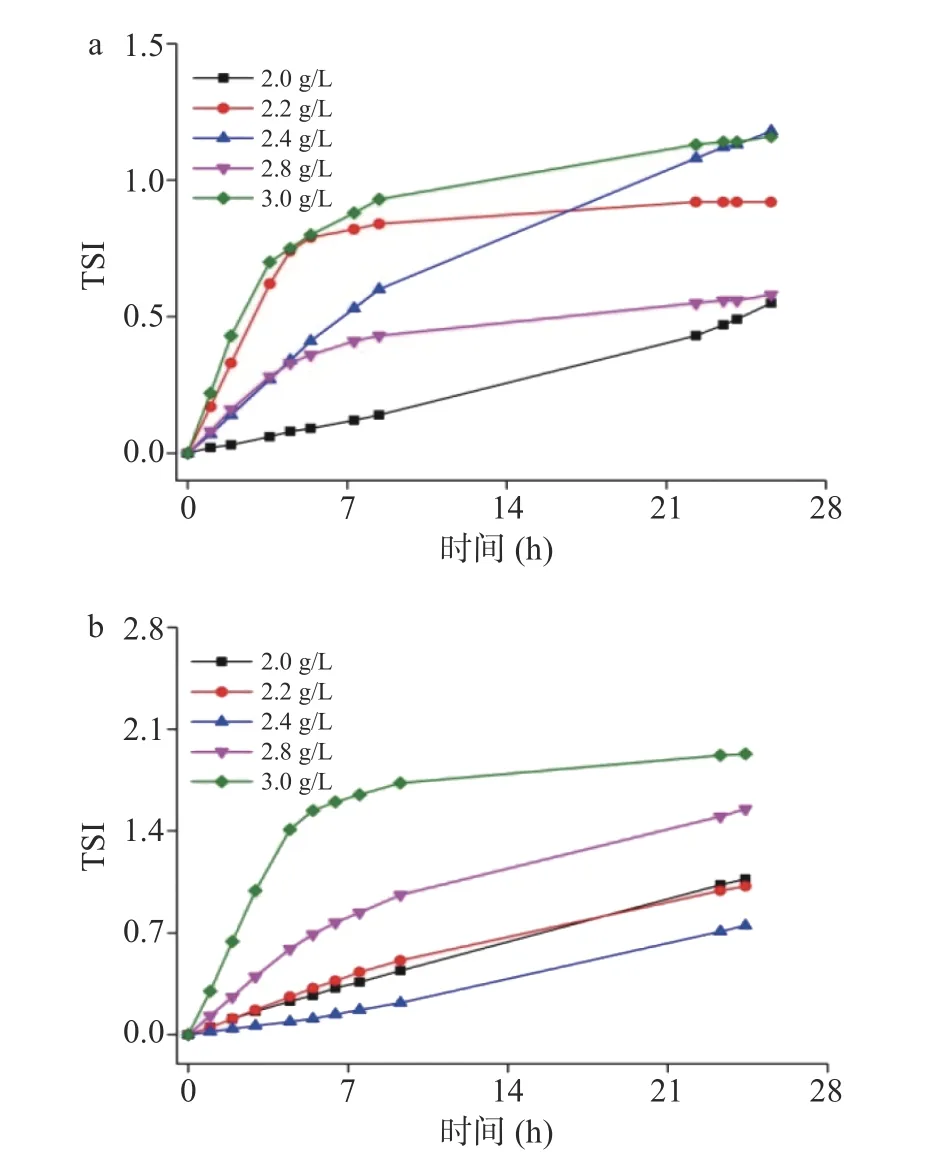
图6 MCC含量对板栗浆悬浊液TSI值变化的影响Fig.6 Influence of MCC concentrations on the TSI value of chestnut suspension
综合分析,虽然MCC含量为2.0 g/L的体系的TSI值在检测时间范围内最小,但由于持续保持增长,其长期稳定性相对于MCC含量为2.8 g/L的体系更差,且经过加速保温实验后其稳定性相对于2.4 g/L的体系更差。考虑到体系的长期稳定性,MCC含量为2.4或2.8 g/L时更好。
3 结论
本文通过粒径、粘度、流变、Turbiscan稳定性分析等多种手段对比了MCC-琼脂悬浮体系中,琼脂含量固定为0.4 g/L,MCC含量在2.0、2.2、2.4、2.8和3.0 g/L时对板栗浆悬浊液稳定性的影响。当MCC在2.4 g/L时,体系具有适中大小的平均粒径、最大的ζ电位绝对值、较高的表观粘度和较小的TSI值,且流变学特性表现出较好的抗破坏能力。经保温加速实验表明,MCC在2.4 g/L时体系的粒径和粘度变化率较低,TSI曲线斜率最小,推测其在长期储存过程中可能表现出较好的稳定性。综上所述,将10 g/L板栗酱含量的配方作为目标,琼脂含量为0.4 g/L时,以2.4 g/L的MCC复配构建MCC-琼脂悬浮体系,可对板栗浆悬浊液起到较好的稳定作用。
