灵仙新苷对膝骨关节炎软骨细胞凋亡和自噬的影响
2023-03-11李纳平涂杜鑫邝高艳刘鑫谭旭仪曾凡卢敏
李纳平 ,涂杜鑫 ,邝高艳 ,刘鑫 ,谭旭仪 ,曾凡 ,卢敏
1.湖南中医药大学第一附属医院,湖南 长沙 410011; 2.湖南中医药大学,湖南 长沙 410208;3.湖南中医药研究院附属医院,湖南 长沙 410006
骨关节炎(osteoarthritis,OA)是中老年人群常见的慢性退行性关节疾病,其病理特征主要包括关节软骨退变、滑膜炎症、软骨下骨硬化、大量骨赘生成等[1-2]。在OA好发部位中,膝骨关节炎(knee osteoarthritis,KOA)发病率最高,其次是手关节炎和髋关节炎,我国中老年人群KOA发病率为8.1%,且有不断升高趋势[3-4]。
关节软骨退变被认为是KOA发病最关键的机制,软骨细胞通过维持细胞外基质(ECM)合成与降解的动态平衡,从而在润滑关节、维持关节软骨机械形态方面发挥重要作用[5],软骨细胞凋亡会打破关节软骨合成与降解的稳态平衡。自噬是细胞维持内稳态的关键机制,细胞通过自噬降解和再利用细胞中衰老的细胞器和大分子物质,从而避免直接死亡。研究发现,软骨细胞自噬和KOA发生密切相关,通过激活自噬可以减少软骨细胞凋亡,延缓关节软骨退变[6-7]。中医药治疗KOA具有多途径、多靶点的特点,且不良反应少,能有效缓解KOA症状,延缓软骨退变[8]。
中药威灵仙为毛茛科植物威灵仙Clematis chinensisOsbeck、棉团铁线莲Clematis hexapetalaPall.或东北铁线莲Clematis manshuricaRupr.的干燥根和根茎,具有祛风湿、通经络、止痹痛作用[9],其三萜皂苷类成分在治疗类风湿关节炎和KOA方面具有一定疗效[10],能通过抑制软骨细胞凋亡[11],维持ECM稳定[12],从而延缓KOA关节软骨退变。灵仙新苷(clematichinenoside AR,C-AR)是从威灵仙中提取的一种三萜皂苷,具有抗炎镇痛作用,能将关节炎大鼠血清和尿液24种类风湿关节炎相关标志物调至正常水平,缓解关节炎症状[13],并可通过激活自噬减轻氧化型低密度脂蛋白诱导的RAW264.7细胞炎症[14]。但其能否治疗KOA目前尚无报道。基于此,本研究观察C-AR对KOA软骨细胞凋亡和自噬的影响,为KOA治疗提供新思路。
1 材料与方法
1.1 样本来源
KOA关节软骨样本来自湖南中医药大学第一附属医院四肢关节科2021年1月-2021年12月接受全膝关节置换术的KOA患者。共14名患者,其中女性11名,男性3名,平均年龄(69.71±6.28)岁。本研究经湖南中医药大学第一附属医院伦理审查委员会批准(HNLL-2021-006-01),并获得所有患者书面知情同意。
1.2 主要试剂与仪器
灵仙新苷,货号L-151,成都瑞思芬;DEME/F12、胎牛血清(FBS),货号分别为11330032、10099,美国Gibco公司;活性氧(ROS)试剂盒、胰蛋白酶,货号分别为S0033S、C0201,上海碧云天;Ⅱ型胶原酶,货号9001-12-1,美国Sigma公司;白细胞介素(IL)-1β,货号200-01B,美国Peprotech公司;IL-6、IL-8 ELISA检测试剂盒,货号分别为CSBE04638h、CSB-E04641h,武汉华美生物工程;BCA蛋白定量试剂盒,货号10030908,长沙艾碧维;PBS、RIPA裂解液,货号分别为G4202、G2002,武汉赛维尔;CCK8试剂盒,货号NU679,日本同仁;Trizol总RNA提取试剂,货号15596026,美国Thermo;HiFiScript cDNA Synthesis Kit,货号CW2569,北京康为生物;甲苯胺蓝染液,货号BL539A,北京索莱宝;DAPI染色液,货号C02-04002,北京Bioss;Ⅱ型胶原一抗,货号AF0135,美国Affinity Biosciences;Bax、Caspase-3、Beclin1、LC3B一抗,货号分别为50599-2-Ig、19677-1-AP、11306-1-AP、18725-1-AP,美国Proteintech;Bcl-2一抗,货号ab59348,英国Abcam;HRP-goat anti-mouse IgG、HRP-goat antirabbit IgG,货号分别为SA00001-1、SA00001-2,美国Proteintech。SW-CJ-2FD超净工作台,江苏苏净;HERAcell2401二氧化碳培养箱,美国Thermo;XDS-3倒置生物显微镜,上海奥显;Enspire多功能酶标仪,美国Perkinelmer;LSM800激光扫描共聚焦显微镜,德国蔡司;Aria Ⅱ流式细胞仪,美国BD;MB-530酶标仪,深圳汇松。
1.3 细胞分离、培养及鉴定
参考文献[15]采用二步酶消化法提取软骨细胞,将软骨组织剪碎,加入0.25%胰蛋白酶,放入37 ℃、5%CO2细胞培养箱消化30 min,加入完全培养基(79% DMEM/F12+20% FBS+1%双抗)终止消化。将软骨组织转移至离心管,1 200 r/min离心5 min,弃上清液,加入与软骨组织等体积的0.2% Ⅱ型胶原酶,转移至无菌玻璃瓶,置于培养箱消化20 h。用70 μm细胞过滤器过滤,滤液1 200 r/min离心5 min,去除上清液,沉淀即为软骨细胞。用完全培养基重悬细胞,接种至培养瓶,3~5 d换液1次,待细胞铺满瓶底80%以上后进行传代。取P1代细胞进行甲苯胺蓝及Ⅱ型胶原免疫荧光染色鉴定。
1.4 分组、造模及给药
将软骨细胞按1×105个/孔接种至6孔板,加入完全培养基,置于培养箱培养过夜。将细胞分为对照组、模型组和C-AR组,每组4个复孔,对照组正常培养,模型组参考课题组前期方法[16]加入10 ng/mL IL-1β处理24 h,C-AR组参照文献[17]方法,先加入30 μmol/L C-AR预处理1 h,然后加入10 ng/mL IL-1β处理24 h。
1.5 CCK8法检测细胞活力
将软骨细胞以1×104个/孔接种至96孔板,使用完全培养基置于培养箱中培养24 h,然后换成无血清培养基继续培养12 h,按“1.4”项下方法分组并进行干预,吸去培养基,每孔加入100 μL CCK8工作液(用PBS按1∶9稀释),放入培养箱避光孵育2 h,酶标仪波长450 nm处检测各孔吸光度(OD值)。
1.6 ELISA检测
将细胞按“1.4”项下方法处理后,吸去培养基,加入预冷PBS洗涤细胞,将细胞转移至离心管中,加入PBS,超声破碎细胞,4 ℃、3 000 r/min离心5 min,取上清液,根据ELISA试剂盒说明书检测细胞IL-6和IL-8含量。
1.7 流式细胞仪检测活性氧含量
按“1.4”项下方法处理细胞后,PBS洗涤细胞2次,加入10 μmol/L DCFH-DA,37 ℃孵育20 min,无血清培养基洗涤细胞3次,收集细胞,使用流式细胞仪检测ROS含量。
1.8 流式细胞仪检测细胞凋亡率
按“1.4”项下方法处理细胞后,胰蛋白酶消化细胞,将细胞转移至离心管,2 000 r/min离心5 min,沉淀用PBS洗涤2次,每次洗涤后2 000 r/min离心5 min,向样品中加入结合缓冲液490 μL、Annexin V-FITC 5 μL和碘化丙啶5 μL,室温避光反应10 min,流式细胞仪检测细胞凋亡率。
1.9 Western blot检测
将细胞按“1.4”项下方法处理后,吸去培养基,加入RIPA裂解液提取蛋白,使用BCA蛋白试剂盒测定蛋白浓度。蛋白进行琼脂糖凝胶电泳,将蛋白转移至PVDF膜,5%脱脂奶粉室温封闭2 h,加入Bax一抗(1∶5 000)、Caspase-3一抗(1∶1 000)、Bcl-2一抗(1∶500)、Beclin1一抗(1∶1 000)、LC3B一抗(1∶500),4 ℃孵育过夜。加相应二抗,室温孵育90 min,ECL发光液显影,凝胶成像系统成像。用Image-Pro Plus 6.0软件对条带进行灰度分析,以β-actin为内参,计算蛋白相对表达量。
1.10 qRT-PCR检测
将细胞按“1.4”项下方法处理后,吸去培养基,用总RNA提取试剂盒提取总RNA,根据HiFiScript cDNA Synthesis Kit,以总RNA为模板反转录合成cDNA,SYBR法对样品进行qRT-PCR。以β-actin为内参,采用2-ΔΔCt法进行相对定量分析。引物序列见表1。

表1 各基因PCR引物序列
1.11 免疫荧光检测
将爬片放入6孔板中,以1×105个/孔接种细胞,按“1.4”项下方法处理。4%多聚甲醛固定30 min,加入0.3%Triton X-100,37 ℃通透15 min,5% BSA 37 ℃封闭10 min,加入LC3B一抗(1∶100),4 ℃孵育过夜。滴加山羊抗兔IgG(1∶100),室温避光孵育20 min,DAPI工作溶液染细胞核,抗荧光淬灭封片剂封片,荧光显微镜下观察并拍照,用Image-Pro Plus 6.0软件计算荧光强度。
1.12 统计学方法
采用Graphpad Prism 8.0软件进行统计分析。实验数据以±s表示,多组间比较采用方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 软骨细胞鉴定
初期软骨细胞呈不规则多角形或短梭形,随着培养时间延长,形态多呈长梭形,细胞核呈圆形或椭圆形,细胞间有伪足相连,形态似成纤维细胞。甲苯胺蓝染色可见胞浆呈浅蓝色,细胞核为深蓝色。Ⅱ型胶原免疫荧光染色显示,胞浆及胞膜呈绿色荧光,表明培养的细胞表达特征性Ⅱ型胶原,细胞核被DAPI复染,呈蓝色。见图1。
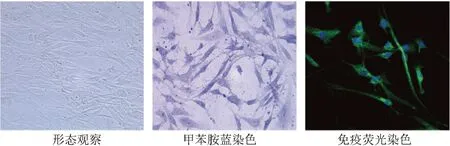
图1 人KOA软骨细胞形态观察及鉴定(×200)
2.2 灵仙新苷对软骨细胞活力的影响
与对照组比较,模型组细胞活力显著降低(P<0.01);与模型组比较,C-AR组细胞活力显著升高(P<0.05)。结果见表2。
表2 各组软骨细胞细胞活力比较(±s)
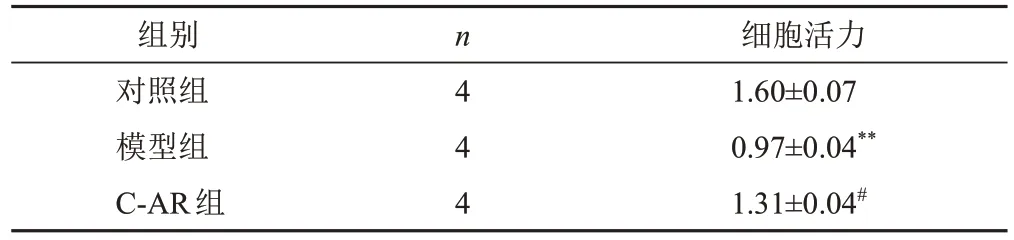
表2 各组软骨细胞细胞活力比较(±s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05
组别对照组模型组C-AR组n 4 4 4细胞活力1.60±0.07 0.97±0.04**1.31±0.04#
2.3 灵仙新苷对软骨细胞白细胞介素-6和白细胞介素-8表达的影响
与对照组比较,模型组细胞IL-6和IL-8含量显著增加(P<0.01);与模型组比较,C-AR组细胞IL-6和IL-8含量显著减少(P<0.05)。结果见表3。
表3 各组软骨细胞IL-6和IL-8含量比较(±s,pg/mL)
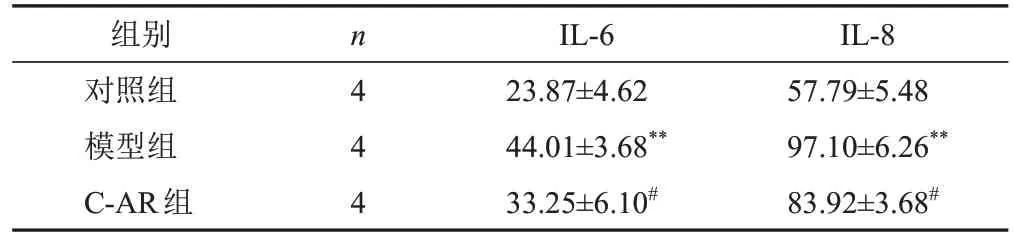
表3 各组软骨细胞IL-6和IL-8含量比较(±s,pg/mL)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05
组别对照组模型组C-AR组n4 4 4 IL-6 23.87±4.62 44.01±3.68**33.25±6.10#IL-8 57.79±5.48 97.10±6.26**83.92±3.68#
2.4 灵仙新苷对软骨细胞活性氧含量及凋亡率的影响
与对照组比较,模型组细胞ROS含量显著增加,凋亡率显著升高(P<0.01);与模型组比较,C-AR组细胞ROS含量显著减少,凋亡率显著降低(P<0.01)。结果见图2、图3、表4。
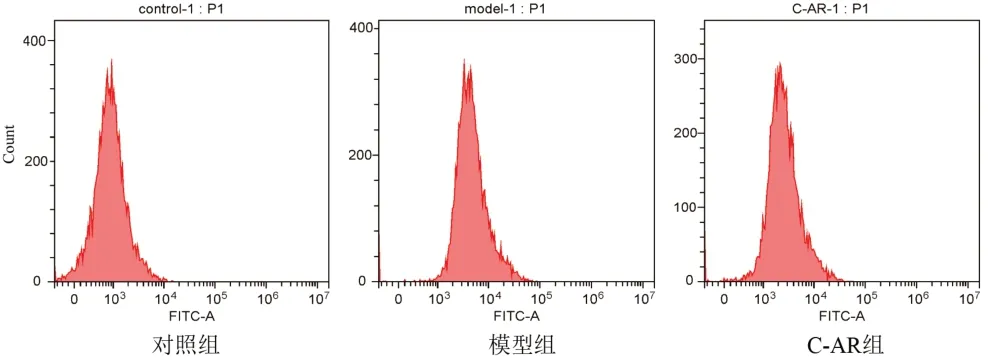
图2 各组软骨细胞ROS检测
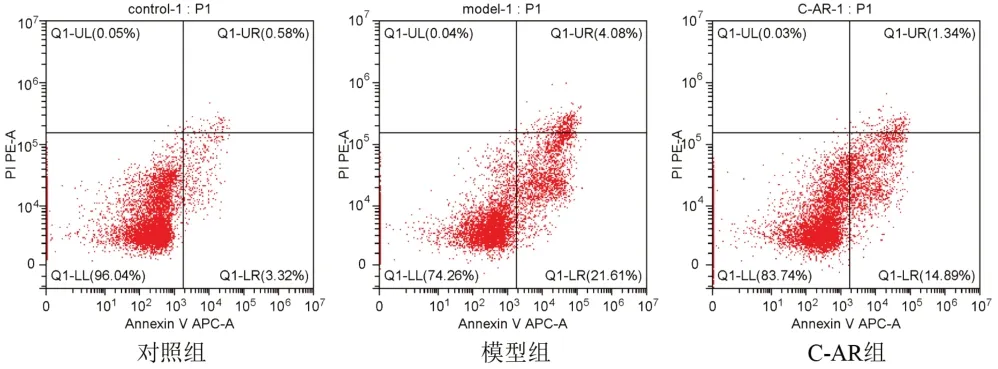
图3 各组软骨细胞凋亡率检测
表4 各组软骨细胞ROS含量和凋亡率比较(±s)
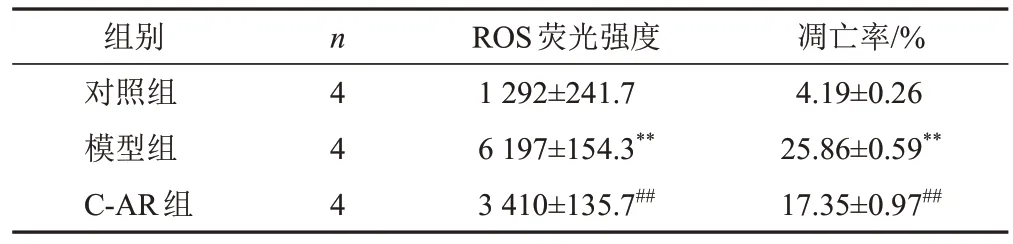
表4 各组软骨细胞ROS含量和凋亡率比较(±s)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别对照组模型组C-AR组n4 4 4 ROS荧光强度1 292±241.7 6 197±154.3**3 410±135.7##凋亡率/%4.19±0.26 25.86±0.59**17.35±0.97##
2.5 灵仙新苷对软骨细胞凋亡相关蛋白表达的影响
与对照组比较,模型组细胞Bax和Caspase-3蛋白表达显著升高(P<0.01),Bcl-2蛋白表达显著降低(P<0.01);与模型组比较,C-AR组细胞Bax和Caspase-3蛋白表达显著降低(P<0.01),Bcl-2蛋白表达显著升高(P<0.01)。结果见图4、表5。
表5 各组软骨细胞Bax、Bcl-2、Caspase-3蛋白表达比较(±s)
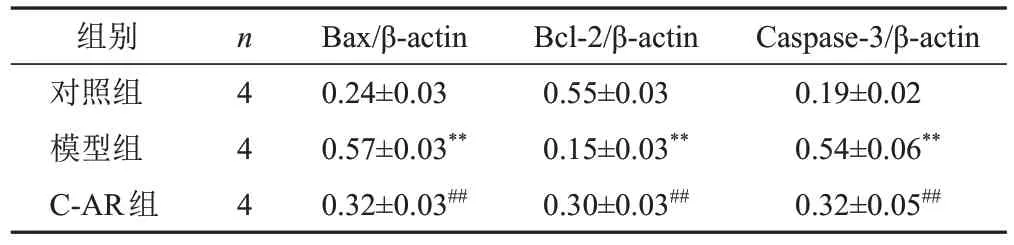
表5 各组软骨细胞Bax、Bcl-2、Caspase-3蛋白表达比较(±s)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别对照组模型组C-AR组n 4 4 4 Bax/β-actin 0.24±0.03 0.57±0.03**0.32±0.03##Bcl-2/β-actin 0.55±0.03 0.15±0.03**0.30±0.03##Caspase-3/β-actin 0.19±0.02 0.54±0.06**0.32±0.05##
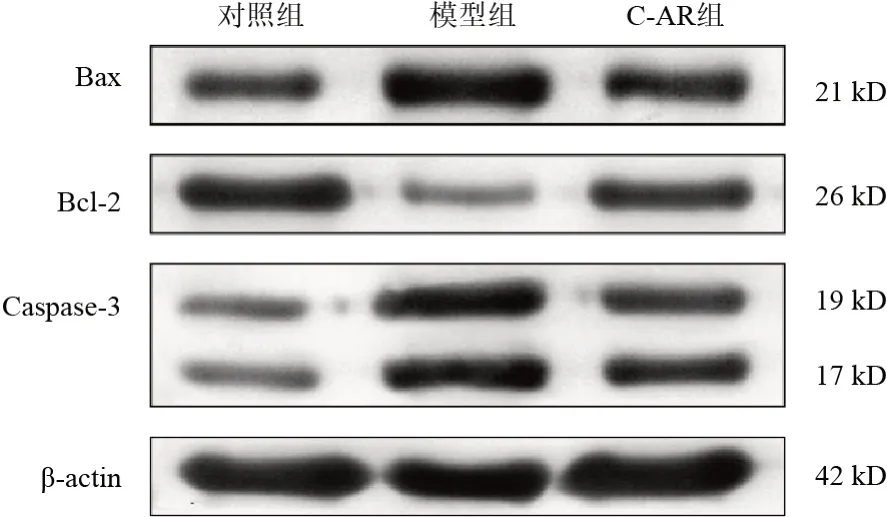
图4 各组软骨细胞Bax、Bcl-2、Caspase-3蛋白免疫印迹
2.6 灵仙新苷对软骨细胞凋亡相关mRNA表达的影响
与对照组比较,模型组细胞Bax和Caspase-3 mRNA表达显著升高(P<0.01),Bcl-2 mRNA表达显著降低(P<0.01);与模型组比较,C-AR组细胞Bax和Caspase3 mRNA表达显著降低(P<0.01),Bcl-2 mRNA表达显著升高(P<0.01)。结果见表6。
表6 各组软骨细胞Bax、Bcl-2、Caspase-3 mRNA表达比较(±s)
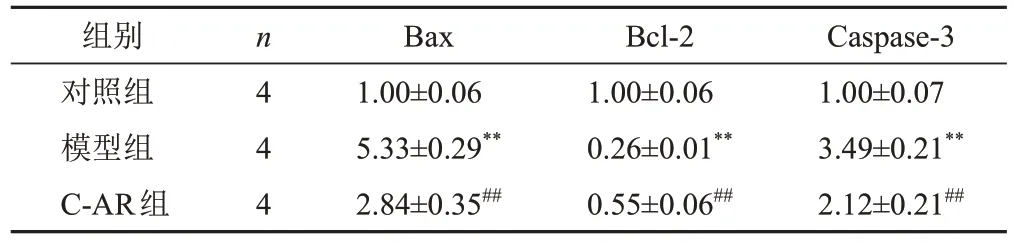
表6 各组软骨细胞Bax、Bcl-2、Caspase-3 mRNA表达比较(±s)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别对照组模型组C-AR组n 4 4 4 Bax 1.00±0.06 5.33±0.29**2.84±0.35##Bcl-2 1.00±0.06 0.26±0.01**0.55±0.06##Caspase-3 1.00±0.07 3.49±0.21**2.12±0.21##
2.7 灵仙新苷对软骨细胞自噬相关蛋白表达的影响
Western blot结果显示,与对照组比较,模型组细胞Beclin1蛋白表达和LC3BⅡ/LC3BⅠ比值显著降低(P<0.01);与模型组比较,C-AR组细胞Beclin1蛋白表达和LC3BⅡ/LC3BⅠ比值显著升高(P<0.01)。免疫荧光结果显示,与对照组比较,模型组细胞LC3B表达显著降低(P<0.01);与模型组比较,C-AR组细胞LC3B蛋白表达显著升高(P<0.01)。结果见图5、图6、表7。
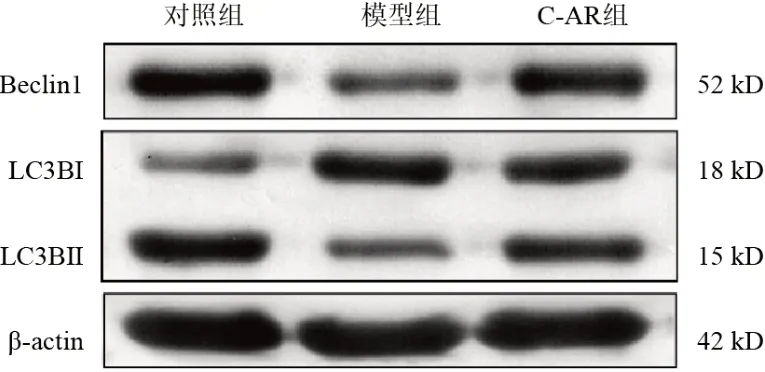
图5 各组软骨细胞Beclin1、LC3B蛋白免疫印迹
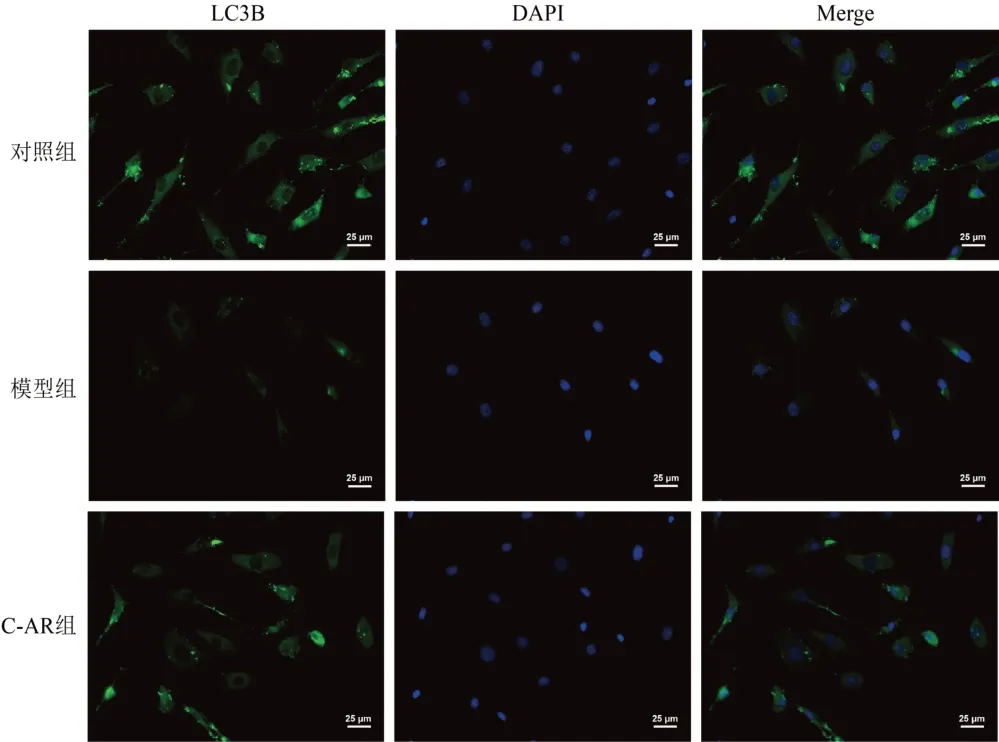
图6 各组软骨细胞LC3B阳性表达(免疫荧光染色,标尺=25 μm)
表7 各组软骨细胞Beclin1、LC3B蛋白表达比较(±s)
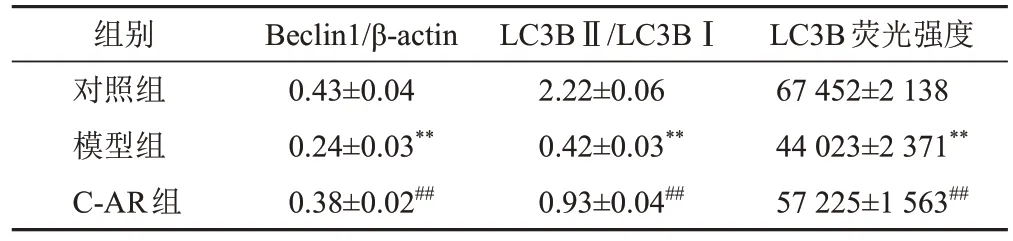
表7 各组软骨细胞Beclin1、LC3B蛋白表达比较(±s)
注:与对照组比较,**P<0.01,与模型组比较,##P<0.01
组别对照组模型组C-AR组Beclin1/β-actin 0.43±0.04 0.24±0.03**0.38±0.02##LC3BⅡ/LC3BⅠ2.22±0.06 0.42±0.03**0.93±0.04##LC3B荧光强度67 452±2 138 44 023±2 371**57 225±1 563##
3 讨论
威灵仙是治疗风湿痹痛的要药。现代研究发现,威灵仙提取物及有效成分在治疗KOA方面均能发挥积极作用[18]。马勇等[19]运用威灵仙提取物对体外培养的兔膝关节软骨细胞进行干预,发现其能促进软骨细胞增殖及转化生长因子β1 mRNA的表达,对关节软骨产生保护作用,从而延缓KOA发展。此外,威灵仙提取物还能促进软骨细胞ECM合成,维持软骨细胞表型稳定[20]。本课题组前期研究发现,在独活寄生汤基础上加入威灵仙、黄芩等药物能降低KOA兔血清及关节液炎症因子表达,缓解软骨退变[21]。体外实验能通过调控Wnt/β-catenin信号通路抑制膝关节软骨细胞凋亡[22]。
C-AR作为威灵仙中一种三萜皂苷类成分,在抗炎、抗氧化应激方面具有一定作用。炎症反应贯穿KOA发病过程,促炎因子如IL-1β、肿瘤坏死因子(TNF)-α等在KOA发病过程中大量释放,导致产生疼痛。软骨细胞异常的氧化应激状态也会诱发炎症因子产生[10],从而进一步加速软骨细胞凋亡。研究发现,C-AR能降低TNF-α刺激下MH7A细胞IL-6和IL-8分泌,减少基质金属蛋白酶产生,有效拮抗TNF-α诱导的炎症和细胞毒性[17]。本研究发现,IL-1β刺激导致软骨细胞活力降低,细胞IL-6和IL-8含量明显增加,氧化应激水平也随之升高,细胞凋亡率明显升高。C-AR处理后,软骨细胞活力升高,细胞IL-6和IL-8含量明显减少,氧化应激水平和细胞凋亡率明显降低,促凋亡Bax、Caspase-3基因和蛋白表达下调,抗凋亡Bcl-2基因和蛋白表达上调。提示C-AR可减轻体外培养的KOA软骨细胞炎症和氧化应激反应,抑制细胞凋亡。
自噬可恢复受损软骨细胞功能,减少软骨细胞凋亡,延缓KOA发生发展[23]。课题组前期研究发现,牛膝多糖能促进软骨细胞自噬相关蛋白Beclin1、LC3Ⅱ/LC3Ⅰ表达,抑制凋亡相关蛋白Fadd、Caspase-3/9表达,降低软骨细胞凋亡率[24-25],提示可通过促进软骨细胞自噬抑制软骨细胞凋亡。本研究结果显示,C-AR组软骨细胞自噬相关蛋白Beclin1、LC3B表达及LC3BⅡ/LC3BⅠ比值升高,表明C-AR能促进自噬发生。结合细胞凋亡率可见,软骨细胞凋亡与自噬水平呈负相关,随着自噬增强,凋亡进一步减弱。
综上所述,C-AR可减轻体外培养的KOA软骨细胞炎症和氧化应激反应,抑制软骨细胞凋亡,其机制可能与激活自噬有关。本研究初步观察了C-AR对KOA软骨细胞自噬和凋亡的影响,对其通过哪些途径激活自噬、抑制细胞凋亡及量效关系尚未明确,今后我们将继续深入研究,为防治KOA提供更多依据。
