阳和汤对三阴性乳腺癌细胞凋亡的影响及机制研究
2023-03-11任翠翠李俊峰吕佳佳叶凯刘子源黄芊窦建卫
任翠翠 ,李俊峰 ,吕佳佳 ,叶凯 ,刘子源 ,黄芊 ,窦建卫
1.西安市第一医院,陕西 西安 710002; 2.甘肃中医药大学基础医学院,甘肃 兰州 730000;3.邛崃天银制药有限公司,四川 邛崃 611530; 4.西安交通大学医学部,陕西 西安 710061;5.西安市中医医院,陕西 西安 710021
世界卫生组织国际癌症研究机构(IARC)发布的全球癌症负担数据显示,2020年全球新增癌症中,乳腺癌(11.7%)首次超过肺癌(11.4%)成为全球新确诊人数最多的癌症[1]。目前乳腺癌主要以手术为主,并配合放疗、化疗、免疫及内分泌治疗等[2-3]。中医治疗乳腺癌积累了丰富经验,《外科症治全生集》记载阳和汤用于治疗乳岩,乳岩归于阴疽,属阴证、寒证,病机主要为阴寒凝结,气血凝滞,故提出以阳和汤加土贝母的方法治疗乳腺癌[4]。近年来,关于阳和汤治疗乳腺癌的临床及基础研究也屡见报道[5-7],然其机制不甚明了。
研究发现,与细胞凋亡有关的STAT1/p53信号通路是乳腺癌发生发展的关键环节[8]。前期研究发现,阳和汤含药血清可显著抑制三阴性乳腺癌细胞BT549增殖及迁移[9]。在此基础上,本研究以STAT1/p53信号通路为切入点,观察阳和汤含药血清对BT549细胞形态、凋亡和周期的影响,探讨阳和汤治疗三阴性乳腺癌的具体作用机制,为其临床应用和后续研究提供实验依据。
1 实验材料
1.1 动物及细胞
SPF级雌性SD大鼠40只,体质量180~220 g,购于西安交通大学医学部实验动物中心。饲养于西安交通大学实验动物中心SPF级动物实验室,实验过程遵守西安交通大学医学部生物医学伦理委员会指导原则与要求。人三阴性乳腺癌细胞BT549,购自上海晶都生物技术有限公司。
1.2 药物及制备
阳和汤(熟地黄30 g,肉桂3 g,麻黄2 g,鹿角胶9 g,芥子6 g,姜炭2 g,甘草3 g,土贝母15 g),饮片购自北京同仁堂西安门店,经西安交通大学药学院窦建卫副教授鉴定,符合2020年版《中华人民共和国药典》标准。鹿角胶先加水1 000 mL煎煮1 h,再加入熟地黄、肉桂、芥子、姜炭、甘草、土贝母继续煎煮30 min,后下麻黄,煎煮10 min,取滤液,药渣加水600 mL再煎煮20 min,合并2次药液,浓缩至原药材浓度1.4 g/mL,4 ℃保存备用。5-氟尿嘧啶注射液,天津金耀,批号12020959,0.25 g/支。
1.3 主要试剂与仪器
RPMI-1640培养基(美国HyClone公司,货号SH30809.01),胎牛血清(美国Gibco公司,批号M3851),胰酶、青霉素-链霉素双抗(美国HyClone公司,批号分别为SH3004201、SV30010),信号传导和转录激活因子(STAT)1抗体(美国CST公司,货号#9176),STAT3抗体(武汉三鹰生物,货号#10253),p53抗体(武汉三鹰生物,货号#60283),Bax抗体(美国CST公司,货号#89477),DAPI染色液(江苏凯基生物,货号KGA215),细胞周期检测试剂盒、细胞凋亡检测试剂盒(福州飞净生物,批号分别为PH0539、PH0530)。
倒置荧光显微镜(日本OLYMPUS公司,型号BX53),电泳仪(北京君意东方电泳设备有限公司,型号JY300C),细胞恒温恒压培养箱(美国Thermo Scientific公司,型号TC 2323),全自动酶标分析仪(美国Thermo Scientific公司,型号HT2型),低温冰箱(青岛海尔公司,型号BCD-458WDVMU1),超低温冰箱(青岛海尔,型号DW-40L278),离心机(德国Heraeus公司,型号Biofugeprimo R),流式细胞仪(美国BD公司,型号FACSCalibur)。
2 实验方法
2.1 含药血清制备
根据体质量将大鼠随机分为空白对照组、阳性药组及阳和汤低、中、高剂量组,每组8只。阳和汤低、中、高剂量组按4.5、9、18 g/kg灌胃(相当于临床成人剂量的5、10、20倍),阳性药组尾静脉注射5-氟尿嘧啶注射液(0.125 g/5 mL)15 mg/kg,空白对照组和阳性药组予蒸馏水灌胃,灌胃体积10 mL/kg,每日2次,连续7 d。末次给药后1 h,腹主动脉取血,4 ℃、3 000 r/min离心10 min,分离血清,56 ℃水浴30 min灭活,分装,-80 ℃冻存备用。
2.2 细胞培养及分组
将胎牛血清与RPMI-1640培养基以1∶9比例混合,再按总体积的1%加入双抗摇匀,配制成完全培养基。BT549细胞复苏或传代后,每培养瓶(25 cm2)加完全培养基4 mL,置于37 ℃、5%CO2培养箱内培养,取对数生长期细胞用于实验。将细胞分为空白对照组、阳性药组及阳和汤低、中、高剂量组,将大鼠血清分别加空白培养基稀释,配制成10%含药血清,用于干预细胞。
2.3 DAPI染色
取对数生长期细胞,以1×106个/孔接种至6孔板,待细胞贴壁后弃去原培养基,加入相应含药血清培养基培养48 h,弃去培养基,PBS洗涤细胞,每孔加入DAPI染液100 μL,避光孵育10~15 min,弃去染色液,PBS漂洗,甘油封片,荧光显微镜下观察并拍照。
2.4 流式细胞术检测细胞凋亡
取对数生长期细胞接种至6孔板中,每孔约1×106个,培养12 h后,弃去原培养基,血清饥饿法继续培养24 h,加入相应含药血清培养基培养48 h,弃去旧培养基,PBS洗涤,胰酶消化细胞1 min,将细胞转移至10 mL离心管,PBS洗涤2次,1 200 r/min离心4.5 min,收集细胞,加入Binding Buffer 450 μL、Annexin V-FITC溶液5 μL、PI溶液10 μL充分混匀,室温避光反应10~15 min,采用流式细胞仪检测细胞凋亡情况。
2.5 流式细胞术检测细胞周期
取对数生长期细胞接种于6孔板,每孔约1×106个,培养箱培养12 h,弃去原培养基,血清饥饿法培养24 h,加入相应含药血清培养基培养48 h。PBS洗涤,胰酶消化细胞,1 200 r/min离心4.5 min,细胞用PBS重悬,调整细胞密度为1.5×106个/mL,取1 mL细胞悬液,1 200 r/min离心4.5 min,吸去上清液,沉淀用PBS 300 μL重悬,加入无水乙醇,4 ℃固定过夜,离心,弃固定液,用RNase A液100 μL重悬细胞,37 ℃水浴30 min,加PI溶液400 μL充分混匀,4 ℃避光放置30 min,流式细胞仪检测细胞周期。
2.6 qRT-PCR检测
将BT549细胞接种于6孔板,每孔约5×105个细胞,培养箱培养12 h,弃去原培养基,血清饥饿法培养24 h,加入相应含药血清培养基培养48 h。Trizol试剂盒提取细胞总RNA,取RNA 5 µg反转录为cDNA,行PCR。反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸30 s,共40个循环。用2-ΔΔCt法计算基因相对表达量。引物由生工生物工程(上海)有限公司合成。引物序列见表1。

表1 各基因PCR引物序列
2.7 Western blot检测
细胞在25 cm2培养瓶培养12 h后,弃去原培养基,血清饥饿法继续培养24 h,加入相应含药血清培养基培养48 h,预冷PBS洗细胞1次,加入RIPA裂解工作液200 µL提取蛋白,冰上孵育5 min,收集细胞,4 ℃、12 000×g离心5 min,BCA法蛋白定量,加5×蛋白上样缓冲液,沸水灭活5 min,凝胶电泳(90 V、30 min,120 V、2 h),转膜(200 mA、1.5 h),血清封闭2 h,加STAT1、STAT3、p53、Bax一抗(均为1∶1 000),4 ℃孵育过夜,TBST洗膜,加二抗(1∶10 000),孵育2 h,TBST洗涤,加发光剂避光反应3 min,显影仪显影,Image J软件检测条带灰度值。
3 统计学方法
4 结果
4.1 阳和汤对BT549细胞形态的影响
空白对照组BT549细胞胞核边缘清晰、着色均匀;阳和汤低、中、高剂量组和阳性药组BT-549细胞均出现细胞边缘不规则、细胞核深染、凋亡小体等典型的细胞凋亡现象,且阳和汤高剂量组凋亡更明显。见图1。

图1 各组BT549细胞形态(DAPI染色,×500)
4.2 阳和汤对BT549细胞凋亡的影响
与空白对照组比较,阳性药组及阳和汤低、中、高剂量组细胞凋亡率明显升高,差异有统计学意义(P<0.01)。见表2。
表2 各组BT549细胞凋亡率比较(±s,%)

表2 各组BT549细胞凋亡率比较(±s,%)
注:与空白对照组比较,**P<0.01
组别空白对照组阳性药组阳和汤低剂量组阳和汤中剂量组阳和汤高剂量组n 6 6 6 6 6凋亡率4.85±0.53 21.48±1.52**7.88±0.67**12.65±0.61**17.52±0.90**
4.3 阳和汤对BT549细胞周期的影响
与空白对照组比较,阳性药组及阳和汤低、中、高剂量组G0/G1期细胞比例增加,G2/M期细胞比例降低,差异有统计学意义(P<0.05,P<0.01)。见表3。
表3 各组BT549细胞周期分布比较(±s,%)

表3 各组BT549细胞周期分布比较(±s,%)
注:与空白对照组比较,*P<0.05,**P<0.01
组别空白对照组阳性药组阳和汤低剂量组阳和汤中剂量组阳和汤高剂量组n 6 6 6 6 6 G0/G1期47.11±4.12 72.38±6.25**55.26±5.09*65.91±5.95**69.87±5.81**S期16.15±2.12 13.12±2.66 12.61±2.08 15.03±2.16 13.48±1.98 G2/M期36.74±3.58 14.50±1.75**32.13±3.15*19.06±2.65**16.65±2.43**
4.4 阳和汤对BT549细胞信号传导和转录激活因子1、p53 mRNA表达的影响
与空白对照组比较,阳性药组及阳和汤高剂量组细胞STAT1 mRNA表达显著升高(P<0.01),阳性药组及阳和汤中、高剂量组细胞p53 mRNA表达显著升高(P<0.05,P<0.01)。见表4。
表4 各组BT549细胞STAT1、p53 mRNA表达比较(±s)
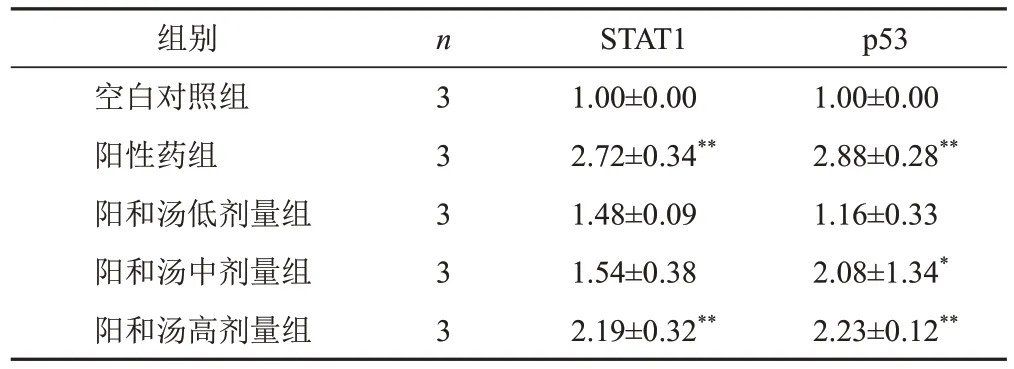
表4 各组BT549细胞STAT1、p53 mRNA表达比较(±s)
注:与空白对照组比较,*P<0.05,**P<0.01
组别空白对照组阳性药组阳和汤低剂量组阳和汤中剂量组阳和汤高剂量组n 3 3 3 3 3 STAT1 1.00±0.00 2.72±0.34**1.48±0.09 1.54±0.38 2.19±0.32**p53 1.00±0.00 2.88±0.28**1.16±0.33 2.08±1.34*2.23±0.12**
4.5 阳和汤对BT549细胞信号传导和转录激活因子1/3、p53、Bax蛋白表达的影响
与空白对照组比较,阳性药组及阳和汤低、中、高剂量细胞p53、Bax蛋白表达显著升高,STAT3蛋白表达显著降低(P<0.05,P<0.01);阳性药组及阳和汤中、高剂量组细胞STAT1蛋白表达显著升高(P<0.01)。结果见图2、表5。

图2 各组BT549细胞STAT1、STAT3、p53、Bax蛋白免疫印迹
表5 各组BT549细胞STAT1、STAT3、p53、Bax蛋白表达比较(±s)

表5 各组BT549细胞STAT1、STAT3、p53、Bax蛋白表达比较(±s)
注:与空白对照组比较,*P<0.05,**P<0.01
组别空白对照组阳性药组阳和汤低剂量组阳和汤中剂量组阳和汤高剂量组n 3 3 3 3 3 STAT1 0.57±0.02 1.22±0.03**0.64±0.09 0.75±0.03**0.88±0.03**STAT3 1.24±0.04 0.39±0.03**0.62±0.04**0.45±0.03**0.40±0.03**p53 0.48±0.02 1.13±0.07**0.68±0.08*0.68±0.09*1.09±0.06**Bax 0.29±0.02 1.02±0.13**0.52±0.07*0.77±0.09**0.84±0.07**
5 讨论
三阴性乳腺癌是乳腺癌中最具侵袭性的亚型,其特点是雌激素受体、孕激素受体和原癌基因HER-2呈阴性表达。虽然三阴性乳腺癌占全部乳腺癌患者的15%~20%,但因其对HER-2选择性和内分泌治疗无效,缺乏特异性靶点,常规治疗效果差。
随着细胞和分子生物学的发展,乳腺癌的分子生物学机制研究已成为当前研究热点[10]。细胞凋亡是机体程序性地清除部分多余、对机体有害细胞的自我防御机制,细胞的异常增殖和分化,以及细胞凋亡异常都可影响肿瘤发生发展[11-12]。STAT1是细胞内信号枢纽的一员,影响细胞的正常活动功能,在调节癌细胞增殖与凋亡、调控细胞周期进程及癌症相关免疫编辑等过程中发挥重要作用[13]。p53是重要的转录因子,可抑制肿瘤细胞生长。野生型p53(wtp53)能够阻滞细胞周期、诱导细胞凋亡、增加肿瘤对放化疗的敏感性,被视为重要的肿瘤抑制基因。STAT1能与p53形成络合物,在p53依赖的细胞凋亡信号转导通路中调节基因的转录活性,还可作为共活化剂增强p53介导的基因转录活性,从而加重DNA损伤和促进细胞凋亡[14]。STAT1通过调节p53的肿瘤抑制功能,从而对肿瘤放疗敏感性产生影响。STAT3是关键的转录因子,可激活癌基因,促进肿瘤发生发展。在乳腺癌中,wtp53借助其下游因子Bax、Bcl-2等引起线粒体外膜通透性改变,形成凋亡复合体,诱导乳腺癌细胞凋亡[15]。
Bcl-2是一种癌基因,具有抑制凋亡作用[16]。Bax是最常见的促凋亡基因[15],正常情况下,Bax位于胞质,在受到凋亡信号刺激后,Bax会移位到线粒体膜,并形成Bax/Bcl-2二聚体,促使线粒体膜形成孔道,导致细胞色素C释放[17],从而诱导细胞凋亡。激活的STAT1(白细胞介素、生长激素等激活)能促进Bax/Bcl-2二聚体解体,加速Bax蛋白释放,诱导细胞凋亡[18]。本实验通过观察阳和汤含药血清对BT549细胞STAT1、STAT3及下游p53、Bax等关键凋亡蛋白表达的影响,探讨阳和汤治疗乳腺癌的潜在机制。
结果显示,低、中、高剂量阳和汤含药血清干预BT549细胞后,G0/G1期细胞比例增加,G2/M期细胞比例降低,说明阳和汤可将BT549细胞的周期抑制在G0/G1期,从而抑制细胞增殖。凋亡检测中,随着阳和汤含药血清浓度增加,细胞凋亡率增加,表明阳和汤能诱导乳腺癌BT549细胞凋亡。通过Western blot和qRT-PCR实验发现,与空白对照组比较,阳和汤各剂量组STAT1、p53、Bax表达升高,STAT3表达降低,表明阳和汤含药血清可通过激活STAT1/p53信号通路及抑制STAT3,进一步上调下游促凋亡蛋白Bax表达,从而抑制癌细胞发展。
本实验采用血清药理学方法,以STAT1/p53信号通路为切入点,研究阳和汤治疗三阴性乳腺癌的分子机制,可为其临床应用和后续研究提供实验支持。但三阴性乳腺癌发病机制复杂,涉及多因素、多靶点的共同作用,对其机制的进一步了解仍需后续深入研究。
