基于网络药理学及实验验证探讨香砂六君子汤治疗功能性消化不良作用机制
2023-03-11赵琳娜成映霞白敏刘梦雅李润法高晗安耀荣段永强
赵琳娜 ,成映霞 ,白敏 ,刘梦雅 ,李润法 ,高晗 ,安耀荣 段永强
1.甘肃中医药大学,甘肃 兰州 730000; 2.甘肃省实验动物行业技术中心,甘肃 兰州 730000;3.宁夏医科大学中医学院,宁夏 银川 750004; 4.石家庄傅山肿瘤医院,河北 石家庄 050000
功能性消化不良(functional dyspepsia,FD)是临床常见的功能性胃肠道疾病之一,全球总患病率约为16%[1],我国患病率可达20%[2],对患者生理、心理及社会产生严重影响[3]。FD临床主要表现为上腹部饱胀感、早饱感、上腹痛、上腹部烧灼感等,且无明显器质性病变。FD病理机制复杂,现代医学多认为与十二指肠低度炎症、胃肠动力障碍等因素有关,常用促胃肠动力、抑酸剂等药物进行治疗,但复发率较高[4]。
FD属中医学“痞满”范畴,其病因病机复杂,主要与脾胃虚弱、饮食不节、情志失调、劳倦过度、先天禀赋不足等相关,其中脾胃虚弱为其主要病机。《证治汇补》有“大抵心下痞闷,必是脾胃受亏,浊气挟痰,不能运化为患”,指出脾胃虚弱是导致机体运化失常、痰湿内生、心下痞满不舒的主要因素。香砂六君子汤出自《古今名医方论》,由人参、白术、茯苓、甘草、陈皮、半夏、砂仁、木香组成,全方以健脾补气的四君子汤加理气化痰药物陈皮、半夏、砂仁、木香组成,促进脾胃运化,为健脾和胃经典方剂,治疗脾胃虚弱型FD临床效果显著[2,5],但其具体作用机制尚不明确。网络药理学将药物作用网络与生物网络相结合,从分子水平阐释药物与疾病的作用靶点与机制,能够准确预测分析中药复方的作用机制[6]。本研究借助网络药理学方法探究香砂六君子汤干预FD的作用靶点及机制,并通过动物实验对核心靶点进行验证。
1 材料与方法
1.1 网络药理学预测分析
1.1.1 药物-成分-靶点-疾病网络构建
通过TCMSP(https://old.tcmsp-e.com/tcmsp.php)对香砂六君子汤组方药物人参、白术、茯苓、甘草、陈皮、半夏、木香、砂仁的化学成分进行查询。以口服生物利用度(OB)≥30%且类药性(DL)≥0.18为条件[7],筛选出药物有效成分及相应靶点,并通过UniProt数据库获取靶点蛋白的基因名称。通过GeneCards数据库(https://auth.lifemapsc.com),以“functional dyspepsia”为检索词,检索FD的基因靶点。将药物靶点与FD基因靶点取交集,筛选出药物与疾病的共同靶点,并通过Cytoscape3.7.1软件构建药物-成分-靶点-疾病网络。
1.1.2 蛋白相互作用网络构建
将药物与疾病共同靶点输入STRING数据库(https://www.string-db.org),类型选择“homo sapiens”(人类)并设置最小关系值≥0.95,删除无连接节点,构建蛋白相互作用(PPI)网络。运用Cytoscape3.7.1软件进行拓扑分析,找出Betweenness、Closeness、Degree、Information、LAC、Network值均大于其平均值的靶点,并根据Degree值大小筛选出核心靶点。
1.1.3 GO及KEGG通路富集分析
将药物与疾病共同靶点导入Metascape数据库(https://metascape.org/gp/index),物种设置为“Homo sapiens”,进行GO及KEGG通路富集分析。
1.2 实验验证
1.2.1 药物
参考《方剂学》[8],香砂六君子汤由人参(生晒参)10 g、麸炒白术9 g、茯苓9 g、陈皮9 g、法半夏12 g、砂仁6 g、木香6 g、炙甘草6 g组成。饮片购自甘肃中医药大学附属医院中药房,并经甘肃中医药大学杨扶德教授鉴定符合2020年版《中华人民共和国药典》规定。饮片常规浸泡2 h,煎煮2次,每次40 min,所得药液浓缩至每毫升含原药材1 g,冷却后置4 ℃冰箱保存。色甘酸钠(美国APRxBIO公司,批号B330021337769),用蒸馏水配制成7.2 mg/mL溶液。
1.2.2 动物
SPF级SD孕鼠15只,通过观察幼鼠行为活动及性别,筛选出60只健康幼年雄鼠用于实验,甘肃中医药大学医学实验中心提供,动物许可证号SYXK(甘)2020-0001。大鼠饲养于SPF环境中,每12 h进行一次标准啮齿动物食物、水和明暗循环,相对湿度45%~55%,室温(23±2)℃。本实验经甘肃中医药大学动物伦理委员会审查批准(2021-204)。
1.2.3 主要试剂与仪器
大鼠白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)ELISA试剂盒,江苏菲亚生物科技有限公司,批号分别为2203R18、2203R30、2203R16;内参GAPDH、二抗IgG,北京ImmunoWay公司,批号分别为YM3215、RS002;p-ERK一抗,美国GeneTex公司,批号GTX24819;p-P38MAPK一抗,武汉塞维尔生物科技有限公司,批号AC220406032;p-NF-κBp65一抗,上海ABmart公司,批号TP56372M;RIPA裂解液、SDS-PAGE蛋白上样缓冲液,北京索莱宝科技有限公司,批号分别为R0010、P1200。
5910R型冷冻型高速离心机,德国Eppendorf公司;美谷SpectraMax i3X酶标仪、VE-180型垂直板电泳装置,美国BIO-RAD公司;DYY-6C型电泳仪,北京六一生物有限公司;GeLView 6000puls凝胶成像系统,广东博鹭腾生物科技有限公司。
1.2.4 造模、分组、给药及取材
将60只SPF级SD大鼠随机抽出10只为空白组,10日龄起灌胃2%蔗糖溶液0.2 mL,每日1次,连续1周,正常饲养至6周龄。其余大鼠采用综合法建立脾胃虚弱型FD大鼠模型[9]:10日龄起灌胃含有0.1%碘乙酰胺的2%蔗糖溶液0.2 mL,每日1次,连续6 d。将大鼠正常饲养到6周龄后,造模大鼠每日游泳至力竭,连续2周,同时隔日禁食。以体质量、进食量下降及胃排空时间长、推进率下降为造模成功标准。
将成模大鼠随机分为模型组、色甘酸钠组及香砂六君子汤高、中、低剂量组(高、中、低剂量组),每组10只。按人与动物体型系数折算[10],色甘酸钠组大鼠予72 mg/(kg·d)色甘酸钠溶液灌胃,高、中、低剂量组大鼠分别予12、6、3 g/(kg·d)香砂六君子汤药液灌胃,给药体积均为10 mL/kg,连续2周。空白组与模型组予等体积生理盐水灌胃。饲养过程中记录大鼠体质量及3 h进食量变化。给药结束后,禁食24 h,测算大鼠胃排空率及肠推进率,剪取胃、十二指肠组织,生理盐水冲洗,一部分以多聚甲醛固定,另一部分于-80 ℃冻存。
1.2.5 胃排空率及肠推进率测定
大鼠禁食24 h后灌服含炭粉的半固体营养糊2 mL,30 min后以3%戊巴比妥钠5 mL/kg腹腔注射麻醉,取出全胃,称重,沿胃大弯剪开,生理盐水充分冲洗清洁后称量胃净重,计算胃排空率。胃排空率(%)=[1-(胃总重-胃净重)÷所给糊重]×100%。以幽门为起点测量黑色糊状物推进距离(L)及小肠全长(S),计算肠推进率。肠推进率(%)=L÷S×100%。
1.2.6 胃肠组织HE染色
取多聚甲醛固定的胃、十二指肠组织,石蜡包埋,切片,苏木素-伊红染色,镜下观察组织形态结构。
1.2.7 ELISA检测十二指肠炎症因子含量
将十二指肠组织制备为10%组织匀浆,按ELISA试剂盒说明书操作,计算各组大鼠十二指肠组织IL-6、TNF-α、IL-1β含量。
1.2.8 蛋白印迹法检测十二指肠关键通路蛋白表达水平
取大鼠十二指肠组织,提取蛋白,蛋白定量后上样,电泳转膜,室温封闭2 h,加入一抗p-ERK(1∶1 000)、p-P38MAPK(1∶500)、p-NF-κBp65(1∶1 000),4 ℃孵育过夜,再加入二抗,室温摇匀2 h,暗室曝光,以GAPDH为内参,分析蛋白相对表达量。
1.2.9 统计学方法
2 结果
2.1 药物-成分-靶点-疾病网络
经数据库检索并筛选后得到香砂六君子汤有效成分159个,对应2 472个靶点,去重后得到230个靶点;FD疾病靶点1 857个。将药物靶点与疾病靶点取交集后得到共同靶点151个。药物-成分-靶点-疾病网络见图1。

图1 香砂六君子汤治疗FD药物-成分-靶点-疾病网络
2.2 蛋白相互作用网络
将药物与疾病共同靶点基因输入STRING数据库生成PPI网络(见图2),并通过Cytoscape3.7.1软件进行拓扑分析。其中Degree值较高的基因有MAPK1、MAPK14、JUN、IL-6等,见图3。

图2 香砂六君子汤治疗FD靶点PPI网络

图3 香砂六君子汤治疗FD靶点PPI网络核心靶点
2.3 GO和KEGG通路富集分析结果
对151个共同靶点进行GO富集分析,得到2 198个条目,其中生物过程(BP)1 689条,细胞组成(CC)97条,分子功能(MF)145条,各前10个条目见图4。KEGG通路富集分析得到203条相关通路,前30条通路见图5。BP主要富集在对UV-A的反应、对活性氧的反应、细胞对镉离子的反应、对脂多糖的反应、对无机物的反应、细胞对脂质的反应、对细菌源性分子的反应等;CC主要富集在蛋白酶抑制剂复合物、丝氨酸蛋白酶抑制剂复合物、肽酶抑制剂复合物等;MF主要富集在氧化还原酶活性、离子通道调节活性、裂解酶活性、外源性蛋白结合DNA结合转录抑制活性等。KEGG通路主要富集在癌症相关通路、脂质与动脉粥样硬化、AGE-RAGE信号通路、MAPK信号通路、TNF信号通路、IL-17信号通路等。

图4 香砂六君子汤治疗FD靶点GO富集分析
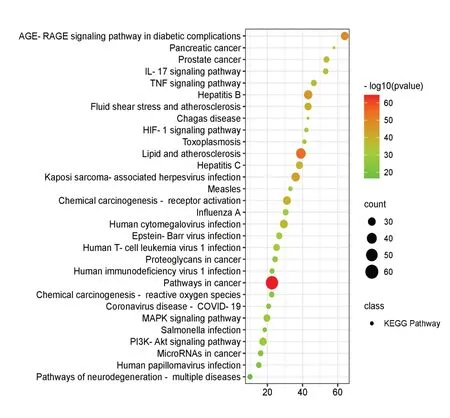
图5 香砂六君子汤治疗FD靶点KEGG富集分析
2.4 香砂六君子汤对模型大鼠体质量、进食量的影响
与空白比较,模型组大鼠体质量增长缓慢,进食量明显减少(P<0.01);与模型组比较,高、中剂量组及色甘酸钠组大鼠体质量和进食量均有所上升(P<0.05,P<0.01)。见图6、图7。

图6 各组大鼠不同时点体质量比较(±s,每组10只)
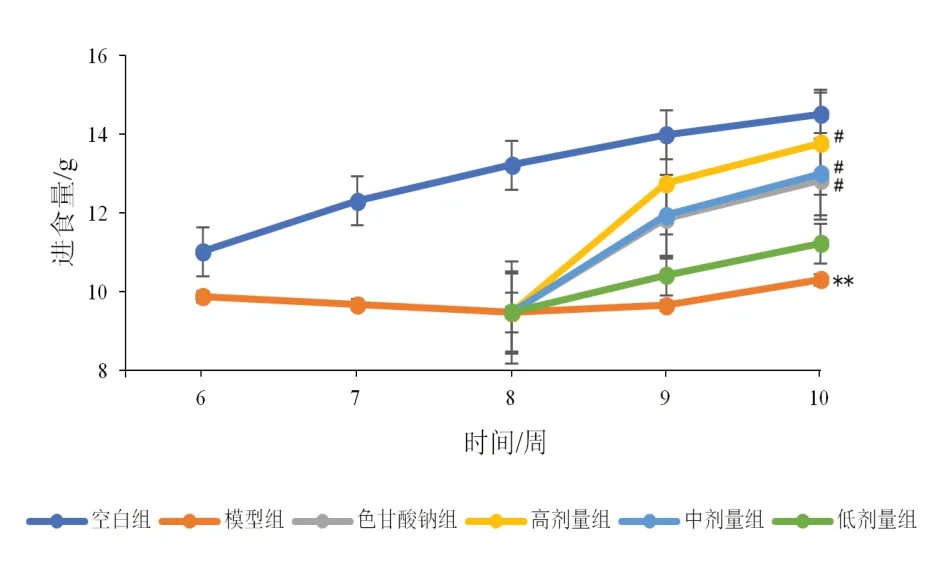
图7 各组大鼠3 h进食量比较(±s,每组10只)
2.5 香砂六君子汤对模型大鼠胃排空率及肠推进率的影响
与空白组比较,模型组大鼠胃排空率及肠推进率显著下降(P<0.01);与模型组比较,各给药组大鼠胃排空率显著升高(P<0.05,P<0.01),除低剂量组外,各给药组大鼠肠推进率显著升高(P<0.01)。见表1。
表1 各组大鼠胃排空率及肠推进率比较(±s,%)

表1 各组大鼠胃排空率及肠推进率比较(±s,%)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别空白组模型组色甘酸钠组高剂量组中剂量组低剂量组只数10 10 10 10 10 10胃排空率56.75±5.05 29.50±5.02**43.20±5.54##47.30±9.00##46.40±6.83##36.60±4.32#肠推进率86.66±12.56 35.38±11.53**66.07±17.41##75.09±10.10##60.29±13.26##45.64±10.98
2.6 香砂六君子汤对模型大鼠胃、肠组织病理形态的影响
空白组及模型组大鼠胃黏膜完整,黏膜上皮细胞及腺体排列规整,黏膜固有层未见炎细胞,黏膜无水肿、充血病理改变。空白组大鼠十二指肠黏膜完整,绒毛排列紧密,黏膜层无炎性浸润;模型组大鼠十二指肠绒毛排列散乱,部分出现倒伏、脱落现象,且黏膜层出现肿胀,有炎性细胞浸润;与模型组比较,各给药组大鼠十二指肠绒毛排列紧密,倒伏、脱落现象减少,黏膜层炎性细胞浸润出现不同程度改善,色甘酸钠组及高剂量组最为明显。见图8、图9。
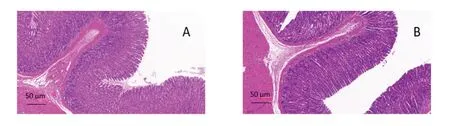
图8 各组大鼠胃黏膜病理形态(HE染色)

图9 各组大鼠十二指肠黏膜病理形态(HE染色)
2.7 香砂六君子汤对模型大鼠十二指肠组织炎症因子含量的影响
与空白组比较,模型组大鼠十二指肠组织IL-6、TNF-α、IL-1β含量明显升高(P<0.01);与模型组比较,各给药组大鼠十二指肠组织IL-6、TNF-α、IL-1β含量不同程度降低,色甘酸钠组及高剂量组最为明显(P<0.01)。见表2。
表2 各组大鼠十二指肠组织IL-6、TNF-α、IL-1β含量比较(±s)
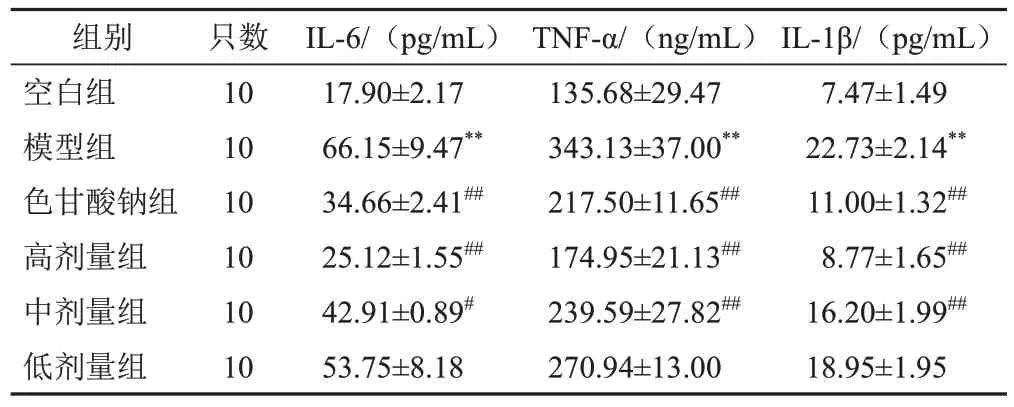
表2 各组大鼠十二指肠组织IL-6、TNF-α、IL-1β含量比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别空白组模型组色甘酸钠组高剂量组中剂量组低剂量组只数10 10 10 10 10 10 IL-6/(pg/mL)17.90±2.17 66.15±9.47**34.66±2.41##25.12±1.55##42.91±0.89#53.75±8.18 TNF-α/(ng/mL)135.68±29.47 343.13±37.00**217.50±11.65##174.95±21.13##239.59±27.82##270.94±13.00 IL-1β/(pg/mL)7.47±1.49 22.73±2.14**11.00±1.32##8.77±1.65##16.20±1.99##18.95±1.95
2.8 香砂六君子汤对模型大鼠十二指肠关键通路蛋白表达的影响
与空白组比较,模型组大鼠十二指肠组织p-ERK、p-P38MAPK、p-NF-κBp65蛋白表达水平显著升高(P<0.01);与模型组比较,各给药组大鼠十二指肠组织p-ERK、p-P38MAPK、p-NF-κBp65蛋白表达水平不同程度降低,色甘酸钠组及高剂量组最为显著(P<0.05,P<0.01)。见图10、表3。

图10 各组大鼠十二指肠组织p-ERK、p-P38MAPK、p-NF-κBp65蛋白表达免疫印迹
表3 各组大鼠十二指肠组织p-ERK、p-P38MAPK、p-NF-κBp65蛋白表达比较(±s,/GAPDH)
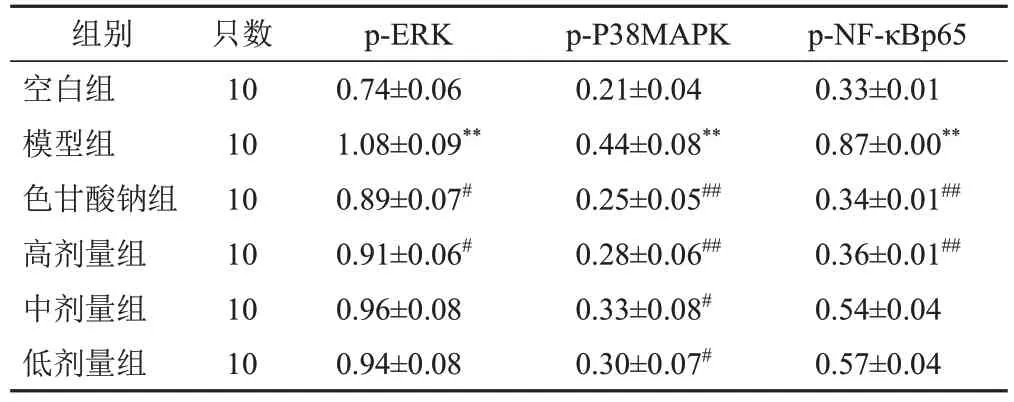
表3 各组大鼠十二指肠组织p-ERK、p-P38MAPK、p-NF-κBp65蛋白表达比较(±s,/GAPDH)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别空白组模型组色甘酸钠组高剂量组中剂量组低剂量组只数10 10 10 10 10 10 p-ERK 0.74±0.06 1.08±0.09**0.89±0.07#0.91±0.06#0.96±0.08 0.94±0.08 p-P38MAPK 0.21±0.04 0.44±0.08**0.25±0.05##0.28±0.06##0.33±0.08#0.30±0.07#p-NF-κBp65 0.33±0.01 0.87±0.00**0.34±0.01##0.36±0.01##0.54±0.04 0.57±0.04
3 讨论
网络药理学预测表明,香砂六君子汤治疗FD相关靶点共151个,PPI网络分析显示关键靶点为MAPK1、MAPK14、JUN、IL-6等。KEGG通路富集分析得到203条相关通路,主要富集在癌症相关通路、脂质和动脉粥样硬化相关通路、AGE-RAGE信号通路、MAPK信号通路、TNF信号通路、IL-17信号通路等,其中MAPK1、MAPK14、IL-6等 靶 点 及AGE-RAGE、MAPK、TNF、IL-17等通路均与炎症密切相关。动物实验结果显示,FD模型大鼠胃组织无明显炎性浸润,而十二指肠组织炎性浸润明显,表明十二指肠低度炎症是FD的重要因素。研究表明,十二指肠低度炎症为FD的始动因素,可以影响十二指肠-胃反馈,从而导致早饱感、腹胀等症状的出现[11]。
十二指肠黏膜内低度炎症主要表现为T细胞、肥大细胞和嗜酸性粒细胞数量增加[12],其中肥大细胞是重要的免疫细胞之一,广泛分布于机体各个部位,与多种慢性疾病、炎性疾病、自身免疫性疾病有关[13]。在十二指肠黏膜中,肥大细胞释放的介质可以影响上皮的完整性,刺激先天和适应性免疫反应[14-15],产生局部甚至全身炎症,进而促进胃肠道FD临床症状的产生。因此,本实验使用肥大细胞稳定剂色甘酸钠作为阻断剂抑制肥大细胞脱颗粒。
动物实验结果显示,香砂六君子汤可以改善FD大鼠十二指肠绒毛散乱及炎性浸润,下调十二指肠组织IL-6、TNF-α、IL-1β含量及p-ERK、p-NF-κBp65、p-P38MAPK表达水平,提示香砂六君子汤能减轻十二指肠低度炎症,其机制可能与下调p-ERK、p-P38MAPK及下游p-NF-κBp65水平有关。IL-6、TNF-α、IL-1β为促炎细胞因子,由单核细胞、肥大细胞及巨噬细胞分泌,可以参与细胞免疫且与炎症的发生发展密切相关。研究表明,IL-6可介导NF-κB、MAPK等多种炎性通路,引起自身免疫疾病[16]。TNF-α、IL-1β属于早期反应细胞因子,在细胞受到刺激后立即分泌从而破坏促炎-抗炎平衡,进一步刺激IL-6、IL-2等炎性因子活化,从而形成炎性反应[17]。TNF-α、IL-1β可通过调节胃酸分泌从而调节FD[18-20]。
丝裂原活化蛋白激酶(MAPK)是一种丝氨酸-苏氨酸蛋白激酶,参与调节细胞的生长、分化及炎症反应等多种生理病理过程,其与炎性介质的调节关系密切。MAPK主要亚族由ERK、P38、JUK组成。其中MAPK1属于ERK亚族,MAPK14属于P38亚族。P38可以调节多种细胞因子、炎性介质的表达,在免疫应答中发挥主要作用。研究显示,在多数炎症性肠病中,P38及其磷酸化表达均有所升高,且抑制P38过度激活可改善肠道炎症及上皮黏膜功能[21-22]。ERK同样为免疫调节中的重要因子,Monick等[23]研究表明,抑制ERK活性可以负调节吞噬细胞,从而调节机体免疫。MAPK可激活下游NF-κB。NF-κB是一种诱导型转录因子,可诱导激活多种免疫调节蛋白、炎性细胞因子,从而导致炎症[24-25]。有研究表明,调节NF-κB的转录可以调控FD大鼠十二指肠低度炎症的发生[26-27]。
综上所述,本研究采用网络药理学方法从分子水平预测分析香砂六君子汤干预FD的作用机制,发现其多与免疫相关。通过动物实验发现,FD大鼠胃组织无明显炎性浸润而十二指肠炎性浸润明显,提示香砂六君子汤干预FD的作用机制与十二指肠低度炎症密切相关。核心靶点验证结果表明,香砂六君子汤可能通过下调p-ERK、p-P38MAPK及下游p-NF-κBp65的水平调控十二指肠低度炎症,改善FD症状。
