基于肺电阻抗成像评价肌间沟臂丛神经阻滞对肺通气的影响
2023-03-10徐国林
徐国林,李 锐,张 野
(安徽医科大学第二附属医院麻醉与围术期医学科,安徽 合肥 230601)
肌间沟臂丛神经阻滞(interscalene brachial plexus block,ISB)被广泛应用于上肢手术的麻醉与镇痛,但ISB 会不可避免的引起膈肌麻痹,导致膈肌运动从正常变为反常运动,影响肺通气[1-3]。研究表明[4-6],超声和肺功能等设备均可以评价肌间沟臂丛神经阻滞对肺通气的影响,但超声只能显示膈肌偏移受损情况,肺功能检查则反映整体肺通气的减少,两者都不能反映肌间沟臂丛神经阻滞对肺通气的实际影响,不利于对患者肺通气受损情况的判断。肺功能电阻抗成像(electrical impedance imaging,EIT)作为一种新型肺通气监测的技术,可以显示左、右肺局部通气情况,实时、无创、连续监测肺通气变化[7-9]。Wiegel M 等[7]报道肺功能电阻抗成像技术可检测到ISB 患者阻滞侧肺通气减少,但尚无基于肺电阻抗成像监测肌间沟臂丛神经阻滞影响肺通气的报道。基于此,本研究拟通过肺功能电阻抗技术观察不同浓度罗哌卡因肌间沟臂丛神经阻滞对肺通气的影响,以期为临床应用提供参考。
1 资料与方法
1.1 一般资料 选取2021 年10 月-2022 年4 月于安徽医科大学第二附属医院择期行上肢手术患者75 例,年龄18~60 岁,ASA 分级Ⅰ~Ⅱ级,BMI 18~28 kg/m2。排除有严重的呼吸系统疾病、通气功能或换气功能严重障碍、单侧膈肌麻痹、局麻药物过敏史、凝血障碍和解剖学异常的患者。采用随机数字表法将患者分低浓度组(A 组)、中浓度组(B 组)和高浓度组(C 组),每组25 例。3 组年龄、性别、BMI和ASA 分级比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究已获安徽医科大学第二附属医院伦理委员会批准(YX2021-084),并与患者或委托人签署知情同意书。
表1 3 组一般资料比较(,n)

表1 3 组一般资料比较(,n)
1.2 方法 入室后开放静脉通路,连续监测心电图、脉搏血氧饱和度和无创血压。在胸部沿第6 肋间放置EIT 电极,连续监测EIT(Swisstom,瑞士),观察通气变化。记录通气中心(CoV)、依赖静止区(DSS)面积百分比(DSS 面积占整个肺区像素的百分比)和非依赖静止区(NSS)面积百分比(NSS 面积占整个肺区像素的百分比)[10,11]。肌间沟臂丛神经阻滞均由一位有经验的麻醉医师实施,体表定位后患者取侧卧位,消毒铺巾,在超声引导下确定肌间沟臂丛神经位置,使用22 G 阻滞针,回抽无血、无气后A、B、C 组分别注射0.25%、0.33%和0.50%的罗哌卡因(AstraZeneca AB,国药准字H20020249,规格:10 ml:100 mg)20 ml。
1.3 观察指标 比较3 组阻滞前(T0)、阻滞后10 min(T1)、阻滞后20 min(T2)和阻滞后30 min(T3)CoV、DSS 和NSS 的面积百分比、改良Bromage 评分及生命体征变化[血压(SBP、DBP)、心率及血氧饱和度(SpO2)]。改良Bromage 评分:0:无阻滞,完全能够弯曲手臂和前臂;1:部分阻滞,可部分活动上臂;2:几乎完全阻滞,不能活动上臂;3:完全阻滞,无法活动上臂和前臂[12]。
1.4 统计学方法 采用SPSS 23.0 软件进行统计分析,符合正态分布的计量资料使用()表示,使用t检验,多组变量比较使用方差分析;非正态分布的计量资料使用[M(P25,P75)]表示,使用秩和检验;计数资料以[n(%)]表示,组间比较使用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 3 组肺电阻抗成像指标比较 与T0 相比,T1、T2和T3 时A、B、C 组NSS 和DSS 均增加(P<0.05),T2和T3 时A 组及T1、T2、T3 时B 组、C 组的CoV 均增加(P<0.05);与A 组相比,B 组和C 组在T1、T2和T3 点的NSS 和DSS 增加(P<0.05),在T1 时COV增加(P<0.05);其余各时间点3 组CoV、DSS 和NSS比较,差异均无统计学意义(P>0.05),见表2。
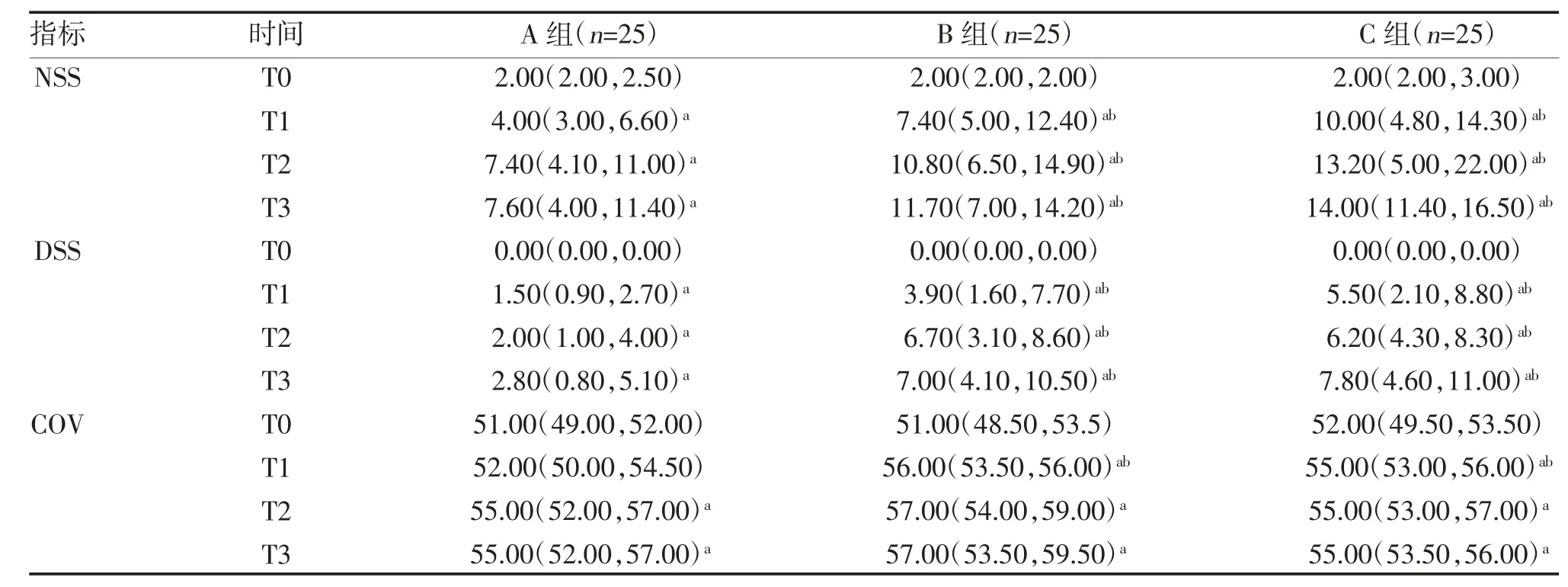
表2 3 组肺电阻抗成像指标比较[M(P25,P75),%]
2.2 3 组生命体征变化比较 3 组各时间点血压、心率和脉搏血氧饱和度比较,差异均无统计学意义(P>0.05),见表3。
表3 3 组生命体征变化比较()

表3 3 组生命体征变化比较()
2.3 3 组改良Bromage 评分比较 与T0 相比,3 组各时点改良Bromage 评分均升高(P<0.05);与A 组相比,B 组在T1 时点,C 组在T1、T2 和T3 时点的改良Bromage 评分均升高(P<0.05),见表4。
表4 3 组改良Bromage 评分比较(,分)

表4 3 组改良Bromage 评分比较(,分)
注:与T0 比较,aP<0.05;与A 组比较,bP<0.05
3 讨论
EIT 是一种实时、无创、无辐射的肺通气监测技术,通过围绕胸部体表的电极测量局部肺组织在发生牵张运动时的电阻抗变化实时反映肺通气[8,9]。CoV 值是反映肺整体通气的几何中心,0%代表最腹侧通气,100%代表最背侧通气;阻抗变化小于最大值的10%肺区域定义为静止区,DSS 和NSS 则分别代表背侧和腹侧的局部肺通气不良。静止区代表低通气,DSS 提示肺萎陷、不张;NSS 提示肺区已经扩张或过度扩张[10,13]。EIT 可以实时监测ISB 对肺局部通气的影响,肌间沟臂丛神经阻滞使肺通气中心向背侧移动,同时引起背侧和腹侧的局部肺通气不良。
本研究显示,3 组COV、DSS 和NSS 在行ISB 后均增加,提示在神经阻滞后肺通气中心向背侧移动,同时引起肺背侧和腹侧局部通气减少。ISB 通常在前斜角肌和中斜角肌之间注射局麻药物[14-16],局麻药物除了阻滞臂丛神经,也阻滞前斜角肌腹侧面的膈神经,引起膈肌麻痹[1,17]。膈肌是呼吸的主要动力,膈肌运动的减弱或消失同时可引起肺通气的减弱或消失[1]。杨勇等[18]在对单侧膈神经切断后的幼猪进行大体解剖发现,幼猪膈肌依赖区域的肺泡萎陷发生率更高。肺泡萎陷后该区域肺组织低通气区域增加,而低通气区域可通过EIT 直接观察。ISB 主要通过阻滞膈神经导致膈肌麻痹而肺通气减弱,引起DSS 和NSS 增加。健康成人一次正常通气是由膈肌和辅助呼吸肌共同完成,由于腹腔脏器的影响,仰卧位腹侧膈肌活动度较背侧更小,中心通气区偏向背侧。肌间沟臂丛神经阻滞后,单侧膈肌麻痹腹侧张力降低,腹侧通气的力量减弱,可能导致中心通气区进一步偏向背侧。肌间沟臂丛神经阻滞增加Cov,也是膈神经阻滞的结果。因此,本研究EIT 中COV、NSS 和DSS 的大小可在一定程度上反映ISB 影响肺通气的程度。
本研究发现,A 组较B 组和C 组NSS 和DSS 更低,COV 发生改变更慢,说明使用0.25%浓度的罗哌卡因进行ISB 引起的肺通气功能改变更小。而B组与C 组上述指标基本一致,则可能表示ISB 使用0.33%浓度罗哌卡因和0.50%浓度罗哌卡因对肺通气功能改变无明显差别,而翟文雯等[13]发现ISB 时使用0.25%罗哌卡因与0.50%的罗哌卡因在膈肌麻痹上无明显差别,但其使用的药量为0.25%罗哌卡因20 ml 和0.5%罗哌卡因10 ml,同本研究出现的结果差异可能与使用的总药量不一致有关,而且本研究使用EIT 进行通气监测,在结果显示方面可能更为敏感[19]。本研究中不同浓度的罗哌卡因行ISB后在10 min 内均引起患者DSS 和NSS 增加,而COV 值在20 min 内均出现增加,提示0.25%~0.5%的罗哌卡因20 ml 肌间沟臂丛神经阻滞均可能迅速引起膈神经阻滞。李慧莉等[14]研究发现,膈肌麻痹在阻滞后5 min 即已开始,且0.5%和0.33%的罗哌卡因ISB 比0.25%罗哌卡因增加DSS 和NSS 更加显著,COV 增加更迅速,提示不同浓度的罗哌卡因ISB引起膈神经阻滞存在一定的浓度效应。同时本研究中不同浓度组的改良Bromage 运动评分结果也反映出与肺通气改变相似的浓度效应。有多项RCT 试验发现,ISB 对膈神经麻痹具有一定的浓度效应。
Thackeray EM 等[20]比较0.25%的布比卡因和0.125%的布比卡因行ISB 的效果,结果发现0.125%组的膈神经麻痹发生率较低。Wong AK 等[21]比较使用0.2%和0.1%的罗哌卡因的ISB,同样发现更低的浓度可使膈神经麻痹发生率降低。Pippa P 等[22]发现0.25%布比卡因+1%利多卡因60 ml 比0.5%布比卡因+2%利多卡因30 ml ISB 引起的膈神经阻滞更少。而低浓度ISB 引起的通气改变更小则可能与到达膈神经周围的局麻药量减少有关[1]。本研究采用EIT监测肺通气的变化,与其他研究使用的超声或肺功能测定相比,能更直观地显示不同浓度局麻药所表现出的浓度效应。本研究还显示,0.25%~0.5%的罗哌卡因20 ml ISB 均可以阻滞膈神经,但对血流动力学和呼吸影响轻微。因此,ISB 可能不可避免的引起膈神经阻滞,既往缺乏足够敏感的设备实时观察到这一点。
本研究还存在一些局限性:未在术后对患者行进一步的EIT 和呼吸功能监测;监测的时间较短,没有观察神经阻滞的恢复情况。
综上所述,肺电阻抗成像可以实时监测肺局部通气变化,可用于观察肌间沟臂丛神经阻滞对肺通气的影响,而更高浓度的局麻药物可更快更显著地引起肺通气改变。
