酵母双杂交筛选与牛病毒性腹泻病毒NS4B互作的宿主蛋白
2023-03-08石金凤韩子琪刁乃超邓贺文李健明
丁 媛,石金凤,韩子琪,刁乃超,邓贺文,李健明,3,4,时 坤,3,4*,杜 锐,3,4,5*
(1.吉林农业大学 动物科学技术学院,吉林 长春 130118;2.吉林农业大学 中药材学院,吉林 长春 130118;3.梅花鹿药用资源利用关键技术研究室,吉林 长春130118;4.吉林省梅花鹿高效养殖和产品开发技术工程研究中心,吉林 长春 130118;5.动物生产及产品质量安全教育部重点实验室,吉林 长春 130118)
牛病毒性腹泻病毒(bovine viral diarrhoea virus,BVDV)隶属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus),已在全球88个国家中检测到该病原体。BVDV感染后发病机制复杂,可导致生长迟缓、生殖功能和免疫功能障碍、并发感染和持续性感染(persistent infection,PI)等,给全球养殖业造成了重大的经济损失。BVDV遗传和抗原多样性可能导致诊断和免疫失败[1],使该病毒的防控变得复杂且具有挑战性。了解BVDV与宿主蛋白的相互作用有助于进一步探究BVDV感染和发病机理,从而开发新的治疗方法和免疫策略。
在病毒复制过程中,RNA的合成是由复制复合物(replication complex,RC)介导的。RC由病毒和宿主细胞蛋白组成,其是在内质网膜形成的囊泡中进行组装的膜结合多蛋白。NS4B是黄病毒RC的核心,在调节病毒毒力和先天免疫反应中发挥作用[2]。NS4B也是BVDV复制酶的重要组成部分,与丙型肝炎病毒(HCV) NS4B在免疫原性上具有相似的遗传特征[3-4]。众所周知,BVDV可通过逃避宿主固有免疫系统引起持续感染,研究发现BVDV NS4B可通过抑制MDA5介导的信号转导通路,发挥干扰素-β拮抗剂的作用,从而促进BVDV的增殖[5]。另一研究发现单独的NS4B可诱导自噬体,从而在BVDV复制中发挥重要功能[6]。因此,本试验以BVDV NS4B为诱饵蛋白,利用酵母双杂交技术,从MDBK-cDNA文库中筛选相互作用的宿主蛋白,为进一步了解NS4B蛋白功能以及探究BVDV致病机制提供新的科学依据。
1 材料与方法
1.1 主要材料MDBK-cDNA文库、BVDV NADL株、MDBK细胞、质粒pGADT7-Rec、pGBKT7、pGADT7-T、pGADT7-Lam、pGBKT7-53、Yeastmaker Carrier DNA等由吉林省梅花鹿高效养殖和产品开发技术工程研究中心保存;Y187 Yeast Strain(630457)、Y2H Gold Yeast Strain(630498)、Matchmaker Gold酵母双杂交系统(630489)、酵母双杂交培养基(630494)和c-Myc单克隆鼠源抗体(631206)购自Clontech生物公司;RNA提取试剂盒、琼脂糖凝胶回收试剂盒均购自天根生化科技(北京)有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser、DNA Marker、核酸染料、常规限制性酶和EmeraldAmp®PCR Master Mix(RR300A)均购自TaKaRa公司;Seamless Assembly Cloning Kit购自中美泰和生物公司;Axygen质粒提取试剂盒购自Axygen公司。
1.2 BVDV NS4B基因的扩增根据GenBank中登录的BVDV NS4B基因序列,利用Primer 5.0软件设计引物,上游引物:5′-GAATTCCCGGGG-ATCCCCTAAGAAAAAGCGCAAAGTTGCGTC-GGGTG ACGTGGAAAAAATC-3′,下游引物:5′-TAGTTATGCGGCCGCTGCAGCAGGTTCCTTATTTTCCCTTGTGAG-3′,其中下划线部分表示酶切位点,斜体部分为PKKKRKV核定位信号。引物由吉林省库美生物科技有限公司合成。以BVDV NADL 株cDNA为模板,PCR扩增NS4B基因序列。反应体系:PrimeSTAR Max premix 25 μL,cDNA 0.3 μL,上、下游引物各0.5 μL,ddH2O 补齐至50 μL。反应条件:94℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min,4℃保存。1%琼脂糖凝胶电泳检测扩增产物,测序鉴定正确后保存备用。
1.3 诱饵质粒pGBKT7-NS4B的构建使用限制性内切酶BamHⅠ和PstⅠ分别酶切pGBKT7载体,利用Seamless Assembly Cloning Kit对纯化后的PCR产物和载体进行连接转化,提取质粒,酶切鉴定后,送至生工生物工程(上海)股份有限公司测序。
1.4 诱饵蛋白NS4B表达的鉴定制备Y2H Gold酵母感受态细胞,将诱饵质粒pGBKT7-NS4B和空载体pGBKT7分别转化至酵母感受态细胞中。转化菌液经倍比稀释后涂于SD/-Trp固体培养基,30℃培养3~5 d。对阳性克隆菌落进行PCR鉴定和测序分析,提取酵母细胞总蛋白,Western blot检测BVDV NS4B蛋白的表达情况。
1.5 诱饵蛋白自激活和毒性检测将Y2H Gold[pGBKT7-NS4B]菌液涂于SD/-Trp、SD/-Trp/-Leu(DDO)固体培养基,30℃培养3~5 d,观察菌落生长情况,判断诱饵蛋白NS4B是否具有自激活活性。将Y2H Gold[pGBKT7-NS4B]和Y2H Gold[pGBKT7]菌液分别涂布于SD/-Trp固体培养基,30℃培养3~5 d,观察培养基上菌落生长情况,判断诱饵蛋白NS4B对酵母细胞是否存在毒性作用。
1.6 BVDV NS4B互作宿主蛋白筛选将4 mL酵母菌Y2H Gold-NS4B菌液和1 mL MDBK-cDNA文库接到45 mL 2×YPDA(50 mg/L Kan+)中,30℃低速培养20 h;将菌液室温1 000×g离心10 min弃上清,用10 mL 0.5×YPDA重悬菌体,涂布于QDO/X固体培养基上;同时也将Y2H Gold[pGBKT7-Lam]和Y187[pGADT7-T](阴性对照)、Y2H Gold[pGBKT7-53]和Y187[pGADT7-T](阳性对照)菌液涂布于QDO/X固体培养基上,30℃培养3~5 d;挑取蓝色单菌落进行PCR扩增、质粒抽提和测序。
1.7 BVDV NS4B互作宿主蛋白回返验证从互作蛋白中随机选择9个蛋白,分别设计引物(表1)进行PCR扩增并连接在pGADT7-Rec载体(将其简称为AD)上,然后将以上AD重组载体分别与pGBKT7-NS4B共转化到Y2H Gold酵母感受态细胞中,同时将上述重组质粒与pGBKT7共转做阴性对照组,杂交液倍数稀释后涂在SD/-Trp、SD/-Leu、DDO和QDO/X固体培养基上,30℃倒置培养3~5 d 后,观察培养基上菌落生长情况;根据QDO/X固体培养基上是否生长蓝色菌落来判定NS4B蛋白分别与AKIP1、LY6E、RABAC1、RPS20、SYNGR2、TIMM17B、LGALS1、RPL31、D18.3蛋白是否存在互作关系。

表1 引物信息
1.8 免疫共沉淀验证蛋白的相互作用构建重组质粒pcDNA3.1(+)-3×Flag-RABAC1、pcDNA3.1(+)-3×Flag-SYNGR2、pcDNA3.1(+)-3×Flag-D18.3,同时构建重组质粒pcDNA3.1(+)-HA-NS4B,用BamHⅠ和XhoⅠ对上述重组质粒进行酶切鉴定,构建重组质粒pcDNA3.1(+)-3×Flag-AKIP1,并用EcoRⅠ和XhoⅠ进行酶切鉴定和测序。分别将构建成功的重组质粒与pcDNA3.1(+)-HA-NS4B共转染至HEK293T细胞,转染48 h后用Lysis/Equilibration Buffer提取细胞总蛋白,取50 μL作为input,加入Rabbit Anti-HA抗体室温孵育20 min;Wash Buffer洗涤,加入Neutralization Buffer中和,用Elution Buffer洗脱蛋白,加入蛋白上样缓冲液煮沸5~10 min,Western blot检测蛋白互作情况。
2 结果
2.1 构建诱饵质粒pGBKT7-NS4B以BVDV NADL株cDNA为模板,PCR扩增NS4B基因片段,获得目的片段大小约为1 062 bp的片段(图1),符合预期大小。经纯化、酶切和连接后转化至E.coliDH5α感受态细胞中,挑取单克隆,提取质粒经BamHⅠ和PstⅠ酶切鉴定,分别获得大小约为7 300,1 062 bp的目的片段(图1),符合预期大小。送至生工生物工程(上海)股份有限公司测序比对,构建诱饵质粒命名为pGBKT7-NS4B。
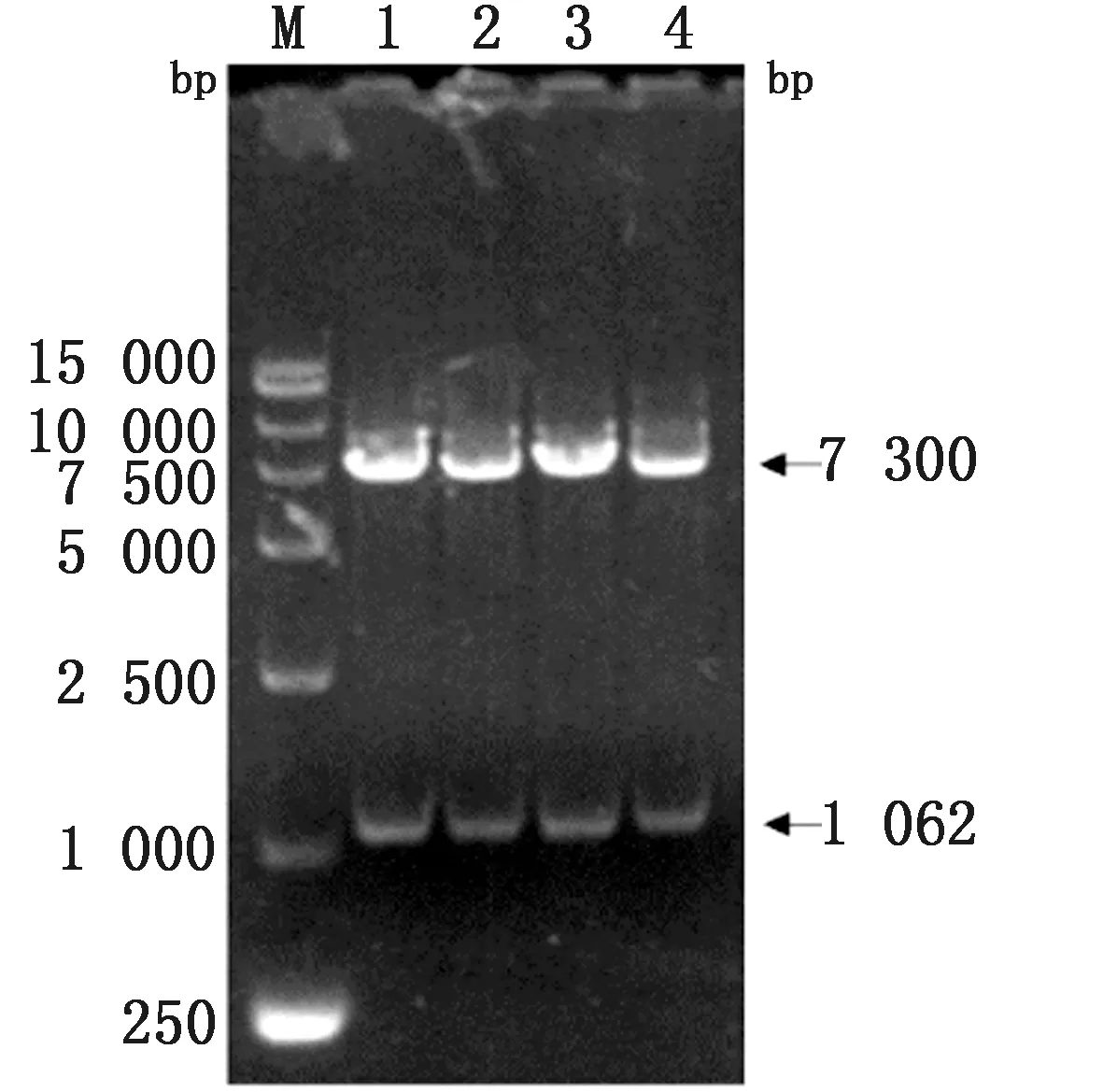
M.DL15000 DNA Marker;1~4.诱饵质粒pGBKT7-NS4B的双酶切产物
2.2 诱饵蛋白NS4B在酵母菌中的表达情况培养并收集重组酵母菌Y2H Gold[pGBKT7-NS4B],提取酵母菌体蛋白,Western blot检测诱饵蛋白NS4B的表达,结果NS4B可在酵母菌中表达,蛋白大小约为40 kDa(图2),对照组Y2H Gold[pGBKT7]菌液未见该蛋白条带,表明诱饵蛋白NS4B可在酵母菌中正确表达。

1.对照质粒pGBKT7;2.诱饵质粒pGBKT7-NS4B
2.3 诱饵质粒pGBKT7-NS4B自激活和毒性检测Y2H Gold[pGBKT7-NS4B]重组菌液在SD/-Trp固体培养基上有菌落生长(图3A),在DDO固体培养基上无菌落生长(图3B),表明诱饵蛋白NS4B无自激活能力。Y2H Gold[pGBKT7-NS4B](图4A)与Y2H Gold[pGBKT7]对照组菌液(图4B)在SD/-Trp培养基上的菌落生长速度及大小无明显差别,表明诱饵蛋白NS4B对酵母细胞无毒性作用,可进行后续试验。
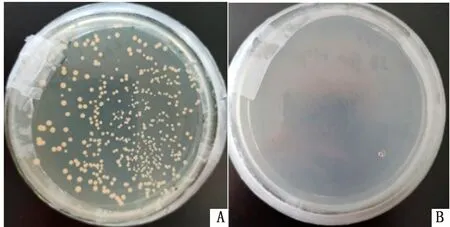
A.Y2H Gold[pGBKT7-NS4B]菌液涂于SD/-Trp培养基;B.Y2H Gold[pGBKT7-NS4B]菌液涂于DDO培养基
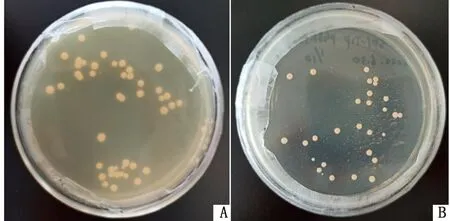
A.Y2H Gold[pGBKT7-NS4B]菌液涂于SD/-Trp培养基;B.Y2H Gold[pGBKT7]菌液涂于SD/-Trp培养基
2.4 酵母双杂交阳性克隆的筛选结果Y2H Gold[pGBKT7-NS4B]与MDBK-cDNA文库菌液杂交后,可观察到杂交液在QDO/X固体培养基上有蓝色单菌落生长,将蓝色单菌落重新转移到新的QDO/X固体培养基上进行复验,复验结果与初筛结果一致(图5)。
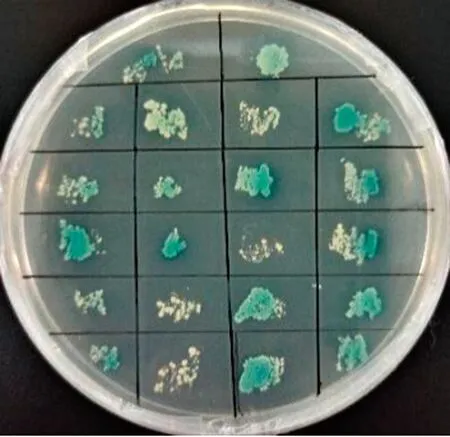
图5 在QDO/X培养基上筛选蓝色克隆菌落的结果
2.5 BVDV NS4B互作蛋白的筛选结果提取QDO/X固体培养基上阳性菌落的质粒,以质粒为模板,NS4B为引物进行PCR扩增,扩增产物直接进行纯化、回收、测序,测序序列经BLAST比对分析,去除相同序列的阳性克隆,初步获得14个与NS4B相互作用的候选宿主蛋白(表2)。

表2 与NS4B相互作用的蛋白筛选结果
2.6 部分互作蛋白的回复杂交试验结果对9种互作蛋白进行了酵母回复杂交试验,杂交液涂布在QDO/X固体培养基上,均出现蓝色单菌落(图6A2~I2),表明这9种蛋白TIMM17B、LGALS1、LY6E、SYNGR2、RPL31、RABAC1、D18.3、AKIP1、RPS20均与NS4B蛋白互作。
2.7 免疫共沉淀结果将构建成功的重组质粒pcDNA3.1(+)-3×Flag-RABAC1、pcDNA3.1(+)-3×Flag-SYNGR2、pcDNA3.1(+)-3×Flag-D18.3和 pcDNA3.1(+)-3×Flag-AKIP1分别与 pcDNA3.1(+)-HA-NS4B分别共转染至HEK293T细胞,转染后48 h裂解细胞,进行免疫共沉淀试验。结果表明,NS4B仅与SYNGR2(图7A)、RABACI(图7B)发生了相互作用。
3 讨论
1989年,有报道首次提出酵母双杂交技术,通过重组转录因子GAL4报告基因的激活检测蛋白质间是否存在相互作用[7]。GAL4由DNA结合结构域(DNA binding domain,BD)和转录激活结构域(activation domain,AD)构成[8]。该技术操作简单、体系成熟、成本较低,可有效检测二元蛋白的相互作用。此外,该方法是在胞内进行反应测定,可避免细胞裂解对反应的影响,该技术已广泛用于蛋白互作研究。ZHANG等[9]利用酵母双杂交技术检测出经典猪瘟病毒(classical swine fever virus,CSFV)NS4B与猪RING指蛋白114(pRNF114)C端结构域存在相互作用,并指出该相互作用可抑制CSFV复制,从而阐明了pRNF114对CSFV的抗病毒机制。QIAN等[10]也使用该技术筛选出CSFV NS4B的互作蛋白FHC,并指出NS4B可能通过与FHC互作影响病毒的复制过程。吴涛等[11]以猪链球菌2型(SS2)透明质酸酶(HYL)作为诱饵蛋白,利用CytoTrap酵母双杂交系统,从人的肺脏组织cDNA文库中筛选与HYL相互作用的蛋白,探索出HYL在SS2致病中的作用。郑博伟等[12]利用酵母双杂交技术筛选出与E种肠道病毒HY12毒株编码VPI蛋白的宿主互作蛋白,为研究牛肠道病毒感染机制及病毒结构蛋白VPI的功能奠定了基础。关于BVDV NS4B互作蛋白的研究较少,因此,本试验将BVDV NS4B蛋白融合到BD载体上,构建了重组质粒pGBKT7-NS4B,与实验室前期制备的MDBK-cDNA文库,进行了酵母双杂交试验。
在试验前期需要确定诱饵蛋白NS4B是否具有自激活活性和对酵母细胞是否有毒性作用。若诱饵蛋白具有自激活活性,则无需与宿主蛋白结合便可直接激活UAS下游基因进行转录,造成假阳性结果。杂交试验是在胞内进行的,若诱饵蛋白对酵母细胞具有毒性作用,则会出现假阴性结果。因此,将诱饵质粒pGBKT7-NS4B转化到Y2H Gold酵母感受态细胞中,转化液分别涂于SD/-Trp、DDO固体培养基上来验证诱饵蛋白NS4B无自激活活性。利用酵母Y2H Gold菌株在氨基酸(Trp、His、Leu或Ade)缺失培养基上无法生长,但BD和AD载体上带有Trp、Leu转化标记,可分别在SD/-Trp、SD/-Leu培养基上生长的特性,将Y2H Gold[pGBKT7-NS4B]与Y2H Gold[pGBKT7]菌液涂于氨基酸缺失培养基上来验证诱饵蛋白NS4B对酵母细胞无毒性作用。

A1.BD+AD-TIMM17B;A2.BD-NS4B+AD-TIMM17B;B1.BD+AD-LGALS1;B2.BD-NS4B+AD-LGALS1;C1.BD+AD-LY6E; C2.BD-NS4B+AD-LY6E;D1.BD+AD-SYNGR2;D2.BD-NS4B+AD-SYNGR2;E1.BD+AD-RPL31;E2.BD-NS4B+AD-RPL31;F1.BD+AD-RABAC1;F2.BD-NS4B+AD-RABAC1;G1.BD+AD-D18.3;G2.BD-NS4B+AD-D18.3;H1.BD+AD-AKIP1;H2.BD-NS4B+AD-AKIP1;I1.BD+AD-RPS20;I2.BD-NS4B+AD-RPS20
采用Y2H系统初步筛选出14种与BVDV NS4B互作的宿主蛋白,均对细胞具有调控作用,参与调节宿主能量代谢、细胞增殖和凋亡等过程,或与病毒感染、复制和免疫逃逸有关。研究表明,GAPDH[13-14]、LY6E[15-17]、RABACI[18-19]、SYNGR2[20-21]、LGALS1[22-24]、RPL31[25]和RPS20[26]蛋白均可与某些病毒蛋白发生相互作用,从而参与病毒的感染和复制过程。AKIP1[27]、TIMM17B[28]、ENTPD6、FAM96B、FLNA[29- 30]、IL-17RA[31-32]、D18.3蛋白参与了细胞凋亡、细胞增殖与分化、免疫反应和遗传疾病等过程,但在病毒学中的功能仍不明确。通过免疫共沉淀进一步明确NS4B与SYNGR2、RABACI发生了相互作用。先前的研究表明,SYNGR2基因突变会影响猪圆环病毒2型(PCV2)病毒的复制能力,SYNGR2被特异性siRNA沉默时,PK15细胞中的PCV2滴度会出现降低[32]。此外,SYNGR2还可能在受监管的外泌体中发挥作用,调节囊泡的形成和成熟。RABACI也是一种高尔基复合体囊泡形成所需的蛋白调节剂,控制囊泡间对接和融合。RABACI可与酵母双杂交系统中的多种异戊二烯化Rabs相互作用,有研究表明,可以通过抑制异戊烯化作用来减弱HCV的复制[32]。
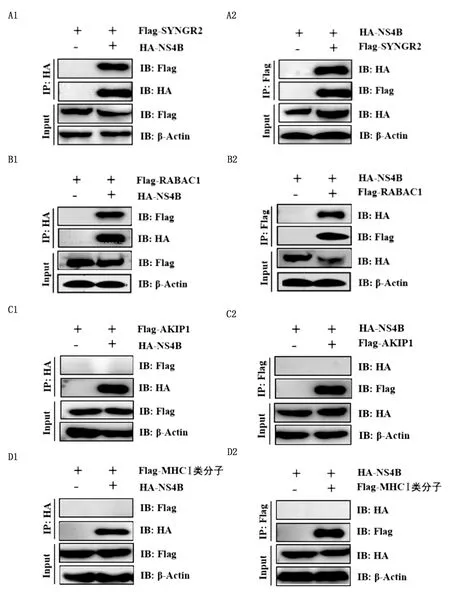
A1,A2.正、反向Co-IP验证NS4B与SYNGR2的相互作用;B1,B2.正、反向Co-IP验证NS4B与RABAC1的相互作用;C1,C2.正、反向Co-IP验证NS4B与AKIP1的相互作用;D1,D2.正、反向Co-IP验证NS4B与MHC-Ⅰ类分子的相互作用
本试验利用酵母双杂交技术筛选出14种与BVDV NS4B互作的宿主蛋白,通过回返试验、正反向Co-IP试验表明BVDV NS4B与SYNGR2、RABACI存在相互作用。为探究BVDV NS4B蛋白在BVDV感染和复制过程中的作用提供了理论依据。
