1株大鲵源葡萄牙柠檬酸杆菌的全基因组测定及毒力基因和耐药基因的分析
2023-03-08杨晓伟刘于畅李毕成骆泽礼赵自亮朱盈名赵光伟
杨晓伟,刘于畅,李毕成,王 艳,骆泽礼,刘 佳,赵自亮,朱盈名,刘 霞,赵光伟,4*
(1.西南大学 动物医学院,重庆 荣昌 402460;2.上海海关动植物与食品检测中心,上海 浦东 200135;3.贵州省动物疫病预防控制中心,贵州 贵阳 550008;4.重庆三杰众鑫生物工程有限公司,重庆 荣昌 402460)
中国大鲵(Chinese giant salamander)俗称娃娃鱼,属两栖纲、有尾目、隐腮鲵科、大鲵属,是世界上现存个体最大的有尾目两栖类动物。大鲵为我国特有的珍稀两栖动物,已被列入国家二级保护动物名录并收录于《濒危野生动植物种国际贸易公约》(CITES)附录Ⅰ[1]。因其在科研、医药、食品和观赏等方面具有重要的价值[2],导致近年来大鲵的人工繁育与养殖业迅猛发展,我国许多有大鲵自然分布的地区都积极开展了人工繁育和养殖,据统计2013年我国大鲵的市场存量约700万尾,2017年已经增至2 000万尾以上[3],养殖数量增长了近3倍。然而,随着大鲵饲养规模及集约化程度的不断发展,大鲵的病害问题日趋严重,因此开展大鲵相关疾病的研究将为大鲵产业的健康发展提供保障。
葡萄牙柠檬酸杆菌(C.portucalensis)是一种革兰阴性兼性厌氧菌,是肠杆菌科柠檬酸杆菌属的成员,存在于人和动物的肠道中,随后经粪便排出也可在多种环境中发现,如污水、土壤等[4]。2017年,第1株葡萄牙柠檬酸杆菌(A60T)是在葡萄牙的水井样本中分离出来的[5]。到目前为止,NCBI数据库中只有29个该菌的基因组数据,说明对该菌的研究相对较少。尽管如此,已有报道证明该菌为机会致病菌[6],其对人和动物造成的潜在致病性不容忽视。
除了致病性,另一个值得注意的是葡萄牙柠檬酸杆菌所表现出的耐药性。有研究表明,分离自家禽的NR-12株[7]、斑点龟的RIT669株[8]和绿叶蔬菜的MBTC-1222株[9]等,均表现出较强的耐药性,这无疑对人类和动物的健康造成潜在的威胁。国内对葡萄牙柠檬酸杆菌的研究较少,而大鲵源葡萄牙柠檬酸杆菌也尚未见报道。因此,对葡萄牙柠檬酸杆菌的耐药性进行研究是十分必要的。鉴于此,本试验对分离自患病大鲵的葡萄牙柠檬酸杆菌进行了全基因组测定及其耐药性分析。
1 材料与方法
1.1 病料及细菌分离重庆开州某大鲵人工繁育场患病大鲵,临床主要表现为皮肤腐烂、腹部膨胀、腹腔积液等症状。无菌采集患病大鲵肝脏接种LB固体培养基,置于30℃恒温培养箱培养18~24 h,挑取单菌落接种于LB液体培养基进行增菌培养18 h,加灭菌甘油,-80℃保存备用。
1.2 16S rDNA测序鉴定参照文献[10]方法,利用DNA提取试剂盒(生工生物工程(上海)股份有限公司,B610367)提取分离菌DNA作为模板,以16S rDNA通用扩增引物(F:5′-AGAGTTTGATCCTGGCTCAG-3′;R:5′-AAGGAGGTGATCCAG-CCGCA-3′,由华大基因科技公司合成)进行PCR扩增。PCR反应体系(25 μL):模板3 μL,10 μmol/L上、下游引物各1 μL,Premix Taq 12.5 μL,无菌ddH2O 7.5 μL。PCR扩增条件:98℃ 5 min;98℃ 60 s,55℃ 45 s,72℃ 60 s,共30个循环;72℃延伸10 min,4℃保存。将PCR产物经1.0%琼脂糖凝胶电泳进行检测后回收目的片段,送华大基因科技有限公司进行测序。
1.3 小鼠致病性试验取10只健康ICR小鼠,随机分成2组,每组5只。第1组为健康对照,腹腔注射0.5 mL灭菌生理盐水;第2组为感染组,每组腹腔注射分离菌0.5 mL,菌液浓度用平板菌落计数法调整至1.0×108CFU/mL,观察并记录小鼠的发病情况,连续观察7 d。
1.4 药敏试验采用K-B纸片法对分离菌进行35种药物的敏感性试验,其中β内酰胺类包括头孢噻肟、头孢拉定、头孢噻吩、头孢曲松、青霉素G、阿莫西林、苯唑西林、氨苄西林、头孢唑啉、头孢氨苄、哌拉西林、头孢他啶、头孢呋辛和羧苄西林等14种药物;氨基糖苷类包括链霉素、庆大霉素、卡那霉素、妥布霉素、新霉素和丁胺卡那等6种药物;喹诺酮类包括环丙沙星、左氧氟沙星、恩诺沙星等3种药物;四环素类药物包括四环素、米诺环素、强力霉素等3种药物;大环内酯类药物3种,包括红霉素、麦迪霉素、乙酰螺旋霉素;磺胺类包括磺胺异恶唑和复方新诺明等2种药物;林可霉素类包括克林霉素和林可霉素等2种药物;还包括多黏菌素类的多黏菌素B和氯霉素类的氟苯尼考。
1.5 全基因组序列的测定及组装细菌全基因组的测定在成都罗宁生物科技有限公司完成。其主要步骤为:提取待测菌株基因组DNA,使其D260/D280在1.8~2.0之间,D260/D230值大于2.0。采用全基因组鸟枪法(whole genome shotgun,WGS)策略,构建约350 bp的文库,利用二代测序技术,基于Illumina HiSeq测序平台的双端测序PE150测序方法进行测序;采用4 bp滑动窗口法去除接头污染,切除两端碱基质量小于3的碱基进行数据过滤;最后利用HGA V1.0[11]进行序列组装,并通过软件SSPACE[12]和QUAST[13]软件对组装后的结果进行进一步的校正和结果评价。随后将全基因组序列信息注册至GenBank数据库,并通过NCBI上的原核基因组注释通道PGAP(prokaryotic genome annotation pipeline,https://www.ncbi.nlm.nih.gov/genome/annotation prok/)对组装后的基因组序列进行注释;利用RAST 数据库(rapid annotations using subsystems technology,http://rast.nmpdr.org/rast.cgi)对编码蛋白进行进一步注释分析;利用病原毒力因子数据库(virulence factors of pathogenic bacteria,VFDB.www.mgc.ac.cn)对细菌的毒力基因进行比对分析。
1.6 耐药基因分析利用耐药基因数据库CARD 3.0.0 (the comprehensive antibiotic resistance database)和ResFinder 3.0对基因组序列进行比对,分析菌株中携带的耐药基因。
2 结果
2.1 患病大鲵的临床表现患病大鲵体长17~39 cm,主要表现为体表、四肢皮肤溃烂(图1A),部分大鲵腹部膨胀,腹腔内有大量混有血液的积液(图1B)。
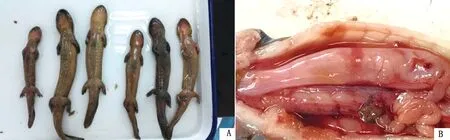
A.患病大鲵外观,可见头颈、四肢部位皮肤溃烂;B.剖检腹腔中有大量积液
2.2 分离菌的形态及16S rDNA鉴定结果病料接种LB培养基可见圆形、白色中等大小菌落,边缘整齐(图2A);革兰染色为阴性杆菌(图2B);随机挑取3个单个克隆进行16S rDNA的扩增,均有单一目的条带(图2C)。阳性PCR产物测序比对,确定分离菌为葡萄牙柠檬酸杆菌,将其命名为CQ-CP1。
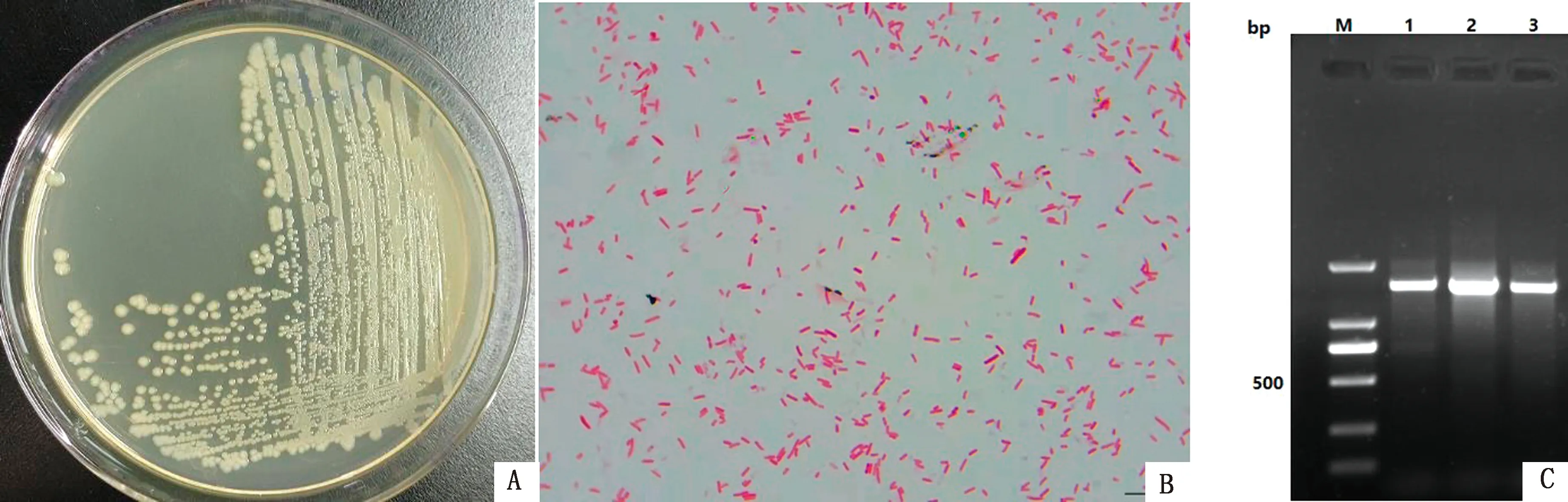
A.分离菌在LB培养基上的形态;B.分离菌革兰染色结果(1 000×);C.分离菌16S rDNA PCR扩增结果(M.DL2000 DNA Marker;1~3.分别为随机挑取单个菌落的PCR扩增产物)
2.3 CQ-CP1对小鼠的致病性在分离菌(CQ-CP1)5×107CFU剂量感染下,小鼠在72 h内全部死亡,病死率100%;阴性对照组未出现死亡。死亡小鼠腹部膨胀,剖检可见肠道鼓气(图3),肝脏有出血。
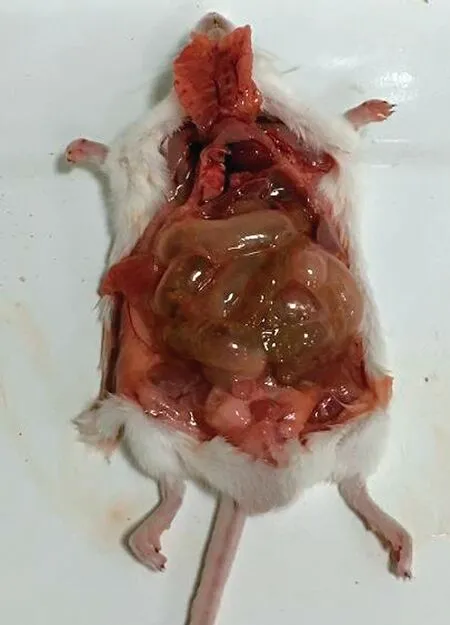
图3 CQ-CP1致死小鼠剖检结果
2.4 CQ-CP1药敏试验结果药敏试验结果发现,CQ-CP1对头孢拉定、头孢唑啉、头孢曲松、羧苄青霉素、头孢他啶和多黏菌素B高度敏感,对头孢噻肟、妥布霉素、阿米卡星和环丙沙星中度敏感;然而对头孢噻吩、青霉素G、阿莫西林、苯唑西林、氨苄西林、头孢氨苄、哌拉西林、头孢呋辛、链霉素、庆大霉素、新霉素、卡那霉素、左氧氟沙星、恩诺沙星、四环素、米诺环素、多西环素、红霉素、麦迪霉素、乙酰螺旋霉素、磺胺异恶唑、复方新诺明、克林霉素、林可霉素和氟苯尼考等25种药物均不敏感,说明CQ-CP1是一多重耐药菌株。
2.5 CQ-CP1全基因组测序结果测序结果表明CQ-CP1共有29个重叠群,碱基数量5 006 960 bp,G+C含量为51.8%,编码4 722个蛋白基因,假基因130个,共有2个rRNA、64个tRNA和5个非编码RNA(ncRNAs),在GenBank中的登录号为RZIH00000000.1。利用RAST对其编码蛋白进行注释,共注释了1 529个基因,其余未能获得注释。从RAST获得的功能分析显示,基因组中有46个基因与铁的获取和代谢有关,226个基因参与蛋白质的代谢,83个基因参与DNA的代谢,65个基因与毒力、疾病和防御相关,76个基因参与膜转运,25个基因与噬菌体、转座因子和质粒有关(图4)。
2.6 CQ-CP1毒力基因注释结果VFDB数据库比对发现,CQ-CP1 中共有49个与其毒力相关的基因(表1),主要包括22个与鞭毛的合成、运动等相关的基因,10个与菌毛的合成、调节、黏附相关的基因,6个与DNA的复制、转录结合相关的基因,5个与其趋化相关的基因,2个与金属铁的摄取转运相关基因,2个与肠杆菌素的输出相关基因,另有外膜蛋白、脂蛋白各1个。
2.7 CQ-CP1耐药基因注释结果通过CARD 3.0.0和ResFinder 3.0这2个数据库的比对发现,CQ-CP1中共携带6个耐药基因,分别是β内酰胺类的blaCMY-35和blaTEM-1A、喹诺酮类的qnrB32和qnrS1、氨基糖苷类的aadA1和磺胺类的dfrA1;耐药基因的详细信息参见表2。
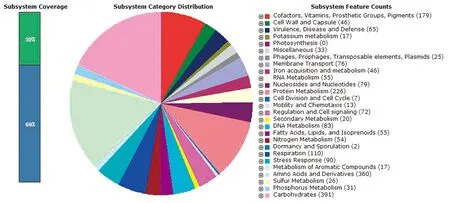
图4 RAST系统注释编码基因功能
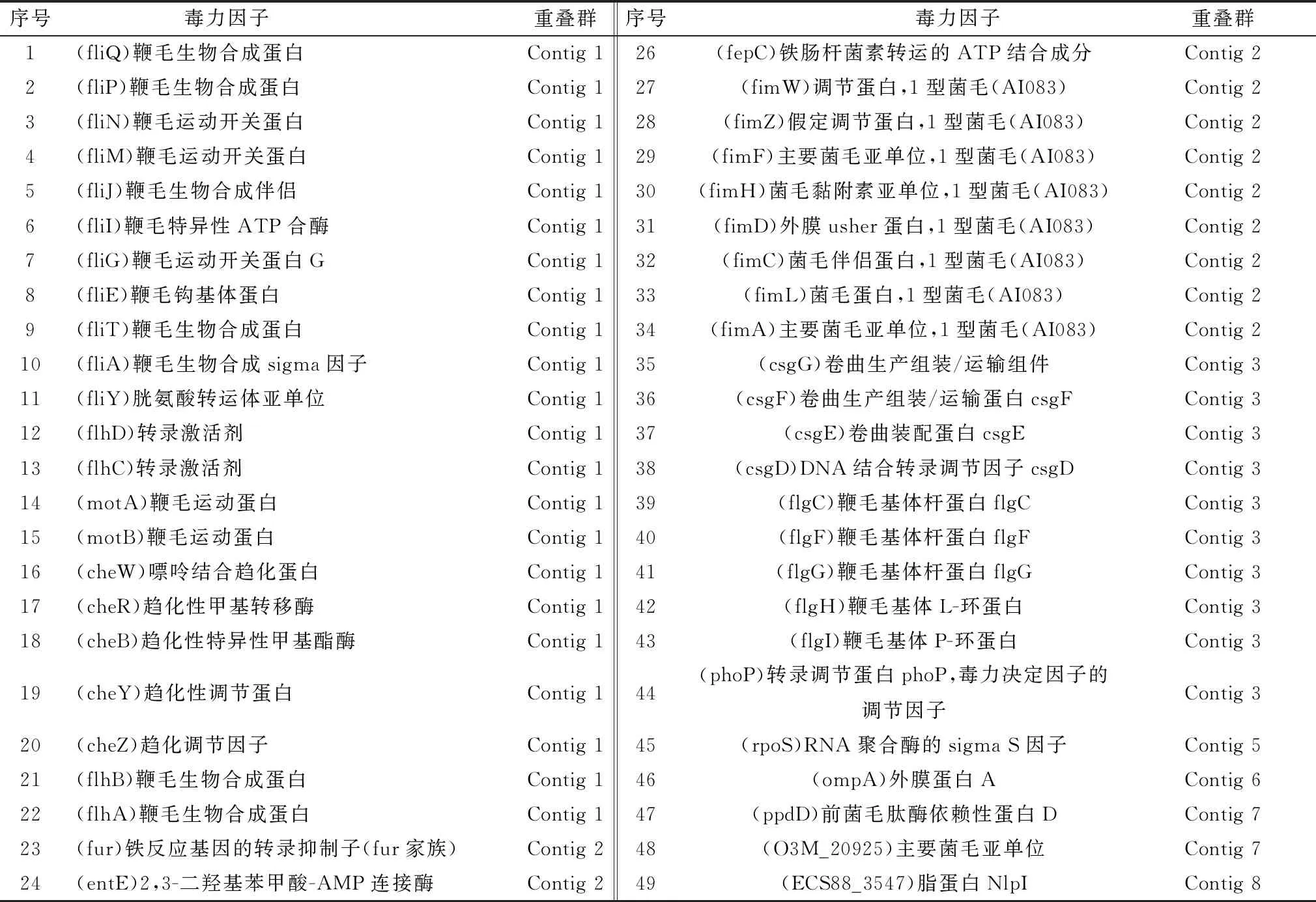
表1 CQ-CP1毒力基因注释结果
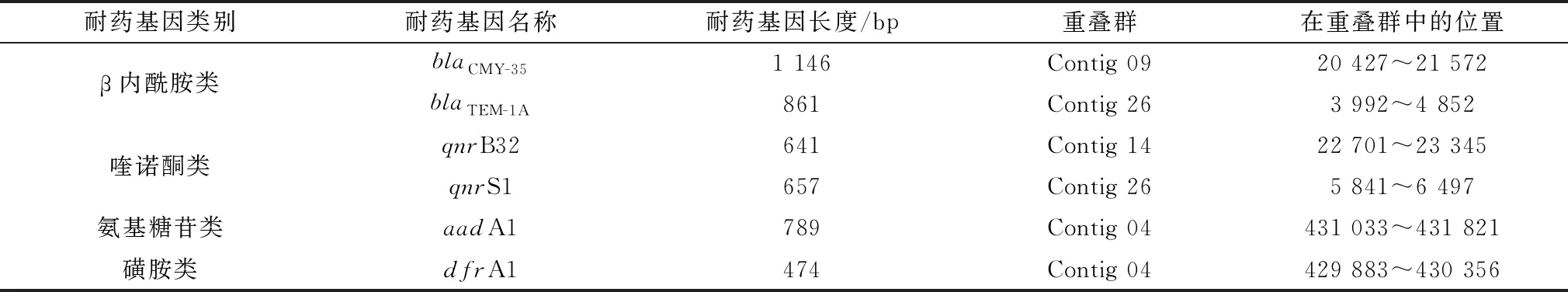
表2 CQ-CP1耐药基因注释结果
3 讨论
随着我国大鲵养殖规模的扩大、集约化程度的提高、放养密度的增加等,导致养殖场不断发生各种病害。引起大鲵疾病的致病原一般包括细菌、真菌、病毒以及寄生虫等,其中细菌性疾病最为常见[14]。本试验中的病鲵来自重庆开州某大鲵人工繁育基地,在此病鲵中分离到多种致病菌,其中一种就是葡萄牙柠檬酸杆菌,这应是首次在该宿主中分离到该菌的报道。致病性试验显示该菌能引起小鼠死亡,且主要侵袭小鼠的消化系统,这与其肠杆菌科的其他成员较类似。随后的毒力基因分析也显示该菌所持有的毒力基因与其他肠杆科细菌较为相似,如大肠杆菌、沙门菌所具有的鞭毛相关蛋白,以及弗氏柠檬酸杆菌(Citrobacterfreundii)所带有的菌毛蛋白等,该结果能够与临床患病大鲵腹腔中大量积液、肝脏肿胀等特征相对应。此外,由于大鲵属于珍稀动物,本试验未将分离菌回归原动物进行致病性研究。
耐药性是柠檬酸杆菌属成员一个不容忽视的问题,由于常表现为低毒力,且能够在宿主体内长期存在并对耐药性进行累积,因而它们会表现出更强的毒性[15]。目前,在巴西龟、家禽、蔬菜上分离到的葡萄牙柠檬酸杆菌均印证了这一观点。本试验分离的CQ-CP1菌株也同样表现出较强的耐药性,对多种抗生素均不敏感,是一典型的多重耐药菌株。全基因组测序并与耐药基因数据库比对显示该菌株中带有6种不同的耐药基因,分别类属于β内酰胺类、喹诺酮类、氨基糖苷类和四环素类,由于数据库所收录耐药基因的限制,该菌株中可能还携带其他耐药元件,例如药敏试验结果显示CQ-CP1对磺胺类和大环内酯类药物不敏感,但并未比对出针对两类药物的耐药基因。
本试验结果表明,6种耐药基因分别是β内酰胺类的blaCMY-35和blaTEM-1A,喹诺酮类的qnrS1和qnrB32,氨基糖苷类的aadA1和磺胺类的dfrA1;结合药敏试验的结果,耐药基因的检出首先与CQ-CP1所表现出的耐药表型是一致的,如对氨苄西林、头孢氨苄、左氧氟沙星、恩诺沙星、卡那霉素、新霉素等药物均不敏感。其次,与临床中不规范使用抗生素药物密切相关,经后期调查该养殖场经常使用恩诺沙星、卡那霉素、新霉素等药物,且使用过程中通常没有进行药敏试验的筛选,根据经验大量投喂,这使得耐药现象在该场较为突出。JIANG等[16]研究表明,qnrB和qnrS是自中国养殖鱼类分离的大肠杆菌中最常见的喹诺酮类基因,与本试验结果一致。然而本试验中的大鲵养殖基地从未使用过磺胺类药物,但CQ-CP1菌株中发现了编码引起磺胺类耐药性的dfrA1基因,推断其很可能是通过饲料、养殖水体环境中从其他鱼类病原体或水生细菌中水平转移过来的,由此可见,耐药菌株的形成机制仍是很复杂的,因而随着我国大鲵人工繁育产业的发展,对其养殖环境中耐药菌株进行持续性跟踪监测对了解其耐药机制的产生是十分必要的。
综上,本试验获得了1份大鲵源葡萄牙柠檬酸杆菌的全基因草图,多种耐药基因的存在揭示该菌株为多重耐药菌株,鉴于其所表现出的致病力及耐药性特征,这种细菌值得持续监测以确定其在兽医乃至人类医学中所存在的健康风险。
