基于变异PEDV的S-N融合双基因蛋白IgA-ELISA抗体检测方法的建立及应用
2023-03-08王隆柏陈秋勇曾宪煜吴学敏车勇良陈如敬周伦江
王隆柏,陈秋勇,曾宪煜,吴学敏,车勇良,陈如敬,周伦江*
(1.福建省农业科学院 畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心,福建 福州 350013;2.长汀县畜牧技术推广站,福建 长汀 366300)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起猪的急性肠道传染病,以食欲下降、腹泻、呕吐和脱水为特征。2010年下半年以来,由于PEDV变异导致该病再次席卷全球,给养猪业造成了重大的经济损失[1-2]。PEDV属于尼多病毒目、冠状病毒科冠状病毒属成员,为单股正链RNA病毒,编码纤突蛋白(S蛋白)、小包膜蛋白(E蛋白)、膜糖蛋白(M蛋白)和核衣壳蛋白(N蛋白)等4种主要结构蛋白[3]。PEDV S蛋白由S基因编码,1 383个氨基酸构成。S 蛋白可分为S1(第1~789位氨基酸)和 S2(第790~1 383 位氨基酸)2 个功能区[4],其中 S1 区包含了病毒主要的中和表位和受体结合域,有3 个诱导中和抗体产生的表位和1个诱导中和抗体产生的区域 (第499~638位氨基酸)。S 蛋白具有识别靶细胞并且使病毒和细胞膜融合的作用[5],且在介导病毒感染、侵入细胞以及毒株变异、抗原和毒力改变等方面均起关键作用[6-7]。N蛋白由 441个氨基酸组成,具有高度保守性,含 6~7个潜在的磷酸化位点。N蛋白是病毒的主要免疫蛋白之一,能够诱导机体产生特异性的抗体免疫和细胞免疫,猪在早期感染PEDV,就可以产生抗N蛋白的高水平抗体[8-9],使其成为早期诊断的靶蛋白。
由于PEDV与猪传染性胃肠炎病毒(TGEV)、猪轮状病毒(PoRV)及博卡病毒在流行病学、临床症状和病理表现极其相似,因此本病仅依据流行病学、临床症状和病理变化很难做出诊断,特别是与TGEV和德塔病毒不易区别,必须依靠实验室技术才能作出诊断。目前,已建立的PEDV诊断方法有病毒分离、免疫电镜、免疫荧光、间接血凝试验、夹心酶联免疫吸附试验、RT-PCR、荧光定量RT-PCR方法等[10],适用于对病毒的病原检测。在抗体检测方面虽然建立了中和试验、IgG-ELISA和IgA-ELISA抗体方法,但病毒中和试验操作繁杂并且耗时长,采用全病毒包被建立的ELISA方法存在病毒培养困难且多容易造成病毒扩散。IgG-ELISA抗体检测方法主要用于检测血清中的抗体,IgA-ELISA抗体检测方法主要用于检测乳汁中的抗体,且应用截断的S蛋白或单个N蛋白建立的ELISA方法仅能检测到单个蛋白产生的抗体,而采用变异PEDV毒株S-N融合蛋白作为包被抗原建立ELISA方法,在血清和乳汁中检测S蛋白和N蛋白产生的PEDV的IgA抗体未见报道。
鉴于此,本研究通过截取变异PEDV S蛋白具有诱导中和抗体产生的区域(第499~638位氨基酸)与N蛋白融合,通过真核表达载体,获得具有免疫原性的S-N融合双基因蛋白。以S-N真核蛋白为包被抗原,通过ELISA反应条件优化,建立在血清和乳汁中检测PEDV的S蛋白和N蛋白IgA抗体ELISA 方法,为该病的血清抗体调查和免疫疫苗效果评估奠定基础,为防控PEDV提供科学依据。
1 材料与方法
1.1 主要材料磷酸盐包被缓冲液、BSA、山羊抗猪IgA-HRP(辣根过氧化物酶)、TMB显色液、终止液、洗涤液均购自Abcam生物公司;TGEV、PoRV阳性血清均购自哈尔滨动物生物制品国家工程研究中心有限公司;伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)阳性血清均购自IDEXX公司;进口商品化ELISA抗体检测试剂盒购自BIONOTE 公司;PEDV的S-N双基因融合蛋白、PEDV阳性血清、阴性血清均由本实验室制备与保存。
1.2 S-N融合蛋白的制备参照文献[2]方法进行。采用同源重组的原理,通过扩增变异PEDV的S、N基因,连接到真核表达载体,构建S-N双基因融合质粒,再将融合质粒转染到293T细胞中,表达出相应的S-N双基因融合蛋白。采用按EQKLISEEDL纯化试剂盒说明进行纯化获得蛋白,作为ELISA方法的包被抗原。
1.3 优化包被蛋白质量浓度将蛋白分别以1,2,4 mg/L 稀释,每个稀释度做8孔重复,100 μL/孔,4℃过夜;5% BSA封闭液封闭抗原蛋白,300 μL/孔,37℃孵育2 h;洗板,加入阳性血清与阴性血清分别1∶10稀释,100 μL/孔,37℃孵育1 h;洗板,再加入1∶10 000稀释羊抗猪HRP,100 μL /孔,37℃孵育30 min;洗板,加入TMB显色液,100 μL/孔,避光37℃孵育10 min;加入终止液,50 μL/孔,摇匀;用酶标仪读取D450 nm值,P代表阳性血清的D450 nm值,N代表阴性血清的D450 nm值,选择P/N值最大者为最佳包被抗原质量浓度。
1.4 优化包被蛋白时间选用2种包被时间进行优化,分别为4℃过夜和37℃孵育2 h。阴性血清和阳性血清分别以1∶10稀释,进行ELISA测定,最后比较450 nm波长下阴性、阳性血清的P/N值,最大者为包被条件最适时间。
1.5 优化最佳封闭液以最适抗原蛋白的包被质量浓度和最佳包被时间包被酶标板,洗板,分别用PBST、1% BSA、2% BSA、5% BSA进行封闭,300 μL/孔,37℃孵育2 h,阴性血清和阳性血清分别以1∶10稀释,进行ELISA测定,最后比较450 nm 波长下阴性、阳性血清的P/N值,最大者为最佳封闭液。
1.6 优化酶标抗体稀释度以最适抗原蛋白包被和最适封闭条件封闭,阳性血清和阴性血清1∶10稀释,37℃孵育1 h;洗板,加入抗猪IgA-HRP 1∶2 500,1∶5 000,1∶10 000,1∶20 000,1∶40 000,1∶80 000稀释,100 μL/孔,37℃孵育30 min;洗板,进行ELISA测定。最后比较450 nm波长下阴性、阳性血清的P/N值,最大者为最佳稀释度。
1.7 优化血清稀释度阳性血清和阴性血清1∶10,1∶20,1∶50,1∶100,1∶200,1∶400稀释,37℃孵育1 h,洗板,进行ELISA测定。最后比较450 nm波长下阴性、阳性血清的P/N值,最大者为最佳稀释度。
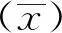
1.9 特异性试验利用已建立的ELISA方法检测PoRV、TGEV、CSFV、PRRSV、PRV阳性血清,血清按照1∶50稀释,并设立阳性和阴性对照,检测方法的特异性。
1.10 敏感性试验选取阳性血清,在稀释1∶200的基础上分别进行倍比稀释,并设立阳性和阴性对照,检测建立方法的敏感性。
1.11 重复性试验
1.11.1批内重复性 在同一批制备的ELISA板中,随机挑选8份血清,按照1∶50稀释,每个血清各做3个孔,计算s和变异系数(CV),分析批内重复性。
1.11.2批间重复性 在随机选择3批制备的ELISA板中随机挑选8个血清,按照1∶50稀释,每个血清各做3个孔,计算s和CV,分析批间重复性。
1.12 临床检测利用已建立的ELISA检测方法对从不同规模猪场采集的179份血清样品和125份乳汁样品进行临床检测,并用对照商品化试剂盒进行检测,最后进行统计和分析,比较两者之间的符合率。
2 结果
2.1 包被抗原蛋白最适质量浓度的确定结果显示,当抗原蛋白质量浓度为2 mg/L时,P/N值为最佳(表1)。
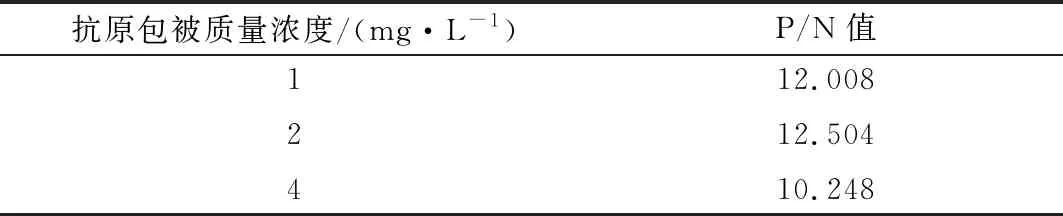
表1 包被抗原蛋白质量浓度优化
2.2 包被最佳时间的确定结果如表2所示,抗原蛋白在4℃包被过夜,P/N值为最佳。

表2 抗原蛋白包被时间优化
2.3 最佳封闭液的确定结果显示,使用5% BSA (BOSTER)作为封闭液,P/N值为最佳(表3)。

表3 封闭液优化
2.4 酶标抗体稀释度的优化由表4可见,Anti-pig IgA酶标二抗稀释度为1∶20 000,P/N值最大。

表4 Anti-pig IgA酶标抗体浓度优化
2.5 血清稀释度的优化结果显示,当血清稀释度为1∶50时,P/N值最大,效果最佳(表5)。

表5 血清稀释度优化
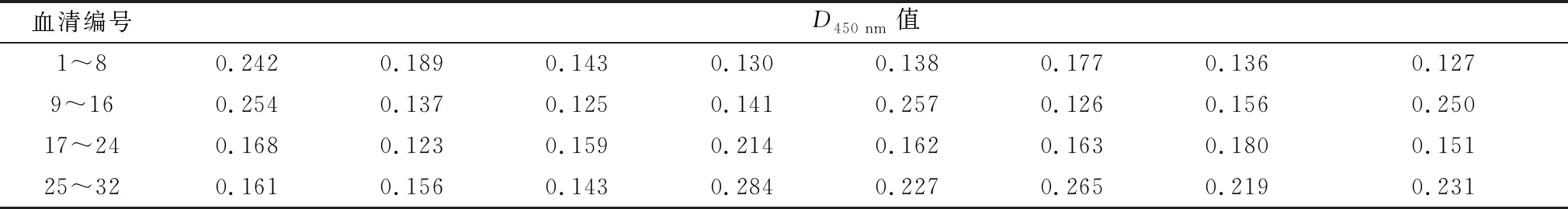
表6 阳性与阴性临界值的确定
2.7 敏感性试验结果如表7所示,该检测方法能检测到1∶3 200倍稀释的血清抗体,具有较好的敏感性。
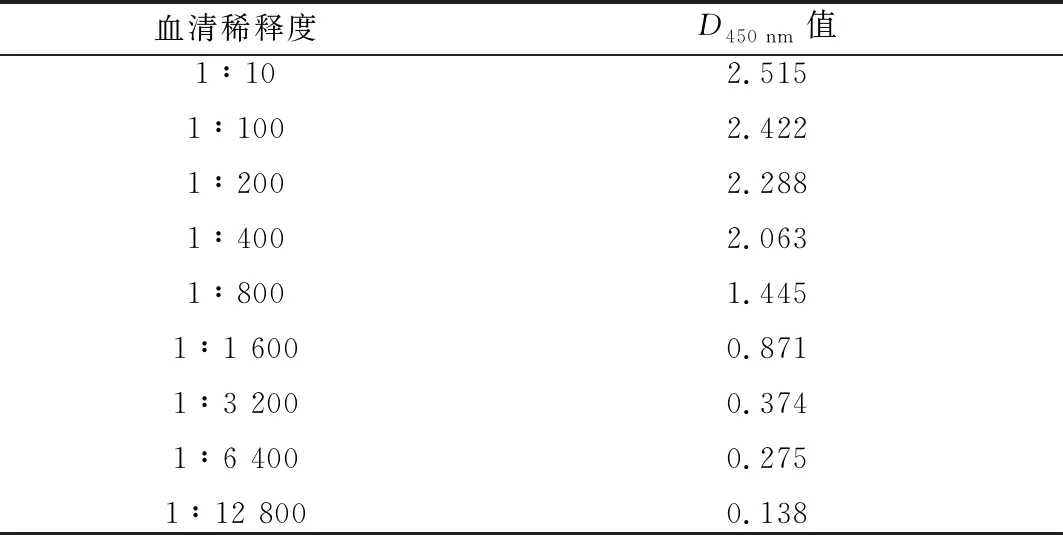
表7 敏感性测定
2.8 特异性试验结果如表8所示,该检测方法检PRRSV、PRV、CSFV、TGEV、PoRV阳性血清均是阴性,无交叉反应,仅检测PEDV阳性血清为阳性。

表8 特异性测定
2.9 重复性试验结果如表9所示,检测方法在批内重复性和批间重复性的CV均小于10%,说明建立的检测方法具有很好的重复性。
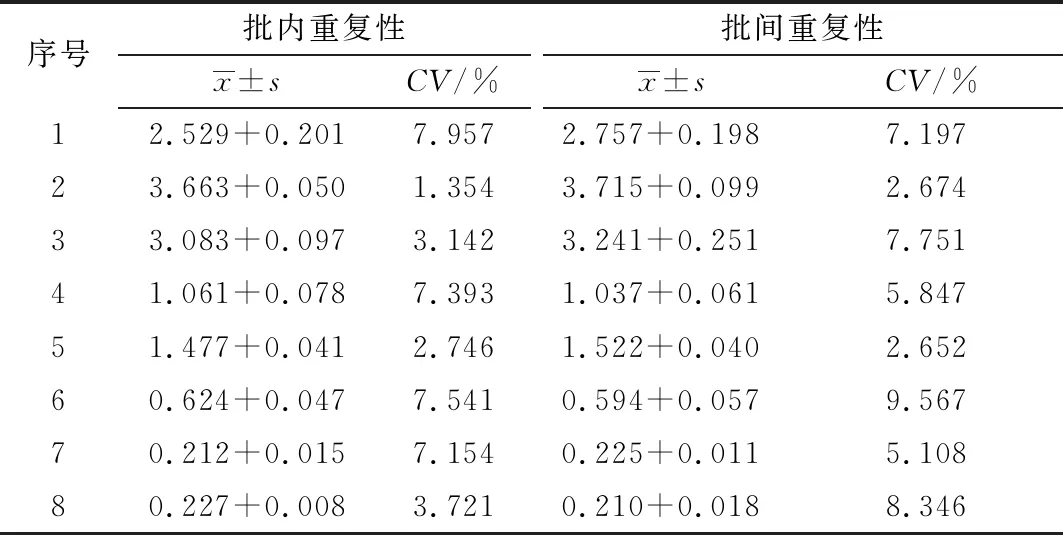
表9 重复性测定
2.10 临床检测共检测血清179份,利用进口商品化检测试剂盒,检测得到阳性样品135份,阴性样品44份;利用本研究建立的方法检测出阳性样品137份,阴性样品42份,与进口试剂盒的阳性符合率达到了97.8%,阴性符合率达到90.9%,总符合率为93.2%,见表10。共检测乳汁125份,利用进口商品化检测试剂盒检测得到阳性样品101份,阴性样品24份;利用本研究建立的方法检测出阳性样品104份,阴性样品21份,与进口试剂盒的阳性符合率达到100.0%,阴性符合率达到 87.5%,总符合率为 93.75%(表11)。表明建立的ELISA检测方法适用于PEDV的临床样品检测,对监测PEDV疫苗免疫抗体或猪群的感染情况具有重要意义。
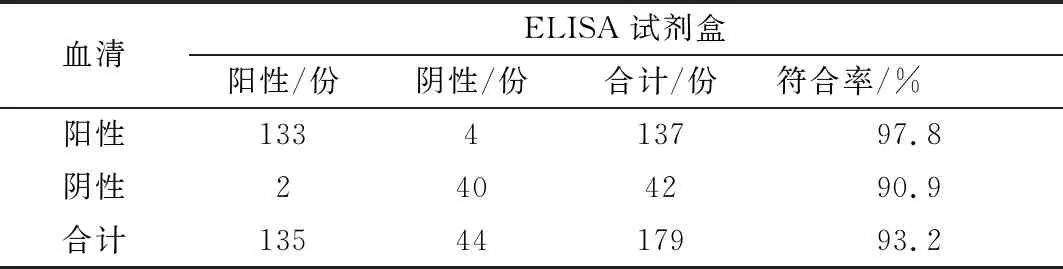
表10 建立的方法与ELISA试剂盒检测血清比较
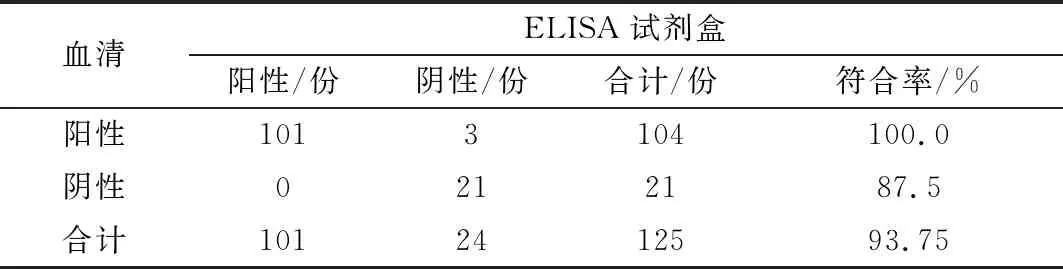
表11 建立的方法与ELISA试剂盒检测乳汁比较
3 讨论
PED是导致猪群腹泻尤其是哺乳仔猪发病死亡的重要疫病,2010—2011年严重影响了我国的生猪养殖业,现在仍时有发生。该病一年四季都可发生,但以寒冷的冬、春季节发病更为严重。当前,PED的防控主要在做好猪场生物安全的情况下,采用弱毒疫苗或灭活疫苗在母猪群产前免疫,由于出生仔猪免疫功能不完善,产生自身免疫抗体十分弱,仔猪只能通过从母猪的乳汁中获得母源抗体,从而达到保护仔猪的效果。大量研究表明,仔猪通过母猪乳汁获得母源的抗体主要为肠道黏膜分泌的IgA 抗体,IgA 抗体能抵御入侵的病原体,仔猪从而获得被动免疫保护。IgA 作为黏膜免疫系统的重要效应因子,其主要特性是多链性、黏膜亲和性以及对蛋白酶的抵抗性,这有助于抗体对病毒的亲和作用,并具有阻抑黏附、免疫排除和中和病毒等多种生物功能[11-12]。可见,PED疫苗免疫后母猪乳汁中的 IgA 抗体水平是评价疫苗免疫原性的一项重要指标,检测血清中的IgG 抗体来评价疫苗保护的方法存在缺陷。鉴于血清特异PEDV IgA抗体水平与局部黏膜免疫水平呈正相关[13-14],通过该方法检测血清中的IgA抗体,能间接反映出乳汁中IgA抗体的情况。因此建立一种安全、稳定的IgA 抗体 ELISA 检测方法对PED的防治具有重要临床实践意义。
在PEDV ELISA抗体检测方面,王丽珍等[15]通过纯化的PEDV为包被抗原,建立了检测PED IgG抗体间接ELISA检测方法,与哈尔滨动物生物制品国家工程研究中心有限公司提供的商品检测试剂盒的符合率为81%。丁振江等[16]通过S 蛋白 S1 亚基的S1D区 (636~798 aa),原核表达出S1D区蛋白,并以该蛋白建立了检测PED IgA 抗体间接 ELISA 检测。该方法能检测到240 倍稀释的阳性乳汁,和韩国BIONOTE 公司生产的 IgA 抗体检测试剂盒进行对比,符合率为93.82%,但该方法只能检测到乳汁中IgA抗体。陈静等[17]通过S蛋白的N端高变区(22~380 aa),原核表达出了S蛋白,并以该蛋白建立了检测PED IgG抗体间接 ELISA 检测方法。郑逢梅等[18]将PEDV N基因上2个大的抗原表位区(112~321 aa)克隆至原核表达载体pET-32α,表达出N蛋白,并建立了基于N基因主要抗原表位检测IgG的ELISA方法,该方法与深圳芬德生物技术有限公司的PDE抗体诊断试剂盒的符合率100%。这些检测方法中有采用PEDV全病毒、截断的S蛋白或N蛋白作为包被抗体建立了IgG-ELISA抗体检测方法,也有采用截断的S蛋白作为包被抗原建立IgA-ELISA抗体检测方法,但这些方法存在病毒扩散带来的风险或只能检测血清中的IgG抗体或乳汁中的IgA抗体,且都存在不能同时检测到血清中和乳汁中S、N蛋白IgA抗体的局限性。
本研究通过采用真核表达载体表达出的S-N双基因融合蛋白,作为包被抗原,建立了PEDV IgA-ELISA抗体检测方法。该方法检测PRRSV、PRV、CSFV、TGEV、PoRV阳性血清结果均是阴性,即为无交叉反应,能检测到1∶3 200倍稀释的血清抗体,批内重复性和批间重复性的CV均小于10%,与BIONOTE 公司生产的 IgA 抗体商品化检测试剂盒总符合率达到93.2%以上,可同时检测到血清和乳汁中PEDV的IgA抗体。因此,本研究建立的PEDV IgA-ELISA抗体检测方法,适合对PED的抗体监测和疫苗免疫进行效果评价,为进一步确保猪群健康提供了有力的技术支撑。
