黑曲霉高耐热葡聚糖酶的分子截短与制备条件优化
2023-03-07吴尚武杨梦莲沈微单逸蓝王施岚杨海泉夏媛媛陈献忠
吴尚武,杨梦莲,沈微*,单逸蓝,王施岚,杨海泉,夏媛媛,陈献忠
1(江南大学 生物工程学院, 工业生物技术教育部重点实验室,江苏 无锡,214122)2(苏州药明康德新药开发有限公司,江苏 苏州,215000)
β-葡聚糖广泛存在于植物细胞壁中,在大麦、高粱等饲料类作物中有较高的含量。大分子质量葡聚糖具有很高的黏度,在饲料中葡聚糖引起的高黏度一方面影响动物对饲料的消化吸收,另一方面造成粪便的高黏度而带来环境卫生问题[1]。大麦中的葡聚糖主要在啤酒工业中造成麦汁的高黏度而影响其过滤[2]。β-葡聚糖酶能降解葡聚糖降低其黏度从而改善麦汁的过滤性能、提高饲料的消化吸收效率[2]。在啤酒工业中,β-葡聚糖酶主要在糖化工段中使用,麦汁糖化需要在高温条件下进行,有时温度可达65 ℃以上[3]。饲料中的β-葡聚糖酶主要在动物的肠道中发挥作用,但饲料生产中的造粒过程却是一个高温过程[4]。在饲料工业中,禽类饲料的造粒温度往往比较高。为了适应禽类的摄食习惯,高质量的禽类饲料需要有较高的颗粒稳定性。提高饲料颗粒稳定性的一个重要方法是利用高温使饲料中的淀粉充分糊化,糊化的淀粉在干燥后形成较高的粘结力从而提高饲料的颗粒稳定性。为了实现淀粉充分糊化,禽类饲料的造粒温度往往在80 ℃以上[5]。因此高耐热葡聚糖酶在饲料工业上有广阔的应用前景,国内外研究者对高耐热葡聚糖酶进行了大量探索性的研究[6-9]。本课题组前期工作中从黑曲霉基因组中克隆了一条编码葡聚糖酶的基因eglA6,该基因表达产物的耐热性显著高于此前报道的来源于黑曲霉的葡聚糖酶[10]。之后的研究发现eglA6在乳酸克鲁维酵母中的表达产物AnEglA6K具有更高的热稳定性,在80 ℃下的酶活力半衰期可达65 min,能较好的适应禽类饲料生产的需要[11]。本文研究通过截短AnEglA6K分子大幅度提高该基因表达水平的方法。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
表达宿主菌乳酸克鲁维酵母KluyveromyceslactisGG799、表达载体pKLAC1,纽英伦生物技术(北京)有限公司;表达宿主菌巴斯德毕赤酵母PichiapastorisGS115、表达载体pPIC9K,Invitrogen公司。用作基因克隆模版的重组质粒pPIC9K-eglA6为本课题组前期构建[10],重组大肠杆菌EscherichiacoliJM109/pPIC9K-eglA6已保藏在中国高校工业微生物资源信息平台,保藏编号为CICIM B6953。表达eglA6成熟肽全长基因的重组菌K.lactispKLAC1-eglA6 SL105[11],P.pastorisGS115/pPIC9K-eglA6b HB133[10]均为本课题组前期构建,用于酶学性质及发酵性能的比较研究。上述2株重组菌以及本文构建的重组菌乳酸克鲁维酵母GG799/pKLAC1-eglA6c KlW114和巴斯德毕赤酵母GS115/pPIC9K-eglA6c PpW5均已保藏在中国高校工业微生物资源平台,保藏编号分别为CICIM Y7062、CICIM Y1489、CICIM Y7093、CICIM Y7094。
1.1.2 酶及主要试剂
质粒小量提取试剂盒、DNA片段回收试剂盒等,康宁生物(吴江)有限公司;DNA聚合酶、限制性内切酶、DNA连接酶、核酸电泳marker,宝日医生物技术有限公司;引物合成及DNA测序,苏州金唯智科技有限公司;微晶纤维素,上海叶源生物科技有限公司;蛋白标准分子质量,翌圣生物科技有限公司;大麦葡聚糖、地衣多糖、羧甲基纤维素钠等,MegaZyme公司;大豆蛋白胨,北京鸿润宝顺科技有限公司;大豆蛋白肽,山东佰诺生物科技有限公司;酵母氮基YNB,Difco公司;镍亲和层析填料,无锡天演技术有限公司;其余所用试剂均为国产分析纯试剂。
用于酶活力检测的底物滤纸为新华滤纸,棉花为医用脱脂棉,O/O,为不含碳源和氮源的合成培养基。
1.1.3 培养基与试剂
用于大肠杆菌培养的LB培养基和酵母培养的YPD培养基等同文献[12]。用于乳酸克鲁维酵母重组菌筛选及发酵的培养基如下:
YCB培养基(g/L):YNB 3,葡萄糖 5,乙酰胺 0.3。
YPG2培养基(g/L):半乳糖30,酵母粉10,酪蛋白胨30,KH2PO43,K2HPO4·3H2O 2。充分溶解后用HCl或NaOH调整pH值至5.5。
YPS培养基(g/L):蔗糖30,酵母粉10,酪蛋白胨30,KH2PO43,K2HPO4·3H2O 2。充分溶解后用HCl或NaOH调整pH值至5.5。
巴斯德毕赤酵母重组菌筛选所使用的MD培养基、摇瓶发酵BMGY、BMMY培养基等均按文献[12]一般方法配制。
结合缓冲液:称取29.2 g NaCl和1.4 g咪唑用20 mmol/L的Na2HPO4和10 mmol/L的NaH2PO4溶解定容至1 L,并调节至pH 7.4。
洗脱缓冲液:称取29.2 g NaCl,34.0 g咪唑用10 mmol/L的NaH2PO4溶解定容至1 L,并调节至pH 7.4。
1.2 实验方法
1.2.1 葡聚糖酶表达载体构建
根据eglA6的核苷酸序列(NCBI登录号:MG913988)设计引物如下:
Pj101:5′-AATTACCGTACGTAAGTCCGAGGGCT AAGCGG-3′
Pj102:5′-AATTACCGGCGGCCGCTTAGTGGTGGT GATGGTGGTGATACCCCTCCAACACC-3′
Pj201:5′-AATTACCGAGATCTAGTCCGAGGGCT AAGCGG-3′
Pj202:5′-AATTACCGGTCGACTTAGTGGTGGTGA TGGTGGTGATACCCCTCCAACACC-3′
以重组质粒pPIC9K-eglA6为模板,通过PCR扩增目的基因。PCR反应条件为98 ℃预变性3 min;95 ℃变性30 s,55 ℃退火15 s,72 ℃延伸1 min,30个循环。以Pj101和Pj102为引物的扩增产物经纯化后用SnaB I和NotI酶切,纯化后与同样经过酶切的质粒pPIC9K连接,连接物转化大肠杆菌JM109,转化子提取质粒后用SnaB I和NotI酶切。Pj201和Pj202为引物的扩增产物按上述同样方法操作,将核酸内切酶更换为BglⅡ和SalI。
1.2.2 酵母转化及筛选
乳酸克鲁维酵母GG799感受态细胞制备方法同文献[11]。大量提取用于乳酸克鲁维酵母表达的重组质粒,用核酸内切酶BstX I酶切线性化后用DNA片段纯化试剂盒纯化。取克鲁维酵母感受态细胞90 μL,加入线性化质粒10 μL,混合后转入预冷的电转化杯中,冰浴10 min。1 200 V连续电击2次,迅速加入冰水预冷的山梨醇溶液900 μL,悬浮菌体。菌体涂布以乙酰胺为唯一碳源的YCB培养基平板。培养72 h,任选300个单菌落划线分离,划线平板培养48 h形成单菌落后在4 ℃冰箱保藏并逐个发酵鉴定。
巴斯德毕赤酵母感受态细胞制备方法同文献[12]。用于巴斯德毕赤酵母表达的重组质粒用BglⅡ酶切线性化后转化巴斯德毕赤酵母感受态细胞。转化方法以及重组菌摇瓶发酵鉴定的方法均同文献[10,12]。
1.2.3 重组蛋白表达与纯化
由于2种重组酵母表达产物的C端均带有His-tag标签,因此采用Ni柱进行亲和层析分离纯化。方法如下:吸取1 mL Ni-NTA填料(0.5 mL床体积)到15 mL分离管中,打开下端管口并静置将上清液体全部放出,依次用10 mL超纯水,10 mL结合缓冲液各洗涤填料层2次,静置放出上清液后将10 mL发酵上清液与填料摇晃振荡25 min使酶与Ni填料结合。振荡完毕后先放出上清液,先用10 mL结合缓冲液缓慢洗涤填料层2次,再加入5 mL洗脱缓冲液洗涤填料层。收集洗涤组分用SDS-PAGE分析。
1.2.4 重组酶检测与性质分析
酶活力检测、酶学性质分析等方法均与文献[11]相同。其中酶活力(U)定义为以大麦葡聚糖为底物,在70 ℃下,每分钟分解底物产生的还原糖,其还原力相当于1 μmol葡萄糖所需的酶量。
2 结果与分析
2.1 葡聚糖酶AnEglA6的结构分析
在已见报道的葡聚糖酶中,与AnEglA6同源性最高的是黑曲霉来源的另一种葡聚糖酶AnCelA[13],两者氨基酸同源性为50.63%[11]。YAN等[13]研究了AnCelA在巴斯德毕赤酵母中的表达并获得了表达产物的晶体结构。以AnCelA三级结构为依据利用I-Tasser软件[I-TASSER server for protein structure and function prediction (zhanggroup.org)]进行同源建模,结果见图1-a,AnEglA6由催化结构域、连接桥和纤维素结合结构域(cellulose binding domain, CBD)3个相对独立的部分组成,其中后2个部分与水解结晶型纤维素有关[14],而水解葡聚糖的功能很可能可以由催化结构域独立完成[15]。据此,将AnEglA6中与后2个结构域对应的羧基端的81个氨基酸残基截去后再进行同源建模,结果如图1-b所示,截短后的肽链形成的三级结构与AnEglA6的催化结构域几乎完全相同。由上述分析看,AnEglA6的羧基端81个氨基酸残基很可能可以截去,由此可以获得一个分子质量减小而葡聚糖水解功能仍然保留的新型葡聚糖酶。

a-AnEglA6K;b-AnEglA6cK
2.2 重组质粒的构建
以重组质粒pPIC9K-eglA6为模板,分别以Pj101、Pj102和Pj201、Pj202为引物进行PCR扩增,获得的扩增片段约为0.9 kbp,与预计的eglA6基因的截短体大小一致,为便于叙述截短体基因命名为eglA6c。上述扩增产物按本文1.2.1的方法酶切纯化后与载体连接,分别获得重组质粒pPIC9K-eglA6c和pKLAC1-eglA6c,图2为重组质粒酶切电泳图。将上述两个质粒分别进行测序,结果显示2个重组质粒中的插入片段的碱基序列与eglA6基因对应区域的序列完全一致。
M1-DL 10000 marker;M2-DL 2000 marker
2.3 重组酵母的构建与重组酶的表达
大量提取重组质粒pPIC9K-eglA6c用核酸内切酶BglⅡ酶切线性化后电转化巴斯德毕赤酵母GS115,任选20个转化子菌落摇瓶发酵并检测酶活力。结果显示其中13个转化子发酵上清液中有明显的葡聚糖酶活力,对照菌即空质粒pPIC9K的转化子则均没有酶活力。上述13个转化子中5#转化子发酵获得最高酶活力,为2 006 U/mL,9#转化子酶活力最低为1 324 U/mL,13个转化子的平均酶活力为1 501 U/mL。其中5#转化子命名巴斯德毕赤酵母GS115/pPIC9K-eglA6c PpW5,简称PpW5,用于后续实验。
大量提取重组质粒pKLAC1-eglA6c用核酸内切酶BstX I酶切线性化后转化乳酸克鲁维酵母GG799,在以乙酰胺为唯一氮源的培养基上筛选转化子。考虑到乳酸克鲁维酵母重组菌筛选时假阳性比较多[11,16],随机挑取了300个单菌落划线分离后再取单菌落摇瓶发酵。结果显示共有16个转化子的单菌落发酵上清液中有明显的酶活力,pKLAC1空质粒的转化子没有酶活力。其中114#转化子酶活力最高为79 U/mL,酶活力最低的是55#转化子,为48 U/mL,16个转化子的平均酶活力为61 U/mL。114#转化子命名为乳酸克鲁维酵母GG799/pKLAC1-eglA6c KlW114,简称KlW114,用于后续实验。
2.4 重组葡聚糖酶的纯化
上述2种重组质粒构建时,PCR扩增的下游引物均增加了编码6个组氨酸的密码子,因此产物的羧基端带有6×His标签,可以利用镍填料进行亲和层析,以实现重组蛋白的高效纯化。结果如图3所示。经过镍填料亲和纯化的重组酶表现为单一条带,说明已经获得纯酶。用图像分析软件Image lab 4.0分析可得,2种纯酶的表观分子质量均为36 kDa,比截短体基因eglA6c编码产物的理论分子质量34 kDa高出约6%,这可能是酵母中蛋白分泌过程中在内质网中被糖基化修饰的结果。为便于叙述,重组毕赤酵母PpW5表达的重组酶命名为AnEglA6cP,而重组乳酸克鲁维酵母表达的重组酶命名为AnEglA6cK。

M-蛋白质标准分子质量8~180 kDa;1-AnEglA6cK纯酶;2-AnEglA6cP纯酶
2.5 酶学性质
2.5.1 重组葡聚糖酶的最适温度及pH
在pH 4.5条件下,根据实验方法在不同温度条件下测定重组葡聚糖酶的酶活力,结果见图4。

图4 温度对重组酶活性的影响
当温度小于75 ℃时,AnEglA6cK与AnEglA6cP的酶活力均随温度的上升而上升,二者的最适催化温度均为75℃。当温度高于75℃时,AnEglA6cP酶活力迅速下降,而AnEglA6cK酶活力下降较为缓慢,在85℃时,AnEglA6cK相对酶活力仍在60%以上。在75℃不同pH环境下测定重组酶活力,结果如图5所示。2种重组酶的最适pH均为4.5,但pH低于4.5时AnEglA6cK的酶活力下降更快,而高于4.5时AnEglA6cP的酶活力下降更快。在pH 4.0~5.0,2种酶的酶活力均保持在最高酶活力的80%以上。

图5 pH对重组酶活性的影响
2.5.2 重组葡聚糖酶的稳定性
在pH 4.5,不同温度下检测重组酶的稳定性,在温度低于65 ℃时2种酶均有很高的稳定性,在65 ℃保温6 h后残余酶活力均在80%以上。在70 ℃以、保温,2种酶均有明显的失活。如图6所示,在70 ℃和75 ℃下2种重组酶的稳定性差异不大。在80 ℃下2种酶的差异很大,保温1 h后AnEglA6cP的酶活力残余只有约16%,而AnEglA6cK的酶活力残留接近50%。进一步检测显示在80 ℃下AnEglA6cK的酶活力半衰期大约为55 min,而AnEglA6P大约为17 min。AnEglA6cK能短时耐受85 ℃高温,保温1 h后其相对残余酶活力大约为10%,进一步检测显示AnEglA6cK在85 ℃下的半衰期约为10 min。AnEglA6cP在85 ℃下快速失活,酶活力半衰期不到5 min,保温1 h后完全检测不到酶活力。热稳定性比较显示,在80 ℃以上高温条件下,AnEglA6cK相对AnEglA6cP明显更加稳定。

图6 重组葡聚糖酶热稳定性
2.5.3 重组葡聚糖酶的底物特异性
将重组酶分别与10 g/L的不同底物在pH 4.5、70 ℃下反应并测定酶活力,结果见表1。对表1数据分析可见,2种宿主表达的截短体的比酶活力均比同一宿主中表达的全长酶高出20%左右。2种宿主表达的截短体和全长酶均能微弱水解棉花和滤纸。乳酸克鲁维酵母表达的全长酶能微弱水解微晶纤维素,但截短体不能水解微晶纤维素,可见CBD是水解结晶型纤维素的必须结构。巴斯德毕赤酵母表达的全长酶虽然带有CBD但是不能水解微晶纤维素,这与王施岚等[11]的研究结果一致,王施岚等研究者认为CBD部分的糖基化情况可能是影响其与结晶型纤维素结合的重要因素。
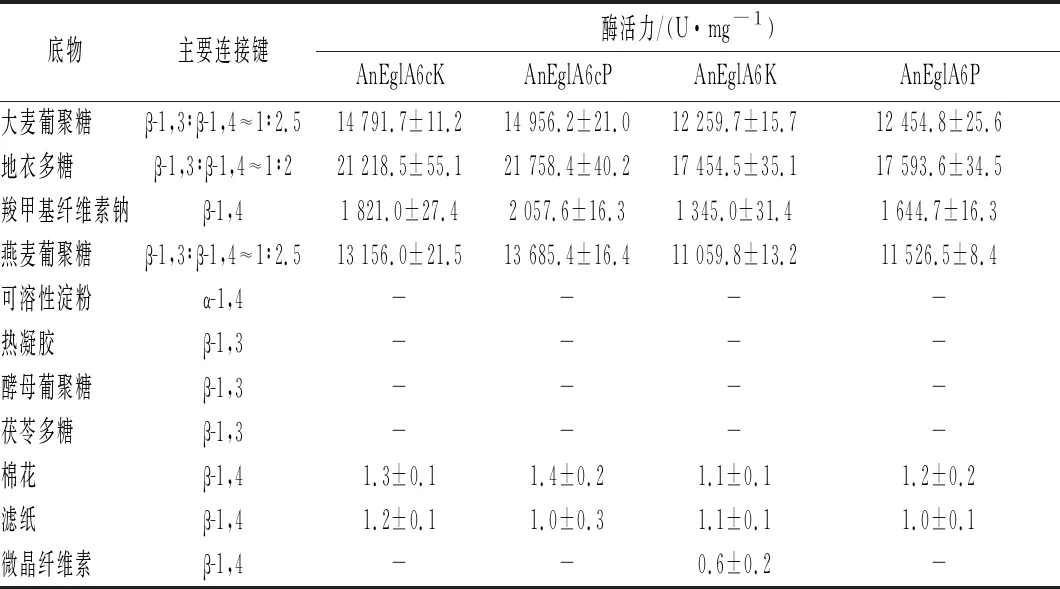
表1 重组葡聚糖酶底物特异性
2.5.4 重组酶AnEglA6cK的水解产物
AnEglA6cK过度水解大麦葡聚糖(图7),主要产物是相对分子质量介于麦芽五糖和二糖之间的小分子寡糖,单糖和大于五糖的很少见。内切型β-葡聚糖酶的一个重要特点是对葡聚糖分子内部的β-1,4-糖苷键进行随机水解,产生大量相对分子质量较小的寡糖。从水解产物可见,AnEglA6cK是一种内切型β-葡聚糖酶。

M-麦芽寡糖标样;1-AnEglA6cK降解大麦葡聚糖产物;2-大麦葡聚糖
2.5.5 金属离子及EDTA对重组酶活力的影响
不同浓度的金属离子、EDTA等对重组酶活性的影响如表2所示。从表2中可以看出大部分常见金属离子对重组酶活力无明显影响,Co2+、Mn2+的存在会提高重组酶活力。而EDTA对重组酶活力有一定的抑制作用,但即使高浓度EDTA处理酶活力剩余仍在80%以上。

表2 金属离子、EDTA对重组酶活力的影响
2.6 重组乳酸克鲁维酵母发酵条件优化
2.6.1 重组菌发酵进程
从本文研究结果看,截短体基因在乳酸克鲁维酵母中表达产物性质显著优于其在巴斯德毕赤酵母中的表达产物,但表达水平明显偏低。为了研究提高基因表达水平的可能性,进一步对表达截短基因的KlW114和表达全长基因的SL105的发酵特点进行研究。根据课题组前期研究结果,在重组乳酸克鲁维酵母发酵时,以蔗糖替代半乳糖可以得到类似的发酵结果,从节约生产成本考虑后续发酵实验均以YPS培养基为基础进行。发酵结果如图8所示。2株菌发酵性能有明显的差异。KlW114前期发酵产酶更快,发酵至36 h即达到最高酶活力,在此之前其酶活力及酶活力增长速度均显著高于SL105。36 h之后则出现相反的情况,KlW114的酶活力迅速下降,到60 h的时候已显著低于SL105,而SL105的发酵酶活力则继续维持增长,没有出现酶活力快速下降的情况。KlW114和SL105采用了相同的表达系统,唯一的差异是后者表达的是全长蛋白而前者表达的蛋白C端被截去了一段81个氨基酸残基的片段。从2.1的分析看,这是一段高度糖基化的片段,截去后表达产物的分子质量下降了1/3,分子的精简有利于酶的高效表达及分泌,这是KlW114在发酵前期酶活力快速增长的原因。KlW114发酵后期酶活力快速下降的原因很可能是重组酶被宿主菌胞外蛋白酶降解,从实验现象分析,AnEglA6分子中C端高度糖基化的片段可能对重组酶抵抗乳酸克鲁维酵母蛋白酶降解有重要的作用。
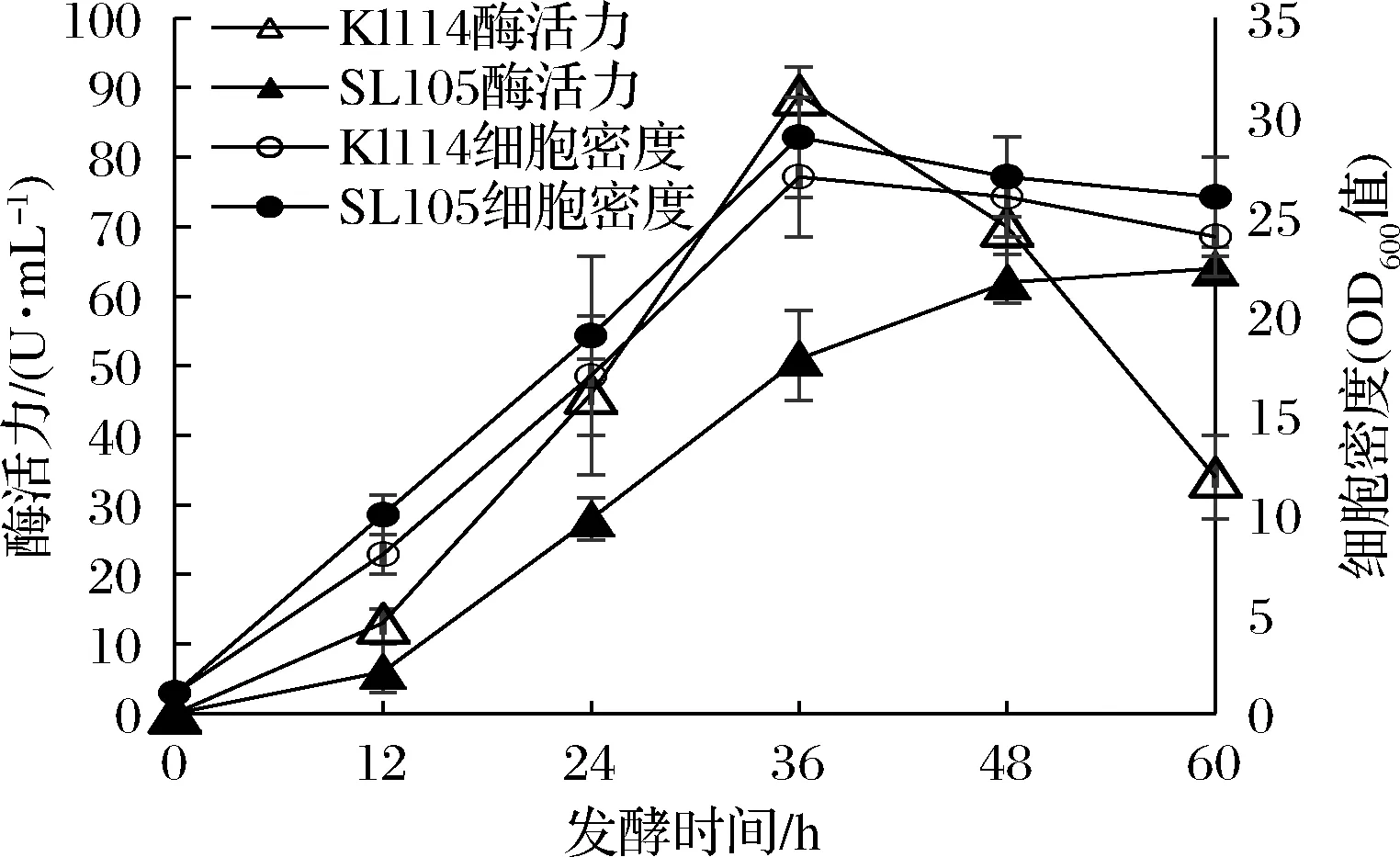
图8 Kl114与SL105发酵特性比较
2.6.2 不同有机氮源对重组菌发酵的影响
有机氮源是影响重组菌产酶的重要因素。在YPS培养基中,酵母粉是一种富含矿物营养和生长因子的氮源,因此在分析有机氮源影响时10 g/L的酵母粉不做改动,只将其中30 g/L的酪蛋白胨改为相同质量的其他氮源,结果如图9所示。在所试验的有机氮源中,2种大豆蛋白的水解物最有利于重组酶的发酵。3种动物来源的蛋白胨的作用相当,以豆饼粉和大豆蛋白为氮源时发酵酶活力很低。用酵母粉替代蛋白胨获得的结果也与上述3种动物蛋白胨的结果相似。图9采用的是发酵48 h的结果,上述3种动物蛋白胨和酵母粉为氮源时最高酶活力均出现在36 h,之后酶活力快速下降。以大豆蛋白胨和大豆蛋白肽为氮源时进行发酵,酶活力增长可以维持到 48 h之后,所以酶活力较高。由于目前大豆蛋白肽价格较高,因此选用大豆蛋白胨为重组菌的发酵氮源。图10是KlW114和SL105的发酵进程曲线,由图10可知,KlW114在以大豆蛋白胨为氮源的培养基中酶活力增长可以维持到48 h,最高酶活力达到121 U/mL,此后酶活力有所下降但下降速度较慢。SL105虽然发酵酶活力低于KlW114,但酶活力稳定,发酵后期没有出现酶活力明显下降的趋势。发酵至48 h,SL105最高酶活力为61 U/mL,KlW114的酶活力比SL105高出近1倍(98%)。

图9 不同有机氮源对KlW114发酵产酶的影响

图10 以大豆蛋白为氮源的培养基中重组菌的发酵性能比价
3 结论
结构分析显示,AnEglA6羧基端的81个氨基酸残基可能与其水解葡聚糖的功能无关。本文获得了去除上述区域编码区的截短体基因eglA6c。截短体表达产物的比酶活力比全长酶大约提高了20%,底物特异性与全长酶基本一致,唯一的显著差异是乳酸克鲁维酵母表达的全长酶AnEglA6K能微弱水解微晶纤维素而截短体完全失去了这一功能,这充分证明基因AnEglA6K羧基端包含了纤维素结合结构域,而这一结构域是水解结晶型纤维素的必须结构,这与有关纤维素酶结构功能的研究结果一致[17-19]。
根据eglA6基因序列推测,AnEglA6全长酶的理论分子质量是41 kDa,截短体为34 kDa(包括6×His)。酵母基因分泌表达过程中,由于糖基化等修饰作用表达产物的实际分子质量往往比理论分子质量大。乳酸克鲁维酵母表达的全长酶AnEglA6K的表观分子质量为56 kDa,比理论分子质量高14.6 kDa,而截短体AnEglA6cK的表观分子质量为36 kDa,相比理论分子质量仅高出2 kDa。由此推测,AnEglA6K的糖基化修饰绝大部分集中在羧基端的81个氨基酸残基上。其他真菌纤维素酶结构研究也有类似的结果,纤维素酶催化结构域和CBD之间的连接桥往往富含Ser、Thr、Gly和Pro等残基,而这些区域往往有超O-糖基化现象[20-21]。这个区域通常会为整个酶提供多种功能,例如增强CBD对纤维素的吸附能力以及增强热稳定性等[22-23]。从本文研究结果看,截短体AnEglA6ck的热稳定性稍低于AnEglA6K,而AnEglA6cP的热稳定性也稍低于AnEglA6P,这说明本文截去羧基端片段对酶的稳定性也有一定的影响。
本文截短体在巴斯德毕赤酵母中的表达水平比全长酶高1.3倍以上,而在乳酸克鲁维酵母中的表达水平提高幅度不大,在针对性的优化发酵培养基之后发酵水平提高幅度为98%左右,提高幅度仍未达到应有水平。本文研究结果显示乳酸克鲁维酵母对截短体的水解可能是重要原因。本课题组对截短体在巴斯德毕赤酵母中的表达进行研究却未发现同样的情况,由此推测乳酸克鲁维酵母中可能存在特定的水解AnEglA6cK的蛋白水解酶。在今后的工作中,通过基因敲除的方法敲除相关的基因可能有利于提高酶在这一宿主中的表达。
