施磷对苜蓿叶片生理参数及抗氧化能力的影响
2023-03-07赵建涛杨开鑫王旭哲马春晖张前兵
赵建涛,杨开鑫,王旭哲,马春晖,张前兵
施磷对苜蓿叶片生理参数及抗氧化能力的影响
赵建涛,杨开鑫,王旭哲,马春晖,张前兵
石河子大学动物科技学院,新疆石河子 832000
【目的】探究连续3年施用磷肥后对紫花苜蓿叶片养分吸收量、光合色素含量、气孔开度及抗氧化系统的影响,为紫花苜蓿高效生产提供科学施肥方法。【方法】2019—2021年,以‘WL366HQ’紫花苜蓿为试验材料,在石河子大学牧草试验站连续开展为期3年的田间试验。试验设置磷肥添加量分别为0(对照,CK)、50 kg·hm-2(低磷,LP)、100 kg·hm-2(中磷,MP)和150 kg·hm-2(高磷,HP),共4个磷肥处理。于苜蓿初花期进行取样,测定干草产量、叶片氮磷含量、色素含量、气孔开度、抗氧化酶活性以及氧化物质等指标。【结果】连续施加磷肥3年后,叶片的氮磷含量、光合色素含量及气孔开度显著增加(<0.05),其中叶片氮磷含量在中磷处理下最高,分别为54.74和2.99 g·kg-1;叶绿素a和叶绿素b的含量均在中磷处理下最高,类胡萝卜素含量在低磷或中磷处理下最高,且均在CK最低;气孔开度在中磷处理下达到最大,且显著高于CK(<0.05)。因此,磷肥对苜蓿叶片的形态和生理特性有不同的影响,且中磷处理显著影响苜蓿叶片的光合生理特性(<0.05)。合理添加磷肥可以提高苜蓿叶片抗氧化酶的活性并降低氧化物质的含量,超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性均在中磷处理达到最高,分别为162.55、406.40和147.13 U·g-1,且显著高于CK(<0.05);丙二醛(MDA)、过氧化氢(H2O2)和脯氨酸(Pro)含量均在中磷处理下最低,分别为2.38和1.04 μmol·g-1以及56.85 μg·g-1。根据Pearson相关性分析可知,苜蓿叶片全氮和全磷含量与叶绿素含量、类胡萝卜素含量、气孔开度、SOD和POD活性显著正相关(<0.05),与MDA和H2O2含量呈显著负相关(<0.05)。综合评价表明,施磷处理的主成分得分排序为:中磷>高磷>低磷>对照。【结论】合理施加磷肥增加苜蓿叶片的营养特性及光合生理特性,从而避免其他环境因子带来的胁迫作用,增强苜蓿的适应能力,使苜蓿更好地适应外界环境变化。综合考虑紫花苜蓿的叶片形态、光合生理特性及抗氧化酶和氧化物质等因素,本试验施磷量为100 kg·hm-2较为适宜。
紫花苜蓿;施磷;叶片表型;叶片生理;干草产量
0 引言
【研究意义】紫花苜蓿(L.)作为优质的豆科饲草,以“牧草之王”著称[1]。磷是植物生长所需的重要元素之一[2],而植物从土壤中获取有效磷含量极低,仅占土壤全磷的2%—3%[3-4]。土壤中添加磷肥促进植物获取更多的有效磷,从而达到优质高产等目的。【前人研究进展】叶绿素在光能的吸收、转换及传递过程中起关键作用,决定光合过程中的电子传递速率[5]。植物叶片的光合作用对磷肥浓度十分敏感,研究表明,植株叶片叶绿素含量损失及叶绿体损伤与高浓度磷肥下叶片光合能力下降有关[6],但是磷缺乏导致植株生长发育延缓、叶面积变小及根系碳水化合物合成受阻,从而降低产量[7-8]。因此,磷在植物叶绿体中的能量转化和代谢过程中起着重要作用,并促进其光合产物的形成[9]。研究发现,适量增施磷肥提高植物叶片的氮磷含量和叶绿素含量,进而促进其光合作用[10]。磷素通过蒸腾途径进入植物机体中的叶片细胞,进而提高叶片光合及碳代谢的能力,然而,施磷量过高其光合速率则会受到抑制[2]。也有研究表明,叶片净光合作用与施肥量之间存在一定的线性关系,一旦施磷量超过阈值后,其光合速率大幅度降低[11]。光合作用在植物生长过程中至关重要,研究发现,一些非环境胁迫导致植株的光合过程受到紊乱、阻碍叶绿素的合成过程并降解叶片中光合色素含量[12]。气孔是植物与外界环境进行气体和水分交换的介质,其数量、大小和密度的变化直接影响植株的光合速率和蒸腾作用[13]。气孔可以调控CO2进入叶片的速率,提高光合作用效率和蒸腾速率,从而达到养分供应目的[14-15]。磷肥过高则会造成叶绿体超微结构变形,光合作用电子传递途径受限,致使植物的光合作用受到抑制[16]。自由基清除机制是植物进行自我保护的第二道防线,超氧化物歧化酶(SOD)的发现为自由基清除机制的研究奠定了基础[17]。植物体内的SOD、过氧化物酶(POD)和过氧化氢酶(CAT)等可以清除胁迫环境产生的活性氧和自由基。也有研究表明,植物在逆境下或衰老时,CAT与POD产生协同作用来清除植株体内超氧化物阴离子及过氧化氢(H2O2)[18]。从植物在低磷逆境下的反应机制中发现,施磷量会引起植物体内SOD活性发生变化,且SOD活性偏高有利于植物长期处于低磷环境中[19]。也有研究表明,低磷胁迫下SOD活性呈现短期迅速上升趋势,使活性氧(ROS)及超氧阴离子达到一种平衡状态,来减轻其对植株的伤害,随着施磷量的增加,SOD、POD及CAT活性均有所降低[20]。【本研究切入点】目前关于施磷对不同作物的生产性能及光合特性影响等问题已做了大量研究,但仍未从叶片的气孔开度及抗氧化系统等问题来揭示低磷或高磷是否导致苜蓿处于胁迫环境。【拟解决的关键问题】本研究通过测定不同施肥条件下苜蓿叶片全氮全磷含量、光合色素含量、叶片的气孔个数和开度、抗氧化酶活性及氧化物质含量,以期明确连续多年不同施肥水平对紫花苜蓿叶片的光合生理及抗氧化系统的影响机制,进而阐明低或高磷是否对紫花苜蓿生长造成胁迫作用,为施肥对紫花苜蓿生理参数的影响机制研究提供理论支撑。
1 材料与方法
1.1 试验地概况
试验于2019—2021年在石河子大学节水灌溉试验站(44°20′ N,88°30′ E)进行,属于温带大陆性气候,常年干燥少雨。年平均气温为7℃,无霜期为168—171 d,年均日照时间为2 770 h,年降水量为190—260 mm,年蒸发量为1 000—1 500 mm。土壤有机质含量为39.5 g·kg-1,全氮含量为1.18 g·kg-1,碱解氮含量为145.47 mg·kg-1,全磷含量为0.53 g·kg-1速效磷含量为19.3 mg·kg-1,速效钾含量为119.8 mg·kg-1,容重为1.54 g·cm-3,pH为7.59。
1.2 试验设计
建植年前通过测定土壤理化性质,认为试验地肥力均匀性较好。本试验采用完全随机排列,供试材料为紫花苜蓿(WL366HQ),设置4个磷肥处理,分别为0(对照,CK)、50 kg·hm-2(低磷,LP)、100 kg·hm-2(中磷,MP)和150 kg·hm-2(高磷,HP),供试化肥为磷酸一铵(含P2O552%),每个处理3次重复。小区面积为24 m2(4 m×6 m),20 cm的播种行距,1.5—2.0 cm的播种深度,人工进行条播,播种量为18 kg·hm-2,灌溉方式为滴灌,滴灌带埋于地面10—15 cm处,间距60 cm,所用滴灌带为内镶式滴灌带,滴头间距为20 cm。试验连续3年进行等量定位施肥,肥料分别于苜蓿返青后、第1茬、第2茬和第3茬刈割后的3—5 d内随水施肥,每年共施肥4次。
1.3 指标测定及方法
连续3年施肥后,于2021年苜蓿初花期(开花10%)取植株样品进行分析,苜蓿全年刈割4茬,留茬高度约为5 cm。在苜蓿初花期测定苜蓿叶片光合色素含量、气孔开度、抗氧化酶活性、氧化物质含量及干物质产量等。
1.3.2 叶片营养的测定 将颜色正常且无破损的新鲜叶片采摘带回实验室,样品先在105℃杀青30 min,再置于65℃干燥箱中烘干48 h成风干样品。将烘干的叶片样品研磨成细粉,用98%硫酸和30%过氧化氢进行消化。叶片全氮和全磷的含量分别用凯氏定氮法和钼锑抗比色法进行测定。
1.3.3 叶片气孔开度的测定 采用指甲油印迹法来测定叶片的气孔开度[21]。选取颜色正常、高度相同且光照相似的上位叶片,先用75%的酒精将叶片表面灰尘擦净,然后将透明指甲油均匀地涂抹在叶片背面。待自然晾干后,将叶片背面表皮紧贴于透明胶带上,并用手指抹平至胶带与叶片间充分接触且无气泡。为防止叶片破损,撕取胶带时一定要缓慢,最后轻贴至干净的载玻片上,从而制成临时载玻片。用ML-800光学显微镜(Olympus,MEIJI,Japan)对气孔进行拍照,每个载玻片在100倍显微镜下选取3个清晰且完整的视野,测量气孔个数、长度(纵径,即哑铃形细胞的最长值)与宽度(横径,即哑铃形细胞垂直处的最宽值),根据下列公式来计算其气孔开度。其中,a是气孔的长度,b是气孔的宽度。
1.3.4 光合色素含量 采用乙醇浸提法来测定苜蓿叶片的光合色素含量。随机选取颜色正常、高度相同且光照相似的上位叶片,利用75%的乙醇将叶片表面灰尘擦净,并剪去叶片中脉部位。称取新鲜叶片0.2 g置于研钵中,加入少量的石英砂和碳酸钙粉末,并加95%乙醇3 mL,研磨至匀浆。把中性滤纸叠好放入漏斗中,置于25 mL的棕色容量瓶上,并用乙醇将其湿润紧贴于漏斗壁。利用玻璃棒将匀浆液引流至漏斗中,吸取少量的乙醇来清洗残渣数次,一起倒入漏斗内,并用乙醇溶液将滤纸上的色素洗于容量瓶中,直至残渣中无绿色为止。最后用乙醇定容至25 mL的棕色容量瓶中并摇匀。将色素提取液倒入1 cm的玻璃比色杯内比色。以95%的乙醇为空白,利用分光光度计在470、663和645 nm波长下测定吸光度值,分别记为A470、A663和A645。叶绿素a、叶绿素b、类胡萝卜素及总叶绿素含量,分别记为Ca、Cb、Car和Ct,根据以下公式计算光合色素含量:
Ca = (13.95×A665-6.88×A649)×提取液总量×稀释倍数/叶片鲜重;
Cb = (24.96×A649-7.32×A665)×提取液总量×稀释倍数/叶片鲜重;
Car = [(1000×A470-2.05×Ca-114.8×Cb) /245]×提取液总量×稀释倍数/叶片鲜重;
Ct = Ca+Cb。
在手术治疗的同时,按照常规护理方法进行干预,包括观察患者的病情变化,监测生命体征,并详细记录,告知患者并介绍一些注意事项,帮助患者进行下床活动,指导患者合理用药等措施。
1.3.5 抗氧化酶活性 随机选取颜色正常、高度相同且光照相似的上位叶片,采摘后立即放入低温冰箱中带回实验室,置于-80℃冰箱长期保存备用。用北京索莱宝科技有限公司提供的“SOD试剂盒”和“CAT试剂盒”来测定叶片中SOD和CAT的活性;用南京建成有限公司提供的“POD试剂盒”来测定POD的活性,具体步骤严格根据制造商的说明书进行。
1.3.6 氧化物质含量 丙二醛(MDA)的含量用硫代巴比妥酸法来测定;用北京索莱宝科技有限公司所提供的“H2O2试剂盒”来测定叶片中H2O2的含量;用南京建成有限公司提供的“脯氨酸(Pro)试剂盒”测定叶片中Pro含量。
1.4 数据处理
使用Excel 2010软件整理数据、SPSS 26.0软件对试验数据进行方差分析,用Origin2019进行作图。利用Image Scope软件处理图片,并测量叶片气孔个数、气孔长度及气孔宽度。试验结果均以“平均值±标准误差”表示。
2 结果
2.1 不同施磷水平下苜蓿茬次叶片氮磷含量动态
连续3年施加磷肥后,苜蓿叶片全氮及全磷含量均随施磷量增加呈先增后降低的趋势(图1),且施磷量为中磷时,叶片全氮含量显著高于CK(<0.05);施磷量为中磷时,苜蓿叶片全磷含量显著高于CK(<0.05),且施磷量过高显著降低叶片全磷含量(<0.05)。
苜蓿叶片全氮含量随茬次变化呈先下降后上升再下降的动态变化,第1或3茬最高,第4茬最低,分别为54.83和44.44 g·kg-1;叶片全磷含量随茬次变化呈先降低后达到相对稳定的动态平衡,其中第1茬最高,为2.99 g·kg-1,且各茬次间的排序为第1茬>第3茬>第2、4茬。
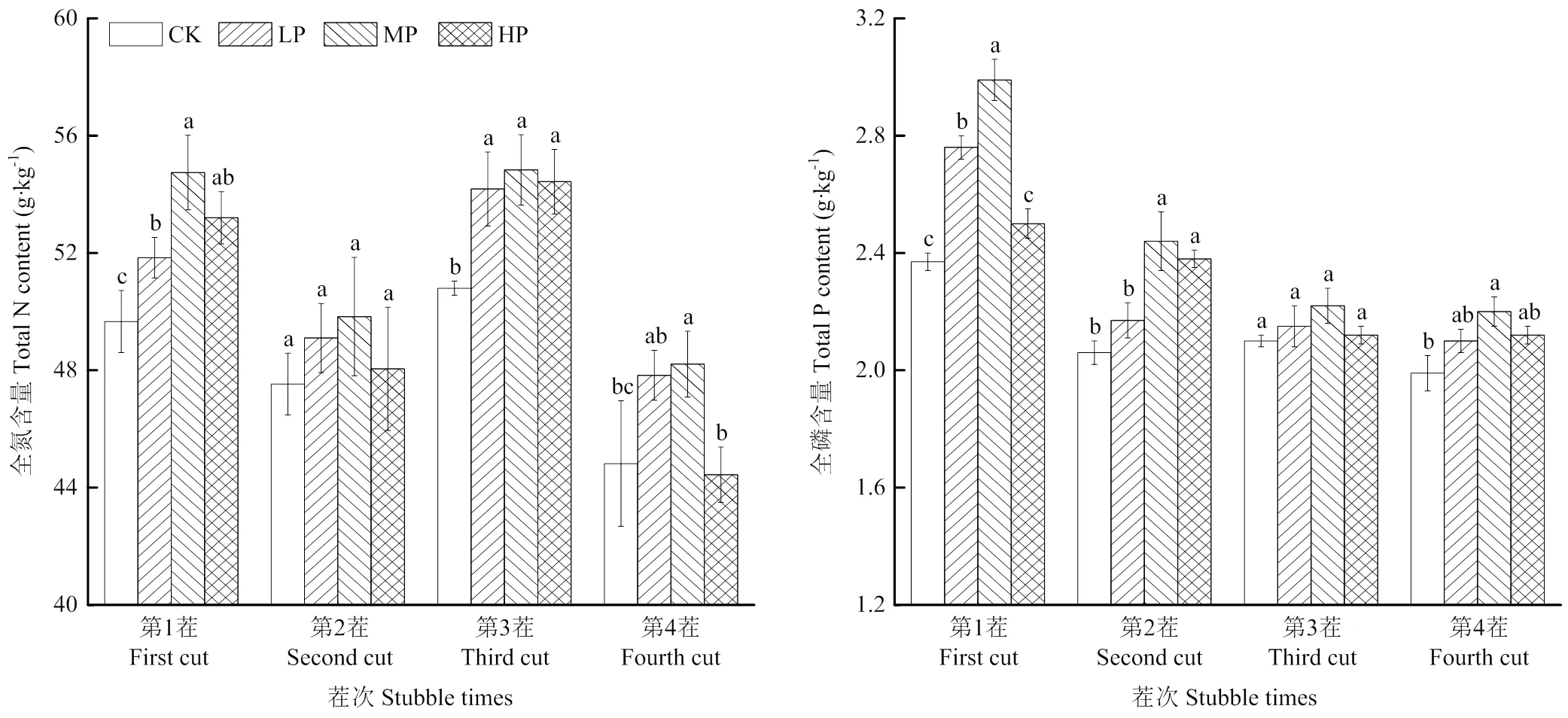
柱上不同字母表示处理间差异显著。下同
2.2 不同施磷水平下苜蓿茬次叶片的光合色素含量动态
相同茬次下,随着施磷量增加,苜蓿叶片中叶绿素a和叶绿素b的含量均呈现先上升后降低的趋势,均在中磷水平下达到最大,且显著高于CK(<0.05)(图2)。施磷增加苜蓿叶片的类胡萝卜素(Car)和叶绿素的含量,一旦磷肥含量过高,则导致其含量的大幅度降低。苜蓿叶片Car含量在中磷水平下达到最高,且显著高于CK(<0.05)。
苜蓿叶片中叶绿素a和叶绿素b含量均随着茬次变化呈先上升后下降再上升的动态规律,而类胡萝卜素含量呈先上升后降低到相对稳定的动态平衡。不同茬次下,与CK相比,中磷处理下苜蓿叶片的色素含量均有所增加,中磷处理下叶绿素a的含量在各茬次间分别增加了12.5%、8.9%、19.5%、8.6%,在第3茬时最大;中磷水平下的叶绿素b含量在各茬次间分别增加了28%、5.7%、21.4%和4.0%,在第1茬时增加量最大;中磷处理下Car的含量在各茬次间分别增加了23.5%、10.5%、5.6%和17.6%,且第1茬时增加量最大。
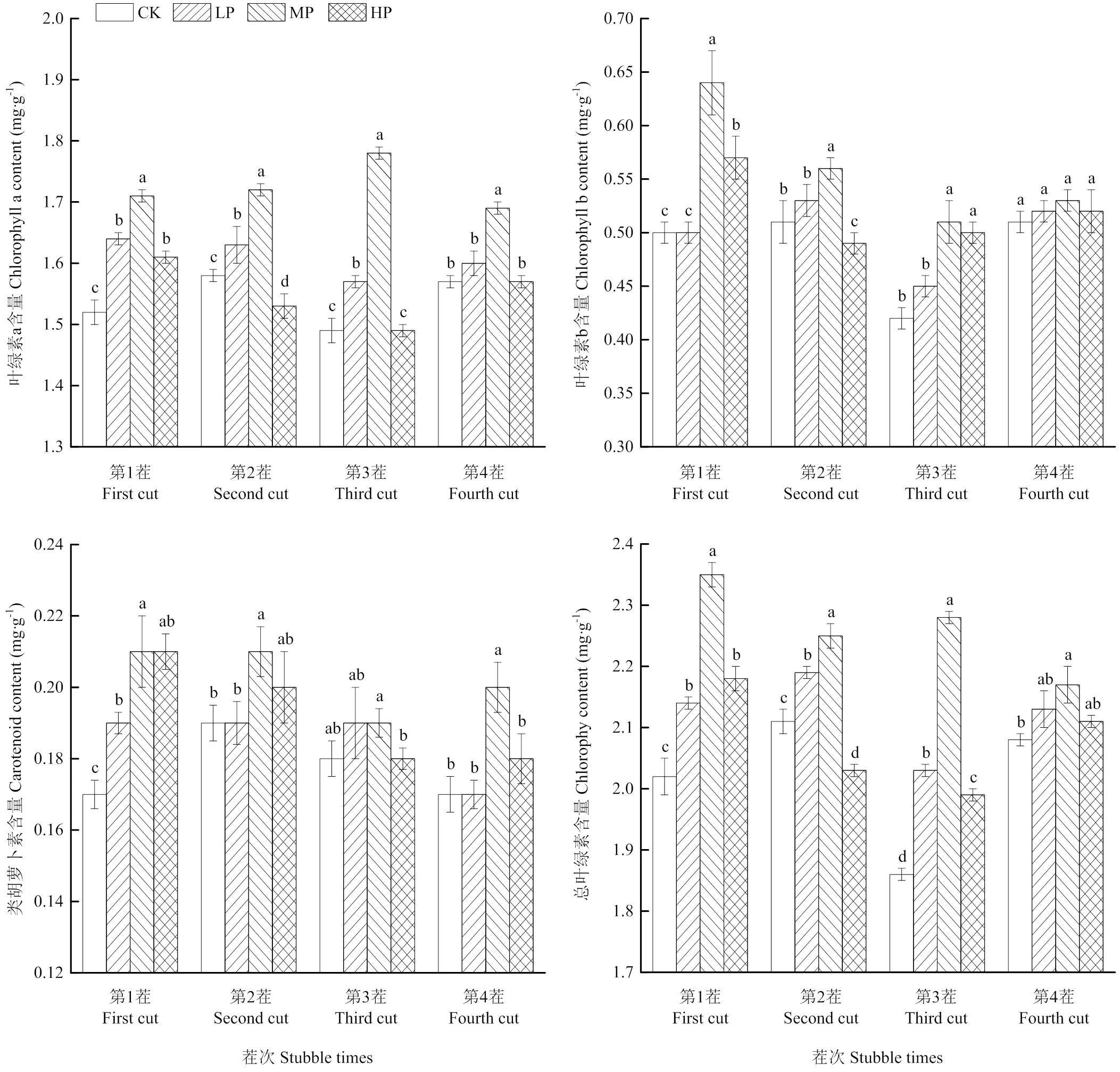
图2 不同施磷水平下叶片1—4茬光合色素含量动态变化
2.3 不同施磷水平下苜蓿茬次叶片的气孔开度动态
正常生长条件下,合理的施磷量在一定程度上增加苜蓿叶片气孔个数及气孔开度。气孔个数、气孔长度以及气孔宽度均随着施磷量增加呈先增加后降低趋势(图3)。相同茬次下,适量添加磷肥显著提高苜蓿叶片的气孔长度和气孔宽度(<0.05),施磷量过高显著降低叶片的气孔宽度与长度(<0.05),进而导致气孔开度大幅度降低(表1)。苜蓿叶片的气孔开度随施磷量增加呈先上升后降低趋势,在中磷水平达到最大,且显著高于CK(第3茬除外)(<0.05)。
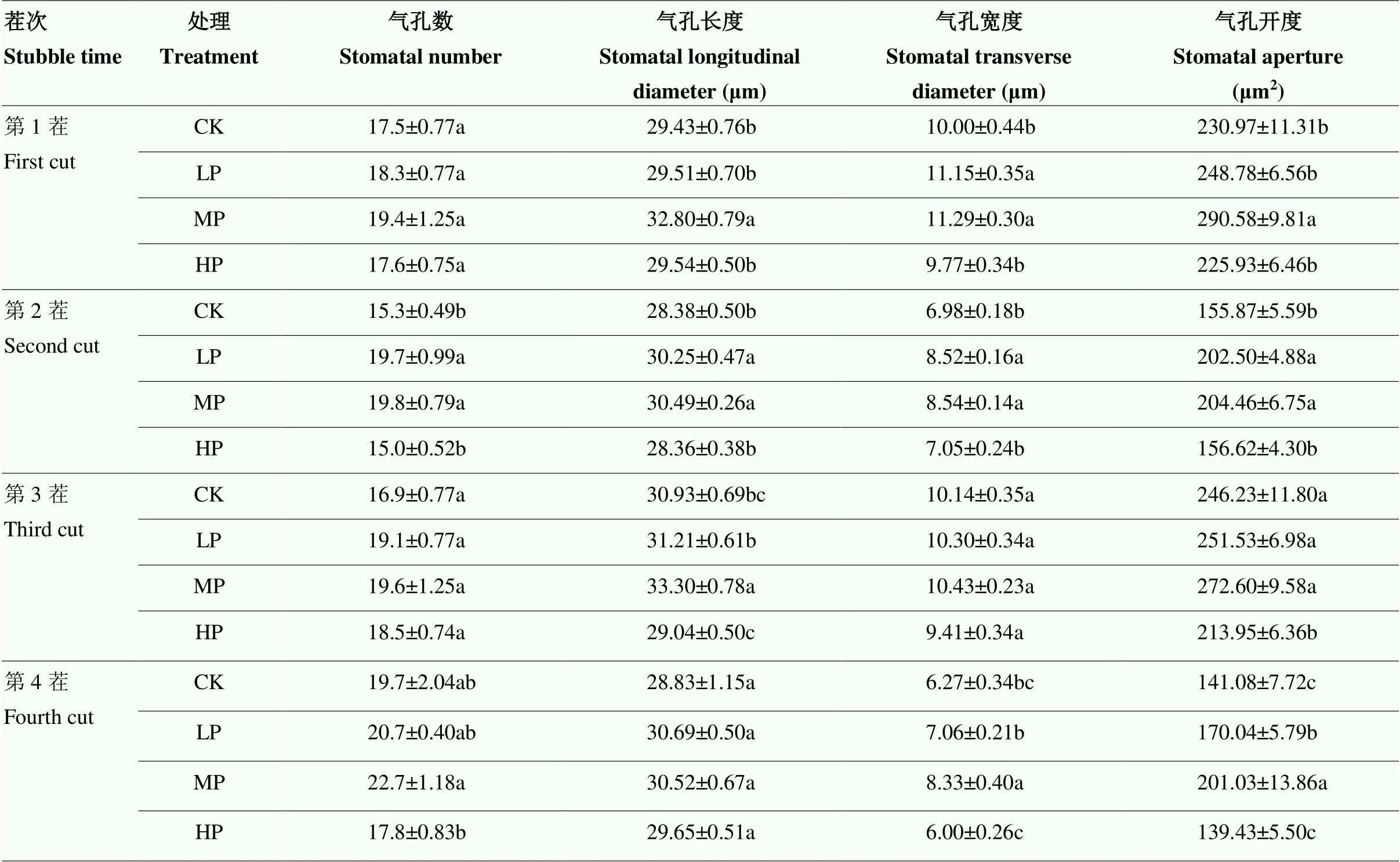
表1 不同施磷水平下苜蓿叶片1—4茬气孔数、长度、宽度和开度的动态变化
表中数值均为平均值±标准误。同列数据后不同小写字母表示处理间在0.05水平差异显著
The data in the table are average ± standard error. Values followed by different lowercase letters in a column indicate significant difference among treatments at 0.05 level
苜蓿叶片的气孔个数随着茬次的变化呈先降低后上升到相对稳定的动态平衡,而气孔开度呈先降低后上升再降低的动态规律。不同茬次下,苜蓿叶片的气孔数在第4茬达到最大,且各茬次间排序为第4茬>第1茬>第3茬>第2茬;气孔开度在第3茬最大,第4茬最小,且各茬次间排序为第3茬>第1茬>第2茬>第4茬。因此,合理的施磷量通过提高苜蓿叶片的气孔开度来促进其光合作用。
2.4 不同施磷水平下苜蓿茬次叶片的抗氧化酶活性动态
连续3年施加磷肥后,苜蓿叶片SOD、POD和CAT活性均随施磷量增加呈先上升后降低的趋势(图4),均在中磷处理达到最高,分别为162.55、406.40和147.13 U·g-1,且显著高于CK(<0.05)。苜蓿叶片SOD、POD和CAT活性随茬次的变化呈先上升后下降的动态规律。不同茬次下,叶片SOD活性在第1茬下最高,且各茬次间排序为第1茬>第3茬>第2茬>第4茬;POD活性在第2茬最高,且各茬次间排序为第2茬>第1茬>第3茬>第4茬;CAT活性在第2茬最高,且各茬次间排序为第2茬>第4茬>第3茬>第1茬。
2.5 不同施磷水平下苜蓿茬次叶片的氧化物质和脯氨酸含量动态
H2O2和MDA的含量可以揭示植株氧化损伤程度[22]。相同茬次下,合理施加磷肥降低苜蓿叶片MDA、H2O2及Pro含量(图5),施磷量过高则会加剧叶片的氧化程度,产生更多过氧化的产物。苜蓿叶片中MDA、H2O2及Pro含量均随施磷量增加呈先下降后上升的趋势,其含量在中磷处理下达到最低,分别为2.38、1.04 μmol·g-1及56.85 μg·g-1,且显著低于CK(<0.05)。苜蓿叶片中MDA、H2O2及Pro含量均随茬次变化呈先上升后降低再上升的动态规律。苜蓿叶片H2O2、MDA和Pro含量在第1茬或第3茬最低,且各茬次间的排序为第1、3茬<第4茬<第2茬。

图A为CK,B为LP,C为MP,D为HP Figure A shows CK, B shows LP, C shows MP and D shows HP
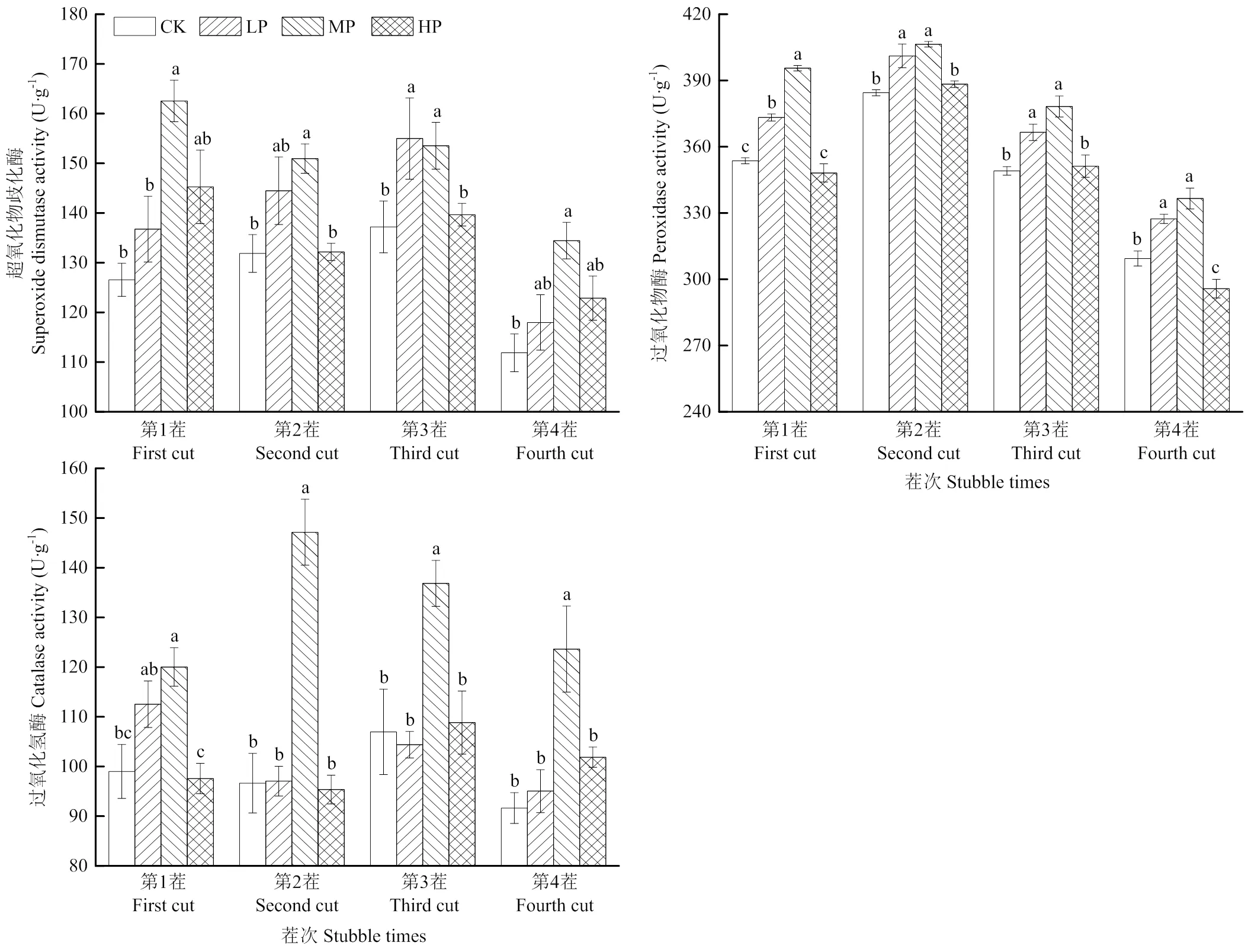
图4 不同施磷下苜蓿叶片1—4茬抗氧化酶活性的动态变化
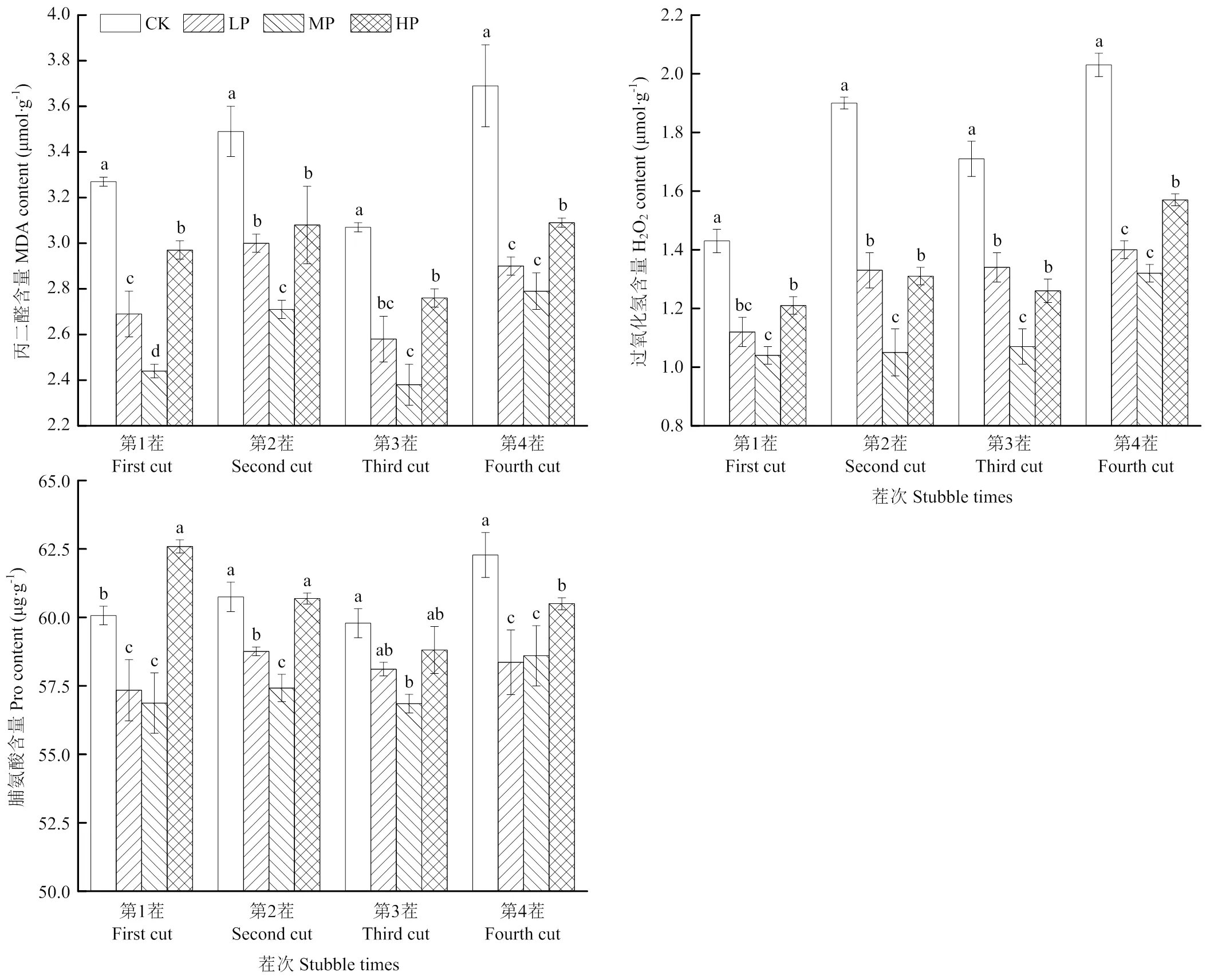
图5 不同施磷下苜蓿叶片1—4茬氧化物质含量的动态变化
2.6 不同施磷水平下苜蓿茬次的干草产量动态
连续3年施加磷肥后,苜蓿干草产量随施磷量增加呈先增加后降低趋势(图6),中磷处理下干草产量达到最高,CK最低。干草产量随茬次的变化呈现先降低后增加再降低的动态规律,其中第1茬最高,第4茬最低,且各茬次间的排序为第1茬>第3茬>第2茬>第4茬。
2.7 叶片氮磷含量与生理参数和抗氧化能力的相关性分析
为了进一步分析3年连续施磷后苜蓿叶片的生理参数和抗氧化能力与氮磷含量之间的关系,对叶片氮磷含量与光合色素含量、气孔开度和抗氧化酶活性等指标进行皮尔逊(Pearson)相关性分析。结果表明(图7),苜蓿叶片氮含量与叶绿素含量、类胡萝卜素含量、气孔开度、SOD活性及POD活性呈显著正相关(<0.05),相关系数分别为0.886、0.925、0.500、0.832及0.575,而与MDA和H2O2含量呈显著负相关(<0.05),相关系数分别为-0.811和-0.760;叶片磷含量与叶绿素含量、类胡萝卜素含量和SOD活性呈显著正相关(<0.05),相关系数分别为0.798、0.740及0.791,与MDA和H2O2含量呈负相关(<0.05),相关系数为-0.576和-0.633。另外,SOD、POD及CAT活性与MDA及H2O2含量呈显著负相关(<0.05)。
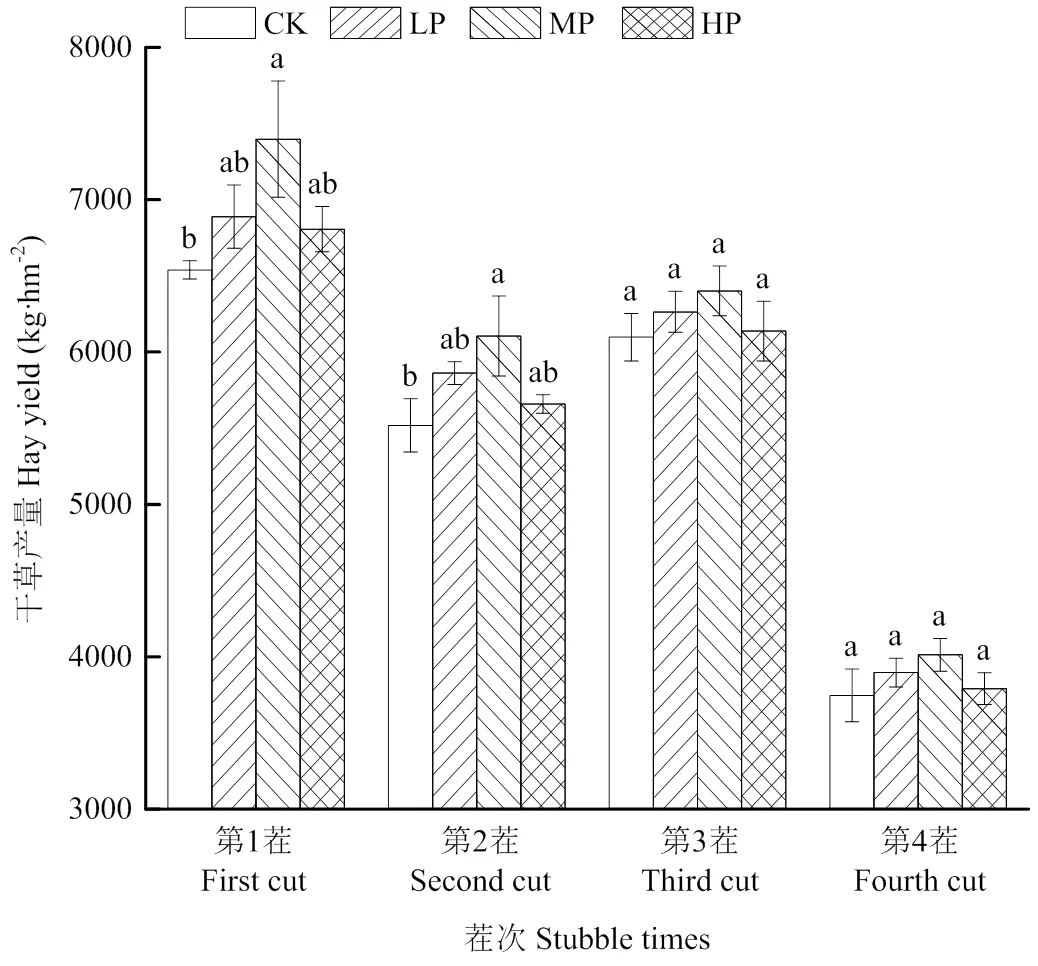
图6 不同施磷下苜蓿1—4茬干草产量的动态变化
2.8 施磷处理对苜蓿叶片的生理参数和干草产量的综合评价
对苜蓿叶片氮磷含量、生理特性、抗氧化酶活性及干草产量等指标采用主成分进行分析,将13个相互关联的单项指标转变成2个相互独立的综合性指标。本试验中,提取主成分特征值大于1,得到2个主成分,其主成分的贡献率分别为60.1%和18.7%,且累计贡献率达到78.8%(图8)。综合得分发现,中磷得分最高,其次是高磷和低磷处理,对照组最低。
3 讨论
3.1 苜蓿叶片氮磷含量与光合色素和气孔开度的关系分析
叶绿素作为反映植物生理活动的指标之一,是光合作用的物质基础[6]。研究表明,叶绿素含量随施磷量不同而有所差异,且磷的有效性提高植物对外界环境变化的适应能力[23],进而改变其光合性能。通过对幼苗叶片的研究发现,蒸腾速率和净光合作用与叶片磷含量呈正相关,表明高施磷量可以提高叶片的蒸腾速率[24]。本研究表明,合理的施磷量提高叶片全磷和光合色素含量,这与前人研究结果一致[9]。作为光合过程中的辅助色素,类胡萝卜素在光合过程中发挥重要作用[25]。研究发现,类胡萝卜素保护叶绿素分子,防止叶片的细胞膜脂和膜蛋白遭到破坏,进而减缓植株的氧化过程[26]。本研究中,适当施加磷肥显著提高紫花苜蓿叶片类胡萝卜素含量,然而,施磷量过高或过低均降低叶片的叶绿素,对植株产生胁迫作用,导致类胡萝卜素含量大幅度降低。
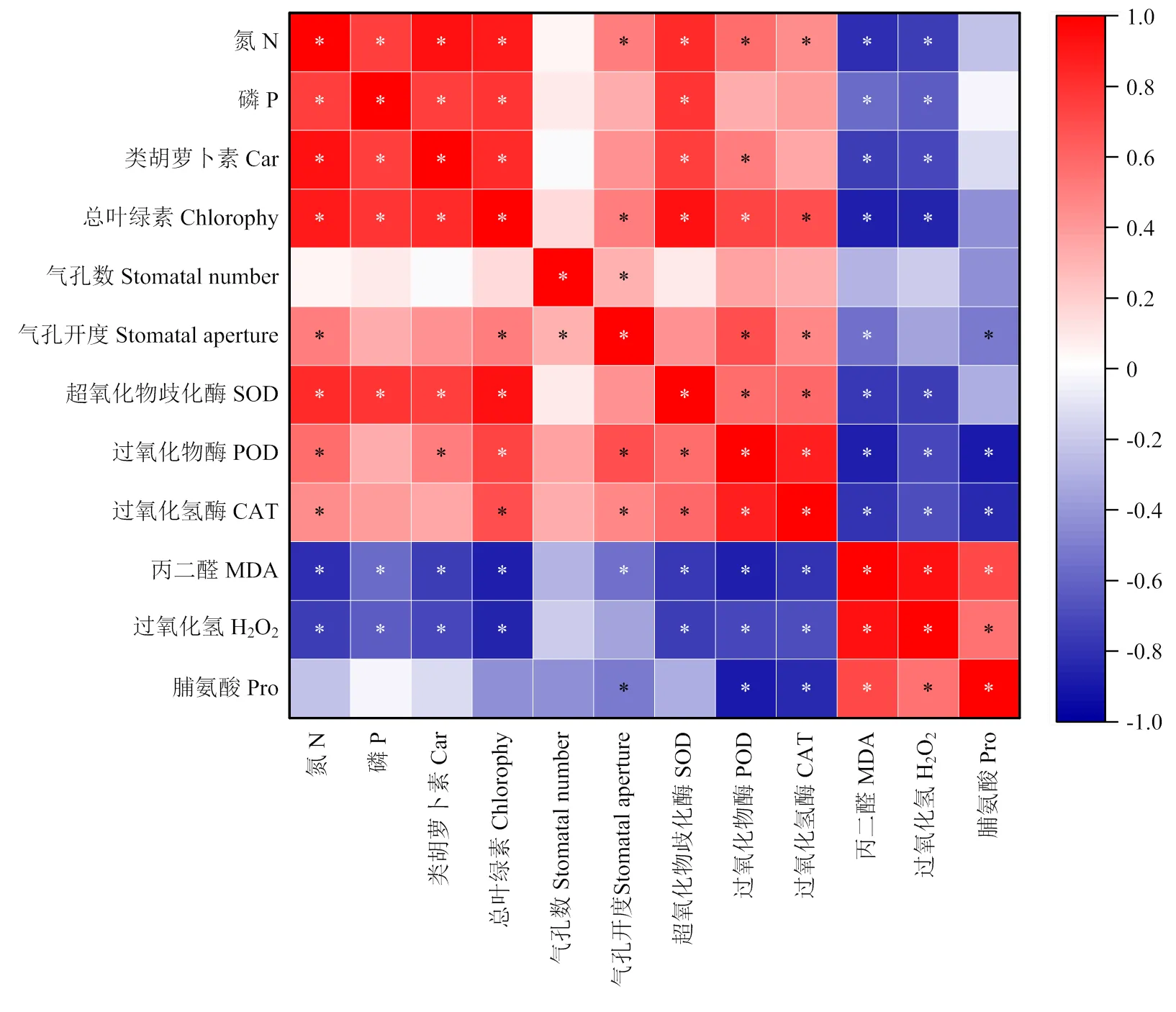
*表示相关性达到显著水平(P<0.05)* mean significant level of correlation (P<0.05)
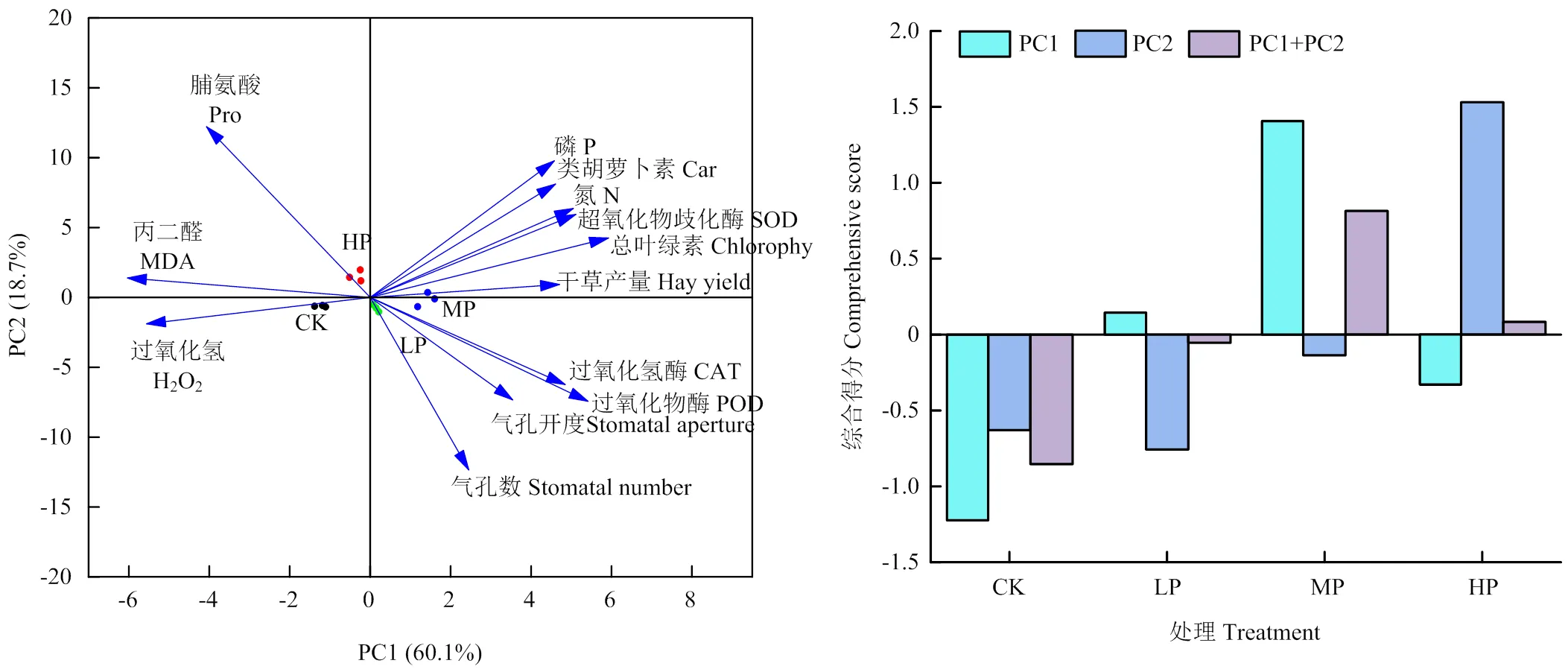
图8 不同施磷水平下各指标的主成分分析及综合得分
气孔控制着植物与外界环境的气体交换,维持植物的碳代谢和水分达到平衡状态[13]。研究发现,当受到外界环境的胁迫时,植物可以通过改变气孔的分布方式来应对环境的胁迫作用[27]。植物对磷肥亏缺的早期适应主要表现在气孔运动上[28],植物体内的水分和气体与环境的交换过程离不开气孔的控制,且影响其叶片光合的能力[29-30]。施肥条件下,气孔密度和气孔导度与水分利用效率有密切的正相关关系[31],这表明合理施磷量可以提高植物叶片的气孔开度,从而增加其气孔密度来适应环境[32]。本研究中,施磷增加苜蓿叶片的气孔个数和气孔开度。研究表明,植物的光合速率和蒸腾作用可以通过气孔开度以及气孔数目来控制,在一定情况下其变化可反映植物对生态环境的适应能力[33]。本研究发现,叶片通过降低气孔个数和气孔开度来减缓磷肥过高而造成的胁迫作用,进而提高其对环境变化的适应性。Pearson相关性分析揭示,叶片氮磷含量与叶绿素和类胡萝卜素含量呈显著正相关,推测可以通过提高叶片氮磷含量来提高其光合能力。因此,长期合理添加磷肥通过提高苜蓿叶片氮磷含量来增加其光合色素含量和气孔开度,从而减缓环境因子对苜蓿引起的伤害。
3.2 苜蓿叶片氮磷含量与叶片抗氧化酶、氧化物质及脯氨酸的关系分析
光能在胁迫条件下不能被完全利用时,植株的抗氧化酶体系(SOD、POD和CAT)可以清除体内过剩的H2O2和ROS,来减轻非生物因素对植物细胞膜造成的伤害,并维持一定的光合速率[34]。研究表明,植物在逆境条件下引起的伤害与体内抗氧化酶活性密切相关,并且植物的正常衰老现象与体内SOD的活性紧密相连[35]。本试验发现,施磷影响紫花苜蓿叶片中SOD和POD活性,一旦施磷量过高,抗氧化酶活性明显受到抑制[36]。MDA和H2O2是膜脂被氧化形成的产物,细胞膜的损伤程度与植株体内MDA的生成量呈正相关[34]。本研究表明,适量施加磷肥显著降低苜蓿叶片中MDA和H2O2含量,而施磷量过高导致叶片中MDA、H2O2和Pro含量显著上升,这可能是因为磷通过刺激植物体内抗氧化酶活性,加快自由基的清除进度,减轻对细胞膜的损害,进而减少胁迫条件对植株的损害[37]。Pearson相关性分析揭示,叶片氮磷含量与SOD活性、MDA含量和H2O2含量有较高的相关性。因此,合理的施磷量通过提高苜蓿叶片氮磷含量,增加抗氧化酶活性并清除体内氧化物质的含量,从而增强苜蓿对环境的适应性。
3.3 不同施磷水平对苜蓿干草产量的影响
干草产量是紫花苜蓿生产性能最具有代表性指标之一。作为多年生豆科牧草,紫花苜蓿以优质高产著名。合适的施磷量通过提高植物叶片叶绿素含量[10]、气孔长度及密度[16],来促进其光合作用;加强植株的抗氧化酶活性,并降低氧化物质含量[19],进而达到更高的生物量。本研究表明,苜蓿干草产量随施磷量的增加呈先增高后降低的趋势,中磷处理下达到最高,而高磷处理有所下降,这与高施磷量对苜蓿造成了胁迫作用有关,从而导致产量降低。主成分分析使大量相关变量转化成一组少量不相关变量,并保留原始数据的信息。主成分分析表明,施磷量为100 mg·kg-1时,叶片的生理特性、抗氧化酶活性及苜蓿干草产量等指标的综合得分最高。因此,合理施磷量增加苜蓿叶片营养特性和光合生理性能,进而提高其生产性能。
4 结论
苜蓿叶片氮磷含量、气孔开度及抗氧化酶活性在中磷(100 kg·hm-2)最高,且氧化物质含量最低。磷肥通过提高苜蓿叶片中氮磷含量,从而增加叶片叶绿素含量积累和抗氧化酶活性,降低叶片中氧化物质含量,进而达到优质高产的目的。综合考虑苜蓿叶片的营养特性、生理参数及干草产量等因素,在新疆石河子地区连续多年施加磷肥条件下,推荐紫花苜蓿的施磷量为100 kg·hm-2。
[1] SCASTA J D, TROSTLE C L, FOSTER M A. Evaluating alfalfa (L.) cultivars for salt tolerance using laboratory, greenhouse and field methods. Journal of Agricultural Science, 2012, 4(6): 90-103.
[2] CHEN Y H, HAN W X, TANG L Y, TANG Z Y, FANG J Y. Leaf nitrogen and phosphorus concentrations of woody plants differ in responses to climate, soil and plant growth form. Ecography, 2013, 36(2): 178-184.
[3] RUSSELL R S, RICKSON J B, ADAMS S N. Istopic equilibria between phosphates in soil and their significance in the assessment of fertility by tracer methods. European Journal of Soil Science, 1954, 5(1): 85-105.
[4] 刘俊英, 回金峰, 孙梦瑶, 刘选帅, 鲁为华, 马春晖, 张前兵. 施磷水平和接种AMF与解磷细菌对苜蓿产量及磷素利用效率的影响. 农业工程学报, 2020, 36(19): 142-149.
LIU J Y, HUI J F, SUN M Y, LIU X S, LU W H, MA C H, ZHANG Q B. Effects of phosphorus application and inoculation arbuscular mycorrhizae fungi (AMF) and phosphate solubilizing bacteria on dry matter yield and phosphorus use efficiency of alfalfa. Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(19): 142-149. (in Chinese)
[5] 毕银丽, 孙江涛, YPYSZHAN Z, 解文武, 于淼. 不同施磷水平下接种菌根玉米营养状况及光谱特征分析. 煤炭学报, 2016, 41(5): 1227-1235.
BI Y L, SUN J T, YPYSZHAN Z, XIE W W, YU M. Hyperspectral characterization and nutrition condition of maize inoculated with arbuscular mycorrhiza in different phosphorus levels. Journal of China Coal Society, 2016, 41(5): 1227-1235. (in Chinese)
[6] DOS SANTOS E F, ZANCHIM B J, DE CAMPOS A G, GARRONE R F, LAVRES J. Photosynthesis rate, chlorophyll content and initial development of physic nut without micronutrient fertilization. Revista Brasileira de Ciência do Solo, 2013, 37(5): 1334-1342.
[7] 任立飞, 张文浩, 李衍素. 低磷胁迫对黄花苜蓿生理特性的影响. 草业学报, 2012, 21(3): 242-249.
REN L F, ZHANG W H, LI Y S. Effect of phosphorus deficiency on physiological properties of. Acta Prataculturae Sinica, 2012, 21(3): 242-249. (in Chinese)
[8] SYNAN F A, SUZANNE M C, JEFFREY J V. Phosphate nutrition and defoliation effects on growth and root physiology of alfalfa. Journal of Plant Nutrition, 2006, 29(8): 1387-1403.
[9] 齐敏兴, 刘晓静, 张晓磊, 刘艳楠. 不同磷水平对紫花苜蓿光合作用和根瘤固氮特性的影响. 草地学报, 2013, 21(3): 512-516.
QI M X, LIU X J, ZHANG X L, LIU Y N. Effects of different phosphorus levels on photosynthesis and root nodule nitrogen-fixing characteristic of alfalfa. Acta Agrectir Sinica, 2013, 21(3): 512-516. (in Chinese)
[10] BOYCE R L, LARSON J R, SANFORD R L. Phosphorus and nitrogen limitations to photosynthesis in Rocky Mountain bristlecone pine () in Colorado. Tree Physiology, 2006, 26(11): 1477-1486.
[11] ZHANG W, CHEN X X, LIU Y M, LIU D Y, DU Y F, CHEN X P, ZOU C Q. The role of phosphorus supply in maximizing the leaf area, photosynthetic rate, coordinated to grain yield of summer maize. Field Crops Research, 2018, 219: 113-119.
[12] ASHRAF M, HARRIS P J C. Photosynthesis under stressful environments: An overview. Photosynthetica, 2013, 51(2): 163-190.
[13] ZHAO W S, SUN Y L, KJELGREN R, LIU X P. Response of stomatal density and bound gas exchange in leaves of maize to soil water deficit. Acta Physiologiae Plantarum, 2015, 37: 1074.
[14] LAWSON T, BLATT M R. Stomatal size, speed, and responsiveness impact on photosynthesis and water use efficiency. Plant Physiology, 2014, 164(4): 1556-1570.
[15] WOLZ K J, WERTIN T M, ABORDO M, WANG D, LEAKEY A D. Diversity in stomatal function is integral to modelling plant carbon and water fluxes. Nature Ecology and Evolution, 2017, 1(9): 1292-1298.
[16] CAI Q, JI C J, YAN Z B, JIANG X X, FANG J Y. Anatomical responses of leaf and stem ofto nitrogen and phosphorus addition. Journal of Plant Research, 2017, 13(6): 1035-1045.
[17] 高宏云. 棉花冠层“铃—叶系统”光合生理特性及其对滴灌量的响应[D]. 石河子: 石河子大学, 2020.
GAO H Y. Photosynthetic physiological characteristics of cotton canopy “boll-leaf system” and the response to drip irrigation amount[D]. Shihezi: Shihezi University, 2020. (in Chinese)
[18] 张燕, 王红兰, 蒋舜媛, 孙辉, 杨萍, 杜玖珍, 孙洪兵, 周毅. 不同氮浓度对羌活幼苗生长及抗氧化酶系统的效应. 中国实验方剂学杂志, 2018, 24(7): 38-44.
ZHANG Y, WANG H L, JIANG S Y, SUN H, YANG P, DU J Z, SUN H B, ZHOU Y. Effect of different nitrogen concentrations on growth and antioxidant enzymes activity inseedling in cultivation matrix. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(7): 38-44. (in Chinese)
[19] 魏婧, 徐畅, 李可欣, 贺洪军, 徐启江. 超氧化物歧化酶的研究进展与植物抗逆性. 植物生理学报, 2020, 56(12): 2571-2584.
WEI J, XU C, LI K X, HE H J, XU Q J. Progress on superoxide dismutase and plant stress resistance. Plant Physiology Journal, 2020, 56(12): 2571-2584. (in Chinese)
[20] SU B Q, WANG L F, SHANGGUAN Z P. Morphological and physiological responses and plasticity into the coupling of water, nitrogen and phosphorus. Journal of Plant Nutrition and Soil Science, 2021, 184(2): 271-281.
[21] 杨妮, 万绮雯, 李逸民, 韩妙华, 腾瑞敏, 刘洁霞, 庄静. 外源亚精胺对盐胁迫下茶树光合特性及关键酶基因表达的影响. 园艺学报, 2022, 49(2): 378-394.
YANG N, WAN Q W, LI Y M, HAN M H, TENG R M, LIU J X, ZHUANG J. Effects of exogenous spermidine on photosynthetic characteristics and gene expression of key enzymes under salt stress in tea plant. Acta Horticulturae Sinica, 2022, 49(2): 378-394. (in Chinese)
[22] ZHANG M, LIU W, LI C H, SHAO T T, JIANG X, ZHAO H Z, AI W T. Postharvest hot water dipping and hot water forced convection treatments alleviate chilling injury for zucchini fruit during cold storage. Scientia Horticulturae, 2019, 249: 219-227.
[23] AERTS R, CHAPIN F S. The mineral nutrition of wild plants revisited: A re-evaluation of processes and patterns. Advances in Ecological Research, 2000, 30: 1-67.
[24] THOMPSON J B, SLOT M, DALLING J W, WINTER K, TURNER B L, ZALAMEA P C. Species-specific effects of phosphorus addition on tropical tree seedling response to elevated CO2. Functional Ecology, 2019, 33(10): 1871-1881.
[25] 陈婷婷, 符卫蒙, 余景, 奉保化, 李光彦,符冠富, 陶龙兴. 彩色稻叶片光合特征及其与抗氧化酶活性、花青素含量的关系. 中国农业科学, 2022, 55(3): 467-478.
CHEN T T, FU W M, YU J, FENG B H, LI G Y, FU G F, TAO L X. The photosynthesis characteristics of colored rice leaves and its relation with antioxidant capacity and anthocyanin content. Scientia Agricultura Sinica, 2022, 55(3): 467-478. (in Chinese)
[26] SERGI M B, TANA J M, LEONOR A. Enhanced photo- and antioxidative protection, and hydrogen peroxide accumulation in drought-stressedandplants. Tree Physiology, 2003, 23: 1-12.
[27] 陆雯芸, 房克, 边红武, 朱睦元. 气孔发育及其调控因素的研究进展. 植物生理学报, 2016, 52(6): 782-788.
LU W Y, FANG K, BIAN H W, ZHU M Y. Advances in stomatal development and its regulation factors. Plant Physiology Journal, 2016, 52(6): 782-788. (in Chinese)
[28] RODRIGUEZ D, SANTA MARIA G E, POMAR M C. Phosphorus deficiency affects the early development of wheat plants. Journal of Agronomy and Crop Science, 1994, 173(1): 69-72.
[29] 王宏亮, 郭思义, 王棚涛, 宋纯鹏. 植物气孔发育机制研究进展. 植物学报, 2018, 53(2): 164-174.
WANG H L, GUO S Y, WANG P T, SONG C P. Research progress in stomatal development mechanism. Chinese Bulletin of Botany, 2018, 53(2): 164-174. (in Chinese)
[30] CORNIC G. Drought stress inhibits photosynthesis by decreasing stomatal aperture-not by affecting ATP synthesis. Trends in Plant Science, 2000, 5(5): 187-188.
[31] XU Z Z, ZHOU G S. Responses of leaf stomatal density to water status and its relationship with photosynthesis in a grass. Journal of Experimental Botany, 2008, 59(12): 3317-3325.
[32] 郑云普, 常志杰, 范晓懂, 张运鑫, 刘亮, 陈文娜, 刘媛媛, 郝立华. CO2浓度升高和磷素亏缺对黑麦草气孔特征及气体交换参数的影响. 农业工程学报, 2021, 37(18): 82-89.
ZHENG Y P, CHANG Z J, FAN X D, ZHANG Y X, LIU L, CHEN W N, LIU Y Y, HAO L H. Effects of CO2concentration increase and phosphorus deficiency on the stomatal traits and leaf gas exchange parameters of ryegrass. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(18): 82-89. (in Chinese)
[33] ZHAO W S, SUN Y L, KJELGREN R, LIU X P. Response of stomatal density and bound gas exchange in leaves of maize to soil water deficit. Acta Physiologiae Plantarum, 2015, 37(1): 1-9.
[34] ULLAH A, SUN H, YANG X Y, ZHANG X L. Drought coping strategies in cotton: Increased crop per drop. Plant Biotechnology Journal, 2017, 15(3): 271-284.
[35] YU Q, RENGEL Z. Drought and salinity differentially influence activities of superoxide dismutase in narrow-leafed lupins. Plant Science, 1999, 142: 1-11.
[36] ISRAR D, MUSTAFA G, KHAN K S, SHAHZAD M, AHMAD N , MASOOD S. Interactive effects of phosphorus andon chickpea (L.) growth, nutrient uptake, antioxidant enzymes and organic acids exudation. Plant Physiology and Biochemistry, 2016, 108: 304-312.
[37] SONG Y Z, KONG F F, XUE Y, QIN B Q. Responses of chlorophyll and MDA of Vallisneria natansto nitrogen and phosphorus availability and epiphytic algae. Journal of Freshwater Ecology, 2015, 30(1): 85-97.
Effect of phosphorus Application on Physiological Parameters and Antioxidant Capacity in Alfalfa Leaves
ZHAO JianTao, YANG KaiXin, WANG XuZhe, MA ChunHui, ZHANG QianBing
College of Animal Science & Technology, Shihezi University, Shihezi 832000, Xinjiang
【Objective】The aim of this study was to investigate the effects on nutrient uptake, photosynthetic pigment content, stomatal aperture and antioxidant system of alfalfa leaves after three consecutive years of phosphorus fertilizer application, so as to provide scientific fertilization methods for efficient production of alfalfa.【Method】Field trials were conducted at the forage experiment station of Shihezi University in Xinjiang from 2019 to 2021. ‘WL366HQ’ alfalfa was used as the test material, and four fertilizer treatments in the experiment included 0 (CK), 50 (Low P, LP), 100 (Middle P, MP), and 150 (High P, HP) kg·hm-2. Samples were taken at the first flowering of alfalfa to determine the hay yield, nitrogen and phosphorus content, pigment content, stomatal opening, antioxidant enzyme activity, and oxidizing substances of leaves.【Result】The nitrogen and phosphorus content, photosynthetic pigment content and stomatal aperture of leaves of alfalfa increased significantly (<0.05) after 3 years of continuous phosphorus fertilization, with the highest nitrogen and phosphorus content under MP treatment (54.74 and 2.99 g·kg-1, respectively), the highest chlorophyll a and chlorophyll b content under MP, and the highest carotenoid content under LP or MP, and the lowest in CK. The stomatal aperture was the highest under MP and significantly higher than that under CK (<0.05). Therefore, phosphorus fertilizer had different effects on the morphological and physiological characteristics of alfalfa leaves, and MP treatment significantly affected the photosynthetic and physiological characteristics of alfalfa leaves (<0.05). Superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) activities were the highest under MP, with the value of 162.55, 406.40 and 147.13 U·g-1, respectively, and were significantly higher than those under CK (<0.05). The malondialdehyde (MDA), hydrogen peroxide (H2O2) and proline (Pro) content were the lowest under MP, at 2.38 and 1.04 μmol·g-1and 56.85 μg·g-1, respectively. According to the Pearson correlation analysis, the total N and P contents of alfalfa leaves showed significant positive correlation (<0.05) with chlorophyll content, carotenoid content, stomatal aperture, SOD activity and POD activity, and significant negative correlation (<0.05) with MDA and H2O2content. The overall evaluation showed that the principal component scores of phosphorus application treatments were ranked as MP>HP>LP>CK. 【Conclusion】 The reasonable application of phosphorus fertilizer increased the nutritional characteristics and photosynthetic physiological characteristics of alfalfa leaves, thus avoiding the stressful effects brought by other environmental factors, enhancing the adaptive capacity of alfalfa, and making it better adapted to external environmental changes. Considering the leaf morphology, photosynthetic physiological characteristics and antioxidant enzymes and oxidizing substances of alfalfa, the phosphorus application rate of 100 kg·hm-2was suitable under this experiment.
alfalfa; phosphorus fertilizer; leaf phenotype; leaf physiology; hay yield

10.3864/j.issn.0578-1752.2023.03.005
2022-05-20;
2022-10-08
国家自然科学基金(32001400)、霍英东青年教师基金(171099)、兵团科技创新骨干人才计划项目(2021CB034)、国家现代农业产业技术体系
赵建涛,E-mail:1513192544@qq.com。通信作者马春晖,E-mail:chunhuima@126.com。通信作者张前兵,E-mail:qbz102@163.com
(责任编辑 杨鑫浩)
