芸薹属植物MYBL2基因的克隆及其在A、B、C基因组中的PCR鉴别
2023-03-07邹婷刘丽莉向建华周定港吴金锋李莓李宝张大为严明理
邹婷,刘丽莉,向建华,周定港,吴金锋,李莓,李宝,张大为,严明理,
芸薹属植物MYBL2基因的克隆及其在A、B、C基因组中的PCR鉴别
邹婷1,刘丽莉1,向建华1,周定港1,吴金锋1,李莓2,李宝2,张大为1,严明理1,2
1湖南科技大学生命科学与健康学院/经济作物遗传改良与综合利用湖南省重点实验室,湖南湘潭 410201;2湖南省作物研究所,长沙 410125
【目的】MYBL2负调控拟南芥花青素和原花青素的生物合成。从芸薹属6个物种的不同叶色材料中克隆MYBL2基因,分析其序列和表达模式,探究其在芸薹属植物花青素生物合成途径中的功能,为油菜的品质、抗逆性、观赏性等性状改良提供参考。【方法】以芸薹属6个物种19份供试材料的总DNA为模板,同源克隆MYBL2基因,并进行多序列比对和进化树分析;对白菜、甘蓝型油菜、芥菜型油菜以及埃塞俄比亚芥的紫叶材料进行遮光处理,结合转录组和qRT-PCR分析MYBL2基因表达水平;对甘蓝、甘蓝型油菜、芥菜型油菜以及埃塞俄比亚芥紫、绿叶材料进行qRT-PCR分析MYBL2基因表达水平;根据克隆和序列的核苷酸变异位点设计特异性引物,开发能够区分MYBL2基因组来源的PCR标记。【结果】克隆获得和各9个同源基因共56个拷贝。其中,为首次获得,编码区序列全长为867 bp,包含2个内含子,分别为168和102 bp,编码198个氨基酸,分子量为22.69 kD,等电点(pi)为8.72。序列比对和进化分析表明,来源于B基因组。芸薹属6个物种和同源基因中,仅、和在不同叶色材料中存在序列差异。经遮光处理后,紫叶材料叶色变浅,在白菜紫宝5号中,和表达量分别为未遮光部分的0.7和0.4倍;在紫叶白花甘蓝型油菜中,、、和表达量分别为未遮光部分的0.4、0.5、0.4和0.4倍;在紫叶芥中,、、和表达量分别为未遮光部分的0.4、0.3、0.4和0.2倍;在紫秆埃芥中,、和表达量分别为未遮光部分的0.3、0.4和0.5倍,而表达量为未遮光部分的2.4倍。对比芸薹属不同叶色材料MYBL2基因表达情况,结果表明,除了羽衣甘蓝,在紫叶材料中MYBL2基因大部分同源基因的表达量均高于绿叶。在羽衣甘蓝中,绿叶羽衣甘蓝和的表达量分别为紫叶羽衣甘蓝的2.5和3.5倍;在甘蓝型油菜中,紫叶白花、和的表达量分别为绿叶白花的7.5、8.6和26.0倍,而绿叶白花的表达量为紫叶白花的13.0倍;在芥菜型油菜中,紫叶芥、、和的表达量分别为四川黄籽的8.3、11.8、23.2和14.6倍;在埃塞俄比亚芥中,紫秆埃芥、的表达量分别为W-BCDH76的7.1和27.6倍,而W-BCDH76的和的表达量则分别为紫秆埃芥的2.8和5.0倍。依据克隆的基因序列设计出5对引物,可以有效鉴别芸薹属植物MYBL2基因的A、B、C基因组来源。【结论】芸薹属紫叶材料MYBL2基因的表达与光照密切相关,而且参与花青素生物合成的调控机制与拟南芥MYBL2负调控花青素生物合成的机制有所不同。
芸薹属植物;MYBL2基因;同源克隆;基因表达;基因组PCR鉴别
0 引言
【研究意义】油菜不仅是重要的油料作物,还是重要的膳食蔬菜,在全世界范围内都有广泛的栽培和食用,其丰富的花色和叶色具有观赏价值。花青素(anthocyanidins)和原花青素(proanthocyanidins,PAs)是植物体内广泛存在的色素,属于类黄酮合成途径中的次生代谢物,是影响植物花色、叶色、茎秆颜色和籽粒颜色形成的重要因素[1],可以帮助植物本身应对干旱、虫害、冻害和吸引昆虫授粉等,蔬用和油用则具有抗氧化、预防心血管和肿瘤疾病等功效[2-3]。植物花青素和原花青素的生物合成途径非常复杂,涉及很多关键酶、转运蛋白和转录因子的参与[4-5],探究并挖掘花青素和原花青素合成的关键基因,对油菜的品质、抗逆性、观赏性等性状的改良具有重要的意义。【前人研究进展】MYBL2(myeloblastosis family transcription factor like-2)转录因子属于R3-MYB蛋白家族,参与植物抗逆境胁迫和类黄酮合成等重要生物过程的调控[6-7]。拟南芥负调控花青素的生物合成,且可能参与了花青素合成的反馈抑制,AtMYBL2通过与TT8(bHLH类转录因子)蛋白相互作用形成转录抑制复合物,该复合物能够结合(编码二氢黄酮醇4-还原酶,Dihydorflavonol 4-reductase)启动子,抑制和的转录,从而抑制花色苷的积累[8-11]。在敲除系中,花青素合成关键基因和调控基因的表达水平上调,花青素含量显著上升[12]。Song等[13]发现的表达与花青素含量呈负相关,紫甘蓝()叶片的紫色是由于启动子替换或基因序列缺失导致的表达缺失所致。然而,Mushtaq等[14]结合qRT-PCR和转录组分析了紫、绿叶白菜(),结果表明,在紫叶中的表达量显著高于绿叶。Rameneni等[15]结合qRT-PCR和转录组分析发现在红紫色白菜(reddish purple Chinese cabbage,RPCC)中的转录水平高于绿色白菜。Ye等[16]发现与甘蓝型油菜黄色和白色花瓣相比,、和是杏色花瓣和粉色花瓣中唯一显著上调的3个花青素调节基因,这些结果与黄色和白色花瓣中花青素含量较低相一致,与花青素积累呈显著正相关。因此,MYBL2基因可能是芸薹属植物花青素生物合成途径中重要的调控基因,但MYBL2基因是发挥正调控还是负调控功能需要进一步验证。有报道表明基因组原位杂交能够辨别芸薹属杂种后代的A、B、C基因组[17-18],也有根据基因上的酶切位点来鉴定A、C组的报道[19]。基因组原位杂交操作比较复杂,有多态性且能被酶切的位点相对有限,虽然有利用PCR和FISH等方法检测B组染色体上的特异序列的报道,但这样的特异序列也非常有限[20]。Drenkard等[21]以拟南芥为研究材料开发了一种改进的等位基因特异性PCR程序,设计引物时引入错配碱基形成错配,用于检测单核苷酸多态性(single nucleotide polymorphism,SNP)位点。YAN等[22-25]根据数据库已有和克隆得到的芸薹属植物、和的DNA序列分别在A、B、C基因组中特有的核苷酸多态位点进行引物设计,开发出能够简单、快速地检测基因的多态性和等位基因的基因组来源的PCR标记。【本研究切入点】芸薹属植物基因的克隆和功能研究主要以白菜、甘蓝、甘蓝型油菜为主,在黑芥、芥菜型油菜和埃塞俄比亚芥中研究较少,芸薹属6个物种花青素生物合成途径中MYBL2基因的功能尚未全部明确,关于芸薹属6个物种MYBL2基因序列的变异和多态性的研究也尚未见报道。【拟解决的关键问题】本研究基于已公布的和的DNA序列设计引物,以芸薹属6个物种不同叶色的材料为对象,同源克隆MYBL2基因,通过比较和在不同叶色材料中的序列差异和基因表达情况,以探讨其与叶色之间的关系。通过分析芸薹属6个物种不同叶色材料中和特异的SNP位点,开发出能够识别来自A、B、C基因组的MYBL2基因的PCR标记,为进一步了解其功能及起源进化关系奠定基础。
1 材料与方法
1.1 试验材料
芸薹属6个物种19份材料,包括白菜(,2n=20,AA)早熟40、绿叶白菜、白菜全紫株、紫宝5号;黑芥(,2n=16,BB)Giebra(由华中农业大学李再云课题组惠赠);甘蓝(,2n=18,CC)绿叶羽衣甘蓝、紫叶羽衣甘蓝;芥菜型油菜(,2n=36,AABB)四川黄籽、李G19、紫叶芥、Z44紫叶黄籽、紫叶cd30;甘蓝型油菜(,2n=38,AACC)湘油787、ZSL409、绿叶白花和紫叶白花;埃塞俄比亚芥(,2n=34,BBCC)W-BCDH76、黄埃和紫秆埃芥,用途详见电子附表1。
1.2 DNA提取和cDNA的合成
采用天根生化科技(北京)有限公司的试剂盒提取叶片的总DNA和总RNA,运用北京擎科生物科技有限公司的反转录试剂盒合成cDNA,1.0%琼脂糖凝胶检测DNA和RNA的完整性,核酸测定仪检测其浓度和纯度,将DNA和cDNA稀释至50 ng·μL-1。
1.3 芸薹属MYBL2基因的克隆和序列分析
以19份供试材料叶片的总DNA为模板进行基因编码区序列克隆,参照NCBI(https://www.ncbi.nlm.nih. gov/)、BnTIR(http://yanglab.hzau.edu.cn/BnTIR)和BRAD(http://brassicadb.cn)等数据库已有的和序列设计引物(电子附表2),由北京擎科生物科技有限公司合成。PCR反应体系为2×Rapid Taq master mix 10 μL、10 mmol∙L-1正向引物1 μL、10 mmol∙L-1反向引物1 μL、50 ng·μL-1DNA模板2 μL,无菌去离子水补足至20 μL。PCR扩增程序为95℃ 5 min;95℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。用1.0%琼脂糖凝胶电泳检测PCR产物,回收后,与pMD19-T载体连接,并转化大肠杆菌DH5α感受态细胞,利用Amp抗性和X-gal/IPTG进行蓝白斑筛选。选取6个阳性克隆送生工生物工程(上海)股份有限公司测序,采用DNAMAN软件分析芸薹属不同叶色材料测序所得序列,结合数据库已有的序列进行生物信息学分析,结合GenBank数据库中下载与芸薹属亲缘关系较近物种的MYBL2蛋白质序列进行比对,用MEGA11.0软件构建系统发育树。
1.4 芸薹属MYBL2基因转录水平的分析
将紫宝5号、紫叶白花甘蓝型油菜、紫叶芥和紫秆埃芥材料的紫叶进行遮光处理(3个生物学重复)2周,取叶片。将紫叶羽衣甘蓝、绿叶羽衣甘蓝、紫叶白花甘蓝型油菜、绿叶白花甘蓝型油菜、紫叶芥、四川黄籽、W-BCDH76和紫秆埃芥材料进行土培,6叶期时取新鲜叶片。对上述叶片提取总RNA,反转录成cDNA。并将紫叶遮光和未遮光材料送上海美吉生物医药科技有限公司进行转录组测序分析。根据测序所得芸薹属6个物种MYBL2基因序列差异设计引物(电子附表2)。利用实时荧光定量PCR(qRT-PCR)检测芸薹属MYBL2基因转录水平,以为内参基因,qRT-PCR反应体系为荧光染料SYBR 10 μL、10 mmol∙L-1正向引物1 μL、10 mmol∙L-1反向引物1 μL、50 ng·μL-1cDNA模板1 μL,无菌去离子水补足至20 μL。qRT-PCR扩增程序为95℃ 5 min;95℃ 10 s,55℃ 30 s,35个循环;65—95℃熔解曲线,每0.5℃读板1次检测扩增产物的特异性。用2-ΔΔCT算法分析目标基因的相对表达量。
1.5 MYBL2-1和MYBL2-2等位基因的特异PCR检测
根据芸薹属6个物种和多态位点和基因特性,通过多次设计引物和优化PCR条件,设计5对特异性引物,能够区分来自A、B、C基因组的MYBL2基因(电子附表2)。PCR反应体系为2×Rapid Taq master mix 10 μL、10 mmol∙L-1正向引物1 μL、10 mmol∙L-1反向引物1 μL、50 ng·μL-1DNA模板2 μL,无菌去离子水补足至20 μL。PCR扩增程序为95℃ 5 min;95℃ 30 s,52℃ 30 s,72℃ 1 min,33个循环;72℃ 5 min。1.5%琼脂糖凝胶电泳检测。
2 结果
2.1 芸薹属植物MYBL2基因的克隆
以芸薹属6个物种19份供试材料叶片总DNA为模板进行编码区序列的克隆,共克隆获得和各9个同源基因,共计56段序列(电子附表1,电子附图1)。其中,用引物和从埃塞俄比亚芥W-BCDH76材料中扩增获得1条约1 000 bp大小的片段。测序结果表明,该序列为867 bp(电子附图2),包含2个内含子,分别为168和102 bp,且在参考基因组上未比对到相应基因。因此,该片段系首次获得,命名为。对序列进行比对,发现该序列与参考基因组中和序列相似性最高,分别为100%和98.39%;与BRAD数据库埃塞俄比亚芥另一个序列相似性为88.24%。因此,所获得的确定为B基因组来源的。
2.2 芸薹属植物MYBL2-1氨基酸序列的推导与分子进化分析
根据埃塞俄比亚芥W-BCDH76材料的cDNA序列,用MEGA11.0和DNAMAN8.0软件推导,BcaMYBL2-1共编码198个氨基酸(图1),分子量为22.69 kD,等电点(pI)为8.72,属于R3-MYB家族。BLASTp分析结果表明,BcaMYBL2-1蛋白序列与黑芥BniB03.MYBL2-1的相似性为100%;与芥菜型油菜BjuB03.MYBL2-1的相似性为95.96%。经多序列比对,BcaMYBL2-1与拟南芥、萝卜以及芸薹属6个物种MYBL2序列具有较高的保守性(电子附图3)。利用MEGA11.0构建进化树,发现来自不同材料的MYBL2-1与MYBL2-2分别聚在不同进化枝,且来源相同基因组(A、B或C基因组)的蛋白聚在一起,表明与的分化在芸薹属基因组分化和异源四倍化之前(图2)。BcaMYBL2-1与来自B基因组的BniB03.MYBL2-1和BjuB03.MYBL2-1的进化关系较近,进一步确定了其来源于B基因组。

BniB03 G:黑芥(Giebra);Bca G:WBCDH76;Bca P:紫秆埃芥;BjuB03 SY:四川黄籽;BjuB03 PM:紫叶芥

Bra G:绿叶白菜;Bra P1:白菜全紫株;Bra P2:紫宝5号;Bni G:Giebra;Bol G:绿叶羽衣甘蓝;Bol P:紫叶羽衣甘蓝;SY:四川黄籽;PM:紫叶芥;Bna G:绿叶白花;Bna P:紫叶白花;Bca G1:W-BCDH76;Bca G2:黄埃;Bca P:紫秆埃芥;At:拟南芥;Rs:萝卜
2.3 芸薹属植物不同叶色材料MYBL2基因的序列差异
通过对克隆MYBL2基因进行分析,结果表明,大部分克隆基因与参考基因组中序列完全一致(50/56),仅在部分材料中、和与参考基因组存在差异(表1)。比较芸薹属植物不同叶色材料MYBL2基因序列,与绿叶白菜相比,白菜全紫株外显子区域存在一段长为61 bp的片段插入(表1、电子附图4)。在芥菜型油菜中,不同叶色材料的外显子区域均有该61 bp片段的插入,而甘蓝型油菜中则均无该片段的插入(表1)。比较绿叶埃芥(W-BCDH76)和紫秆埃芥的编码区序列,共发现9个核苷酸差异位点差异(电子附图2),导致4处氨基酸变化(表1和图1);比较绿叶和紫叶羽衣甘蓝的序列,共发现11个核苷酸位点变异,导致3个氨基酸变化(表1,电子附图5)。但和在不同叶色的甘蓝型油菜和埃塞俄比亚芥材料中的均无差异(电子附图5)。此外,8个拷贝(黑芥暂无紫叶材料)在不同叶色材料中编码区序列均无差异(电子附图6)。
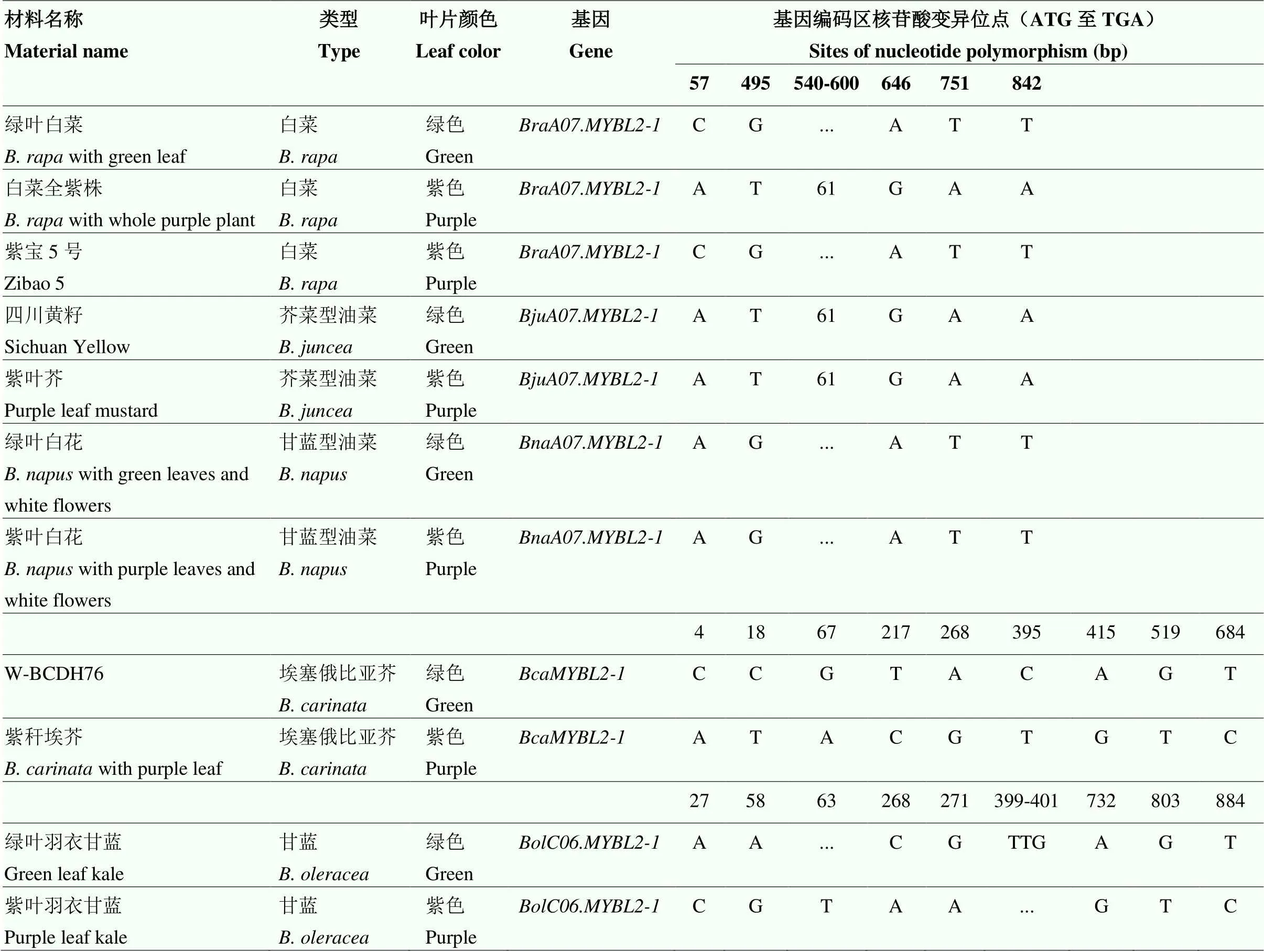
表1 芸薹属不同叶色材料MYBL2基因序列差异位点
61 bp片段为TTGTTTCAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAGGGAATCGATCCAACT
The 61 bp fragment is TTGTTTCAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAGGGAATCGATCCAACT
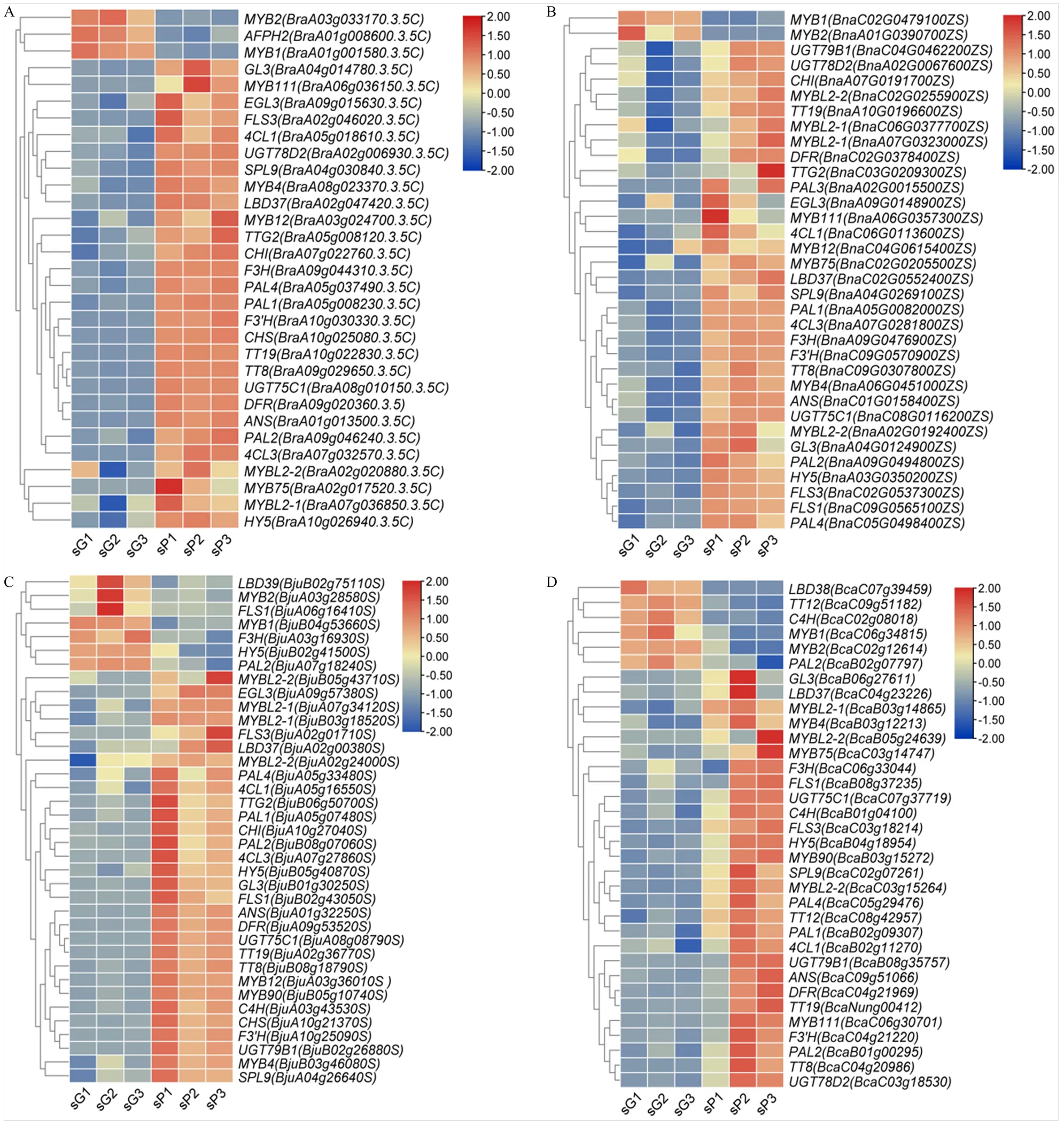
2.4 遮光处理下芸薹属MYBL2基因的表达
白菜、甘蓝型油菜、芥菜型油菜和埃塞俄比亚芥的紫叶材料经遮光处理2周后进行转录组测序与qRT-PCR分析,结果表明,紫叶材料经过遮光处理后叶色变浅,MYBL2基因表达普遍下调(图3)。在紫宝5号、紫叶白花甘蓝型油菜和紫叶芥中,与未遮光部分相比,MYBL2基因在遮光后均下调表达。在白菜紫宝5号中,和表达量分别为未遮光部分的0.7和0.4倍(图3-B);在紫叶白花甘蓝型油菜中,、、和表达量分别为未遮光部分的0.4、0.5、0.4和0.4倍(图3-C);在紫叶芥中,、、和表达量分别为未遮光部分的0.4、0.3、0.4和0.2倍(图3-D)。在紫秆埃芥中,、和表达量分别为未遮光部分的0.3、0.4和0.5倍,而表达量为未遮光部分的2.4倍(图3-E)。对紫叶材料遮光前后转录组数据进行分析,结果表明,花青素代谢途径中基因在遮光后平均表达量相比未遮光部分均下调(图4)。其中,、、等基因在芸薹属植物多个材料遮光后均下调表达,因此,推测上述基因与MYBL2基因一样,与光照密切相关,且遮光后被抑制表达。

A:芸薹属紫叶材料遮光处理后的表型;B:紫宝5号;C:紫叶白花甘蓝型油菜;D:紫叶芥;E:紫秆埃芥;sP:紫叶未遮光部分;sG:紫叶遮光部分
2.5 芸薹属植物不同叶色材料MYBL2基因的表达
比较甘蓝、甘蓝型油菜、芥菜型油菜和埃塞俄比亚芥紫绿叶材料中MYBL2基因的表达,结果表明,除了羽衣甘蓝,紫叶材料中MYBL2基因大部分同源基因均比绿叶上调表达。在羽衣甘蓝中,绿叶羽衣甘蓝和表达量分别为紫叶羽衣甘蓝的2.5和3.5倍(图5-B);在甘蓝型油菜中,紫叶白花、和表达量分别为绿叶白花的7.5、8.6和26.0倍,而绿叶白花表达量为紫叶白花的13.0倍(图5-C);在芥菜型油菜中,紫叶芥、、和表达量分别为四川黄籽的8.3、11.8、23.2和14.6倍(图5-D);在埃塞俄比亚芥中,紫秆埃芥、表达量分别为W-BCDH76的7.1和27.6倍,而W-BCDH76的和表达量则分别为紫秆埃芥的2.8和5.0倍(图5-E)。对芸薹属紫绿叶材料中花青素合成相关(甘蓝16个,甘蓝型油菜31个,芥菜型油菜31个,埃芥32个)基因表达进行分析(电子附图7),结果表明,甘蓝、甘蓝型油菜、芥菜型油菜和埃塞俄比亚芥紫绿叶材料中花青素合成相关基因表达模式存在差异,推测上述材料紫叶形成机制存在差异。
2.6 MYBL2-1和MYBL2-2等位基因的特异PCR检测
根据芸薹属6个物种和序列的SNP位点,设计5对引物以区分来自A、B、C基因组MYBL2基因(图6)。在9份供试材料中,引物可从具有A基因组材料中扩增出预期的目标条带;引物B1、B2和B均可从B基因组材料中产生特异的目标条带;引物对仅从具有C基因组的材料中产生预期的目标条带。通过上述引物,可以有效地鉴别芸薹属植物MYBL2的基因组来源。
3 讨论
3.1 羽衣甘蓝不同叶色材料MYBL2基因的表达分析
比较不同叶色芸薹属植物MYBL2基因,结果表明,仅、和编码区序列在紫、绿叶材料中存在差异。Song等[13]对紫叶甘蓝位于C06染色体上的的启动子区序列和编码区序列研究,结果表明,无论是启动子的替换,还是的全缺失,都可能导致甘蓝紫叶性状的出现。LIU等[26]在研究同一株观赏性羽衣甘蓝叶绿素、类胡萝卜素和花青素色素沉着时,发现MYBL2基因在粉红色叶片、浅粉红色叶片和绿色粉色杂色叶片中依次上调表达。HAN等[27]在对甘蓝花青素合成相关基因进行全基因组表征,发现和在紫叶甘蓝(材料:15Z-P)中的表达量显著低于绿叶羽衣甘蓝(材料:120QY-G)。本研究绿叶羽衣甘蓝和紫叶羽衣甘蓝的编码区序列存在11个核苷酸位点变异,会导致3个氨基酸变化,且紫叶材料中和表达量均相比绿叶低,但本研究所用甘蓝材料编码区序列的差异是否会导致叶色变化还有待进一步研究。
3.2 白菜、甘蓝型油菜、芥菜型油菜和埃塞俄比亚芥MYBL2基因的表达分析
Zhao等[28]发现在MYBL2基因上游通过抑制MYBL2基因正向调控蔗糖诱导的拟南芥花青素生物合成,MYBL2基因过表达显著抑制过表达幼苗的花青素合成。Xie等[29]在研究茉莉酸和赤霉素对花青素合成的影响过程中发现MBW复合物活性被MYBL2和JAZ家族蛋白抑制,它们分别与bHLH和MYB/bHLH竞争性结合,DELLA蛋白直接隔离MYBL2和JAZ抑制子,导致bHLH/MYB亚基的释放,随后形成活性MBW复合物,激活花青素生物合成途径,推测JAZ-DELLA-MYBL2模块在非生物胁迫诱导的花青素合成中也发挥了重要作用。Nguyen等[30]研究发现在高强度光照情况下,HY5(bZIP家族)直接与启动子结合抑制拟南芥MYBL2基因的表达增加花青素的积累。然而,在芸薹属植物研究中,IMTIAZ等[31]发现在钒胁迫下紫叶芥和绿叶芥花青素含量降低,花青素生物合成基因在紫叶芥中高表达,尤其是钒胁迫下的、和,钒浓度与花青素生物合成之间呈负相关,结果表明,、和的上调可以触发钒胁迫下花色苷的积累。KHUSNUTDINOV等[32]发现在芥菜型油菜的3个紫色品种(Vitamin、Red velvet和Freckle)中的表达量均显著高于绿色品种 。Ye等[16]发现与甘蓝型油菜黄色和白色花瓣相比,、和是杏色花瓣和粉色花瓣中唯一显著上调的3个花青素调节基因,这些结果与黄色和白色花瓣中花青素含量较低相一致,与花青素积累呈显著正相关。本研究白菜、甘蓝型油菜、芥菜型油菜和埃塞俄比亚芥的紫叶材料经遮光处理后叶色变浅,MYBL2基因表达量普遍下降,表明MYBL2基因的表达水平与光照密切相关且可能与花青素的积累呈正相关。对甘蓝型油菜、芥菜型油菜和埃塞俄比亚芥不同叶色材料MYBL2基因的表达进行分析发现,除了、和在紫叶中的表达量均低于绿叶,其余和在紫叶中的表达量均高于绿叶。因此,在芸薹属植物花青素合成途径中MYBL2转录因子究竟发挥正调控、负调控还是拮抗功能?芸薹属植物与拟南芥MYBL2是否发挥着不同功能?仍需要进一步验证。
A:紫宝5号;B:紫叶白花甘蓝型油菜;C:紫叶芥;D:紫秆埃芥;sP:紫叶未遮光部分;sG:紫叶遮光部分
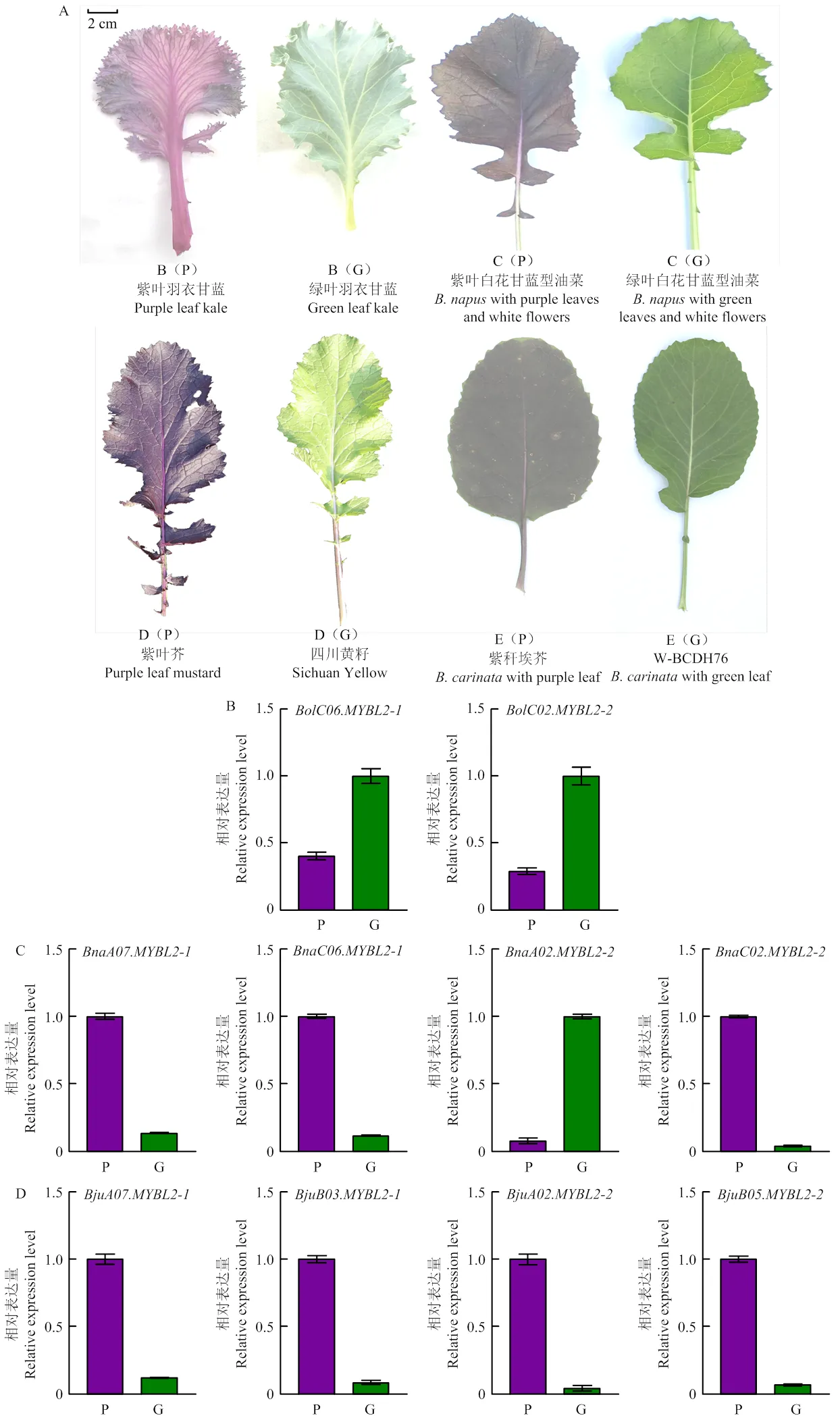
A:芸薹属不同叶色材料的表型;B(P):紫叶羽衣甘蓝;B(G):绿叶羽衣甘蓝;C(P):紫叶白花甘蓝型油菜;C(G):甘蓝型油菜绿叶白花;D(P):紫叶芥;D(G):四川黄籽;E(P):紫秆埃芥;E(G):W-BCDH76;P:紫叶材料;G:绿叶材料
A: Phenotypes ofwith different leaf colors; B(P): Green leaf kale; B(G): Purple leaf kale; C(P):with purple leaves and white flowers; C(G):with green leaves and white flowers; D(P): Purple leaf mustard; D(G): Sichuan Yellow; E(P):with purple leaf; E(G): W-BCDH76; P: Materials with purple leaf; G: Materials with green leaf
图5 芸薹属不同叶色材料MYBL2基因的表达
Fig. 5 The expression ofwith different leaf color

M:标准分子量;A:白菜早熟40;B:黑芥;C:羽衣甘蓝;AB1:紫叶芥;AB2:李G19;AC1:湘油787;AC2:紫叶白花甘蓝型油菜;BC1:黄埃;BC2:紫秆埃芥;N:空白对照;ACT:内参基因对照
3.3 芸薹属植物MYBL2基因A、B、C基因组的鉴别
芸薹属植物中,高花青素含量的材料多见在白菜、甘蓝和芥菜型油菜,而大规模种植的甘蓝型油菜其高花青素含量材料相对较少,且部分为远缘杂交获得[33-35]。本研究基于芸薹属6个物种和序列多态性位点设计的特异性引物,通过等位基因特异PCR可以准确区分来自A、B基因组的基因和来自B、C基因组的。在解析芸薹属MYBL2基因功能后,上述标记可为利用远缘杂交在A、B、C基因组间转移MYBL2基因,创制高花青素含量的甘蓝型油菜提供参考。
4 结论
芸薹属紫叶材料经遮光处理后,MYBL2基因表达量普遍下降,叶色变浅,表明该基因的表达与光照密切相关。除了羽衣甘蓝,发现在甘蓝型油菜、芥菜型油菜和埃塞俄比亚芥的紫叶材料中MYBL2基因的大部分同源基因的表达水平均高于绿叶,表明芸薹属植物中MYBL2基因参与花青素生物合成的调控机制与拟南芥有所不同。
[1] YAN M L, Ding S P, Liu L L, YIN X M, SHU J B. Cloning and expression analysis of an anthocyanidin synthase gene homologue fromJournal of genetics, 2014, 93(2): 513-516.
[2] IWASHINA T. Contribution to flower colors of flavonoids including anthocyanins: a review. Natural product communications, 2015, 10(3): 529-544.
[3] BAI S L, TAO R Y, TANG Y X, YIN L, MA Y J, NI J B, YAN X H, YANG Q S, WU Z Y, ZENG Y L, TENG Y W. BBX16, a B-box protein, positively regulates light-induced anthocyanin accumulation by activating
[4] HE Q, WU J Q, XUE Y H, ZHAO W B, LI R, ZHANG L G. The novel gene, located on chromosome A07, with a short intron 1 controls the purple-head trait of Chinese cabbage (L.). Horticulture research, 2020, 7: 97.
[5] ZHANG D W, LIU L L, ZHOU D G, LIU X J, LIU Z S, YAN M L. Genome-wide identification and expression analysis of anthocyanin biosynthetic genes inJournal of Integrative Agriculture, 2020, 19(5): 1250-1260.
[6] OGATA K, KANEI-ISHII C, SASAKI M, HATANAKA H, NAGADOI A, ENARI M, NAKAMURA H, NISHIMURA Y, ISHII S, SARAI A. The cavity in the hydrophobic core of MYB DNA-binding domain is reserved for DNA recognition and trans-activation. Nature structural biology, 1996, 3(2): 178-187.
[7] YE H X, LI L, GUO H Q, YIN Y H. MYBL2 is a substrate of GSK3-like kinase BIN2 and acts as a corepressor of BES1 in brassinosteroid signaling pathway inProceedings of the National Academy of Sciences of the United States of America, 2012, 109(49): 20142-20147.
[8] MATSUI K, UMEMURA Y, OHME-TAKAGI M. AtMYBL2, a protein with a single MYB domain, acts as a negative regulator of anthocyanin biosynthesis in. The Plant Journal, 2008, 55(6): 954-967.
[9] ZHANG X, ZHANG K, WU J, GUO N, LIANG J, WANG X, CHENG F. QTL-Seq and sequence assembly rapidly mapped the genefor the purple trait inica. Scientific reports, 2020, 10: 2328.
[10] WANG Y L, Wang Y Q, Song Z Q, Zhang H Y. Repression of
by both microRNA858a and HY5 leads to the activation of anthocyanin biosynthetic pathway in. Molecular plant, 2016, 9(10): 1395-1405.
[11] XU W J, GRAIN D, BOBET S, LE GOURRIEREC J, THÉVENIN J, KELEMEN Z, LEPINIEC L, DUBOS C. Complexity and robustness of the flavonoid transcriptional regulatory network revealed by
comprehensive analyses of MYB-bHLH-WDR complexes and their targets inseed. New phytologist, 2014, 202(1): 132-144.
[12] DUBOS C, LE GOURRIEREC J, BAUDRY A, HUEP G, LANET E, DEBEAUJON I, ROUTABOUL J M, ALBORESI A, WEISSHAAR B, LEPINIEC L. MYBL2 is a new regulator of flavonoid biosynthesis in. The Plant Journal, 2008, 55(6): 940-953.
[13] SONG H, YI H, LEE M, HAN C T, LEE J, KIM H, PARK J I, NOU I S, KIM S J, HUR Y. Purpleis due to the loss ofexpression. BMC plant biology, 2018, 18(1): 82.
[14] MUSHTAQ M A, PAN Q, CHEN D Z, ZHANG Q H, GE X H, LI Z Y. Comparative leaves transcriptome analysis emphasizing on accumulation of anthocyanins in: molecular regulation and potential interaction with photosynthesis. Frontiers in plant science, 2016, 7: 311.
[15] RAMENENI J J, CHOI S R, CHHAPEKAR S S, KIM M S, SINGH S, YI S Y, OH S H, KIM H, LEE C Y, OH M H, LEE J, KWON O H, PARK S U, KIM S J, LIM Y P. Red Chinese cabbage transcriptome analysis reveals structural genes and multiple transcription factors regulating reddish purple color. International journal of molecular sciences, 2020, 21(8): 2901.
[16] YE S H, HUA S J, MA T T, MA X W, CHEN Y P, WU L M, ZHAO L, YI B, MA C Z, TU J X, SHEN J X, FU T D, WEN J. Genetic and multi-omics analyses revealas the key gene conferring anthocyanin-based color inflowers. Journal of Experimental Botany, 2022, 73(19):6630-6645.
[17] 孔芳, 蒋金金, 吴磊, 王幼平. 利用原位杂交及CAPS标记分析芸薹属A、B和C基因组间的关系. 作物学报,2008, 34(7): 1188-1192.
KONG F, JIANG J J, WU L, WANG Y P. relationships among genome A, B and C revealed by FISH and CAPS. Acta Agronomica Sinica, 2008, 34(7): 1188-1192. (in Chinese)
[18] 李宗芸, 伍晓明, 王秀琴, 宋运淳. 甘蓝与芸薹属5个近缘物种的基因组原位杂交分析. 中国油料作物学报, 2003, 25(4): 16-19, F003.
LI Z Y, WU X M, WANG X Q, SONG Y C. Genomic in situ hybridization analysis ofand 5 relatedspeciesChinese Journal of Oil Crop Scieves,2003, 25(4): 16-19, F003. (in Chinese)
[19] WU Y H, XIAO L, WU G, LU C M. Cloning of fatty acid elongase1 gene and molecular identification of A and C genome inspecies. Science in China. Series C, Life sciences, 2007, 50(3): 343-349.
[20] SCHELFHOUT C J, SNOWDON R, COWLING W A, WROTH J M. A PCR based B-genome-specific marker inspecies. Theoretical and applied genetics, 2004, 109(5): 917-921.
[21] DRENKARD E, RICHTER B G, ROZEN S, STUTIUS L M, ANGELL N A, MINDRINOS M, CHO R J, OEFNER P J, DAVIS R W, AUSUBEL F M. A simple procedure for the analysis of single nucleotide polymorphisms facilitates map-based cloning inPlant physiology, 2000, 124(4): 1483-1492.
[22] YAN M L, LIU X J, GUAN C Y, Liu L L, Lu Y, Liu Z S . Cloning and SNP analysis ofgene incaActa Agronomica Sinica, 2010, 36(10): 1634-1641.
[23] YAN M L, LIU X J, GUAN C Y, CHEN X B, LIU Z S. Cloning and expression analysis of an anthocyanidin synthase gene homolog from.Molecular Breeding, 2011, 28(3): 313-322.
[24] 严明理, 刘丽莉, 向建华, 丁素萍, 舒佳宾, 孙婵. 黑芥基因的克隆和在芸薹属B基因组的PCR鉴别. 中国油料作物学报, 2013, 35(5): 484-490.
YAN M L, LIU L L, XIANG J H, DING S P, SHU J B, SUN C. Cloning ofgene inand PCR identification froma B-genomes. Chinese Journal of Oil Crop Sciences,2013, 35(5): 484-490. (in Chinese)
[25] YAN M L, Liu X J, Guan C Y, Liu L L, Xiang J H, Lu Y, Liu Z S. Cloning ofgene and PCR identification of genomes A, B and C inspecies. Genetica, 2014, 142(2): 169-176.
[26] Liu Y, Feng X, Zhang Y T, Zhou F H, Zhu P F. Simultaneous changes in anthocyanin, chlorophyll, and carotenoid contents produce green variegation in pink-leaved ornamental kale. BMC genomics, 2021, 22(1): 455.
[27] HAN F Q, ZHANG X L, YANG L M, ZHUANG M, ZHANG Y Y, LIU Y M, LI Z S, WANG Y, FANG Z Y, JI J L, LV H H. Genome-wide characterization and analysis of the anthocyanin biosynthetic genes in. Planta, 2021, 254(5): 92.
[28] ZHAO D M, ZHENG Y X, YANG L J, YAO Z Y, CHENG J F, ZHANG F, JIANG H Y, LIU D. The transcription factor AtGLK1 acts upstream of MYBL2 to genetically regulate sucrose-induced anthocyanin biosynthesis inBMC plant biology, 2021, 21(1): 242.
[29] XIE Y, TAN H J, MA Z X, HUANG J R. DELLA proteins promote anthocyanin biosynthesis via sequestering MYBL2 and JAZ suppressorsof the MYB/bHLH/WD40 complex inMolecularplant, 2016, 9(5): 711-721.
[30] NGUYEN N H, JEONG C Y, KANG G H, YOO S D, HONG S W, LEE H. MYBD employed by HY5 increases anthocyanin accumulation via repression ofThe Plant Journal, 2015, 84(6): 1192-1205.
[31] Imtiaz M, Mushtaq M A, Nawaz M A, Ashraf M, Rizwan M S, Mehmood S, Aziz O, Rizwan M, Virk M S, Shakeel Q, Ijaz R, Androutsopoulos V P, Tsatsakis A M, Coleman M D. Physiological and anthocyanin biosynthesis genes response induced by vanadium stress in mustard genotypes with distinct photosynthetic activity. Environmental toxicology and pharmacology, 2018, 62: 20-29.
[32] Khusnutdinov E, Artyukhin A, Sharifyanova Y, Mikhaylova E V. A mutation in thegene is associated with purple pigmentation inInternational journal of molecular sciences, 2022, 23(19): 11865.
[33] HU D D, JING J J, SNOWDON R J, MASON A S, SHEN J X, MENG J L, ZOU J. Exploring the gene pool ofby genomics-based approaches. Plant Biotechnology Journal, 2021, 19(9): 1693-1712.
[34] FU W, CHEN D, PAN Q, LI F, ZHAO Z, GE X, LI Z. Production of red-flowered oilseed rape via the ectopic expression ofOvPAP2.Plant biotechnology journal, 2018, 16(2): 367-380.
[35] GOSWAMI G, NATH U K, PARK J I, HOSSAIN M R, BISWAS M K, KIM H T, KIM H R, NOU I S. Transcriptional regulation of anthocyanin biosynthesis in a high-anthocyanin resynthesizedcultivar. Journal of Biological Research (Thessalonike , Greece), 2018, 25: 19.
Cloning of MYBL2 gene fromand its PCR identification in genomes A, B and C
ZOU Ting1, LIU LiLi1, XIANG JianHua1, ZHOU DingGang1, WU JinFeng1, LI Mei2, LI Bao2, ZHANG DaWei1, YAN MingLi1,2
1College of Life Science and Health, Hunan University of Science and Technology/Hunan Provincial Key Laboratory of Genetic Improvement and Comprehensive Utilization of Cash Crops, Xiangtan 410201, Hunan;2Hunan Crop Research Institute, Changsha 410125
【Objective】In,MYBL2 negatively regulates the biosynthesis of anthocyanins and proanthocyanidinsThe MYBL2 genes from sixspecies with different leaf colors were cloned. By analyzing the sequence and expression pattern of MYBL2, the function of MYBL2 in the biosynthesis of anthocyanins inspecies was explored. 【Method】The sequences of MYBL2 from the sixspecies with different leaf colors were obtained using homology-based cloning method and multi sequence alignment and phylogenetic tree analysis were performed. The purple leaf materials of,,andwere treated with shading, and the expression level of MYBL2 gene was analyzed by transcriptome sequencing and qRT-PCR. The qRT-PCR in,,andwith purple and green leaves were also performed to evaluate the expression level of MYBL2. Based on the nucleotide variation sites of the clonedandsequences, PCR markers which could distinguish the genomic origin of alleles were developed. 【Result】A total of 56 copies of 9 homologs ofandwere cloned from 19 samples of six species of. Thegene was obtained for the first time. The total length ofsequence was 867 bp, including two introns of 168 bp and 102 bp respectively, encoding 198 amino acids, with a molecular weight of 22.69 kD and an isoelectric point (pI) of 8.72. Sequence alignment and evolutionary analysis showed thatwas derived from B genome. Among theandcopies of six species in, only,andexhibited sequence differences in different leaf color materials. After shading treatment, the leaf color of purple leaf material becomes lighter than that of the unshaded part. In Chinese cabbage Zibao 5, the expression ofandwith purple leaves and white flowers, the expression of,,and,,andwith purple leaf, the expression of,and, the results showed that the expression of most of the homologous genes of MYBL2 gene in purple leaf materials was higher than that in green leaf materials except kale. In kale, the expression ofand, the expression of,and,,andwere 8.3 times, 11.8 times, 23.2 times and 14.6 times of those in Sichuan yellow respectively. Inwith purple leaf, BcaMYBL2-1 and BcaB03.MYBL2-1 were 7.1 and 27.6 times as much as W-BCDH76, respectively. However,andgenes of W-BCDH76 were 2.8 and 5.0 times as much as those ofwith purple leaf, respectively. Five pairs of primers were obtained, which can effectively identify thefrom A, B and C genomes of. 【Conclusion】After shading treatment, MYBL2 gene expression was closely related to light. the regulation mechanism of MYBL2gene inplants involved in anthocyanin biosynthesis was different from that ofplants in which MYBL2 gene negatively regulated anthocyanin biosynthesis.
species; MYBL2gene; homologous cloning; gene expression; genomic PCR identification

10.3864/j.issn.0578-1752.2023.03.002
2022-08-31;
2022-10-24
国家自然科学基金(31971980,U19A2029)
邹婷,Tel:15297827231;E-mail:3392648002@qq.com。通信作者张大为,E-mail:zhangdawei.hnust@foxmail.com。通信作者严明理,E-mail:ymljack@126.com
(责任编辑 李莉)
