经导管主动脉瓣置换术后心脏传导阻滞及其并发症相关研究
2023-03-06潘佳君安朝唐小军乔帆蔡成良陆方林徐志云李白翎赵志敏
潘佳君 安朝 唐小军 乔帆 蔡成良 陆方林 徐志云 李白翎 赵志敏
自2002年首例经导管主动脉瓣置换术(TAVR)开展以来,其适应证不断拓宽[1]。2017 年美国和欧洲心脏学会的心脏瓣膜病指南均将不适合外科手术、外科手术高危和中危患者列为TAVR 适应证[2-3]。随着介入瓣改进和术者经验积累,中度以上瓣周漏等并发症的发生率逐步下降,而术后心脏传导阻滞,主要包括左束支传导阻滞(LBBB)和导致永久起搏器植入(PPM)的发生率改善不明显,它仍是目前TAVR 最常见的并发症[4]。目前国产常用的主动脉介入瓣为Venus-A 和J-Valve,但其术后心脏传导阻滞并发症的研究仍较少。本研究旨在明确TAVR 术后新发心脏传导阻滞情况及其对预后的影响。
1 对象与方法
1.1 研究对象
连续纳入2017 年9 月至2019 年12 月海军军医大学第一附属医院心血管外科收治的符合TAVR手术适应证(外科手术禁忌或经美国胸外科医师协会评分为外科手术高危),行TAVR 术的重度主动脉瓣狭窄或反流患者。排除标准:术前有心脏永久起搏器植入史。TAVR 使用的介入瓣为国产Venus-A 瓣膜(经动脉途径,杭州启明医疗器械股份有限公司)或J-Valve 瓣膜(经心尖途径,苏州杰成医疗科技有限公司)。
1.2 方法
记录患者一般资料、既往史,术前、手术次日及出院前的实验室检查(血常规、肝肾功能、脑钠肽水平)结果和12 导联心电图,术前及出院前超声心动图,测定心腔大小、左室射血分数(LVEF)、主动脉瓣跨瓣压差和主动脉瓣最大跨瓣血流速度等。记录围手术期并发症,如死亡、因高度房室传导阻滞(HAVB)或完全性房室传导阻滞(CHB)植入永久起搏器、严重瓣周漏、脑卒中、急性心肌梗死、主动脉夹层、心包填塞、急性肾功能损伤(需要血液透析治疗)、血管并发症等。
根据患者是否存在术后新发且出院时仍持续存在的心脏传导阻滞,包括LBBB、室内传导阻滞、房室传导阻滞(AVB)、术后PPM,或患者术前即存在一度AVB 或束支阻滞,出院前PR 间期或QRS波延长≥20 ms,将患者分为心律正常组和传导阻滞组,比较组间基线资料、出院前的情况和心超参数。
平均随访患者6 个月,记录有否有死亡、植入心脏永久起搏器、因心力衰竭再入院等不良事件,并复查心脏超声。
1.3 统计学分析
使用SPSS 23.0 软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,非正态分布的计量资料以中位数(最小值,最大值)表示。计数资料以例数和百分数表示。计量资料的组间比较使用独立样本t检验或秩和检验,计数资料的比较采用Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
2.1 患者基础情况
共入组54 例患者,其中使用Venus-A 介入瓣者44 例,使用J-Valve 介入瓣者10 例。TAVR 术后左室收缩末期内径(3.5 cm 对3.2 cm,P=0.004)、左室舒张末期内径(5.1 cm 对4.7 cm,P<0.001)、主动脉瓣跨瓣压差(82.5 mmHg 对22.0 mmHg,P<0.001)、主动脉瓣上最大流速(459 cm/s 对238 cm/s,P<0.001)较术前均显著改善,LVEF 变化无统计学差异。
心律正常组32 例,传导阻滞组22 例,与心律正常组相比,传导阻滞组年龄偏大[(74.22±6.27)岁对(78.00±5.57)岁,P=0.027],高血压(56.3%对86.4%,P=0.035)和冠状动脉粥样硬化性心脏病(12.5%对45.5%,P=0.011)比例较高,性别、既往PCI 病史、肝肾功能、脑钠肽(BNP)水平、基础心电图表现(心房颤动、一度AVB、LBBB、RBBB 比例)和超声心动图参数(见表1)的差异无统计学意义。
2.2 TAVR术后传导阻滞情况
围术期新发传导阻滞22 例(40.7%),其中最常见为LBBB(16 例);其次为一度AVB(4 例)、HVAB/CHB(3 例)、二度2 型AVB、PR 间期延长>20 ms、左前分支传导阻滞等。
出院时完全性左束支传导阻滞(CLBBB)患者16 例(其中3 例合并一度AVB)。这16 例患者中,3 例在术后有一过性CHB;1 例有一过性一度AVB;1 例术后新发室内传导阻滞,之后发展为CLBBB;1 例基础为室内传导阻滞,术后发展为CLBBB;QRS波时限增加>20 ms。CHB 患者3 例,1 例在术后9 d 行PPM,1 例为交界性逸搏心律。出院时一度AVB 共4 例(3 例合并CLBBB,1 例有间歇性二度2 型AVB)。1 例基础存在一度AVB,术后PR 间期延长>20 ms。1 例术后新发左前分支传导阻滞(该患者术前即有一度AVB+CRBBB 的基础,术后5 d 出现CHB,术后12 d无CHB)。
2.2 随访情况
2 组患者术前、术后超声心动图参数比较均无统计学差异,见表1。
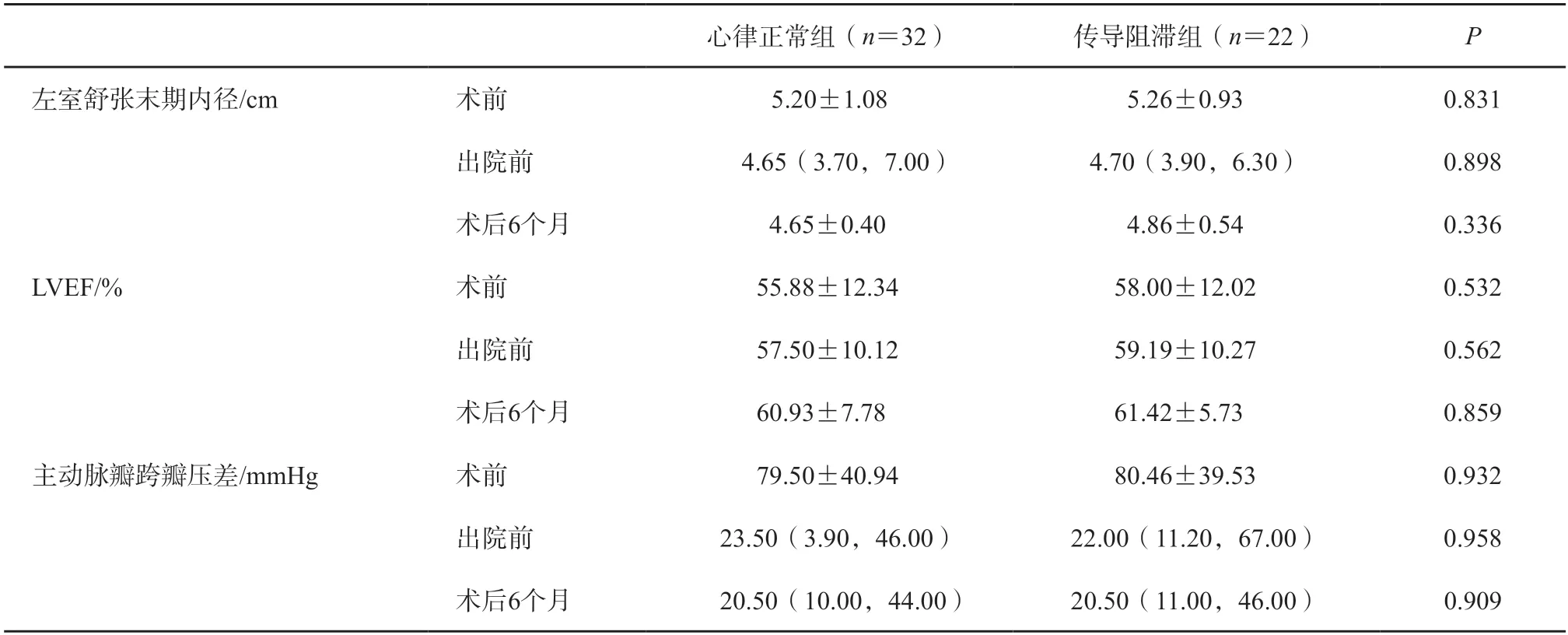
表1 TAVR患者围术期及术后6个月超声心动图数据对比
平均随访6 个月,随访期间心律正常组死亡3 例(1 例因心力衰竭、肝肾功能不全,1 例因心力衰竭、心源性休克,1 例因感染),再入院2 例(1 例因肾功能衰竭、高钾血症,1 例因心力衰竭);传导阻滞组再入院1 例(因心力衰竭)。2 组在6 个月随访时不良事件(死亡或再入院)、死亡率及超声心动图参数的差异均无统计学意义,见表1。
3 讨论
心脏传导阻滞是目前TAVR 术后最常见的并发症,主要为LBBB[5-6]和CHB[7-8],CHB 也是TAVR 术后行PPM 最常见的适应证。在主要以自膨式的Corevalve 介入瓣和球扩式的Sapien 介入瓣为代表的第一代瓣膜中,新发LBBB 的发生率为4%~65%,导致需PPM 的房室传导阻滞发生率为3%~38%。新一代产品(Sapien 3 介入瓣、CoreValveEvolut R 介入瓣等)对术后心脏传导阻滞的改善有限[5-6]。针对国产介入瓣术后的数据仍较少,本研究中,TAVR 术后心脏传导阻滞并不罕见(发生率为40.7%),以LBBB 为主(发生率为29.6%),CHB 发生率为5.6%,其中植入PPM 的AVB 比例较低(1.9%)。
多项研究探讨了TAVR 术后心脏传导阻滞的机制和相关预测因素[9-16]。在术后新发LBBB 的临床危险因素中,公认的是介入瓣在左心室流出道(LVOT)的植入深度[9-13]。在术后需要PPM 的预测因素中,基础RBBB 是最强烈的PPM 预测因子[14-16]。在本研究中,与心律正常组相比,传导阻滞组患者年龄较大,术前合并高血压和冠状动脉粥样硬化性心脏病比例较高,其余术前基础指标未见统计学差异。
关于TAVR 术后传导阻滞对患者预后的影响,本研究的2 组患者在出院和术后6 个月随访时超声心动图参数组间无明显差异。随访时不良事件(死亡或再入院)、死亡率也未见统计学差异。这提示TAVR 术后心脏传导阻滞在短期内对心脏结构、功能及预后影响并不明显。有研究发现术后新发LBBB 会增加术后1 年心源性死亡、心力衰竭再住院和PPM 的风险,是否增加全因死亡仍有争议[6,17]。这可用术后进展性AVB 和猝死,以及长期LBBB 造成的心室不同步,影响患者的心脏收缩功能[18]来解释。PPM 对TAVR 术后中期死亡率的影响略有争议,近期1 篇纳入21 项研究42 927 例患者的meta 分析发现,TAVR 术后围术期PPM 与较高的全因死亡(RR=1.17,95%CI:1.11~1.25,P<0.001)、1年心力衰竭再住院(RR=1.18,95% CI:1.03~1.36,P<0.02)有关,与心源性死亡的增加无关(RR=0.84,95%CI:0.67~1.05,P=0.13),这可用右心室起搏的不良作用来解释[19]。而PPM 对传导阻滞(部分研究PPM 的适应证较宽松,包括新发LBBB)的患者发生恶性缓慢性心律失常有保护作用,这可抵消对心室功能的不良影响,因此,并不增加术后1 年心源性死亡风险,其远期影响仍需进一步研究明确。
综上所述,TAVR 术后可能新发LBBB、CHB等心脏传导阻滞,但需要行PPM 的比例较低。心脏传导阻滞在术后短期(6 个月内)对患者临床事件、死亡率、心脏结构、功能未见明显影响。远期影响有待进一步观察。本研究为小样本单中心研究,病例数较少,随访时间短,且缺少部分术中指标(如瓣膜植入深度等)和随访时心电图变化,有一定局限性。
