pH值偏移大豆油体-姜黄素复合乳液的物理特性及稳定性
2023-03-06康梦雪孙禹凡宋晗钰钟明明齐宝坤
康梦雪,孙禹凡,宋晗钰,钟明明,王 帅,齐宝坤
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
姜黄素是一种存在于姜黄根茎中的低分子质量亲脂性多酚化合物[1]。姜黄隶属于姜科,被东南亚等地用作香料、调味剂、着色剂、防腐剂和传统药物。姜黄素是姜黄中最具生物活性的成分,具有抗炎、抗氧化、抗菌、抗糖尿病、抗肿瘤和抗癌等活性;但其水溶性差、化学不稳定、光降解、代谢降解率较高、生物利用度较低等缺点阻碍着姜黄素在食品中的应用[2]。近年来,研究人员通过包埋,利用乳液、凝胶、脂质体、纳米晶体等递送体系稳定姜黄素,提高其生物利用度[3]。
油体是植物种子细胞中贮存脂质的细胞器,是具有内核为三酰甘油、被单层磷脂和蛋白质包裹、直径为0.5~2 μm的球形结构,蛋白质、磷脂和油脂含量分别为0.59%~3.46%、0.59%~1.57%和94.28%~98.17%[4]。由于其天然单层磷脂-蛋白膜结构,油体能均匀分散在水中,形成天然水包油乳液且具有良好稳定性[5]。同时,油体的疏水内核可用于溶解油溶性维生素、多酚等非极性生物活性物质,为油体作为天然运载体提供了可能,但由于其稳定的结构较难封装疏水性营养成分,使得该特性并未得到充分利用[6]。近年来,研究人员试图利用油体作为载体,通过加热法、pH值驱动法、油溶乳化等方法包埋营养成分进行应用[6-7],但由于营养成分的不稳定性,探究如何将活性物质装载到油体中仍具有重要意义。
pH值偏移法是一种有效改变蛋白质结构和功能的方法[8]。其通过将蛋白质等置于碱性或酸性环境,导致蛋白质构象发生变化,然后调整到中性环境,使蛋白质分子发生完全或部分展开和重新折叠[9]。蒋将[10]和Kuwajima[11]发现极端pH值偏移处理有效诱导了大豆蛋白熔球态,即一种处于变性与未变性之间的稳定态,具有与未变性蛋白相似的二级结构,但三级结构松散。Wang Yuying等[12]研究了pH值偏移处理过程中大豆蛋白的去折叠-重折叠过程,并成功制备姜黄素大豆蛋白纳米颗粒。
本研究以大豆为原料,采用湿法磨浆的方式从原料中分离富集油体,试图通过pH值偏移法使油体蛋白处于熔球态,制备姜黄素油体乳液,并探究不同pH值偏移法制备姜黄素油体乳液的包封率、粒子特性、显微结构、蛋白质结构及稳定性,从而考察油体对亲脂性多酚的包埋效果,为油体应用提供一种新途径。
1 材料与方法
1.1 材料与试剂
大豆(东农52号) 东北农业大学大豆研究所;姜黄素 上海源叶生物科技有限公司;尼罗红、尼罗蓝美国Sigma公司;其他化学试剂均为分析纯。
1.2 仪器与设备
GL-21M高速冷冻离心机 湖南湘仪离心机仪器有限公司;HK-02万能粉碎机 广州鸿兴机械有限公司;JY92-IIN超声波细胞破碎仪 宁波新芝生物科技股份有限公司;F-4500型荧光分光光度计 日本Hitachi公司;Zetasizer Nano ZS9型粒度及电位分析仪 英国马尔文仪器有限公司;UV-6100紫外-可见分光光度计 日本岛津公司;PHSJ-4A型实验室pH计 上海仪电科学仪器股份有限公司;AUY120分析天平(0.0001 g) 北京赛多利斯仪器系统有限公司。
1.3 方法
1.3.1 油体的提取
参照Tzen[13]和李杨[14]等的方法,并稍作修改。清洗大豆,在4~6 ℃下与蒸馏水以1∶5(g/mL)的比例浸泡18~20 h,用组织捣碎机以18000 r/min磨浆5 min,用4 层脱脂纱布过滤,除去豆渣、收集滤液。向滤液中加入20%蔗糖溶液,冰水浴搅拌15 min,并用2 mol/L NaOH溶液将pH值调节至11.0,转移至离心桶内,4 ℃、15000 r/min离心30 min,收集上层乳状物,并重复此步骤2 次,获得大豆油体富集物。用去离子水清洗大豆油体富集物即得大豆油体,置于4 ℃冰箱中保存备用。
1.3.2 姜黄素-油体的制备
取适量姜黄素粉末分散于去离子水中,置于搅拌器上搅拌至分散均匀。用去离子水将油体稀释,并用2 mol/L NaOH溶液将pH值调至11.0,搅拌均匀,分别用4 mol/L HCl溶液将pH值调至6.0、5.0、4.0、3.0、2.0、1.0。加入姜黄素分散液,充分搅拌混合、超声(100 W,4 min)使其接触均匀。用4 mol/L NaOH溶液将各样品pH值调至中性,加去离子水至乳液中油体含量为10%、姜黄素质量浓度为2.4 mg/10 mL,并结合超声(150 W,8 min)促使其作用均匀。4 ℃、2000 r/min离心2 min去除未包封姜黄素,透析2 d(截留分子质量8000 Da)去除乳液中盐离子。
1.3.3 包封率的测定
参考Zheng Bingjing等[15]的方法,并稍作改动。取1 mL乳液与9 mL二甲基亚砜混合,3000 r/min离心10 min,离心后收集有机层,重复萃取2 次合并萃取液。将萃取液稀释至适宜浓度,420 nm处测定其吸光度,根据标准曲线y=0.1354x-0.0498,相关系数(R2)=0.9991,计算姜黄素含量。
按式(1)计算包封率:
式中:CE为乳液中姜黄素的添加质量浓度/(mg/mL);CI为样品中测定的姜黄素质量浓度/(mg/mL)。
1.3.4 粒径、Zeta电位和多相分散指数的测定
将油体乳液均匀分散于磷酸盐缓冲液(phosphate buffered saline,PBS)中,利用Zetasizer Nano ZS90型粒度与电位分析仪于25 ℃下测定0.05%油体乳液Zeta电位、平均粒径和多相分散指数(polydispersity index,PDI),分散相和连续相的折射率分为1.456和1.330。
1.3.5 超高分辨显微镜观察
参考Sun Yufan等[16]的方法,并稍作改动。将制备好的样品用PBS(pH 7.4,10 mmol/L)稀释15 倍,将尼罗蓝、尼罗红溶于异丙醇中,制成1.0%尼罗蓝染液和0.1%尼罗红染液。向1 mL样品中分别加入50 μL尼罗蓝染液、50 μL尼罗红染液,混合均匀,各避光15 min。将样品置于载玻片上,盖上盖玻片,使用超高分辨率显微镜在488 nm和633 nm的激发波长下观察脂滴形态、大小。
1.3.6 内源荧光光谱的测定
根据孙禹凡等[17]的方法,并稍作修改,测定油体乳液的内源荧光光谱。将样品用10 mmol/L PBS释至10 倍,将样品放置在石英比色皿的固体样品支架中,利用荧光分光光度计记录内源荧光光谱。激发波长为280 nm,发射波长为300~400 nm,狭缝宽度为5 nm,扫描速率为600 nm/min。
1.3.7 油体表面蛋白提取及表征
参考Ding Jian等[18]的方法,并稍作改动。将样品与丙酮1∶3(V/V)混合,室温下缓慢摇晃30 min。12000×g离心15 min,收集下层物质,重复上述过程3 次。最终获得油体表面蛋白,氮气吹干,冷冻干燥。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分离胶为12%、浓缩胶为5%,将油体表面蛋白溶于水至蛋白质量浓度为3 mg/mL,加入上样缓冲液,沸水浴5 min,上样量15 μL,80 V运行30 min,120 V运行至结束。用考马斯亮蓝染液染色后脱色至条带清晰,利用凝胶成像仪拍照保留。
1.3.8 油体乳析指数测定
将新制样品置于带塞试管,在常温下放置14 d,放置后乳液分为两层,上层为乳析层,下层为清液层。按式(2)计算乳析指数:
式中:HS为乳清层的高度;HE为玻璃管中乳液的总高度。
1.3.9 油体pH值稳定性的测定
用1 mol/L HCl或NaOH溶液将新制样品的pH值分别调至2、4、6、8、10,利用Zetasizer Nano ZS90型粒度与电位分析仪在25 ℃条件下测定0.05%不同pH值下油体乳液的Zeta电位和平均粒径。
1.3.10 油体氧化稳定性测定
将新制样品乳液放置于45 ℃恒温恒湿箱中,加速其氧化,利用紫外-可见分光光度计进行实验测定。
1.3.10.1 氢过氧化物测定
参考Zhao Luping等[19]的方法,并稍作改动。取0.3 mL样品加入至1.5 mL异辛烷-异丙醇(2∶1,V/V)中,旋涡振荡30 s,2000×g离心2 min。取200 μL上层有机相加入至2.8 mL甲醇-正丁醇(2∶1,V/V)中,分别加入30 μL 3.94 mol/L硫氰酸盐和0.072 mol/L Fe2+,旋涡混合,避光反应20 min。使用紫外-可见分光光度计在510 nm波长处测定样品的吸光度,以过氧化氢异丙苯作标准曲线。标准曲线为y=0.419x-0.0658,R2=0.990。
1.3.10.2 硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARS)值测定
参考武利春等[20]的方法,并稍作改动。取1 mL样品加入至2 mL硫代巴比妥酸测试液(由15%三氯乙酸、0.375%硫代巴比妥酸和0.25 mol/L HCl组成)中,旋涡混合,沸水浴30 min后冷却至室温,过0.22 μm滤膜。使用紫外-可见分光光度计在532 nm波长处测定样品吸光度,以1,1,3,3-四乙氧基丙烷作标准曲线。标准曲线为y=0.545x+0.0732,R2=0.991。
1.4 数据分析
2 结果与分析
2.1 姜黄素大豆油体乳液的包封率
如图1所示,随着pH值减小,油体中姜黄素的包封率由35.46%增加至65.55%。这可能因为随着pH值降低,蛋白质结构发生去折叠现象,疏水性增强、二硫键打开,姜黄素进入油体油相内核,且处于极端酸性环境时,蛋白质疏水基团得以充分暴露,蛋白质具有相对柔性的构象,更多姜黄素进入油体内核油相中[21-22]。当pH值偏移为1.0时,油体包封率最高,为65.55%。这可能因为pH值偏移引起蛋白质产生的“熔球”状态,相关蛋白质的侧链相互作用变弱,结构充分展开,姜黄素溶于油体油相中,姜黄素包封率达到最佳[23-24]。

图1 不同pH值偏移制备的姜黄素油体乳液的包封率Fig.1 Encapsulation efficiencies of curcumin-loaded oil body emulsions prepared at different pH levels
2.2 姜黄素大豆油体乳液的物理特性分析
乳液中脂滴的Zeta电位和平均粒径是衡量乳液稳定性的重要指标之一[25]。由表1可知,经pH值偏移处理后乳液Zeta电位绝对值显著小于未处理样品(P<0.05);除pH值偏移为6.0时,不同pH值偏移处理的乳液Zeta电位无显著区别(P>0.05);处理后样品PDI显著大于未处理油体(P<0.05)。这可能由于油体蛋白分子的N和C末端带电荷,其正电荷指向内部,负电荷暴露于乳液微环境中;酸性条件下,油体相关蛋白发生质子化,产生正电荷,中性条件下时,蛋白发生去质子化;同时,酸性环境使油体蛋白结构扩展、表面蛋白结构打开,姜黄素得以进入油体油相中,但疏水基团等相关基团暴露,影响了电荷结合能力和表面电荷分布,从而导致当乳液环境回到中性时,表面负电荷减少,乳液稳定性下降[22,26]。

表1 不同pH值偏移制备的姜黄素油体乳液的性质表征Table 1 Characteristics of curcumin oil-loaded body emulsions prepared at different pH levels
由图2可知,不同pH值偏移制备的姜黄素油体乳液粒径分布形成的峰相似;当pH 1.0时,与其他pH值相比,粒径明显增大,粒径分布形成的峰右移,并呈单峰分布。结合图1可得,随着pH值的降低,油体对姜黄素的包封率增大,内核油相中姜黄素含量增多,从而导致乳液粒径增大[2];而当pH值处在蛋白质等电点(pH 4.0~5.0)附近时,乳液液滴的双峰分布可能是由于油体之间静电斥力不足,其聚集行为使乳液稳定性丧失、产生絮凝和分层;pH值恢复至中性时,部分乳液因构象紧密,未实现全部分离[22,27]。故经pH值偏移后,油体乳液稳定性略有降低;而当pH值偏移为1.0时,乳液粒径呈均匀的单峰分布,表明乳液再次重新排列成相对稳定的状态。

图2 不同pH值偏移制备的姜黄素油体粒径体积分布Fig.2 Particle size volume distribution of curcumin-loaded oil body emulsions prepared at different pH levels
2.3 姜黄素大豆油体乳液的微观结构观察
如图3所示,乳液为O/W型,与Sun Yufan等[16]研究结果一致,油相基本成椭球形或球形,蛋白锚定在油相表面形成闭环,将油相包裹。
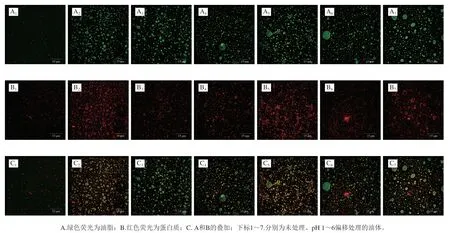
图3 不同pH值偏移制备的姜黄素油体乳液的微观结构Fig.3 Microstructure of curcumin-loaded oil body emulsions prepared at different pH levels
由图3可知,未处理油体脂滴呈球形分布、粒径最小;当pH≤2.0时,乳液中脂滴分散良好,蛋白和油脂锚定紧实;当pH>2.0时,脂滴出现聚集且多呈椭球状或不规则状分布,这与粒径结果一致。当pH 5.0时,油脂和蛋白质分别聚集,部分蛋白质未包裹油相,这可能因为当环境接近油体蛋白等电点时,油体蛋白之间的静电排斥不足以克服相互吸引作用,蛋白质发生絮集[22]。当pH 6.0时,部分蛋白成双层壳形网状结构,形成不规则椭球形,这可能由于pH值回归中性时,蛋白质结构柔性降低,油脂聚集,为将油脂全部包裹,形成不规则椭球闭环;同时,部分小分子蛋白在闭环内部与其相连接,部分疏水端锚入油脂中,从而形成壳形网状结构。当pH 1.0时,脂滴多呈球状分布,这可能因为在短暂的极酸环境中,油体蛋白的二级结构保持相对完整,当恢复至中性环境时,蛋白结构得以恢复,使其结构与未处理油体结构相似[22,28]。
2.4 姜黄素大豆油体乳液油体的内源荧光光谱分析
内源荧光对色氨酸残基微环境和蛋白质三级结构的变化高度敏感。通常,若色氨酸荧光λmax<330 nm,则将色氨酸指定为掩埋且处于“非极性”环境中;若λmax>330 nm,则色氨酸被指定为处于“极性”环境中。如图4所示,姜黄素油体的发射荧光光谱在306 nm波长处有一个峰值(小于330 nm),因此油体的色氨酸基团处于“非极性”环境中[28]。

图4 不同pH值偏移制备的姜黄素油体乳液的内源荧光光谱图Fig.4 Endogenous fluorescence spectra of curcumin-loaded oil body emulsions prepared at different pH levels
如图4所示,当油体经极端酸性pH值偏移处理后,其最大波长未发生红移、蓝移,而当pH≥4.0时,λmax红移1 nm。这可能由于蛋白质在极端酸性pH值偏移处理过程中更容易形成能保持蛋白质结构完整的“熔球”结构,从而减少蛋白质内部疏水氨基酸的暴露,这与Yan Shizhang等[24]的研究结果一致;而当偏移环境接近等电点时,蛋白分子部分发色基团暴露,色氨酸基团向更亲水的微环境移动。pH 1.0时,荧光强度与未处理油体相似,这表明pH 1.0时,pH值偏移处理未破坏蛋白质的三级结构;而pH≥2时,与未处理油体相比,荧光强度增大,油体蛋白发生一定的变性和解离。这可能因为短暂的极酸环境未对油体蛋白结构造成不可逆影响,该结果与2.3节中推测结果一致;其他pH值下荧光强度增强,这是因为在正常情况下,发色团通常隐藏在分子内部,从而表现出较低荧光强度,经历pH值偏移处理后,油体蛋白结构松散,蛋白质内部的色氨酸残基等疏水基团暴露出来,从而使荧光强度增加[25]。
2.5 姜黄素大豆油体乳液油体蛋白的SDS-PAGE
油体表面蛋白在维持油体的稳定性和调整油体大小方面起重要作用,为进一步探明pH值偏移对姜黄素油体乳液稳定性的影响,不同pH值偏移得到的姜黄素油体相关蛋白的亚基结构如图5所示。不同油体蛋白均显示出内源蛋白(分子质量15~25 kDa)条带和外源蛋白(分子质量>33 kDa)条带。

图5 不同pH值偏移制备的姜黄素油脂体乳液油体蛋白的SDS-PAGEFig.5 SDS-PAGE patterns of curcumin-loaded oil body emulsions prepared at different pH levels
随着pH值偏移的增加,外源蛋白含量逐渐增多,同时出现分子质量小于15 kDa的肽;这可能因为pH值偏移处理使蛋白质分子结构疏散,影响了蛋白质分子之间的相互作用,促使外源蛋白分子发生重排,形成亚基的交联[10,29]。而pH 1.0时,蛋白质亚基的种类和含量未发生明显改变;这可能因为极酸环境仅打开了蛋白质的表面结构,并在中性环境时发生重组、结构恢复[10]。故当pH值偏移为1.0时,蛋白质未发生实质性改变,与以上研究结果一致。
2.6 姜黄素大豆油体乳液的稳定性分析
2.6.1 贮藏稳定性分析
如图6所示,与未处理油体乳液对比,经pH值偏移制备的姜黄素油体乳液贮藏稳定性较差,这与表1结果一致。这可能由于pH值偏移处理后,油体油-水界面被破坏,油体蛋白疏水基团等相关基团暴露,进而改变了乳液液滴表面电荷分布,表面负电荷减少,乳液稳定性下降,随着贮藏时间延长,液滴间静电相互作用减弱,乳液发生聚集和絮凝[17,22]。

图6 不同pH值偏移制备的姜黄素油脂体乳液的贮藏稳定性Fig.6 Storage stability of curcumin-loaded oil body emulsions prepared at different pH levels
2.6.2 pH值稳定性分析
如图7所示,随着pH值增加,乳液平均粒径先增加后减小,Zeta电位逐渐减小。pH 4.0时,平均粒径达到最大,Zeta电位绝对值最小,乳液表现出不稳定;pH 2.0和pH 6.0~10.0时,乳液表现出较低的平均粒径和较大的Zeta电位绝对值,乳液较为稳定[30]。这是由于pH 4接近油体蛋白的等电点(pH 4.0~5.0),此时液滴表面电荷较少,液滴之间静电相互作用较弱,导致颗粒聚集[7]。
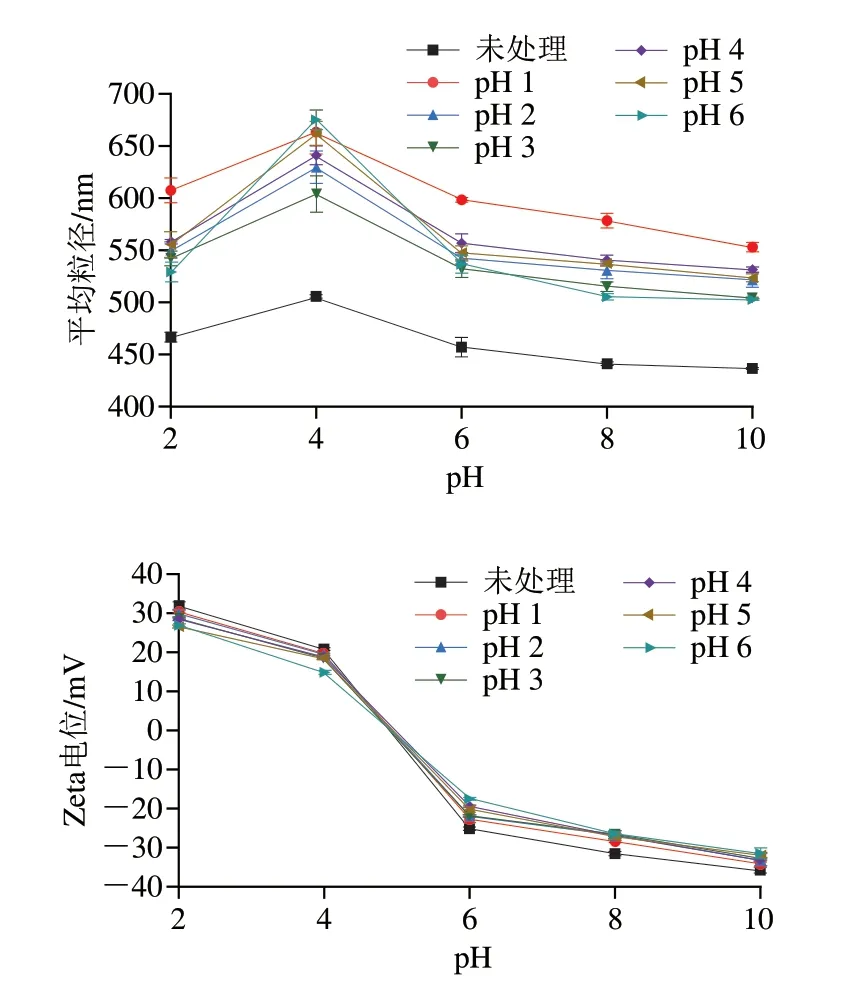
图7 不同pH值偏移制备的姜黄素油脂体乳液的pH值稳定性Fig.7 pH stability of curcumin-loaded oil body emulsions prepared at different pH levels
同时,与未处理油体乳液对比,经pH值偏移处理的油体乳液具有较大的平均粒径和较小的Zeta电位绝对值;此外,在不同pH值偏移处理的姜黄素油体乳液中,pH值偏移为1.0时,乳液具有较大的Zeta电位绝对值。结合图5可知,因为pH值偏移为1.0时,未显著破坏油体蛋白结构,对表面电荷分布的破坏较小,静电相互作用较强,所以Zeta电位绝对值较大,乳液较为稳定[31]。
2.6.3 氧化稳定性分析
通过监测贮存期间油脂氧化的初级产物(氢过氧化物)和次级产物(TBARS)含量,反映不同pH值偏移制备的姜黄素油体乳液的氧化稳定性。
如图8所示,随着贮藏时间的延长,未处理油体氢过氧化物的含量随贮藏时间延长,整体呈缓慢上升趋势,处理过的油体呈先减少后增大趋势,且油体氧化稳定性得以改善。这可能因为油体本身的特殊结构,其外层紧实的蛋白-磷脂层将内核油脂与外界环境相隔离,并含有少量的生育酚和植物甾醇等抗氧化物质[32],部分结合在油体表面的姜黄素提供了一定的抗氧化能力[5]。贮藏4~10 d,pH 5.0的样品中氢过氧化物含量上升趋势明显,而pH 1.0时的变化趋势与未处理油体趋于一致。结合图3研究,这可能由于pH 5.0时,油体聚集、部分油脂暴露于空气中,加速油脂氧化,而pH 1.0时,姜黄素油体成球状结构,蛋白质结构未发生显著变化,氧化稳定性较好。同时,初始状态下,处理过的油体氢过氧化物含量大于未处理油体,这可能由于经过处理的油体表面油水界面被破坏,导致氧化稳定性下降[33]。
由图8可知,贮藏0~2 d,TBARS值快速增加;贮藏6 d后,全部油体TBARS值呈上升趋势,此时,样品出现乳析现象,油体稳定性丧失,氧化加速进行。贮藏2~6 d,样品TBARS值整体呈下降趋势;贮藏结束时,不同pH值处理过的油体TBARS值均低于未处理油体,这可能由于姜黄素改变了油体清除自由基和螯合金属离子的能力,姜黄素将氢离子提供给过氧化自由基从而避免进一步降解,从而抑制油体次级氧化物的生成[5,34-35]。

图8 不同pH值偏移制备的姜黄素油脂体乳液的氧化稳定性Fig.8 Oxidation stability of curcumin-loaded oil body emulsions prepared at different pH levels
3 结论
通过pH值偏移处理,姜黄素可成功被油体包埋,pH值偏移为1.0时,包埋效果及氧化稳定性最佳。包封特性研究表明,随着pH值的减小,乳液包封率由35.46%增加至65.55%,脂滴聚集减少并逐渐呈均匀的椭球或球形分布。内源荧光光谱、SDS-PAGE结果表明,pH值偏移处理使油体蛋白结构疏散,发生一定解离,同时,促使外源蛋白分子发生重排,形成亚基交联;但pH 1.0时,蛋白质结构未发生明显变化,与天然油体蛋白结构相似。稳定性分析发现,pH值偏移法降低了油体的贮藏稳定性,油体pH稳定性略差,但姜黄素的存在提高了油体的氧化稳定性;pH值偏移为1.0时,氧化稳定性最佳。本实验为设计姜黄素运载体系和开发油体递送体系提供一定理论依据。
