脑型肌酸激酶促进胶质瘤干细胞增殖
2023-03-05梁盼盼朱秋泓周文超
梁盼盼,朱秋泓,周文超
(中国科学技术大学生命科学与医学部附属第一医院病理科,合肥 230036)
胶质母细胞瘤(glioblastoma, GBM)是一种常见的恶性原发性脑肿瘤[1,2],患者中位生存期仅为12~16 个月[3,4]。GBM 中的胶质瘤干细胞(glioma stem cells, GSCs)具有很强的自我更新、多向分化和治疗抵抗能力,与GBM 的恶性发展和治疗抵抗密切相关,是GBM 中的关键恶性细胞群体,因此是GBM 治疗的主要靶细胞[1,5]。
肌酸(creatine, Cr)是临床上用于胶质瘤磁共振波谱(MRS)检测的常用指标之一,与胶质瘤恶性程度有关[6‐8],但其发挥促肿瘤作用的具体机制尚不清楚。在细胞中,Cr 主要作为肌酸激酶(creatine kinase, CK)的代谢底物发挥功能。CK 催化Cr 与磷酸肌酸(phosphocreatine, PCr)相互转化,同时伴随着ATP 的消耗或再生成,由此构成CK/PCr 系统,发挥能量缓冲功能,调控细胞能量稳态[9‐11]。脑型肌酸激酶(brain‐type creatine kinase, CKB)是脑组织中含量最丰富的CK 亚型[12]。研究表明,肌酸激酶/磷酸肌酸(creatine kinase/phosphocreatine, CK/PCr)系统对于一些具有高能量需要的细胞如神经元、精子和肌细胞等至关重要[11],而肿瘤干细胞相比于非干性肿瘤细胞维持更高的细胞ATP 水平[13],因此CK/PCr系统可能通过促进GSCs 维持进而助长GBM 恶性发展。基于以上推测,本文探讨了CKB 催化的CK/PCr系统在GSCs 中的功能及其潜在的治疗意义,为提供一种GSCs 的GBM 治疗新方案提供实验依据。
材料与方法
1 试剂
兔 抗CKB/CKM 多 克 隆 抗 体(15137‐1‐AP)和小鼠抗α‐tubulin 单克隆抗体(HRP‐66031)购自Proteintech 公司;小鼠抗CKB 抗体 B‐9(sc‐373686)购自Santa Cruz Biotechnology 公司;羊抗SOX2 抗体(AF2018)购自R&D Systems 公司;兔抗SOX2单克隆抗体(3579)购自Cell Signaling Technology公司;Alexa Fluor™ 568 标记的驴抗兔荧光二抗(A‐10042)、Alexa Fluor™ 488 标记的驴抗羊荧光二抗(A‐11055)、Hoechst 33342,三盐酸盐,三水合物(H3570)、HRP 偶联的羊抗鼠二抗(A16072)、HRP 偶联的羊抗兔二抗(65‐6120)均购自Invitrogen公司;RPMI 1640(C3010‐0500)、DMEM 高糖培养基(C3113‐0500)和Trypsin EDTA Solution A(C3530)均来自VivaCell 公司;胎牛血清(FB25015)来自CLARK 公司;Neurobasal®‐A Medium(12349‐015)和50×B‐27 补 充 剂(17504044)来 源 于Gibco 公司;丙酮酸钠溶液(03‐042‐1B)、非必需氨基酸溶液(01‐340‐1B)、青链霉素溶液(03‐031‐1B)和L‐谷氨酰胺溶液(03‐020‐1A)均来源于BI 公司;Accutase(7922)来源于STEMCELL 公司;重组人表皮生长因子EGF(1150‐04‐1000)来源于GoldBio公司;重组人成纤维细胞生长因子FGF(100‐18B‐1000)来源于Peprotech 公司;CCK8‐试剂(A311‐02)来源于Vazyme 公司;环肌酸(377627)来源于Sigma‐Aldrich 公司;磷酸肌酸(19333‐65‐4)来源于阿拉丁公司。
2 细胞培养
H2S‐GSC 细胞系获赠于美国匹兹堡大学的Jeremy N Rich 教授,悬浮生长于Neural Basal 完全培养基中。培养基配方为:500 mL Neurobasal®‐A Medium+10 mL B‐27 补充剂(50×)+5 mL 丙酮酸钠溶液+5 mL 非必需氨基酸溶液+5 mL L‐谷氨酰胺溶液+500 μL 青霉素/链霉素溶液+10 μL 重组人表皮生长因子EGF(1 mg/mL)+10 μL 重组人成纤维细胞生长因子FGF(1 mg/mL),置于37 ℃ 5% CO2的恒温细胞培养箱进行培养。H2S‐NSTC 细胞通过含有10%~20%胎牛血清的RPMI‐1640 培养基对H2S‐GSC 进行诱导分化7 ~10 d 获得。
3 胶质瘤组织收集
本实验所涉及的胶质瘤组织收集经过中国科学技术大学生物医学伦理委员会批准,从中国科学技术大学附属第一医院手术室收集,包含3 例WHO IV级 GBM 样本(患者女66 岁,男73 岁和男73 岁)。
4 生物信息学分析方法
胶质瘤静脉和足背静脉血浆代谢组学数据来源于Xiong N 等[14]发表的代谢组学数据,分别计算13个患者相应的胶质瘤静脉/足背静脉比值,对13 组比值求平均得到FC(Fold change),并计算log2FC,筛选出log2FC > 1.5 且P < 0.05 的代谢物认为其在胶质瘤静脉中显著上调,筛选出log2FC < ‐0.2 且P< 0.05 的代谢物认为其在胶质瘤静脉中显著下调。GBM 单细胞测序数据来源于Neftel 等[15]发表的研究成果(GEO:GSE131928),使用PCA 对单细胞数据进行降维,使用原始Louvain 算法进行聚类,使用tSNE 进行可视化,降维、聚类和可视化算法均基于R 语言实现;通过单细胞拷贝数变异(CNV)分析区分恶性肿瘤细胞和非恶性细胞;进而通过特定细胞类型的分子标记物基因集合的综合表达情况将非恶性细胞分群为巨噬细胞(CD14、AIF1、FCER1G、FCGR3A、TYROBP、CSF1R)、T 细 胞(CD2、CD3D、CD3E、CD3G)和少突胶质细胞(MBP、TF、PLP1、MAG、MOG、CLDN11)。分离出肿瘤细胞群,通过干性相关基因集(OLIG1、OLIG2、SOX2、SOX4、SOX9、SOX11、STMN2、STMN4、OMG、PLLP、DCX、DLX5、CD44 和PROM1)的综合表达情况对单细胞的干性程度进行打分。
5 Western blot
收集细胞,加入适量裂解液裂解,4 ℃ 13000 r/min 离心10 min,取上清液,考马斯亮蓝法测定蛋白浓度,加入上样缓冲液制备成一定浓度的蛋白样,煮沸10 min,取10 μg 进行SDS‐PAGE 电泳,蛋白条带转移到PVDE 膜上,加5%脱脂牛奶封闭1 h,4℃一抗稀释液(1 ∶1000 ~1 ∶2000)孵育过夜,TBST 缓冲液洗膜3 次×5 min,孵育特超敏ECL 化学发光底物,使用Bio‐Rad 化学发光凝胶成像仪进行显影。
6 qRT-PCR
RNA 抽 提、反 转 录cDNA 和qRT‐PCR 等 步骤中所用试剂分别为EZ‐10 柱式总RNA 抽提试剂 盒(BBI, B610583)、PrimeScript RT Master Mix(TaKaRa,RR036A)和荧光定量PCR 试剂盒SYBR Green(Biosharp, BL705A),具体操作依据试剂商提供的标准说明书进行。引物序列:CKB 上游——5’‐TTCTCAGAGGTGGAGCTGGT,下 游 ——5’‐AGGCATGAGGTCGTCGAT;SOX2上 游——5’‐GCTGCGAACAGTCAGACAGA, 下游——5’‐ACCTCCCGTCCAAGGTAG;PRL13A 上游——5’‐CTCAAGGTCGTGCGTCTG,下游——5’‐TGGCTTTCTCTTTCCTCTTCTC。
7 免疫荧光染色
组织切片使用磷酸盐缓冲液(PBS)常温润洗5 min,4%多聚甲醛常温固定15 min,PBS 洗片3 次×5 min,含1%牛血清白蛋白、0.3% TritonX‐100 的PBS 溶液透膜封闭1 h,PBS 洗片5 min,4 ℃一抗稀释液(1 ∶200 ~1 ∶300)孵育过夜,PBS 洗片3 次×5 min,常温荧光二抗稀释液(1 ∶1000)和Hoechst 染料(0.00005%)避光孵育2 h,PBS 避光洗片3 次×5 min,封片剂封片,干燥1 h 以上即可使用荧光显微镜观察。
8 慢病毒包装与转染
本实验所用慢病毒包装细胞为293T 细胞;慢病毒包装质粒psPAX2(Plasmid #12260)和pCI‐VSVG(Plasmid #1733)来源于Addgene;敲低质粒shNT、shCKB‐1 和shCKB‐2 插 入 序 列 分 别 为5’‐CCGGCAACAAGATGAAGAGCACCAACTC‐GAGTTGGTGCTCTTCATCTTGTTGTTTTT‐3’(shNT)、5’‐CCGGCGAGGAGTCCTACGAAGT‐GTTCTCGAGAACACTTCGTAGGACTCCTC‐GTTTTTTG‐3’(shCKB‐1)、5’‐CCGGC‐CCAGATTGAAACTCTCTTCACTCGAGTGAAGA‐GAGTTTCAATCTGGGTTTTT‐3’(shCKB‐2)。 利用磷酸钙转染法将质粒导入细胞,病毒包装质粒与目的表达质粒比例为6 μg ∶6 μg ∶6 μg,质粒转染24 h 后更换新鲜培养基,再48 h 后收集含病毒培养基上清。
9 CCK-8 实验
将细胞制备成每毫升1.25×104个细胞的细胞悬液,接种于96 孔板中,每孔添加200 μL 的细胞悬液(2500 个细胞),空白对照组则添加200 μL 的培养基,每组4 重复。检测时每孔加入20 μL CCK‐8 试剂,置于细胞培养箱中避光孵育2 h后,测定OD450。
10 统计学分析
本研究中所有柱状图、散点图和折线图均使用Graphpad prism 8.0 软件绘制。柱状图和散点图使用非配对t检验(非参数,双尾检验)分析两组数据间差异的显著性;折线图使用双因素方差分析(多重比较检验,Tukey 法)分析差异的显著性。*表示P< 0.05,**表示P< 0.01,***表示P< 0.001,P<0.05 表示两组数据间存在差异。
结 果
1 胶质瘤静脉血中Cr 含量显著上升
为了探究胶质瘤与正常组织的代谢差异,基于Xiong N 等[14]发表的代谢组数据分析13 例胶质瘤患者的胶质瘤静脉与相对应足背静脉血液样本中存在差异的代谢物。通过热图(图1A)展示胶质瘤静脉相比于足背静脉血液样本中含量显著升高或降低的代谢物。Cr 水平在所有胶质瘤静脉相比于足背静脉血液中均显著上调(图1B)。Cr 的主要功能是作为CK 的代谢底物参与到CK/PCr 系统中调控细胞能量稳态[16](图1C),而CKB 是主要存在于脑组织的CK 同工酶。
2 CKB 在干性样肿瘤细胞群中高表达
基于Neftel 等[15]发表的GBM 单细胞转录组测序数据集分析Cr 代谢的催化酶基因CKB 在干性样肿瘤细胞群和非干性肿瘤细胞群中的相对表达水平。首先从GBM 单细胞数据中分离出肿瘤细胞群(图2A),并通过干性相关基因集的综合表达情况对单细胞的干性程度进行打分(图2B)。接着分析CKB 在肿瘤细胞群中的表达,结果显示高表达CKB细胞在肿瘤细胞群中分布范围基本与高干性细胞的分布范围一致(图2C)。将图2B 中干性得分相对较高的细胞群定义为干性样肿瘤细胞群,反之为非干性肿瘤细胞群,进而分析CKB 在干性样肿瘤细胞群和非干性肿瘤细胞群中的表达,结果显示CKB在干性样肿瘤细胞群中有着更高和更广泛的表达水平(图2D)。最后,通过对Mario L. Suvà 等[17]发表的GSCs 和从GSCs 诱导分化而来的NSTCs 的混样转录组测序数据进行分析,进一步验证了CKB 在GSCs 相对于NSTCs 中表达上调(图2E)。
3 胶质瘤干细胞CKB 较非干性肿瘤细胞显著增高
通过Western blot 和qRT‐PCR 技术,分别从蛋白和mRNA 水平检测CKB 在GSCs 和NSTCs 中的表达水平显示:CKB 在GSCs 的表达水平显著高于NSTCs(图3A,3B)。接下来,收集3 例手术切除的GBM 冰冻切片,通过免疫荧光染色分析CKB 和SOX2 在GBM 组织内的分布情况,结果显示CKB与干性标记物SOX2 呈现一种共标的染色模式。随后,统计3 张免疫荧光染色图中CKB+像素点分别在SOX2+和SOX2﹣区域所占的比例,结果显示CKB+SOX2+的细胞比例显著高于CKB+SOX2﹣的细胞,说明在人体内的GBM 组织中,CKB 也更倾向于在SOX2+细胞中高表达(图3C)。
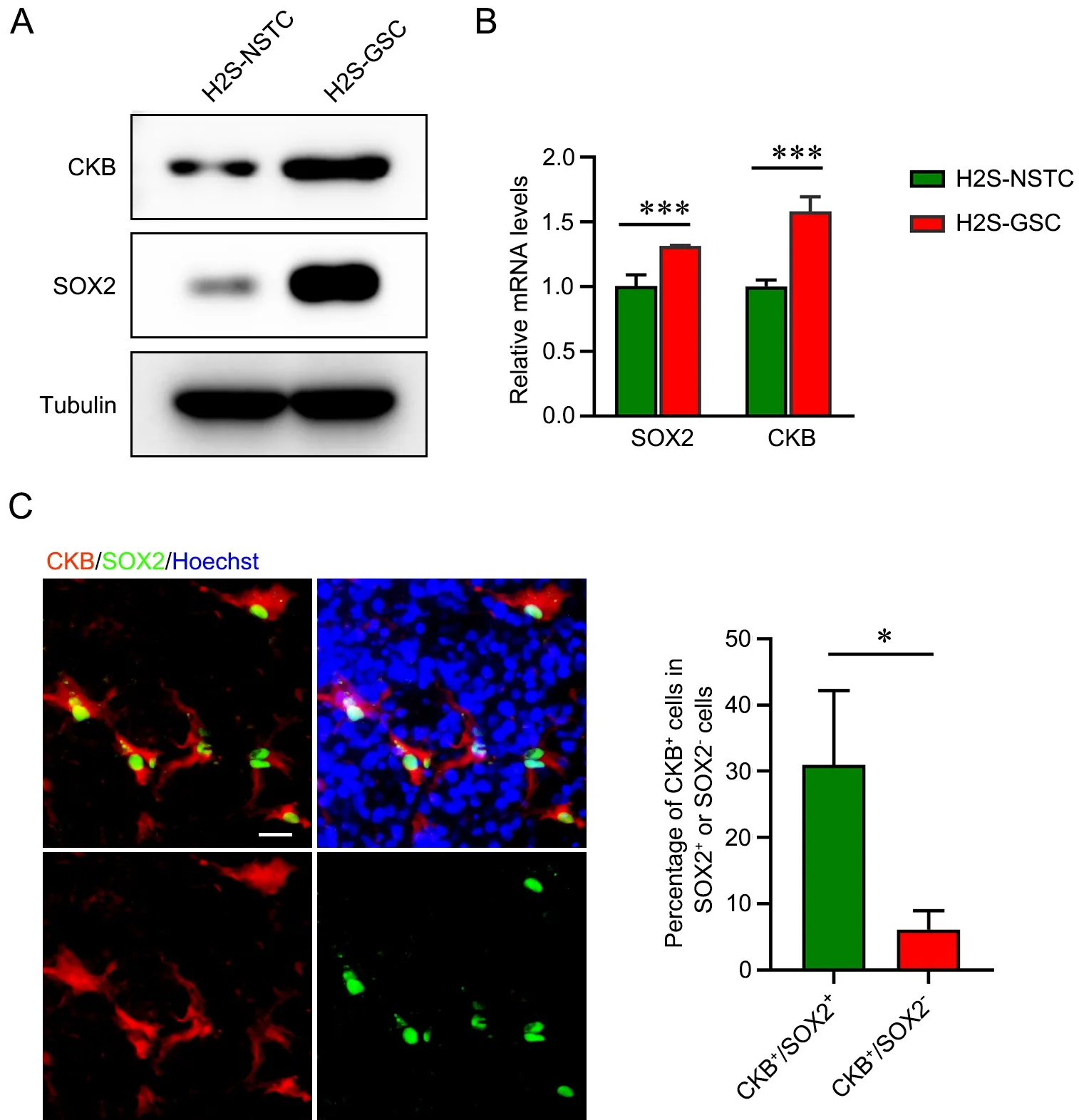
图3 CKB 的蛋白和mRNA 水平在胶质瘤干细胞相比于非干性肿瘤细胞中的表达差异分析。A,Western blot 检测CKB 的蛋白水平在GSCs 较NSTCs 中的表达。B,qRT‐PCR 检测CKB 的mRNA 水平在GSCs 较NSTCs 中的表达(***P < 0.001,n=4)。C,免疫荧光染色检测CKB和SOX2 在GBM 组织冰冻切片中的共定位,并统计CKB+像素点分别在SOX2+和SOX2‐区域所占的比例(*P < 0.05,n=3)。比例尺,25 μmFig. 3 Expression difference of CKB in glioma stem cells compared with non‐stem tumor cells. A, the protein level of CKB in GSCs and NSTCs was detected by Western blot. B, the mRNA level of CKB in GSCs and NSTCs was detected by qRT‐PCR (***P < 0.001, n=4). C, the co‐localization of CKB and SOX2 in the frozen sections of glioblastoma tissues was detected by immunofluorescence staining, and the proportion of CKB+ pixels in SOX2+ and SOX2‐ regions was calculated (*P < 0.05, n=3). Scale bar, 20 μm
4 敲低CKB 显著抑制胶质瘤干细胞的增殖
为了探讨CKB 在GSCs 中是否发挥功能,使用两个靶向于CKB 的shRNA(shCKB‐1 和shCKB‐2)分别在GSCs 和NSTCs 中敲低CKB(图4A),通过CCK‐8实验检测敲低CKB能否对GSCs和NSTCs的存活和增殖产生影响,结果显示敲低CKB 明显抑制GSCs 的增殖,而对NSTCs 影响较小(图4B),进一步通过体外成球实验证明CKB 为GSCs 增殖所必须(图4C)。
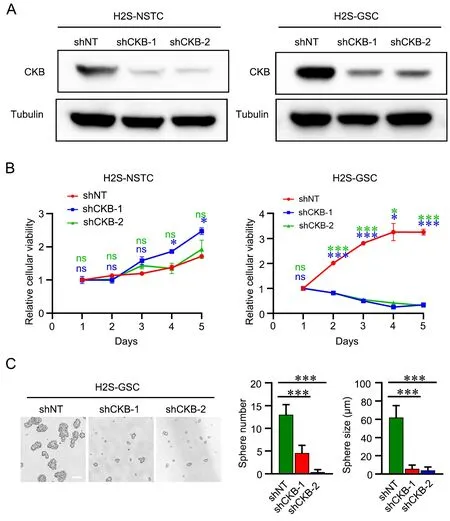
图4 敲低CKB 对胶质瘤干细胞和非干性肿瘤细胞存活和增殖的影响。 A,Western blot 检测靶向于CKB 的shRNA 在GSCs 和NSTCs 中敲低CKB 的程度。B,CCK‐8 实验分析敲低CKB 对GSCs 与NSTCs 存活和增殖的影响(*/***P < 0.05/0.001;ns 无统计学差异,n=4)。C,体外成球实验检测敲低CKB 对GSCs 成球能力的影响,细胞明场图片于显微镜100×放大倍数下采集,细胞球数目为显微镜图片中4 cm×4 cm方框内的细胞球个数,细胞球尺寸为单个细胞球的直径(***P < 0.001,n=5)。比例尺:50 μmFig. 4 Effects of knocking down CKB on survival and proliferation of glioma stem cells and non‐stem tumor cells. A, the effect of CKB knock‐down by CKB‐targeting shRNA in GSCs and NSTCs was detected by Western blot. B, cell survival and proliferation of the CKB knock‐down GSCs and NSTCs was detected by CCK‐8 assay (*/***P < 0.05/0.001, ns statistically non‐significant, n=4). C, the sphere formation efficiency of CKB knock‐down GSCs in vitro. The bright field pictures of GSCs were collected under the microscope 100× magnification. The sphere number was the number of cell spheres in the box of 4 cm × 4 cm in the microscope pictures, and the sphere size was the diameter of a single spheroid (***P < 0.001, n=5). Scale bar, 50 μm
5 CKB 在胶质瘤干细胞中的功能依赖于CK/PCr系统
为了探究CKB是否通过CK/PCr系统促进GSCs生存和增殖,本实验使用一系列浓度梯度的环肌酸(cyclocreatine,CCr)分别处理GSCs 和NSTCs 48 h。CCr 是Cr 类似物,也可被CKB 磷酸化产生磷酸环肌酸(Phosphocyclocreatine,P‐CCr),但是P‐CCr 的转化效率仅为PCr 的1/160,可在功能上阻断CK/PCr 系统[18](图5A)。结果显示CCr 以剂量依赖的效应降低GSCs 的细胞活力,而对NSTCs 的影响较小(图5B)。此外,在敲低CKB 的GSCs 中加入Cr 的代谢产物PCr,能在一定程度上挽救敲低CKB 导致的GSCs 细胞活力下降(图5C)。以上实验说明CKB 在GSCs 中所发挥的重要作用依赖于CK/PCr 系统。

图5 环肌酸对胶质瘤干细胞和非干性肿瘤细胞增殖能力的影响以及磷酸肌酸对CKB 敲低胶质瘤干细胞细胞活力的挽救能力。A,肌酸、磷酸肌酸、环肌酸和磷酸环肌酸的分子结构(Cr:肌酸,PCr:磷酸肌酸,CCr:环肌酸,P‐CCr:磷酸环肌酸)。B,CCK‐8 实验分析使用环肌酸抑制CKB 的代谢功能对GSCs 和NSTCs 细胞活力的影响(**/***P < 0.01/0.001, ns 无统计学差异,n=4)。C,CCK‐8 实验分析100 μM 磷酸肌酸对CKB 敲低的GSCs 细胞活力的挽救能力(*/***P < 0.05/0.001, ns 无统计学差异,n=4)。Fig. 5 Effect of cyclocreatine treatment on the proliferation of glioma stem cells and non‐stem tumor cells and the rescue ability of phosphocreatine on CKB knock‐down glioma stem cells. A, the molecular structure of creatine (Cr), phosphocreatine (PCr), cyclocreatine (CCr) and phosphocyclocreatine(P‐CCr). B, effect of cyclocreatine treatment on the proliferation of glioma stem cells and non‐stem tumor cells was analyzed by CCK‐8 assay (**/***P< 0.01/0.001, ns statistically non‐significant, n=4). C, the rescue ability of 100 μM phosphocreatine on CKB knock‐down glioma stem cells (*/***P <0.05/0.001; ns statistically non‐significant, n=4)
讨 论
GBM 是一种最恶性的原发性脑肿瘤[1,2]。在GBM 中存在一群关键恶性细胞GSCs,与GBM 的恶性发展[19‐21]、治疗抵抗[22,23]和复发[24]等过程密切相关,是GBM 治疗的潜在策略。据报道,GSCs与NSTCs 具有显著不同的代谢特征[25],代谢过程是肿瘤细胞用以维持自身存活和恶性增殖的核心机制,因此靶向抑制GSCs 特异的代谢过程可能对其产生强大的杀伤效应。本研究通过对Xiong N[14]等发表的代谢组学数据分析发现胶质瘤静脉比足背静脉血液样本中存在更高水平的Cr。此外,在临床胶质瘤MRS 诊断中,Cr 与其他一些颅内代谢物的定性和定量分析常被用于胶质瘤的鉴定、分级预测和肿瘤边界描绘[6],这进一步提示了Cr 可能与胶质瘤的恶性发展有关。Cr 是CK/PCr 系统中CK 的代谢底物,被催化与ATP 产生高能磷酸化合物PCr,后者负责在时间和空间层面传递能量,对于一些高能量和能量剧烈波动的细胞如神经元、精子和肌细胞等至关重要[11]。有研究表明,GSCs 比NSTCs 维持更高的细胞能量状态[13],因此推测CK/PCr 系统可能在GSCs 中发挥了重要作用。基于此推测,本文探讨了CK/PCr 系统在GSCs 中的功能及其潜在的治疗意义。
CK 是CK/PCr 系统关键的催化酶,而CKB 是脑组织中含量最为丰富的CK 亚型[12],本研究首先对CKB 在GSCs 和NSTCs 中的表达情况进行检测。基于Neftel 等[15]发表的GBM 单细胞转录组测序数据集进行单细胞分群,从中分离出肿瘤细胞,并使用一系列干性相关基因的综合表达情况筛选出干性样肿瘤细胞和非干性肿瘤细胞,通过分析CKB 在两个细胞群中的表达情况发现CKB 在干性样肿瘤细胞群中有着更高和更广泛的表达水平,这提示CKB 可能在GSCs 相比于NSTCs 中具有更高的表达水平。紧接着基于Mario L. Suvà 等[17]发表的GSCs 和NSTCs的混样转录组测序数据分析,进一步验证了CKB 在GSCs 相对于NSTCs 中表达上调。随后,本研究也在体外GSC 细胞系和分化的NSTCs 细胞中证实,CKB 的mRNA 和蛋白水平均在GSCs 较NSTCs 中显著高表达。本研究进一步探究了CK/PCr 系统在GSCs 中发挥的功能,敲低CKB 或使用抑制剂CCr抑制Cr 代谢能显著抑制GSCs 的存活和增殖能力,而对NSTCs 的影响较小,而使用Cr 的代谢产物PCr则在一定程度上挽救了CKB敲低导致的细胞死亡,这表明CKB 依赖其对Cr 的代谢活性促进GSCs 的存活和增殖。综上所述,本研究发现CKB 在GSCs中表达上调,通过CK/PCr 系统促进GSCs 的存活和增殖,是杀伤GSCs 来治疗GBM 的一个潜在靶点。
本研究仅初步探讨了CKB 在GSCs 中的表达情况和功能。有研究表明CKB 通过直接调控细胞的能量稳态或某些癌基因的表达水平促进包括乳腺癌[26]、结直肠癌[27]、胰腺导管癌[28]、黑色素瘤[29]和人骨肉瘤[30]等多种癌症的进展,CKB 是否影响GSCs 的细胞能量水平以及发挥信号通路的调控功能还有待进一步探讨。
