ATF4在SiewertⅡ型食管胃结合部腺癌中的表达及与长期随访结果的关系*
2023-03-04朱小娟时振国阮豪杰葛东峰亢崇照王晓宏高社干
朱小娟, 时振国, 阮豪杰, 葛东峰, 亢崇照, 王晓宏, 高社干
河南科技大学第一附属医院 1肿瘤放疗科, 2病理科, 3肿瘤内科(河南洛阳 471003)
食管胃结合部腺癌(adenocarcinoma of esophagogastric junction,AEG)是一种特殊的恶性肿瘤[1],近年来,其发病率呈现急剧的增长,尤其在发展中国家其发病率呈明显上升趋势,发病率男性高于女性[2-4]。值得注意的是,AEG临床表现隐匿,大多数患者发现时已是局部晚期或出现全身转移,预后较差[5]。而SiewertⅡ型AEG作为真正意义上的贲门癌,最能反映食管胃结合部癌变的异质性,并且其处理在国际上尚存在争议[6]。因此,迫切需要揭示SiewertⅡ型AEG的潜在发生及进展机制,并确定新的治疗靶点。内质网应激反应被认为是抗肿瘤治疗的新靶点[7],转录激活因子4(activating transcription factor 4,ATF4)作为一种重要的内质网应激转录因子,当细胞受到炎症因子、损伤等刺激时,ATF4可以通过促进其下游促凋亡分子DDIT3(DNA damage induced transcript 3)的表达来促使细胞产生凋亡;此外,ATF4还可通过调控Bcl-2家族成员诱导肿瘤细胞凋亡。在使用化疗药物治疗肿瘤时,ATF4也可诱导内质网应激的产生并引起肿瘤细胞凋亡[8]。因此,ATF4在肿瘤的靶向治疗领域中具有极大的吸引力,很有可能成为肿瘤治疗的新靶点,然而ATF4在AEG中的研究鲜见报道。本研究采用免疫组化的方法检测ATF4在SiewertⅡ型AEG与对应癌旁组织中的表达情况,并通过长达10年的随访,分析ATF4与AEG临床病理参数及预后的关系,为进一步研究AEG的发病机制及预后判断提供新策略。
1 资料与方法
1.1 一般资料 纳入标准:(1)符合SiewertⅡ型AEG的诊断标准[6];(2)术前头颅、胸腹盆CT或MRI扫描、全身骨扫描无远处转移;(3) ECOG-PS评分0~1分;(4)术前未进行放、化疗等抗肿瘤治疗;(5)行手术治疗及淋巴结清扫;(6)临床病理资料及随访数据完整。
排除标准:(1)合并较严重基础疾病或其他肿瘤性疾病;(2)术后病理未达到R0切除;(3)术后生存期<30 d。
最终纳入2010年1月至 2013年12月我院R0切除的SiewertⅡ型AEG患者80例,年龄42~81岁,中位年龄63.5岁,男68例,女12例。参照美国癌症联合会(AJCC)第八版的TNM分期标准:Ⅰ期8例,Ⅱ期16例,Ⅲ期56例;分化程度:高分化15例,中分化42例,低分化23例;组织学类型:溃疡型55例,蕈伞型2例,隆起型9例,浸润型14例;其中无淋巴结转移19例,有淋巴结转移61例,所有患者均有相应的癌组织及癌旁组织石蜡标本,癌旁组织定义为距癌组织旁2 cm处的组织和正常切缘组织[9]。本研究经河南科技大学第一附属医院伦理委员会批准(2022-03-B125)。
1.2 方法
1.2.1 免疫组化 免疫组化SP法检测ATF4在SiewertⅡ型AEG及癌旁组织中的表达情况。兔抗人ATF4单克隆抗体购自英国Abcam公司,免疫组化链霉菌抗生物素蛋白~过氧化物酶(SP)试剂盒及DAB显色剂均购自福州迈新生物科技有限公司,具体实验步骤严格按照试剂盒说明书进行。已知阳性切片作为阳性对照,PBS代替一抗作阴性对照。
1.2.2 结果判定 ATF4在AEG细胞中表达为棕黄色颗粒,主要定位于胞浆。每张切片观察5个高倍镜视野,采用半定量的方法评分:(1)阳性细胞百分比:<5%为0分,5%~25%为 1分,26%~50%为2分,51%~75%为 3分,>75%为4分。(2)染色密度:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。(1)和(2)相乘得分即为阳性等级:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。免疫组化结果由2位病理科医师采用双盲法阅片判定。
1.2.3 随访 通过门诊和电话随访,随访截止时间为2022年8月20日,总体生存期定义为从术后第1天开始到最后一次随访或任何原因造成的死亡,所有患者均随访成功,无失访患者。
1.3 统计学方法 采用SPSS 22.0 统计软件,计数资料用频数(n)和构成比(%)表示,用2检验等非参数方法比较差别。中位随访时间的计算采用反向Kaplan-Meier法。Kaplan-Meier生存曲线进行生存分析,组间生存率的比较采用log-rank检验;预后分析采用单因素和多因素Cox风险回归模型,无论单因素的显著性水平,所有可能与生存相关的因素均纳入多因素回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 ATF4在SiewertⅡ型AEG中的表达 ATF4免疫组化染色主要定位于AEG癌组织的胞浆中,呈弥漫棕黄色颗粒状,其在AEG中表达的阳性率为28.8%(n=23),其中(+++)9例(11.3%),(++)8例(10.0%),(+)6例(7.5%),(-)57例(71.3%),显著低于癌旁组织87.5%(70/80),差异有统计学意义(2=56.723,P<0.001)。见图1。

图1 免疫组化检测ATF4在AEG及癌旁组织中的表达(SP,×400)
2.2 ATF4表达与SiewertⅡ型AEG患者临床病理特征的关系 亚组分析结果显示,AEG组织中ATF4的表达与肿瘤的分化程度、TNM分期及淋巴结转移均显著相关(P<0.05),而与性别、年龄、病理形态无关(P>0.05)。见表1。
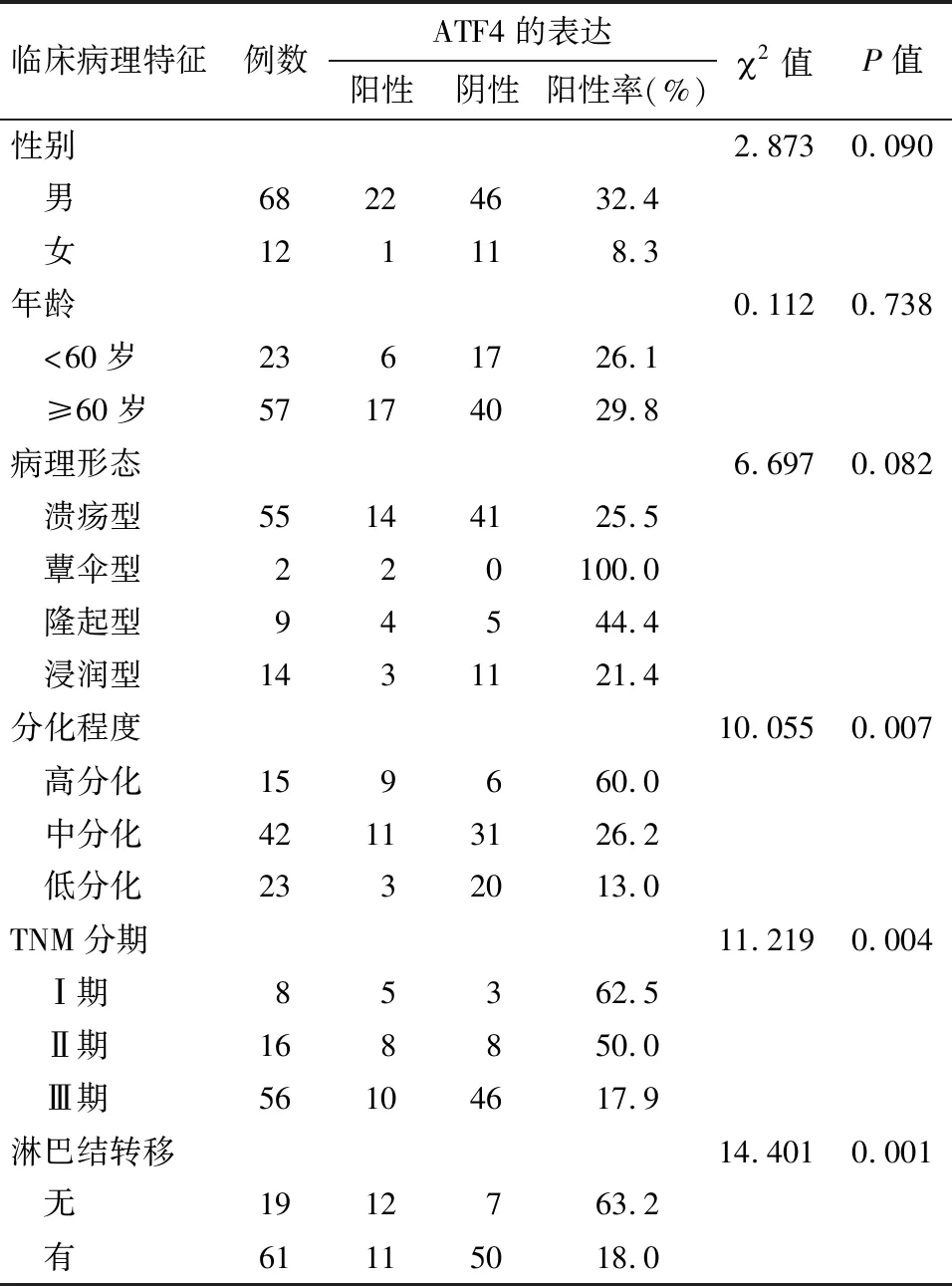
表1 SiewertⅡ型AEG癌组织中ATF4的表达与临床病理特征的关系 例
2.3 ATF4表达与SiewertⅡ型AEG患者生存的关系 至随访结束,整个队列的患者中位随访时间为120(95%CI: 108.542~131.458)个月。Kaplan-Meier分析显示,ATF4表达阳性的患者5年、8年、10年的总生存率分别为95.7%、82.2%、72.8%;ATF4阴性的患者分别为54.1%、28.7%、24.1%,差异有统计学意义(2=17.047,P<0.001)。见图2。
2.4 预后分析 单因素COX回归分析显示TNM分期(HR=2.082,95%CI: 1.065~4.070,P=0.032)和ATF4的表达(HR=0.214, 95%CI: 0.096~0.480,P<0.001)可能是SiewertⅡ型AEG患者总生存期的影响因素。进一步多因素分析结果显示ATF4的表达(HR=0.156,95%CI: 0.057~0.428,P<0.001)是影响SiewertⅡ型AEG患者远期总体生存期的独立预测因素。见表2。

图2 ATF4阳性和阴性组Kaplan-Meier生存曲线分析
3 讨论
近年来,内质网应激(endoplasmic reticulum stress,ERS)介导的凋亡途径是除死亡受体介导的信号转导途径和线粒体途径之外的一种新的诱发凋亡途径[10]。内质网应激是指由氧化应激、炎症、缺氧和钙代谢紊乱等多种原因引起的内质网中错误折叠和未折叠蛋白质的积累,导致细胞平衡紊乱[11]。持续的内质网应激激活凋亡途径,最终导致细胞凋亡[12]。然而,细胞对内质网应激的反应是双重的:温和的应激诱导基因转录,促进细胞适应改变的条件,并支持细胞存活;而强烈、持久的应激导致促进细胞死亡的基因激活,诱发细胞凋亡[13]。ATF4基因是一种应激反应转录因子,参与生理内稳态和细胞保护,并受GRP78/PERK-eIF2α通路激动,因此上游信号的活化必定上调并激活ATF4[14]。ATF4激活后可以进一步促进分子伴侣及促凋亡分子DDIT3表达。当损伤刺激持续存在,ERS 超过了细胞代偿能力,DDIT3高表达将激活Caspase-3 凋亡级联反应,促使细胞凋亡[15]。
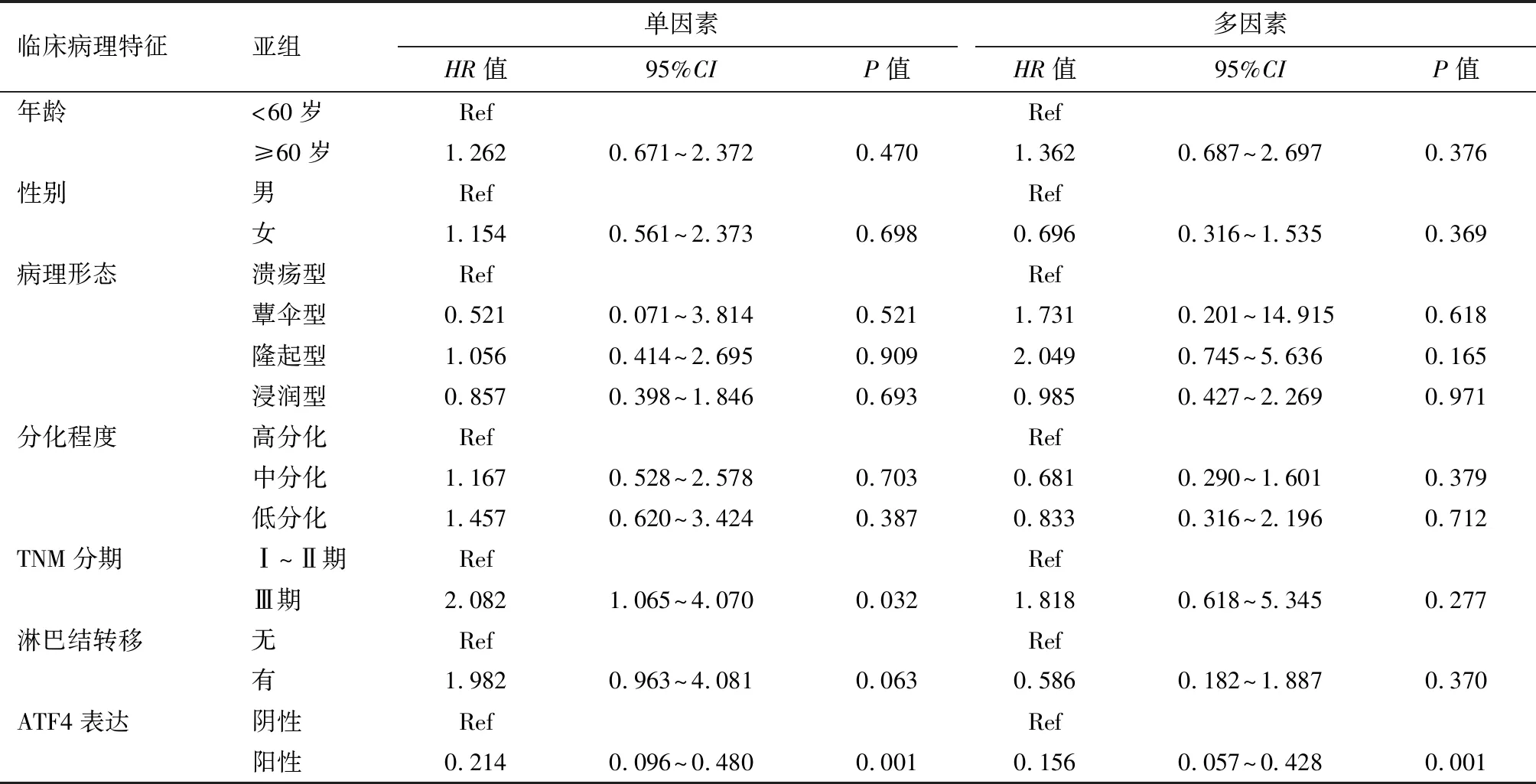
表2 SiewertⅡ型AEG患者总体生存率的单因素和多因素分析
ATF4在人类肿瘤中的作用仍不十分清楚。既往研究发现,与正常组织相比,ATF4在骨肉瘤[16]、Ewing肉瘤[17]和食管鳞癌[18]等肿瘤组织中的表达水平较高,并受肿瘤周围微环境信号如缺氧、氧化应激和ERS等调控。然而,也有部分学者得出相反的结论,在乳腺上皮细胞特异性过度表达ATF4的转基因小鼠中发现,ATF4的过度表达能阻断细胞分化[19]。Lang等[20]研究证明,高剂量的褪黑素(MT)导致头颈部鳞状细胞癌细胞内质网应激后ATF4上调,从而诱导内质网应激相关的凋亡。另有研究表明,延长内质网应激可使肿瘤细胞更容易发生细胞凋亡[21]。本研究发现ATF4在SiewertⅡ型AEG中的表达明显低于癌旁组织,这提示在贲门黏膜早期受致癌因素的影响可能发生了ERS,癌组织中的ATF4下调,抑制细胞凋亡,造成肿瘤的发生。由此可见,ATF4可能在SiewertⅡ型AEG中发挥着重要的保护性作用。另有研究表明,黄卡瓦胡椒素B(Flavokawain B,FKB)抑制人类多形性胶质母细胞瘤(GBM)细胞的恶性行为,并通过ATF4—DDIT3—TRIB3—AKT—MTOR—RPS6KB1信号通路诱导细胞保护性自噬[22]。此外,Mielnicki等[23]研究发现,在成纤维细胞中,野生型ATF4过度表达能抑制由人类c-Ha-ras癌基因启动子引导的转录,减少ras癌基因在转移细胞中的易位表达能力,认为ATF4在抑制肿瘤转移中也发挥一定的作用。
我们进一步分析ATF4表达与SiewertⅡ型AEG临床病理特征的关系发现,ATF4的表达与肿瘤患者的TNM分期、分化程度及淋巴结转移呈明显的相关性,生存分析发现ATF4阳性表达的患者总体生存期明显优于阴性的患者,Cox单因素回归分析结果显示TNM分期和ATF4的表达与患者的预后有关。进一步多因素Cox回归分析显示ATF4可作为SiewertⅡ型AEG患者的独立预测因子。因此,对ATF4表达下降或缺失的患者需加强随访,可能会早期发现肿瘤的复发及转移,及早介入更加积极有效的治疗,对改善SiewertⅡ型AEG患者的预后有重要意义。另一项研究表明,ATF4是甲状腺髓样癌(MTC)的一个候选肿瘤抑制基因,在敲除ATF4基因的小鼠中发现,ATF4敲除后引起甲状腺旁细胞增生,这是MTC的癌前病变过程,在MTC肿瘤细胞中,ATF4的高表达能降低肿瘤细胞的存活率。相反,ATF4的表达下降或缺失与MTC患者的低生存率有关,ATF4可作为区分MTC高危患者与较长生存期患者的分子标记[24]。因此,ATF4还可作为SiewertⅡ型AEG的发生、发展及预后不良的预测指标。
然而,本研究也有相应的局限性:(1)由于回顾性研究的特性,导致患者的部分临床资料缺失;(2)样本量相对较小,没有进一步的组内分析。下一步我们将采用更大样本的前瞻性研究,进行亚组分析的同时开展体内外实验,深入研究ATF4在AEG中的作用机制,进一步明确ATF4对Siewert Ⅱ型AEG的诊断和预后价值。
综上所述,ATF4在肿瘤的靶向治疗领域中具有极大的吸引力,未来有望成为SiewertⅡ型AEG治疗的新靶点及预后判断的重要生物学标志物。因此,有必要进一步地深入研究ATF4在AEG发生、发展过程中的具体作用机制。
利益相关声明:全体作者均无利益冲突。
作者贡献说明:朱小娟、时振国、高社干:研究方案设计;朱小娟、葛东峰:实施研究;朱小娟、时振国、阮豪杰、葛东峰:采集、分析数据;朱小娟:论文撰写;高社干、亢崇照:对论文的知识性内容作批评性审阅及指导;朱小娟、时振国、阮豪杰:统计分析;王晓宏、高社干:技术指导及支持性贡献。
